INTRODUCCIÓN
La homogeneización se define como el proceso de división de grandes glóbulos de grasa polidispersos de una emulsión aceite en agua en un gran número de glóbulos grasos pequeños de menor tamaño y de manera homogénea (Michalski y Januel, 2006). Esta reducción homogénea del tamaño se logra forzando el paso a alta presión de las partículas suspendidas en el fluido a través de una válvula (Donsì et al., 2009). Los homogeneizadores pueden estar equipados con dos válvulas conectadas en serie; una primera válvula de homogeneización que trabaja a mayor presión (conocida también como primera etapa), y una segunda válvula (o segunda etapa) que trabaja a presiones de homogeneización inferiores (normalmente de 10-20% de la presión de la primera válvula). Los efectos combinados de estas dos válvulas permiten la obtención de emulsiones mucho más estables físicamente, con menor cantidad de agregados de partículas en suspensión (Walstra et al., 2006).
En 1900, Auguste Gaulin desarrolló la primera válvula de homogeneización, mediante la cual surgió una alternativa tecnológica para la estabilización de emulsiones alimentarias. Desde ese momento, la homogeneización se ha aplicado ampliamente en la industria química, farmacéutica y alimentaria para la estabilización de emulsiones y la obtención de productos con nuevas propiedades reológicas (Floury et al., 2000; Thiebaud et al., 2003). El homogeneizador diseñado por Gaulin, es conocido actualmente como homogeneizador convencional.
En la industria láctea, las presiones utilizadas en los homogeneizadores convencionales oscilan entre ~20 y 60 MPa (Dumay et al., 2013) con el propósito principal de reducir el tamaño de los glóbulos de grasa (Coutouly et al., 2014). En general, el tamaño de los glóbulos grasos nativos de la leche se encuentra mayormente en 1-10 µm. Sin embargo, con el proceso de homogeneización se consigue reducir el tamaño (<1 µm) (Hayes y Kelly, 2003a) e incrementar la superficie (5-10 veces) de los nuevos glóbulos de grasa (Keenan et al., 1983). Por otro lado, la homogeneización también ha sido utilizada ampliamente en emulsiones para evitar los fenómenos de desestabilización, clarificación y cremado (Thiebaud et al., 2003).
Dependiendo del nivel de presión nominal, la tecnología se denominará homogeneización a alta presión (HPH, ~150 a 200 MPa) u homogeneización a ultra-alta presión (UHPH, ~350 a 400 MPa) (Dumay et al., 2013). La HPH y UHPH son tratamientos no térmicos que se basa en los mismos principios que la homogeneización convencional, pero gracias al diferente diseño de la geometría de la cámara de reacción y el tipo de material, puede alcanzar presiones de 10 a 20 veces superior a los homogeneizadores clásicos (Paquin, 1999).
En general, los beneficios de la HPH y UHPH incluyen la prolongación de la vida útil a través de la inactivación de microorganismos y mejoras en la funcionalidad de las matrices alimentarias (Patrignani y Lanciotti, 2016), debido al aumento de la capacidad y estabilidad de la emulsión, sin afectar el valor nutricional y las características sensoriales (Zamora y Guamis, 2015). Entre otras ventajas importantes de esta tecnología están, además de la reducción del tamaño del glóbulo de grasa (Thiebaud et al., 2003), la desfloculación de agregados de glóbulos de grasa y la dispersión uniforme de aglomerados (Floury et al., 2000), cambios en la conformación de la proteína, aumento de la viscosidad y estabilidad de la emulsión (Desrumaux y Marcand, 2002) e inactivación de enzimas (Hayes et al., 2005).
EQUIPOS DE HPH Y UHPH
Desde un punto de vista tecnológico, un homogeneizador consta principalmente de una bomba y una válvula de homogeneización. La bomba se utiliza para forzar el paso del fluido dentro de la válvula donde se produce la homogeneización (Diels y Michiels, 2006). Cuando el fluido pasa por la válvula, este es sometido a caída repentina de presión, fenómenos de cizalla, impacto, cavitación, esfuerzo de corte y turbulencia (Paquin, 1999; Patrignani y Lanciotti, 2016), causando la disrupción de sus partículas, incrementos de temperatura y una reducción concomitante de la carga microbiana (Thiebaud et al., 2003).
A principios de los años 80 fue introducida una nueva tecnología para la producción de emulsiones finas, basada en la disponibilidad de dispositivos capaces de generar y manejar presiones en líquidos por encima de 100 MPa, y presiones muy altas de 350 a 500 MPa con nuevos diseños en la cámara de homogenización (Donsì et al., 2009). En 1987, el equipo Microfluidizer de la Corporación Microfluidics (USA) fue introducido en la industria alimentaria alcanzando presiones de 100 MPa (Paquin, 1999).
Los modelos Emulsiflex, desarrollados por la compañía Avestin (Canadá), fueron semejantes a un homogeneizador convencional, pero con un diseño novedoso de las válvulas que permitió alcanzar presiones de 220 MPa (Paquin, 1999), aunque actualmente son capaces de alcanzar presiones de hasta 300 MPa, por medio del ajuste micrométrico de la boquilla y el uso de materiales altamente resistentes al desgaste, tales como el acero inoxidable o cerámica. El uso de los homogeneizadores Emulsiflex se describen para la ruptura de suspensiones celulares a presiones comprendidas entre 100 y 300 MPa, así como para la producción de nanosus-pensiones y desnaturalización de proteínas (Donsì et al., 2009). Otros fabricantes de homogeneizadores a alta presión son Bee International (USA), Gea Niro Soavi (Italia) y APV (Reino Unido), los cuales proponen dispositivos piloto capaces de ejercer presiones de homogenización de 100 a 200 MPa, para un flujo promedio de 160 l/h a 200 MPa (Zamora y Guamis, 2015).
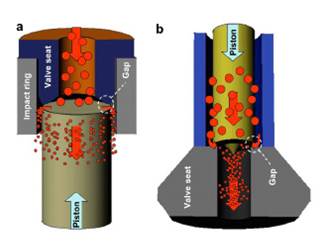
Diversos autores (Middelberg, 1995; Pandolfe, 1999; Miller et al., 2002) centraron sus esfuerzos en el estudio de los procesos físicos responsables de la ruptura de los glóbulos de grasa y microrganismos en homogeneizadores clásicos de alta presión, tales como el APV-Gaulin y Rannie (Figura 1a). En la válvula homogeneizadora clásica, el fluido es alimentado axialmente en el asiento de la válvula y luego se acelera radialmente hacia un pequeño orificio denominado «espacio de válvula» comprendida entre el pistón y el asiento de válvula. Una vez que el fluido sale del espacio de válvula (10 a 30 ìm), se convierte en un chorro radial que impacta contra el cabezal de la válvula antes de salir del homogeneizador a presión atmosférica (Kleinig y Middelberg, 1998). La presión de funcionamiento se controla ajustando el espacio de válvula (Patrignani y Lanciotti, 2016) y reduciendo este espacio, se logra incrementar la presión del homogeneizador (Donsì et al., 2009).
En 2006, la empresa Stansted Fluid Power Ltd. (Reino Unido) modificó la geometría de la válvula de homogenización Stansted (Figura 1b) en comparación a la clásica APV-Gaulin. Las válvulas Stansted fueron modificadas con asientos y agujas construidos en cerámica (Zamora y Guamis, 2015) o revestidos con diamante artificial (Dumay et al., 2013), material que es conocido por soportar los niveles de presión utilizados en los procesos de HPH y UHPH (Patrignani y Lanciotti, 2016). En las válvulas Stansted, el fluido se alimenta axialmente a lo largo de la parte móvil de la válvula (pistón) y luego se acelera radialmente a través del estrecho espacio entre la válvula y el asiento de válvula (Donsì et al., 2013). El tamaño de la abertura (~2-2.5 µm), la velocidad del fluido y la presión a la cual el fluido es sometido dependen de la fuerza que actúa sobre el pistón de la válvula, que puede ajustarse para regular la intensidad de la homogeneización. La caída de presión del líquido en la válvula se denomina presión de homogeneización. El homogeneizador Stansted está equipado con dos válvulas de homogenización para indicar la presión y temperatura del fluido (Donsì et al., 2009), siendo la primera de alta presión y la segunda de baja presión (Dumay et al., 2013). Por lo tanto, se pueden realizar procesos utilizando la primera válvula de presión (primera etapa) o la segunda válvula de presión (segunda etapa) o una combinación de ambas.
Actualmente existen empresas que ofrecen la posibilidad de construir prototipos capaces de superar los 300 MPa, por ejemplo, UHP 4000 de Gea Niro Saovi o NanoDeBee® de Bee Intenational. Sin embargo, debe destacarse que el diseño de las válvulas difiere drásticamente de las válvulas Stansted (Zamora y Guamis, 2015). La geometría de las válvulas de homogenización parecen ser un factor muy importante que influyen en el flujo de la emulsión y la ruptura del tamaño de las partículas (Tesch et al., 2003) e inactivación microbiana (Middelberg, 1995). Al respecto, Donsì et al. (2012, 2013) evaluaron el efecto de la geometría de dos válvulas de homogeneización con presiones desde 70-300 MPa en la inactivación microbiana de nanoemulsiones, resultando más eficiente la válvula cónica de pistón (3-14 µm) de Stansted Fluid Power, que la válvula de orificio (130 µm) de Bee International, resultado atribuido principalmente a una mayor cavitación e interacción mecánica directa de las células y la válvula cónica de pistón.
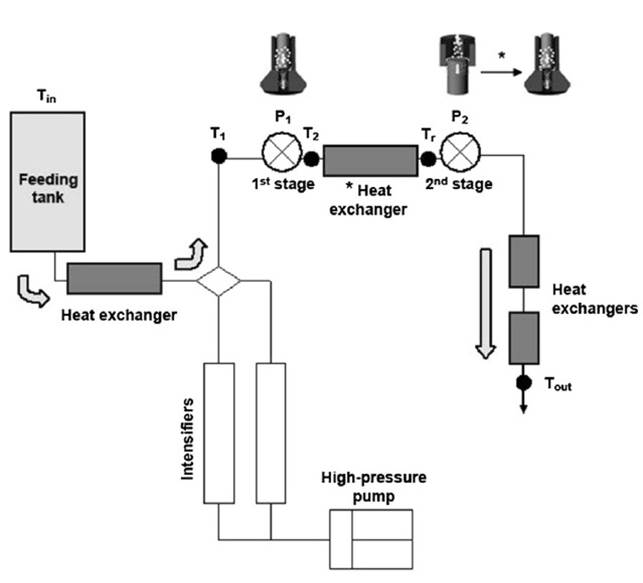
Por otro lado, Zamora y Guamis (2015) hicieron modificaciones al esquema del sistema de UHPH, diseñado y patentado por el CERPTA, modelo FPG11300 (Figura 2). La principal modificación fue el remplazo de la válvula convencional de la segunda etapa por una válvula Stansted. Asimismo, se incorporó un sistema de refrigeración entre las dos válvulas con el fin de minimizar el efecto térmico del tratamiento, lo que permitió un enfriamiento instantáneo y una disminución de la temperatura de salida.
Recientemente la empresa Ypsicon (Barcelona, España) tiene la capacidad de fabricar prototipos de laboratorio (10 l/h), de planta piloto (150 l/h) e incluso equipos industriales (1000 l/h) que pueden alcanzar los 300 MPa.Algunos investigadores del CIRTTA (Centre d’Innovació, Recerca i Transferència en Tecnologia dels Aliments, UAB) son inventores de la patente internacional EP10380094.2 «Sistema continuo y procedimiento de esterilización y estabilización física de fluidos bombeables mediante ultra alta presión de homogeneización», patente que se ha extendido a la Unión Europea, Estados Unidos, Turquía, México, Brasil, China, Japón, Corea del Sur, India y Australia.
HOMOGENIZACIÓN A ULTRA-ALTA PRESIÓN
Efectos sobre la Carga Microbiana de la Leche
Middelberg (1995) realizó una revisión de los posibles procesos físicos implicados en la ruptura microbiana durante la homogeneización a alta presión. Entre los mecanismos de ruptura celular propuestos se encuentran: la repentina caída de presión, fuerzas de corte y de torsión, turbulencia y, más probablemente, la cavitación. En general, son varios los factores que determinan el nivel de inactivación microbiana en el producto, entre los que destacan: la temperatura de entrada del producto, la presión de homogenización (Diels et al., 2005; Donsì et al., 2009; Kheadr et al., 2002; Thiebaud et al., 2003), la geometría de la válvula de homogenización (Donsì et al., 2013), el número de ciclos o etapas que se realicen sobre el fluido (Hayes y Kelly, 2003b; Picart et al., 2006; Trujillo et al., 2016), la composición de la membrana celular, la forma de los microorganismos (Vachon et al., 2002; Lanciotti et al., 2006; Donsì et al., 2009; Patrignani y Lanciotti, 2016;), los recuentos iniciales de microorganismos en el producto (Moroni et al., 2002; Vachon et al., 2002), la presencia de inhibidores microbianos o conservantes naturales (Vannini et al., 2004), el tipo de matriz y las características fisicoquímicas del producto fresco (Kheadr et al., 2002; Vachon et al., 2002; Diels et al., 2005; Briñez et al., 2006).
Aunque la UHPH se considere una tecnología no térmica, cuando el fluido atraviesa la válvula de homogeneización, la temperatura del fluido aumenta de ~2 a 2.5 ºC por cada 10 MPa (Hayes y Kelly, 2003b; Thiebaud et al., 2003). Este incremento de temperatura en tiempos cortos (menos de un segundo) debería ser considerado como un factor para explicar la inactivación microbiana por tratamientos de homogeneización a alta presión (Trujillo et al., 2016). Thiebaud et al. (2003) evaluaron la población de la flora endógena de la leche sometida a UHPH (300 MPa) a Ti (del inglés temperature inlet) de 4 y 24 ºC, concluyendo que tanto la presión de homogenización y las Ti influyen en la inhibición de la flora endógena de la leche de 1 a 3 ciclos logarítmicos. Por otro lado, Pereda et al. (2007) reportaron reducciones en la población de coliformes, enterococos y lactobacilos de 3 y 4 ciclos logarítmicos en muestras de leche tratadas por UHPH (300 MPa) con Ti = 30 y 40 °C, en comparación a las leches tratadas por métodos convencionales. Zamora et al. (2012b) observaron una reducción de ~3 ciclos logarítmicos en la población de bacterias totales y psicrotróficas en muestras de leche tratada por UHPH (300 MPa, Ti=30 ºC) en comparación a las tecnologías convencionales de pasteurización y homogenización. En otros estudios, Briñez et al. (2006a,b; 2007) también lograron inactivar las células vegetativas de bacterias patógenas (Escherichia coli O157:H7, Listeria monocytogenes, Staphylococcus aureus,y Salmonella spp) en muestras de leche tratada por UHPH.
La aplicación del tratamiento UHPH ha demostrado tener la misma eficacia del tratamiento de pasteurización para garantizar la estabilidad microbiológica de la leche. Sin embargo, la UHPH es menos efectiva en la inactivación de las esporas bacterianas, incluso a presiones máximas posibles, lo que limita su aplicación para obtener alimentos de calidad estéril si no es acompañada con una Ti >60 ºC (Trujillo et al., 2016).
Efectos sobre los Componentes de la Leche
Tamaño del glóbulo de grasa
La tecnología UHPH se ha utilizado principalmente en la leche para reducir el tamaño de los glóbulos de grasa. En leches tratadas por UHPH, y según intensidad de presión y temperatura de entrada (Ti) del producto, se han reportado reducciones del tamaño de los glóbulos de grasa por debajo de <0.6 µm (Pereda et al., 2007). Asimismo, Picart et al. (2006) observaron reducciones del tamaño de partícula (hasta 0.19 µm) a medida que se incrementaba la presión de homogenización a 300 MPa. Sin embargo, el aumento de la presión de homogeneización lleva a la formación de agregados de glóbulos de grasa (~1 µm) en muestras de leche tratadas por UHPH (Picart et al., 2006; Pereda et al., 2007; Trujillo et al., 2016), atribuida principalmente a la mayor exposición superficial de los nuevos glóbulos grasos e insuficiente caseína disponible para recubrirlos. Pereda et al. (2007) observaron formaciones de agregados en leche tratada por UHPH (300 MPa, simple etapa) en el orden de5 y10% aTi = 40y30ºC, respectivamente. Contrariamente, Thiebaud et al. (2003) no reportaron formaciones de agregados de glóbulos de grasa en muestras de leche tratada por UHPH a 300 MPa y Ti = 24 ºC.
Rodarte et al. (2018) observaron variaciones en la distribución del tamaño de partícula de diferentes muestras de nata tratada por UHPH y homogeneización convencional (Figura 3). Todas las muestras, a excepción de la nata homogeneizada por UHPH presentaron una curva de distribución de tamaño de partícula bimodal. Con el tratamiento UHPH se logró reducir el diámetro de los glóbulos de grasa hasta ~0.4 µm en el pico principal; sin embargo, apareció la formación de agregados en un pico pequeño a 2 µm. Estos agregados podrían haberse formado por la falta de proteínas, que resultó ser insuficiente para cubrir los nuevos glóbulos de grasa formados por la homogeneización, promoviendo así la floculación. Sin embargo, la adición de 1.5% de caseinato de sodio a la nata antes del tratamiento UHPH fue suficiente para cubrir la superficie de los nuevos glóbulos de grasa formados, estabilizándolos y previniendola formacióndeagregadosoflóculos.Asimismo, el diámetro del tamaño de partícula en la NUHC fue reducido hasta ~0.3 µm.
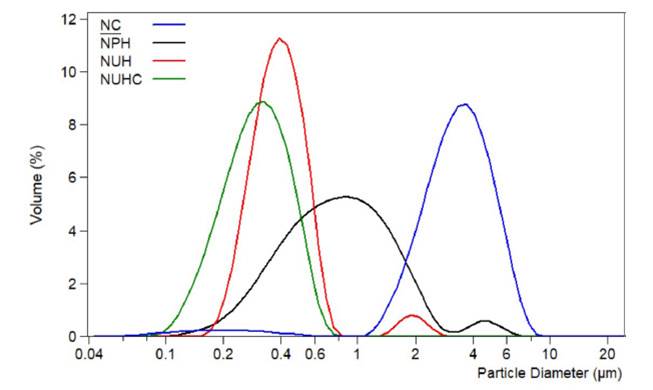
Figura 3 Distribuciones del tamaño de partícula de muestras de nata cruda, homogeneizada-pasteurizada y homogeneizada por ultra-alta presión (UHPH) después del tratamiento. NC: nata sin tratamiento; NPH: nata homogenizada-pasteurizada (15 MPa, 65 °C por 30 min); NUH: nata homogenizada por UHPH (300 MPa, Ti = 40 °C); NUHC: nata homogeneizada por UHPH (300 MPa, Ti = 40 °C) con 1.5% de caseinato de sodio (Rodarte et al., 2018)
Proteínas
Los fluidos alimentarios, en su paso por la válvula de homogenización, se ven sometidos a fenómenos físicos que afectan a las características de sus proteínas. En la leche tratada por UHPH se ha descrito la ruptura y reducción del tamaño de las micelas de caseína en leche (Kheadr et al., 2002) y la desnaturalización de proteínas séricas (Pereda et al., 2007), afectando estas estructuras proteicas, llevando a la incorporación de las micelas de caseína y sus subunidades en la membrana del glóbulo graso si el tratamiento se aplica a leche con grasa (Metzger y Mistry, 1994). Kheadr et al. (2002) observaron reducciones del tamaño de las micelas de caseína pasando de 200-300 nm a 125150 nmmediante homogeneización (200 MPa, Ti = 28 ºC). Roach y Harte (2008) también observaron reducciones en el tamaño de las micelas de caseína de 278 a 171 nm en muestras de aislados de micela de caseína tratadas a 200 MPa. Sin embargo, al incrementar las presiones de homogenización a 250 y 350 MPa se han descrito incrementos en el tamaño de las micelas de caseína a 178 y 200 nm. Durante el tratamiento de homogenización a presiones >200 MPa, las micelas de caseína pueden incrementar de tamaño por agregación debido a la presencia de grandes cantidades de calcio por la solubilización del fosfato cálcico micelar (Trujillo et al., 2016).
Por otro lado, a medida que se incrementan las presiones y las temperaturas de entrada y del proceso alcanzado durante el tratamiento UHPH de la leche, se produce desnaturalización de las proteínas del suero siendo la desnaturalización de la βlactoglobulina y en mayor proporción en comparación a la α-lactoalbúmina (Hayes et al., 2005; Zamora et al., 2012a).
Inactivación de enzimas
En general, el tratamiento de la leche por UHPH produce inactivación de las enzimas nativas de la leche (lactoperoxidasa, lipasa, plasmina y fosfatasa alcalina) en proporciones variables. Estas variaciones podrían explicarse por las diferencias en las máquinas y el diseño y construcción de la válvula, así como la temperatura de entrada y tiempo en el que la leche alcanza la más alta temperatura en el equipo UHPH (Trujillo et al., 2016). El tratamiento UHPH (300 MPa, Ti = 30 y 40 ºC) aplicado a la leche produce una disminución de la actividad enzimática de la plasmina y plasminógeno (sistema enzimático con importancia ya que delimita la vida útil de las leches UHT, y ejerce una importante actividad proteolítica en los quesos madurados) en comparación a las muestras de leche cruda. Aproximadamente, el 70% de la actividad de la plasmina de la leche cruda es inactivada en la leche por UHPH (Pereda et al., 2008). Por otro lado, Hayes y Kelly (2003b) observaron una inactivación de la plasmina (65%) a 200 MPa en comparación a las muestras tratadas de homogenización convencional. Hayes et al. (2005) también observaron inactivaciones del 85 y 95% de plasmina en muestras de leche homogenizadas a 150 y 250 MPa, respectivamente.
Minerales
Zamora et al. (2007) evaluaron el contenido de Ca, P y Mg en el suero obtenido por centrifugación de geles enzimáticos producidos a partir de leche tratada por UHPH (300 MPa). Los resultados mostraron una disminución de la cantidad de los minerales de la leche en la fase soluble al incrementar la presión de homogeneización. Por otro lado, Sandra y Dalgleish (2005) reportaron una mayor cantidad de Ca soluble en leche tratada a 200 MPa en comparación a leche pas-teurizada. La aplicación de la homogeneización de la leche produce una disrupción parcial de las micelas de caseína que pueden ocasionar una transferencia de Ca y de fosfato inorgánico a la fase soluble.
Efectos en la Aptitud Tecnológica de la Leche para Quesería
Zamora et al. (2007) observaron una mejora en las propiedades de coagulación enzimática de la leche tratada por UHPH (300 MPa, Ti = 30 y 40 °C, simple etapa) atribuido al efecto combinado de la presión (que produce la reducción del tamaño de partícula) y al incremento de temperatura (que produce la desnaturalización de las proteínas séricas) en la formación de nuevas estructuras lipoproteicas de la leche que aumentan el número de enlaces potenciales para crear el gel. Sin embargo, dichas propiedades fueron afectadas negativamente con la utilización de la segunda etapa (30 MPa), la cual produjo geles más débiles, similares a los obtenidos por el tratamiento de homogeneización-pasteurización. Lodaite et al. (2009) estudiaron las propiedades reológicas de geles enzimáticos obtenidos a partir de leche desnatada (0.08% de grasa) a 55 °C y tratadas por UHPH (300 MPa, 2 etapas), observando que el tratamiento UHPH produjo geles más duros y formados en menor tiempo, en comparación a geles elaborados con leche sin homogeneizar. La influencia ocasionada por el tratamiento UHPH a la leche desnatada ocurre principalmente por reducción del tamaño de las micelas de caseína.
APLICACIONES EN LA FABRICACIÓN DE QUESOS
La posibilidad de afectar la tecnología UHPH sobre la distribución del tamaño de partícula de los glóbulos de grasa, la estructura de las proteínas y la actividad enzimática, además de reducir significativamente la carga bacteriana de la leche y su evolución durante su almacenamiento, ha estimulado estudios sobre la elaboración de queso a partir de leche tratada por UHPH (Trujillo et al., 2016).
Quesos frescos
Zamora et al. (2011) evaluaron las características texturales de quesos frescos producidos a partir de leches tratadas por UHPH (300 MPa, Ti = 30 ºC) en comparación a los quesos procedentes de leche tratadas convencionalmente, tales como la pasteurización (80 °C, 15 s) y pasteurización-homogeneización (15+3 MPa a 60 °C, y 80 °C por 15 s). Los resultados mostraron que tanto la homogeneización convencional y la UHPH produjeron cambios en las características texturales de los quesos. Los quesos elaborados con leche homogeneizada convencionalmente fueron firmes, menos deformables, pastosos, granulosos, más blancos y con mayor capacidad de retención de agua, pero con una menor sensación en boca en comparación a los quesos elaborados con leche pasteurizada. Sin embargo, el efecto de la UHPH fue mayor que la homogeneización convencional obteniéndose una mayor firmeza y menor deformabilidad en los quesos elaborados con leche UHPH que fue atribuido a la incorporación de proteínas séricas a la cuajada y la reducción del tamaño del glóbulo graso.
Las diferencias en la composición (tipología del agua, contenido de proteína) y la microestructura, podrían explicar las características sensoriales de los quesos. En general, se destacaron varias mejoras en los quesos frescos elaborados a partir de leche tratada por UHPH (300 MPa, Ti = 30 ºC) en comparación a los quesos elaborados con leche tratada por tecnologías convencionales como la pasteurización y homogeneización. Los quesos UHPH presentaron una mayor humedad, menor actividad lipolítica, menor sinéresis durante el almacenamiento (Zamora et al., 2015), menor crecimiento de bacterias totales y psicrotróficos y con un incremento de la vida útil (13-19 días) (Zamora et al., 2012b, 2015). Sin embargo, los valores de oxidación lipídica obtenidos en los quesos elaborados a partir de leche tratadas por UHPH fue mayor que en el resto de los quesos, aunque sensorialmente este defecto no fue detectado (Zamora et al., 2015).
Escobar et al. (2011) evaluaron el rendimiento, composición, textura y propiedades organolépticas de quesos frescos elaborados a partir de leches crudas y pasteurizadas (65 °C, 30 min), ambas sometidas a diferentes presiones (0-300 MPa, 2 etapas). Los resultados mostraron que la aplicación combinada de tratamientos de pasteurización y UHPH a la leche produjo quesos frescos con mayor humedad y mayor rendimiento (1% por cada 100 MPa), debido principalmente a la mayor retención de las proteínas del suero durante la formación de las cuajadas, y al aumento de la capacidad de retención de agua de las proteínas. Las muestras de leche tratadas por pasteurización y 300 MPa produjeron quesos más desmenuzables, con mayor humedad, mayor rendimiento y una fina matriz de caseína-suero capaz de retener mejor el suero dulce. Sin embargo, se evidenció una mayor rancidez enzimática debido a la enzima lipasa activa.
Mayta-Hancco et al. (2019) evaluaron el efecto de la incorporación de la nata tratada por UHPH (300 MPa, Ti = 40 ºC) con o sin adición de caseinato de sodio, en comparación con natas tratadas mediante homogenización-pasteurización (15 MPa, 65 ºC, 30 min) y pasteurización (65 ºC, 30 min), encontrando un incremento del 5 al 13% de rendimiento quesero, para la homoge-neizaciónpasteurización y UHPH, respectivamente. La adición de caseinato de sodio a la nata tratada por UHPH incrementó el rendimiento del queso en un 22%, obteniendo el mismo valor que los quesos enteros. Estos quesos fueron menos duros, elásticos, cohesivos, gomosos y masticables que sus homólogos reducidos en grasa, mostrando valores similares a los quesos enteros. Los panelistas los describieron con mayor sensación acuosa y fueron los más valorados en la escala de preferencia.
Quesos madurados
Kheadr et al., (2002) evaluaron la calidad reológica y microestructural del queso Cheddar elaborado a partir de leches tratadas por homogenización a 200 MPa, Ti = 28 °C y 5 ciclos de 1 min, en comparación a quesos elaborados con leche pasteurizada. Los resultados mostraron que la leche homogenizada produjo quesos con mayor contenido de humedad, proteína y rendimiento en comparación a los quesos elaborados con leche pasteurizada. Asimismo, estos quesos presentaron una textura más firme, elástica y cohesiva debido a la formación de una matriz de caseína muy compacta y regular en la cual se detectó la presencia de glóbulos grasos de pequeño tamaño, no observándose diferencias de recuentos de bacterias totales en todas las muestras de quesos Cheddar.
Juan et al. (2015, 2016) evaluaron la proteólisis y lipólisis de quesos de cabra elaborados a partir de leche tratada por UHPH (200 MPa, Ti = 30 ºC) en comparación con los elaborados a partir de leche pasteurizada-homogenizada y pasteurizada, respectivamente. Los quesos elaborados a partir de leche tratada por UHPH presentaron una mayor hidrólisis de las caseínas αs2-, β-y de la para κ-caseína que los elaborados con leche pasteurizada, hecho que fue atribuido a la mayor exposición del sustrato a las enzimas proteolíticas. El tratamiento UHPH de la leche incrementó significativamente los niveles de nitrógeno soluble del queso y péptidos hidrofóbicos e hidrofílicos. Por otro lado, no observaron variaciones en la lipólisis de las muestras de quesos UHPH y los elaborados por pasteurización; sin embargo, la homogenización convencional produjo una extensa lipólisis de los quesos debido a la reducción del tamaño del glóbulo de grasa, incrementando el área para la actividad de la lipasa. Las diferencias en el nivel de lipólisis de los quesos elaborados por UHPH y homogenización convencional podrían estar relacionadas con la intensidad de los tratamientos y por los cambios producidos por estas tecnologías en la MFGM (del inglés milk fat globule membrane), modificando la accesibilidad de la enzima a la grasa.
La combinación de tratamientos convencionales y la UHPH también pueden ser utilizados para reducir la carga microbiana de la leche y durante la maduración de los quesos. López-Pedemonte, et al. (2006) evaluaron la calidad microbiológica de quesos blandos elaborados a partir de leches inoculadas con Staphylococcus aureus y sometidas a una combinación de tratamientos de pasteurización, alta presión hidrostática (HHP) y UHPH. Con el tratamiento UHPH (330 + 30 MPa, Ti = 6 ºC) lograron reducir la población de St. aureus de 8.5 log cfu/g a 5, ~2,8 y ~1 log ufc/g para los días 1, 15 y 30 de maduración, respectivamente. Asimismo, incrementando la Ti a 20 ºC del tratamiento UHPH, lograron inactivar completamente el St. aureus a los 15 días de maduración. El tratamiento adicional de HHP (400 MPa) a la UHPH tuvo un efecto sinérgico.
CONCLUSIONES
La UHPH tiene un gran potencial como tecnología emergente para reemplazar a la homogeneización convencional y los tratamientos térmicos, proporcionando estabilidad física y microbiológica de los alimentos líquidos. El tratamiento UHPH a la leche de fabricación quesera ha mostrado resultados prometedores, tales como, alta estabilidad física debido a una mayor reducción del tamaño de partícula, disminución de la carga bacteriana (incluida la reducción de microorganismos patógenos), inactivación de enzimas y cambios en la estructura de las proteínas (agregación de micelas de caseína). Los cambios obtenidos en la microestructura y las características de textura de los quesos apuntan al potencial de la tecnología UHPH para el desarrollo de una nueva generación de quesos.












 uBio
uBio