INTRODUCCIÓN
En el Perú se viene empleando biotec- nologías reproductivas como la superovu- lación y transferencia embrionaria (SOV-ET), y la criopreservación de embriones produci- dos in vivo; técnicas que han demostrado su gran aporte al mejoramiento genético de la ganadería bovina del país. Así mismo, la pro- ducción in vitro de embriones y la conserva- ción de gametos por empresas comerciales o centros de investigación, conlleva a la nece- sidad del uso de tecnologías de criopreservación. Tal es así, que la criopreservación de ovocitos tiene aplicación potencial, no solo para la investigación bási- ca, reproducción asistida, tecnologías comer- ciales o programas de crianza de animal, sino también para la preservación de la biodiversidad (Chaves et al., 2017). De igual forma, la criopreservación de ovocitos bovi- nos representa una alternativa para la crea- ción de bancos genéticos y una herramienta necesaria en los programas de mejoramiento genético (Dinnyés et al., 2000).
En la actualidad existen protocolos co- merciales en técnicas de criopreservación lenta, rápida y ultra rápida de ovocitos huma- nos (Braude, 2006). Una de estas tecnolo- gías es la vitrificación, que es considerada como una tecnología ultra rápida, la cual per- mite congelar ovocitos disminuyendo la for- mación de cristales de hielo mediante el incremento de la viscosidad y logrando la for- mación del estado vítreo en el citosol (Pegg, 2002). Así mismo, los protocolos de criopreservación se fundamentan en proce- sos combinados de deshidratación, depresión del punto de congelación y sobre-enfriamiento en un intento de evitar daño celular. Sin em- bargo, sus efectos tóxicos por el uso de altas concentraciones de crioprotectores; así como el estrés osmótico por la pérdida de agua, si- gue siendo un problema para la viabilidad de estas células (Pugh et al., 2003). De allí la importancia de utilizar combinaciones de crioprotectores de acción interna y externa que permitan reducir los daños a nivel de la membrana, citoesqueleto, ADN, función de proteínas y la zona pelúcida del ovocito (Men et al., 2003). Estos problemas hacen que la criopreservación de ovocitos bovinos siga siendo un reto significativo para la reproduc- ción asistida (Martins, 2004). Ejemplos de crioprotectores usados incluyen al glycerol, dimethyl sulphoxide (DMSO), ethylene glicol (EG) y algunos azucares como la sacarosa (Pegg, 2002).
Estudios en la técnica de vitrificación de embriones y ovocitos humanos indican que los resultados de éxito se traducen en tasas de gestación y que están influenciadas por el germoplasma criopreservado (Almodin et al., 2010), material usado (Roy et al., 2014; Marco-Jiménez et al., 2016), proceso de descongelamiento, y el sistema de vitrificación empleado (Vajta et al., 2000; Kuwayama et al., 2007), entre otros. Es así, que el objetivo de este trabajo fue evaluar el efecto de un protocolo de vitrificación de ovocitos en es- tadio maduro sobre la supervivencia, desa- rrollo embrionario y tasa de gestación de bo- vinos Bos indicus.
MATERIALES Y MÉTODOS
Los reactivos y medios de cultivo usa- dos proceden de Sigma-Aldrich (USA), sal- vo indicación expresa de otras fuentes.
Lugar del Estudio
El estudio se desarrolló en la región Amazonas (Perú). Los ovarios se colectaron en el camal de Bagua Grande (440 msnm), Amazonas, Perú, entre agosto de 2017 y enero de 2018. La vitrificación de los ovocitos y la posterior fecundación in vitro fue realizada en el Laboratorio de Biotecnología Animal, Reproducción y Mejoramiento Genético de la Universidad Nacional Toribio Rodríguez de Mendoza de Amazonas en la ciudad de Chachapoyas (2335 msnm). Los embriones producidos in vitro se trasfirieron en marzo de 2018 a vacas cruzadas, previamente sincronizadas, en el distrito de Quinjalca (3065 msnm), provincia de Chachapoyas.
Material Biológico
Se colectaron ovarios de ganado bovi- no Brahman en un recipiente isotérmico con- teniendo ClNa al 0.9% (wt/vol) suplementa- da con 0.025 mg/ml de estreptomicina, temperado a 37 °C. En el laboratorio, los com- plejos cúmulos ovocitos (COC) se aspiraron de folículos de 2-7 mm de diámetro con una jeringa de 10 ml y una aguja de 18G 11/2". Los COC fueron seleccionados usando un estereoscopio (Olympus, Japón) y se utiliza- ron solo los que presentaron un citoplasma homogéneo y por lo menos dos capas com- pletas de células del cumulus oophorus (Liebfried y First, 1979).
Maduración in vitro
Un total de 415 COC se maduraron in vitro hasta alcanzar la metafase II, en gru- pos de 20, en gotas cubiertas con aceite mi- neral durante 22 h a 38.5 °C y 6% de CO , con aire saturado de humedad. Las gotas para la maduración estuvieron compuestas de medio de maduración TCM-199 enriquecido con 0.1 mg/ml de L-glutamina, 0.25 mg/ml de piruvato de sodio, 0.01 U/ml de hormona folículo estimulante (FSH), 0.01 U/ml de hor- mona luteinizante (LH), 1 µg/ml de 17ß- estradiol, 50 µg/ml de gentamicina y 10% de suero fetal bovino (SFB).
Luego de las 22 h, se evaluó la estruc- tura nuclear de 80 COC seleccionados al azar, con ayuda de un microscopio binocular (Olympus, Japón), previa fijación de los ovocitos en láminas portaobjeto con solución de ácido acético-etanol (1:3, vol/vol) y teñi- dos con 1% de aceto-orceína al 1% (wt/vol) (Motlik y Fulka, 1976; Hirao et al., 1995).
Vitrificación y Descongelación de Ovocitos
Luego de las 22 h, los 335 COC restan- tes, fueron divididos en dos grupos; 181 COC fueron distribuidos al azar para conformar el grupo control (sin vitrificación) y continuar inmediatamente la fecundación y cultivo in vitro de los embriones, y 154 COC fueron usados como grupo experimental (para vitrificación). Los COC del grupo experimen- tal fueron sumergidos en una solución de equilibrio (SE) durante 3 min. La SE consistió en 7.5% de etilenoglicol (EG) y 7.5% de dimetilsulfóxido (DMSO) en una solución base (SB). La SB estuvo compuesta por TCM- 199 HEPES y 20% de SFB. Posteriormente, los COC fueron expuestos por 1 min a la so- lución de vitrificación (SV) preparada con 15% de EG, 15% de DMSO y 0.5M de saca- rosa en SB. Los COC fueron colocados en cryotops y sumergidos inmediatamente en nitrógeno líquido y almacenados en tanques de nitrógeno líquido (MVE, USA).
Luego de 20 días de la vitrificación del grupo experimental, se procedió a la descon- gelación de los COC. Para ello, se sumergió cada cryotop directamente en la solución de descongelamiento (SD) durante 30 segundos a 40 °C (preparada con 1M de sacarosa en la solución base), para luego exponerlos a la solución de dilución (SDi) durante 5 minutos a 40 °C (preparada con 0.5M sacarosa en la solución base). Finalmente, los ovocitos fue- ron lavados tres veces en SB dejándolos re- posar por 3 minutos entre lavados, para lue- go ser incubados a 38.5 °C y 6% de CO en medio TCM-199 HEPES suplementado con 10% de SFB y 50 µg/ml de gentamicina du- rante 4 horas para su recuperación.
Fecundación y Cultivo in vitro
Los COC, una vez descongelados, fue- ron colocados en el medio de fecundación, el cual estuvo compuesto por TALP FIV (Vajta et al., 2000) suplementado con 0.044 g/l de piruvato de sodio, 0.03 mg/ml de heparina, 50 µg/ml de gentamicina y 3.0 mg/ml de albúmi- na sérica bovina (BSA-FAF). Los ovocitos se fecundaron in vitro con espermatozoides (106/ml) de toros Angus seleccionados y ca- pacitados con la técnica de gradientes de Percoll (Parrish et al., 1995), para finalmente ser incubados por 18 horas a 38.5 °C y 6% de CO2.
Los presuntos cigotos se cultivaron en gotas cubiertas de aceite mineral en grupos de 20 cigotos por placa petri por 7 días a 38.5 °C en una incubadora con mezcla de gases. Para ello, se utilizó el medio SOF base (Vajta et al., 2000) suplementado con 0.044 g/l de piruvato de sodio, 0.039 g/l de Lglutamina, 3.0 mg/ml de albúmina sérica bovina (BSA-FAF), 1X de aminoácidos esenciales, 1X de aminoácidos no esenciales, 10 mg/ml de EGF, 0.1 mg/ml de ácido cítrico, 0.5 mg/ml de myo-inositol, 50 µg/ml de gentamicina y 2% de SFB.
Luego de los 7 días, los embriones resultantes fueron clasificados según la meto- dología descrita por la Sociedad Internacio- nal de Transferencia de Embriones (IETS, 2011) usando un estereoscopio (Olympus, Japón) a un aumento de 20X.
Sincronización de Receptoras y Transferencia de Embriones
Para la selección de las vacas recepto- ras se visitaron las ganaderías locales para determinar las condiciones sanitarias, edad (1.6-5 años), número de partos (0-4 partos) y condición corporal (2.5-3) de los animales. Se utilizaron hembras cruzadas, descartán- dose vacas preñadas y con anormalidades reproductivas mediante ecografía. Cincuen- ta vacas candidatas a receptoras fueron so- metidas a un protocolo de sincronización de estro, donde el día cero se aplicó progesterona 1.38 g (DIB(r), Zoetis) y benzoato de estradiol 2 mg (Estrovet(r), Montana), el día 10 se reti- ró la progesterona y se aplicó benzoato de estradiol 2 mg (Estovet(r), Montana), 400 UI de gonadotropina coriónica equina (ECG) (Novormon(r), Intervet) y 25 mg de prostaglandina F como luteolítico (Lutalyse(r), Pfizer). Lamentablemente, solo se presentó celo en 14 receptoras, las mis- mas que fueron usadas para la transferencia de embriones en estadio de mórula (8) o blastocisto (6) en el día 19.
Se transfirieron los embriones genera- dos del grupo experimental (COC vitrificados) seleccionados según su calidad, los cuales fueron transportados en bolsas selladas con mezcla de gases atemperadas a 37 °C hasta el centro poblado de Chontapampa, distrito de Quinjalca, Chachapoyas. Para la transfe- rencia de los embriones, se verificó la pre- sencia de cuerpo lúteo (CL) por palpación (CL >16 mm) para confirmar la aptitud de la vaca como receptora de embrión. Las trans- ferencias se realizaron utilizando una pistola de transferencia de embriones (21") con fun- das punta de acero (Agtech, USA), revesti- da con una camiseta sanitaria. La pistola fue dirigida al cuerno ipso lateral del CL funcio- nal, depositando el embrión en el tercio cra- neal del cuerno uterino. El diagnóstico de gestación se realizó a los 35 días de transfe- rido el embrión, mediante ultrasonografía transrectal (Esaote, Italia).
Análisis Estadístico
Se calculó el intervalo de confianza del 95% y el valor de probabilidad mediante la prueba de Chi cuadrado para los porcentajes de embriones (mórulas y blastocistos), obte- nidos in vitro a partir del grupo control (sin vitrificación) y el grupo experimental (ovocitos vitrificados). Los datos obtenidos se analiza- ron en el programa SPSS v. 15.0.
RESULTADOS Y DISCUSIÓN
Experimento 1: Competencia Meiótica in vitro de los Ovocitos
Las propiedades asociadas con cada etapa de la meiosis hasta la metafase de la segunda división meiótica (metafase II), in- cluyen el acoplamiento metabólico entre los ovocitos y las células del cúmulus (COC), la permeabilidad de la membrana plasmática, la presencia o ausencia de una membrana nuclear, la reorganización del citoesquelto y el huso acromático, y la condensación de los cromosomas (Sprícigo et al., 2014). En el estudio, el 82% de los COC madurados in vitro por 22 h alcanzaron la metafase II (Cuadro 1), mostrando la expansión de las células del cumulus (Figura 1 B), la extrusión del cor- púsculo polar (Figura 1 C), la desaparición de la vesícula germinal y la formación de la pla- ca metafásica (Figura 2 A,B); indicando la lle- gada al estadio nuclear de metafase II. Estos resultados son similares a lo reportado por diversos autores (Lancellotti Schwarz et al., 2014; Liang et al., 2015; Bezerra et al., 2016).
Cuadro 1 Estadio nuclear de los Complejos Cúmulos - Ovocitos (COC) a las 22 horas de maduración in vitro
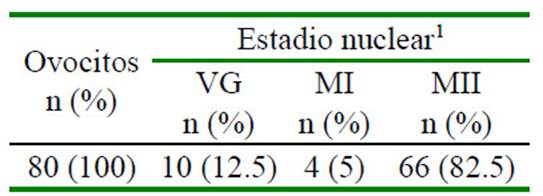
1 VG: en estadio de vesícula germinal; MI y MII: ovocito maduro en metafase II o MII
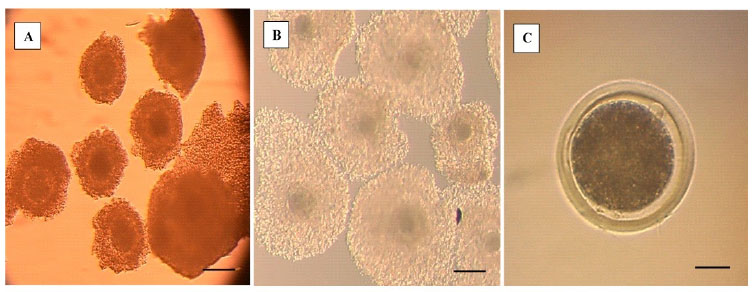
Figura 1 Observación de complejos cúmulos-ovocitos (COC). A. COC antes de la maduración in vitro. B. COC posterior a la maduración in vitro. Se observa expansión de las células del cumulus oophorus. C. Aparición del corpúsculo polar en el espacio perivitelino del ovocito (la barra representa 100 µm en A y B, y 25 µm en C)
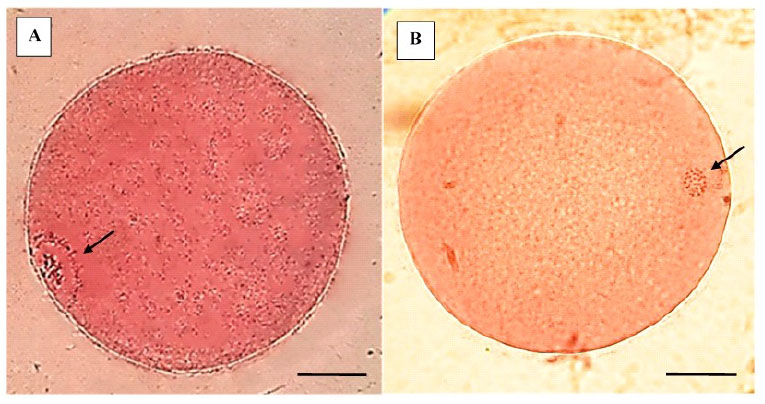
Figura 2 Determinación del estadio nuclear de los COC con aceto-orceína. A. Ovocito en estadio de vesícula germinal (VG). Presenta membrana nuclear intacta y la cromatina en el nucleoplasma. B. Ovocito maduro (metafase II - MII). Presenta cromosomas condensados y la ausencia de la membrana nuclear (la barra representa 25 µm)
Experimento 2: Competencia de Desa- rrollo Embrionario in vitro
Con la finalidad de comparar el desa- rrollo embrionario in vitro a partir de ovocitos sin previa vitrificación (control) y con previa vitrificación (experimental), un segundo grupo de COC (335) fueron madurados in vitro por 22 h. Luego, se dividieron aleatoriamente en dos grupos, el primero (181 COC como control) fue usado inmediatamente para fe- cundarlos y cultivarlos in vitro por siete días. El segundo grupo (154 COC), fueron vitrificados y mantenidos en nitrógeno líquido por tres semanas para posteriormente descongelarlos, fecundarlos y cultivarlos in vitro (Figura 3).
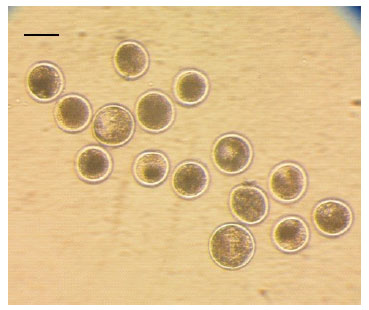
Figura 3 Embriones producidos in vitro a partir de ovocitos vitrificados (la barra representa 100 µm)
Se observó que el desarrollo embriona- rio del grupo experimental fue significati- vamente reducido por efecto de la vitrificación; obteniendo un 5.8% de mórulas y 10.4% de blastocistos en comparación con el grupo control (sin proceso de vitrificación), donde se obtuvo una tasa de 11.6% de mórulas y 24.9% de blastocistos (Cuadro 2). Estos porcentajes son similares a los encontrados por Liang et al. (2015) quienes obtuvieron una tasa 8.9% de blastocistos a partir de ovocitos bovinos vitrificados, pero superiores a los reportados por Sprícigo et al. (2014) quienes reportaron una tasa de 4.1% de blastocistos a partir de ovocitos maduros vitrificados en cryotops. La reducción signi- ficativa en el desarrollo de blastocisto en com- paración al del grupo control, demostró que la vitrificación tiene efectos negativos a lar- go plazo en el desarrollo de los embriones. El mecanismo exacto del daño se desconoce, pero la despolimerización del huso causado por crioprotectores, así como la desorganiza- ción del citoesqueleto, combinada con el enfriamiento, podrían haber sido las causas (Dinnyés et al., 2000).
Experimento 3: Tasa de Concepción a los 42 Días
Con el objetivo de evaluar la capacidad de implantación de los embriones que se ge- neraron in vitro a partir de COC vitrificados (grupo experimental), se transfirieron estos embriones a receptoras previamente sincronizadas. Lamentablemente, la falta de disponibilidad de receptoras solo permitió la trasferencia de 14 embriones a 14 recepto- ras. De estos, ocho embriones fueron transferidos en estado de mórula y seis como blastocistos, clasificados por su calidad. El 21.4% de los embriones transferidos (2 blastocistos y 1 mórula) lograron formar ve- sícula embrionaria a los 35 días de realizada la transferencia (Figura 4).
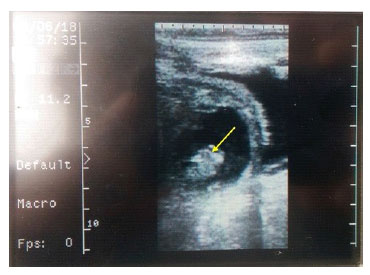
Figura 4 Ecografía a los 35 días pos-transferencia embrionaria en una vaca. La flecha indica la vesícula embrionaria dentro del líquido amniótico
La baja proporción de gestaciones lo- gradas podría deberse a que las muestras uti- lizadas provenían de vacas sacrificadas, don- de factores como la restricción de oxígeno y flujo sanguíneo podrían haber dañado la es- tructura del ovario y, por consiguiente, la viabilidad de los ovocitos. De igual manera, los animales usados para la transferencia no disponían de un sistema adecuado de manejo (Colazo y Mapletoft, 2007). Resultados exitosos de gestación y nacimiento de crías vivas a partir de embriones vitrificados han sido reportados. Así, Sanches et al. (2016) obtuvieron 35.9% de gestación.












 uBio
uBio 


