INTRODUCCIÓN
Las tilapias son peces de agua dulce, endémicos y originarios de África y el Cercano Oriente, cuya producción a nivel mundial sobrepasa los seis millones de toneladas métricas (FAO, 2018). En el Perú, es la cuarta especie acuícola de mayor producción, cuyos volúmenes se han incrementado de 40 t (2000) a 3247 t (2017), siendo las principales zonas productoras: Piura (67%), San Martín (27%) y Lima (6%) (PRODUCE, 2017). El 91% de la producción es comercializada en el mercado local y el 9% es destinado al mercado internacional, principalmente en Estados Unidos (81%) y Ecuador (18.5%) (Baltazar, 2009; Baltazar et al., 2014).
En el cultivo de tilapias se puede distinguir cinco fases: desove, fertilización, incubación, alevinaje, y la etapa de crecimiento, donde el pez desarrolla hasta estar apto para el engorde y posterior cosecha (Burgos, 1999). Dentro de las patologías que pueden afectar a los peces se encuentra las aberraciones genéticas, denominadas también «malformaciones» o «anomalías congénitas» que se originan durante el desarrollo embrionario (Adler, 1974). Tales características pueden o no ser hereditarias (Tave1 et al., 2011; Sajeevan y Thoranam, 2016). Se debe considerar que la calidad de los huevos en especies de cultivo es muy variable y afectan las tasas de desarrollo en la incubación (Kjørsvik et al., 2003; Bonnet et al., 2007).
Las malformaciones o anomalías son uno de los mayores problemas de la producción intensiva de alevines de peces en criaderos, dado que traen como consecuencia la disminución del crecimiento, mayor susceptibilidad a enfermedades, altas mortalidades, y pérdidas económicas en las etapas de alevines y crecimiento de la tilapia (Andrade et al., 1996; Koumoundouros et al. 1997, 2001; Boglione et al., 2001, 2013, Argüello et al., 2014). La mayoría de los factores externos que han sido estudiados están relacionados a la alimentación durante el cultivo (Izquierdo et al., 2001), así como temperatura, pH, salinidad, oxígeno, fotoperiodo, estrés térmico, además de la inducción o sincronización de la ovulación y la maduración de los embriones (Bonnet et al., 2007; Prochazka, 2009).
En el presente trabajo se describen 12 anomalías congénitas observadas durante los diversos experimentos de incubación artificial de embriones de tilapia desarrollados en diversos centros de producción y en laboratorios de empresas privadas entre 2005 y 2017.
MATERIALES Y MÉTODOS
Reproductores
Se trabajó con tilapias Oreochromis niloticus (variedad roja) del ex Centro de Acuicultura Tambo de Mora, Ica (2005-2007), del Centro de Investigaciones Acuícolas de Calango de la Universidad Científica del Sur, Lima (2010-2016) y de laboratorios de empresas privadas (2008-2009 y 2017). Los peces reproductores, tanto machos como hembras, tenían entre 200 y 300 g de peso. La proporción sexual fue de un macho por tres hembras. Los peces estuvieron estabulados en estanques de 20 m2 y alimentados tres veces al día con alimento comercial extruido (30% proteína). Una vez realizada la puesta y comprobada la incubación bucal por parte de las hembras, los huevos fueron retirados manualmente de la boca de la hembra, luego de un periodo de 5-10 días de incubación. Durante el periodo indicado en los tres lugares mencionados se estima que la producción fue alrededor de tres millones de larvas y, de las cuales, las anómalas no llegaron a sobrepasar el 1% del total.
Cría de Larvas
Inmediatamente después de la colecta se realizó una selección en función del desarrollo ontogénico (embriones, larvas recién eclosionadas, larvas en proceso de reabsorción del saco vitelino), colocándose el material seleccionado en incubadoras rectangulares de 0.008 m3, con flujo continuo de agua de 1-2 L.seg-1 y a temperatura constante de 28 °C. Los embriones y larvas permanecieron en el laboratorio hasta la eclosión y reabsorción del saco vitelino. El agua empleada en la incubación de los embriones provino principalmente del subsuelo, pasaba por filtros de 10, 5 y 1 µm y lámparas UV, para luego ser aireada y mantenida a 28 °C con calentadores termostatos y a niveles de oxígeno mayor a 5 mg. L-1 .
Larvas que macroscópicamente presentaban algún tipo de malformación eran retiradas y observadas mediante un microscopio de contraste de fase con ocular micrométrico. Se les hacía el registro fotográfico y eran fijadas en alcohol. Para las observaciones en individuos vivos se les anestesiaba con una gota de una solución de benzocaína: acetona (2:1 p/v).
Para la nomenclatura y clasificación de las malformaciones se utilizaron referencias de la literatura científica (Dawson, 1964, 1966, 1971; Adler, 1974; Dawson y Heal, 1976; Dorland, 2001; Godoy, 2015).
RESULTADOS
Se observaron 10 malformaciones unitarias y dos dobles. Las unitarias afectaban a un solo individuo, destacando las macrocefalias, anoftalmia bilateral, ciclopía, agenesia caudal, escoliosis, lordosis, megalovitelo, agenesia vitelina, disposición posterior del saco vitelino y prognatismo inferior. Las malformaciones dobles afectaban a dos individuos al mismo tiempo, encontrándose los anacatadídimos y teratodymos.
Malformaciones de la Cabeza
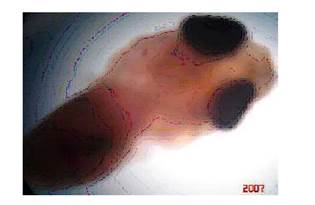
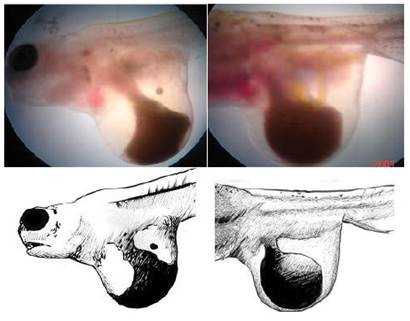
Macrocefalia o megalocefalia
Las larvas presentaron un mayor tamaño de la cabeza en relación con el cuerpo, en comparación con otras larvas de la edad similar. El tamaño de la cabeza representó entre el 60 y el 80% del total de tamaño corporal de las larvas (Figura 1). Las larvas, luego de la reabsorción del saco vitelino no llegan a sobrevivir. La frecuencia de casos no sobrepasó el 1% del total de las larvas en incubación.
Malformaciones Oculares
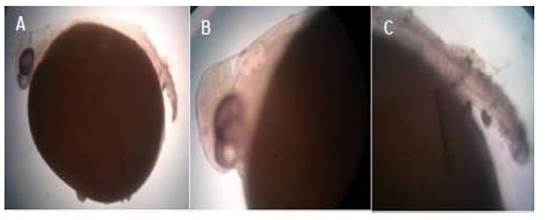
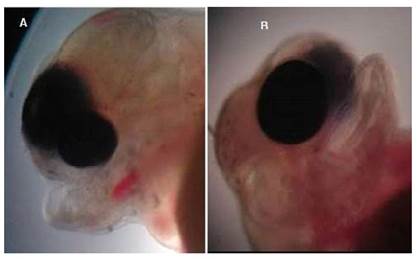
Anoftalmia bilateral
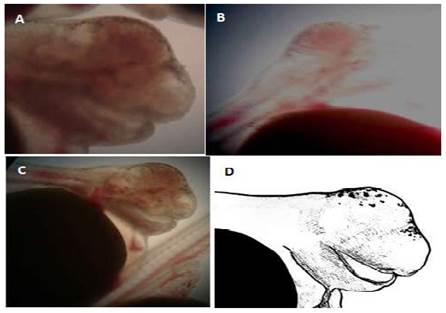
Es un defecto embriológico congénito raro que se caracteriza por la falta completa de uno o ambos globos oculares. Generalmente hay presencia de vestigios oculares rudimentarios (Noden y Lahunta; 1990). La anoftalmia se asocia con una alteración cromosómica en la mayoría de las especies (Hamori, 1983).
Las larvas de tilapia con esta malformación no presentaban vestigios oculares (Figura 2), morían a las pocas horas de la eclosión y no sobrepasaron el 1% de la población eclosionada.Algunas larvas, además de la anoftalmia, presentaban deformaciones en la estructura bucal (Figura 2C).
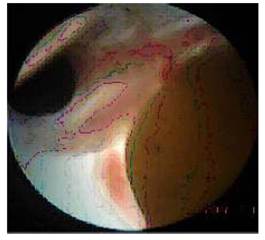
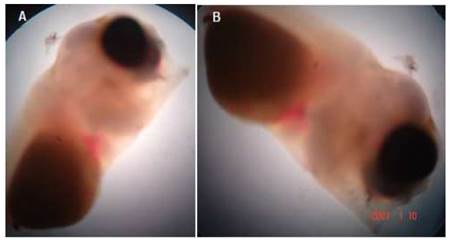
Ciclopía
Se trata de larvas que tienen un solo ojo y una sola órbita ocular situada en la línea media, aunque en algunos casos se ubican lateralmente. Esta puede contener un solo ojo normal o los dos ojos fusionados (Noden y Lahunta, 1990). Las larvas con esta deformidad presentaron una cabeza con una frente plana en donde los ojos se encontraron fusionados.
Las larvas de tilapia con ciclopía presentaban toda la estructura ocular situada centralmente y el globo ocular tenía un tamaño bastante grande como si se hubiesen fusionado ambos ojos (Figura 3). Estas larvas sobrevivían pocas horas. La frecuencia de esta malformación fue muy baja (<1%).
Malformaciones de las Aletas
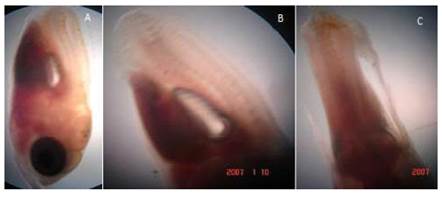
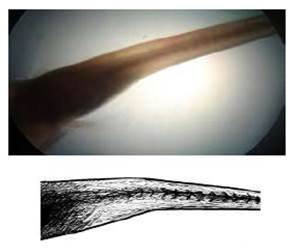
Agenesia caudal
Ausencia de la aleta caudal, debido principalmente a la falta de formación de su primordio en el embrión. Existe una reducción de las vértebras (3-4) con respecto a alevines normales que presentan alrededor de 30 vértebras. En los alevinos afectados se notó la falta de desarrollo de la aleta caudal, mas no del total del pedúnculo caudal (Figura 4). En algunos casos estaba presente un vestigio muy primitivo, lo que pudo haber sido un desarrollo incompleto de la aleta caudal. Algunos especímenes que presentaron esta anomalía llegaron a desarrollar hasta adultos. La frecuencia siempre estuvo por debajo del 1%.
Malformaciones de la Columna Vertebral
Escoliosis
La deformación se caracterizó por presentar una desviación o curvatura anormal de la columna vertebral, por lo general a nivel de las primeras vértebras, que afectaba la longitud del cuerpo. Las larvas afectadas llegaron a la etapa adulta, pero presentaban problemas de desplazamiento, dado que, al nadar, giraban en un mismo punto (Figura 5). La anomalía se observó en larvas de 0.8-10 mm de longitud y con escasa frecuencia (<1%).
Lordosis
Las larvas presentaron una curvatura hacia delante de la columna vertebral y que, al mirarla de costado, ésta se ve inclinada hacia atrás. Así mismo, se observa una angulación ventral y una notable desviación dorsal del pedúnculo caudal. Esta curvatura se da principalmente en las vértebras torácicas de manera que la zona baja del tórax adopta una forma cóncava (Figura 6). Las malformaciones se presentaron principalmente entre las vértebras 7 y 13, siendo más pronunciado entre las vértebras 8 y 11, afectando un mínimo de 2 y un máximo de 5 vértebras consecutivas. El ángulo de curvatura espinal varió en función de la localización (mayormente entre 50 y 70º, pudiendo alcanzar 84º de desviación). Las larvas sobrevivieron hasta la etapa adulta.
Las larvas con este tipo de malformación mantienen una completa normalidad de sus órganos internos. Solo se observa un desgate de la musculatura en la región ventral. La malformación se presentó en larvas con tallas de 0.8-10 mm de longitud total y en una frecuencia menor al 1%.
Malformaciones del Saco Vitelino
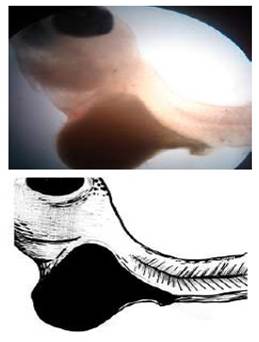
Megalovitelo
Esta malformación se define como un excesivo tamaño del saco vitelino (205 ± 5 µm) con relación al tamaño total de la larva (320 ± 10 µm).
Las larvas que presentaban esta anomalía generalmente eclosionaban muertas o morían entre el 1° y el 3°r día de haber eclosionado. Además, la mayoría de estas larvas presentaban todo el cuerpo enrollado sobre el saco vitelino (Figura 7A), y la forma del cuerpo no correspondía al de una larva normal (Figura 7B, y las estructuras corporales estaban poco desarrolladas; por ejemplo, el pedúnculo caudal (Fig. 7C).
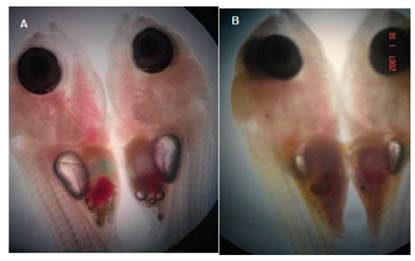
Agenesia vitelina
Esta malformación es la ausencia total o parcial del saco vitelino en las larvas recién eclosionadas. Se observaron larvas que tenían un saco vitelino muy rudimentario. Algunas larvas presentaron estructuras rudimentarias de lo que podría ser el remanente del saco vitelino (Figura 8A). Otra malformación observada en estas larvas es la disposición siempre abierta de la estructura bucal (Figura 8B). Estas larvas mueren al cabo de 1 a 2 días de eclosionadas.
Disposición posterior del saco vitelino
Esta malformación se caracteriza por que la ubicación del saco vitelino por detrás del orificio anal (Figura 9) y con presencia de una microvitelosis. Estas larvas no logran sobrevivir más de 48 horas después de la reabsorción total del saco vitelino. La frecuencia fue menor del 1% del cultivo.
Malformación de las Estructuras Bucales
Prognatismo inferior
Esta malformación es una proyección de la mandíbula por delante de un plano tangente a la parte anterior de la cabeza y es perpendicular a su vez a un plano horizontal (Noden y Lahunta; 1990). Se observó que la mandíbula sobresalía en 2/5 partes del tamaño total de la mandíbula (Figura 10).
Poliembrionía
Dentro de este grupo se encontraron, aquellos que formaban una sola estructura, y según el nivel de la unión corporal, algunos en forma de «H» denominados teratópagos y otros unidos en forma de «Y» llamados teratodymos (Adler, 1974). Según Petrescu-Mag et al. (2011), estas deformaciones dobles se denominan onfalopagias y pueden ser epigástricas cuando las larvas se encuentran unidas ventralmente a nivel de la zona vitelina, Teratópagos o anacatadídimos y onfalopagias epigastro-caudal cuando están unidas ventralmente a nivel de la región vitelina y caudal. Esta anomalía no fue frecuente en los sistemas de incubación (<1%).
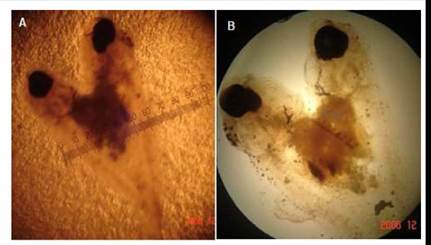
Teratópagos o anacatadídimos
Las larvas se encontraron unidas simétricamente, cara a cara, de tamaño similar, y con longitudes que variaron entre 142 y 147 μm. Cada ejemplar mantuvo su circulación sanguínea, los órganos y estructuras anatómicas por separado; tanto en la región encefálica y troncocaudal. La conexión solo fue a nivel de la región abdominal, por intermedio de la pared del saco vitelino; es decir, por la somatopleura (ectodermo más la hoja somática del mesodermo lateral) y la esplacnopleura (endodermo más la hoja del mesodermo lateral), compartiendo la masa de vitelo y la cavidad celómica (Figura 11).
Suelen llegar a sobrevivir hasta el término de la reabsorción del saco vitelino. Posteriormente, al presentar dificultades en el nado y búsqueda de alimento llegan a morir. Esta anomalía presentó una muy baja frecuencia en los sistemas de incubación.
Teratodymos, dicefagos o catadídimos
Las larvas se encuentran fusionadas a nivel de la región vitelina, así como por los tejidos de la musculatura de la región caudal (Figura 12), conformando una «Y». Ambas larvas tenían un tamaño similar (140 y 145 µm). Las larvas se encuentran mirándose ventralmente y entre las cabezas forman un ángulo de 40 a 60°. Ambos ejemplares mantienen individualmente los órganos y estructuras anatómicas por separado. En ambos casos, suelen llegar a sobrevivir hasta el término de la reabsorción del saco vitelino, tienen dificultades para el nado y en la ingesta de alimento, por lo que tienden a morir al poco tiempo.
DISCUSIÓN
Tave et al. (2011) describen cerca de 31 anormalidades en O. niloticus, principalmente en etapas juveniles y adultas, de las cuales ocho se han podido observar en este trabajo, pero en etapas larvales. Estas malformaciones no son propias de la tilapia, sino que se presentan en todas las poblaciones de peces (Dawson 1964, 1966, 1971; Dawson y Heal, 1976; Afonso et al., 2000, Verhaegen et al., 2007; Arguello et al., 2014; Wosnick et al., 2019).
Las malformaciones están asociadas a la intensificación del cultivo, a condiciones medioambientales desfavorables (temperatura, pH, velocidad de la corriente, hipoxia), desbalances nutricionales, enfermedades y factores genéticos (Andrade et al., 1996; Izquierdo et al., 2001, 2010; Cahu et al., 2003; Fraser y de Nys, 2005; Verhaegen et al., 2007; Georgakopoulous et al., 2010; Sajeevan y Thoranam, 2016; Rosas et al., 2019; Wosnick et al., 2019). Según sea el caso, pueden ser clasificadas como aquellas que afectan a los tejidos blandos (anoftalmía, ciclopía, agenesia caudal, megalovitelo, agenesia vitelina, disposición posterior del saco vitelino, teratópagos y teratodymos) o a los tejidos duros (escoliosis, lordosis, prognatismo inferior) (Godoy, 2015).
Todas estas anormalidades se pudieron observar durante la incubación artificial de las larvas de O. niloticus. Cabe indicar que las densidades de cultivo en las incubadoras se encontraron entre 4 y 16 embriones/m3, densidades inferiores a las reportadas por Prieto yOlivera (2002) de 1000 huevos.L-1 y por De Silva et al. (2015) de 500 embrioneslarvas.L-1). Los parámetros fisicoquímicos del agua se encontraron dentro de los estándares establecido para incubación de las ovas-embriones, al igual que los nutrimentos para los reproductores de esta especie (Tsadik y Bart, 2007; Bhujel et al., 2007), de allí que la densidad, calidad de agua y la dieta no podrían ser las causales de estas malformaciones. Por otro lado, Tave et al. (2011) indica que estas anormalidades pueden ocurrir con mayor frecuencia en especies hibridas, siendo este el presente caso donde las larvas que presentaron estos problemas procedieron de reproductores híbridos.
Según Climent (2004) y Hamori (1983), la escoliosis y la lordosis son desviaciones anormales de la columna vertebral, que pueden variar entre leves a graves. Algunas deformidades esqueléticas son explicadas a través de modelos unigénicos, recesivos o dominantes, como es el caso de la lordosis y fusiones de vértebras en tilapia del Nilo (Oreochromis nilotica) y en guppy (Poecilia reticulata) (Rosenthal y Rosenthal, 1950; Lodi, 1978; Petrescu-Mag et al., 2011), o por modelos poligénicos para una deformidad a modo de giba en salmón del Atlántico (McKay y Gjerde, 1986). En el caso de la dorada (Sparus aurata L), una triple deformidad de la columna vertebral (lordosisescoliosis-cifosis) ha sido asociada a la estructura familiar (Afonso et al., 2000). Los resultados del presente estudio están de acuerdo con los obtenidos por Chatain (1994) y Divanach et al. (1996) respecto a la ubicación y número de vértebras afectadas por la lordosis.
Se evidenciaron dos grupos de siameses, los cuales estuvieron unidos hasta la eclosión y reabsorción del saco vitelino. Según Teraoka et al. (2003), esto ocurre en peces a partir de un solo zigoto y que se encuentran dentro de una misma membrana embrionaria. Por otro lado, Noden y Lahunta (1990) indican que la citocinesis se presenta tardíamente, y esto ocasiona que no se dividan correctamente las estructuras celulares, de allí que, las larvas al eclosionar compartan algunas estructuras u órganos. Con respecto a la viabilidad de los peces con este tipo de malformaciones congénitas, Laale (1984) indica que una trucha marrón Salmo truta bicéfalo sobrevivió hasta 7.5 años llegando a alcanzar 203 mm de longitud, mientras que Paredes (2005) indica que un siamés Melanochromis auratus llegaron a sobrevivir por dos años; hecho que no se ha evidenciado en el presente estudio donde los siameses murieron al terminar la reabsorción del saco vitelino.
La aparición de larvas anómalas de O. niloticus en los sistemas de incubación que no estaba prevista. Por otro lado, no hay mucha información a nivel de malformaciones en larvas de peces de cultivo en ambientes continentales y en particular para O. niloticus. Existen reportes principalmente para peces marinos (Boglione et al., 2001, 2013; Arguello et al., 2014; Prestinicola et al., 2014; Godoy 2015) sobre este tipo de anormalidades.












 uBio
uBio