INTRODUCCIÓN
El paiche (Arapaima gigas) pertenece a la familia Arapaimidae. Es una de las especies de peces de agua dulce de mayor importancia económica en el Perú debido al potencial mercado que representa en la Unión Europea, Estados Unidos y Japón. Se encuentra distribuido en las regiones tropicales de agua dulce de América del sur, especialmente en Perú, Bolivia, Guayana y Brasil, particularmente en las cuencas hidrográficas de los ríos Amazonas y Tocatins-Araguia (Carvajal-Vallejos et al., 2017). Puede llegar a pesar 10 kg el primer año de vida y alcanza la edad reproductiva a los 4 años (Da Silva y Duncan, 2016).
Los datos poblacionales de esta especie son desconocidos según la IUCN (Kirsten et al., 2018). No obstante, su población ha sufrido una drástica disminución según datos de desembarques, toda vez que la captura de paiche representó el 6% de la captura total de peces amazónicos en 1984 y en 2016 solo representó el 0.5% del desembarque total de la región amazónica (Garcia-Dávila et al., 2018). Por ese motivo, en 1996, el INRENA impulsó programas de protección contra la pesca ilegal a la especie en la Reserva Nacional Pacaya Samiria (Adler et al., 2003). Años después, se observó que estos programas dieron buenos resultados, porque entre 2010-2018 hubo una tendencia a la recuperación de la población silvestre de paiche (PRODUCE, 2018).
Se han llevado a cabo diversos trabajos de investigación en el ámbito reproductivo a fin de obtener un mayor entendimiento de su biología reproductiva (Godinho et al., 2005; Amaral 2009; Lopes et al., 2013). Morfológicamente, se ha descrito que el paiche posee un único ovario funcional, localizado en el lado izquierdo de la cavidad celómica, además de presentar múltiples pliegues transversales, en los cuales se desarrollan los folículos ováricos de forma asincrónica, debido a que el tipo de desove en esta especie es parcial (Amaral, 2009). Histológicamente, el proceso de oogénesis ha sido caracterizado según ciertos criterios de clasificación de peces teleósteos: tamaño, cantidad y distribución de varias inclusiones celulares, presencia de gránulos de vitelo y morfología de los cromosomas (Rocha M y Rocha E, 2006). Sin embargo, no existe información sobre el desarrollo folicular en el crecimiento, tal y como se conoce en otras especies de teleósteos (Rocha M y Rocha E, 2006). La insuficiente información disponible acerca de la biología reproductiva de la especie trae como consecuencia un manejo inadecuado de programas de reproducción según la edad del pez, dificultando la obtención de alevinos (Monteiro et al., 2010).
El presente estudio tuvo como objetivo determinar el desarrollo de las diferentes fases foliculares del paiche con respecto a la edad de los individuos, basado en un análisis microscópico y la determinación de la frecuencia de folículos vitelogénicos. Esto permitirá determinar la edad en que comienzan a desarrollar aparentes características compatibles con un ovario maduro.
MATERIALES Y MÉTODOS
Consideraciones Éticas
El manejo y eutanasia de los paiches se realizaron según lo indicado en la guía de la American Veterinary Medical Association de eutanasia para animales (AVMA, 2013), usando el compuesto metasulfonato de tricaína (MS-222). El proyecto fue aprobado por el Comité de Ética para el Uso de Animales de la Universidad Peruana Cayetano Heredia (UPCH).
Población Objetivo
La población objetivo del estudio fueron los ovarios de paiche recolectados en los meses de mayo-junio de 2018 en la piscigranja Amazon Harvest, distrito de San Juan Bautista, ciudad de Maynas, departamento de Iquitos, Perú. Se usó un muestreo por conveniencia debido a que la cantidad de ovarios estuvo limitada por la disponibilidad actual de los animales. Se recolectaron 9 ovarios de ejemplares de 12 meses, 13 ovarios de ejemplares de 18 meses y 4 ovarios de ejemplares de 24 meses.
Para evitar posibles variaciones en el desarrollo folicular, la toma de las muestras consistió en realizar tres cortes sagitales de ubicación anterior, medial y distal, con respecto al conducto urogentital (Chellappa et al., 2005). Las muestras fueron preservadas en formol al 10% y procesadas en parafina. Los cortes histológicos se hicieron a una longitud de 7 µm con un micrótomo Leica® (Sánchez, 2013) y teñidas con HematoxilinaEosina (H-E). La lectura para la interpretación de las láminas se realizó con un microscopio compuesto Boeco®, a 10x, y una cámara fotográfica incorporada al cabezal del microscopio con apoyo del software ScopeImage 9.0. Esto permitió realizar la medición de los folículos mediante objetivos que fueron calibrados por medio de una lámina a medidas de 50 µm. A fin de obtener una distribución normal del diámetro de los folículos, basándose en un valor de intervalo de confianza del 95%, se registraron las mediciones de al menos 30 folículos por fase folicular y por edad.
Análisis Estadístico
Se utilizó el análisis de varianza para cada una de las proporciones de las etapas foliculares con respecto a la edad, diámetros foliculares con sus respectivas etapas, diámetros foliculares de cada etapa folicular con respecto a la edad y, por último, las proporciones de atresia con respecto a la edad. Se determinó la diferencia estadística de las medias con la prueba de Tukey.
RESULTADOS
En este estudio se diferenciaron y clasificaron cuatro fases foliculares en A. gigas, basándose en la información descrita para esta especie por Amaral (2009), Godinho et al. (2005) y Lopes et al. (2013), además de la información descrita para peces teleósteos por Rocha M y Rocha E (2006) (Cuadro 1, Figura 1).
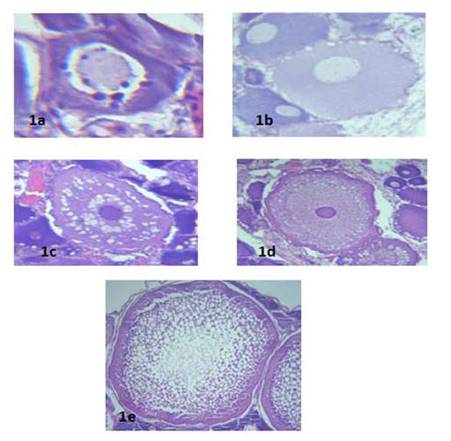
Figura 1 Cortes histológicos mostrando las fases foliculares en Arapaima gigas. a) Perinucleolar. b) y c) Vitelogénesis endógena I, d) Vitelogénesis endógena II, e) Vitelogénesis exógena. Coloración H-E. 10x
Se observó un mayor porcentaje de folículos en fase Perinucleolar (PN) en la edad de 12 meses, seguido de la edad de 1824 meses (Cuadro 2). De otra parte, a la edad de 18 meses se encontró la mayor cantidad de folículos en fase de vitelogénesis endógena 1 (VE1), y a la edad de 24 meses se encontraron diferencias significativas en diámetros foliculares (Cuadro 3).
Cuadro 2 Fases de folículos ováricos en especímenes de Arapaima gigas de tres edades
1 PN: Perinucleolar; VE1: Vitelogénesis endógena 1; VE2: Vitelogénesis endógena 2; VEX: Vitelogénesis exógena; ATR: Atrésico
a,b,c Letras diferentes dentro de filas indican diferencia significativa (p<0.05)
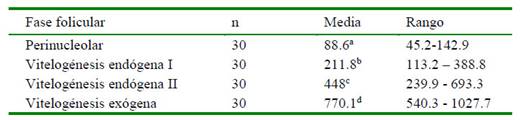
Cuadro 3 Diámetro de folículos ováricos de Arapaima gigas (µm), según la fase folicular

a,b,c,d Letras diferentes dentro de columnas indican diferencia significativa (p<0.05)
Los diámetros foliculares encontrados en la fase folicular VE1, en las edades de 18 y 24 meses, no presentaron diferencia significativa entre sí, pero a la edad de 12 meses se pudo observar diferencia significativa (Cuadro 4).
Cuadro 4 Diámetro de folículos ováricos (µm) de Arapaima gigas de acuerdo con la edad de los especímenes (n=30 folículos por grupo)

a,b Letras diferentes dentro de columnas indican diferencia significativa (p<0.05)
Se observaron folículos que fallaron en alcanzar la madurez completa, clasificándose su atresia en tipo α, pudiéndose observar que las paredes foliculares invaden el citoplasma (Figura 3b,c), atresia tipo β, donde se observa el engrosamiento de las capas foliculares (Figura 3e) y vacuolización intracelular (Figura 3a); así como atresia de tipo δ, donde se observa una pigmentación marrón en el folículo (Figura 3d).
DISCUSIÓN
El crecimiento primario o en el desarrollo de los folículos en fase perinucleolar (PN) se encuentra una transcripción constante por el núcleo, conllevando a una tinción basófila del citoplasma y el progresivo aumento del folículo, debido a la acumulación de RNA (Spadella et al., 2005), lo cual estaría vinculado a las características encontradas en esta fase folicular (Figura 1a).
El inicio del crecimiento folicular secundario en el paiche ha sido denominado últimamente como alvéolos corticales (Amaral et al., 2019). En otros estudios histológicos en diversas especies (Parenti et al., 2015; Moslemi-Aqdam et al., 2016; Jan y Ahmed, 2019) comparten asimismo esta denominación. En el estudio se encontraron folículos con presencia de estructuras esféricas vacías (Figura 1b), coincidentes con lo observado por West (1990), quien sustenta que estas estructuras se denominan alvéolos corticales y en tinciones con H-E aparecen vacías; además estos folículos ya contaban con una coloración acidófila, de modo que se consideró que este cambio era producido por el inicio del crecimiento folicular secundario. Es por esto que se consideró que esta fase debería denominarse vitelogénesis endógena I (VE1), mientras que el estadio consecuente, donde los folículos cumplen con las tres características necesarias (Figura 1c) para ser considerados dentro de la vitelogénesis temprana indicada en la literatura (MoslemiAqdam et al., 2016; Jan y Ahmed, 2019; Araújo et al., 2019), se le denominó vitelogénesis endógena II (VE2). Este tipo de clasificación también puede verse en especies como Salminus hilarii (Honji et al., 2008), Acipenser baerii (Le et al., 2018) y Merluccius merluccius (Treasurer, 2017).
El inicio del crecimiento folicular secundario, o el pase de la fase folicular PN a VE1, está fuertemente ligado a la secreción de niveles elevados de FSHr por la hipófisis (Kwok et al., 2005). Esta secreción estimula la aromatización de la testosterona por las células de la granulosa, favoreciendo la producción de 17â-estradiol (E2) (Valdebenito et al., 2011). El E2 está vinculado a la activación de procesos dentro del folículo o procesos endógenos, que estimularían a la formación de alvéolos corticales a través del cuerpo de Balbiani (Domínguez Castanedo y Uribe, 2019). Así también, la secreción de E2 está relacionada al crecimiento de los folículos ováricos dentro de la fase VE1 en salmónidos (Forsgren y Young, 2012) y soleidos (Solé et al., 2016). Por lo tanto, los ejemplares en este estudio podrían estar afectados por una secreción elevada de FSHr y E2 a partir de la edad de 18 meses. Esto explicaría el menor tamaño encontrado en los folículos en fase VE1 a los 12 meses con respecto a los de 18 y 24 meses, a pesar de encontrarse en la misma fase folicular (Cuadro 4) y la mayor proporción folicular en la fase PN a los 12 meses (Cuadro 2), debido a una menor activación. Asimismo, también es posible ver una disminución gradual en el total de folículos ováricos en la fase PN, lo que plantearía la interrogante de determinar la edad en que las hembras de paiche cuenten aún con una reserva folicular para un desove.
Consecuentemente con la maduración folicular o el pase de la VE2 a la VEX, se encuentra principalmente involucrado el E2, que estimula al hígado para la producción de vitelogenina, siendo transportada por el flujo sanguíneo para finalmente ser endocitada y procesada por los folículos ováricos (Hiramatsu et al., 2015).
No se logró distinguir las capas foliculares de la granulosa y de la teca, pero los resultados concuerdan con lo planteado por Valdebenito et al. (2011), quienes indican que solo son distinguibles con la observación ultraestructural. La composición de la zona radiata fue imprecisa y difícil de observar y su coloración acidófila (Figura 2) presenta características compatibles con un complejo de proteínas, por lo que se tendría que utilizar tinciones específicas en el estadio de VEX para definir su composición. Por otra parte, su aparición se relaciona con los cíclidos (Varela et al., 2017), ciprínidos (Jan yAhmed, 2019) y carácidos (Honji et al., 2009) debido a que el proceso de zonagénesis precede al proceso de vitelogénesis exógena, tal y como se observó en el presente estudio en que su aparición comenzó en el estadio de vitelogénesis endógena II (Figura 1d).
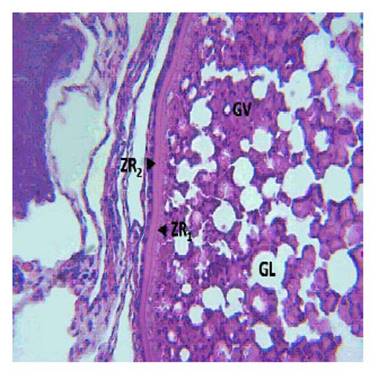
Figura 2 Corte histológico que muestra las capas de un folículo ovárico en Fse de vitelogénesis exógena de Arapaima gigas. CF: Capa granulosa y Teca; ZR : Zona radiata externa; ZR : Zona radiata interna; GV: Glóbulos de vitelo; GA: Glóbulos lipídicos. Coloración H-E. 40x
Además, a diferencia de Lopes et al. (2013), quienes consideran que la etapa folicular más avanzada está representada por el llenado completo de vitelo en el citoplasma, en esta clasificación solo se consideró la presencia de glóbulos lipídicos y vitelo en la fase VEX. Debido a los cambios introducidos en la clasificación, no pudo tomarse como referencia los valores del diámetro folicular reportados por Godinho et al. (2005) y Lopes et al. (2013). Sin embargo, se debe mencionar que el presente estudio contó con un número de muestra inferior a la utilizada en las otras investigaciones y que los paiches utilizados no habían alcanzado la edad reproductiva, por lo que no se logró observar folículos maduros y, consecuentemente, no pudieron llegarse a observar algunas características que las investigaciones anteriores discuten.
Según Hunter y Macewicz (1985), se distinguieron tres tipos de estadios de atresia en este estudio: tipo α (Figura 3b,c), tipo β (Figura 3e) y tipo δ (Figura 3d). De estos, el más importante es el estadio á en folículos vitelogénicos, dado que un análisis de la proporción de estos en animales maduros podría indicar una temporada de desove próxima o la edad de reproducción.
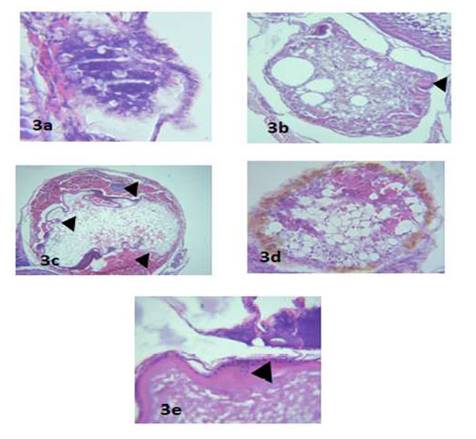
Figura 3: Cortes histológicos que muestran folículos en estadio de atresia en Arapaima gigas. a) Vacuolización citoplasmática. 40x; b) Disrupción de las capas foliculares e invasión en el citoplasma. 10x; c) Infiltrado inflamatorio, eritrocitario y disrupción de las capas foliculares. 10xM d) Cambios degenerativos de las capas foliculares e intrusión en el citoplasma. 10x; e) Engrosamiento de la teca. 40x. Coloración H-E
Las características microscópicas del ovario en los ejemplares de 12 y 18 meses corresponderían con individuos que estarían dentro de la etapa de maduración inicial del ovario según lo reportado por Lopes et al. (2013) e histológicamente por Godinho et al. (2005). Por otro lado, concuerda con lo propuesto por Blancas et al. (2008) en Chirostoma humboldtianum, quienes hallan un mayor porcentaje de folículos previtelogénicos a la edad de 12 meses, característica de ovario inmaduro.
Las características del ovario en los ejemplares de 24 meses indican que podrían encontrarse en la etapa de ovario en maduración avanzada según Lopes et al. (2013). En forma similar, desde el punto de vista histológico debido a la presencia de múltiples etapas foliculares y una tendencia al aumento de las etapas foliculares más avanzadas (Godinho et al., 2005; Blancas et al., 2008). Las diferentes fases foliculares encontradas en los ejemplares de 24 meses expresan, asimismo, un crecimiento folicular asincrónico, que concuerda con las observaciones hechas hasta el momento sobre la especie (Chu-Koo et al., 2008; Amaral, 2009), aunque también este tipo de crecimiento folicular también podría explicarse por el tipo de alimentación y por la presencia de ondas foliculares (Durham y Wilde 2008; Rideout y Tomkiewicz, 2011).
En resumen, el análisis en conjunto del desarrollo histológico folicular junto a un estudio de niveles hormonales de E2 y FSHr en hembras de paiche y el análisis de la proporción de folículos atrésicos vitelogénicos en esta especie podrían ser herramientas clave para la mejora del manejo reproductivo en esta especie.
CONCLUSIONES
El diámetro folicular para la fase perinucleolar fue similar entre los ejemplares de distintas edades del paiche Arapaima gigas.
Se encontró un porcentaje similar de folículos en atresia en especímenes de tres edades (12, 18 y 24 meses)
Las etapas foliculares más avanzadas son observables a partir de los 24 meses de edad












 uBio
uBio 


