INTRODUCCIÓN
Los defectos congénitos del tubo neural (DTN) son condiciones de etiología multifactorial que pueden surgir como resultado de la interacción de agentes genéticos, infecciosos, ambientales, raciales, físicos y químicos, así como también por deficiencia o alteración en el metabolismo del ácido fólico (David et al., 1989; Juárez et al., 2014; Raksaseri y Klomkleaw, 2017). La malformación caracterizada por una protrusión del contenido encefálico a través de un defecto del cráneo en la línea media se denomina cefalocele y, según su contenido y ubicación, se puede clasificar como meningoceles craneales (contienen solo leptomeninges y líquido cefalorraquídeo) y encefaloceles (contienen parénquima cerebral) (Gupta y Elizabeth Ross, 2017).
El término meningoencefalocele (MEC) describe una herniación de tejido cerebral y meninges a través de un defecto en el cráneo por una de las suturas o por falta de consolidación de los huesos que forman la bóveda craneal (David et al., 1989; Lazzerini et al., 2017) y los individuos afectados sucumben poco después del nacimiento (Martlé et al., 2009). El MEC puede ser el resultado de un trastorno congénito o adquirido, generalmente de etiología desconocida y ha sido observado en todas las especies de animales domésticos, aunque más comúnmente en el cerdo (Lahunta y Glass, 2009). Se han reportado casos de meningoencefalocele frontoetmoidal en perros y gatos y se ha sugerido que estos defectos de desarrollo pueden involucrar, al menos, trastornos genéticos que inducen un proceso defectuoso del desarrollo neuroectodérmico (Sponenberg y GrafWebster, 1986; Jeffery, 2005; Martlé et al., 2009; Raksaseri y Klomkleaw, 2017).
Con la finalidad de investigar la posible asociación entre un defecto del tubo neural y la existencia de alguna anomalía cromosómica, se presentan los resultados de un estudio citogenético realizado en dos hembras caninas de raza Pinscher Miniatura que murieron después de nacer, una con MEC y la otra aparentemente normal.
CASO CLÍNICO
El caso clínico fue reportado en la clínica docente de especialidades médicas veterinarias de la Universidad Técnica de Machala, en el Cantón Machala, provincia El Oro, Ecuador, y el análisis citogenético se realizó en el laboratorio de biotecnología e investigación de la misma institución.
Una hembra canina Pinscher Miniatura de 1.5 años y 3.2 kg de peso corporal que había parido a un cachorro sano 24 horas antes, ingresó por urgencia con signos de distocia. El análisis ecográfico reveló la presencia de dos fetos que presentaban latidos cardíacos. La perra fue intervenida por cesárea, extrayendo dos hembras vivas que pesaban 150 g.
Los neonatos mostraron signos de hipoxia con mucosas cianóticas. Los métodos de reanimación empleados no tuvieron éxito y ambos murieron 5 minutos después de su extracción. Uno de los individuos presentó apariencia normal, mientras que el otro mostró falta de consolidación de los huesos a nivel de las suturas parieto-occipitales, sin piel, con una protuberancia de masa cerebral de 18 mm de ancho y 22 mm de largo, cubierta por meninges. La protrusión presentó color rosado, con áreas rojizas debido al derramamiento de sangre contenida debajo de la duramadre (Figura 1). Al examen físico su cabeza era más alargada que la correspondiente a la raza al nacer y las otras estructuras no presentaron cambios relevantes.

Figura 1 Vista lateral y dorsal del meningoencefalocele en un cachorro hembra Pinscher Miniatura recién nacida
Cultivo de linfocitos y obtención de células metafásicas
Con autorización del propietario de la mascota, se obtuvo sangre de ambos cachorros por punción cardíaca mediante jeringa hipodérmica heparinizada. La sangre se mantuvo durante 45 minutos a temperatura ambiente para permitir la sedimentación espontánea de los eritrocitos.
Para la obtención de los cromosomas mitóticos se empleó la técnica para cultivos de células sanguíneas humanas (Moorhead et al., 1960) con las siguientes modificaciones: en condiciones asépticas, la capa de plasma rica en leucocitos sobre los eritrocitos fue agregada a 5 ml de medio PB-Max (Gibco), y fue mezclada con movimientos circulares e incubada en estufa a 38 °C durante 48 h. Cada día se verificó la ausencia de contaminación en el cultivo y se homogeneizó delicadamente con movimientos circulares durante 3 s para suspender las células. Al concluir el periodo de incubación, a cada uno de los cultivos se añadió 100 µl de solución de colchicina 0.016% y se volvió a incubar durante 30 min a 38 °C. Luego, la suspensión celular fue transferida a un tubo cónico y centrifugada a 1200 rpm durante 10 min. El sobrenadante fue descartado y las células suspendidas en 10 ml de solución de KCl 0.075 M, mezclando suavemente con pipeta Pasteur. La suspensión fue incubada a 38 °C durante 20 min y se agregaron 10 gotas de fijador Carnoy frío, recién preparado (3 partes de metanol: 1 parte de ácido acético glacial), homogeneizando cuidadosamente para evitar la formación de grumos. Luego de 2-3 min se duplicó el volumen hasta 10 ml con fijador frío. La suspensión se centrifugó a 1200 rpm durante 10 min y el sobrenadante fue remplazado por 5 ml de fijador nuevo frío. Este último paso se repitió dos veces más y las células finalmente fueron suspendidas en 0.5 ml de fijador.
Obtención y análisis de cariotipos
Desde aproximadamente 10 cm de altura se dejó caer una gota de la suspensión celular sobre portaobjetos limpios, dejando secar las extensiones celulares a temperatura ambiente. Las preparaciones fueron teñidas durante 10 min con colorante de Giemsa diluido al 10% en tampón fosfato (pH 6.8).
Las células metafásicas fueron fotografiadas usando un microscopio Olympus CX31 equipado con una cámara digital Motic, empleando el Software Motic Images Plus 2.0.
Solo se consideraron las metafases que presentaron una distribución uniforme de los cromosomas en forma circular o ligeramente elíptica, sin elementos superpuestos. El conteo de cromosomas se realizó en las imágenes digitales por un solo observador, utilizando la herramienta de conteo del software Adobe Photoshop CC 2015. Los recuentos tabulados se analizaron con el software estadístico Statgraphics® Centurion XVI v. 16.1.18.
RESULTADOS Y DISCUSIÓN
Casos de meningocele congénito (MG) y MEC han sido reportados en caballos, cerdos, perros, gatos y cabras (Vogt et al., 1986; Sponenberg y Graf-Webster, 1986; Ohba et al., 2008; Lahunta y Glass, 2009), aunque con mayor incidencia en cerdos Large White (Cho et al., 2015). MG y MEC son Defectos del Tubo Neural (DTN) congénitos, cuyas patogénesis no son bien conocidas porque, por un lado, la evidencia sobre su etiología y origen es contradictoria y, por el otro, hay una falta de información debido a la disponibilidad limitada de modelos animales (Rolo et al., 2019). En humanos, los DTN congénitos son malformaciones que se presentan con una incidencia de 0.5-2 por cada 1000 nacimientos y hay evidencias de que los fetos con estas malformaciones conllevan un riesgo de anomalías cromosómicas que representa <10% de todos los defectos (Chen, 2007; Greene et al., 2009).
El análisis de 156 metafases (75 del ejemplar con la patología encontrada y 81 del ejemplar sin esta patología) mostró un complemento femenino unimodal típico 2n = 78 (76, XX) en el 95.06% de todas las metafases en el cachorro normal, mientras que el cachorro con MEC mostró un cariotipo multimodal con tres líneas celulares distintas: 2n = 78 (36%); 77 (28%); 76 (10.67%). El 1 % de células restantes correspondió a células con menos de 76 cromosomas, lo que indica un caso de mosaicismo cromosómico (Figura 2).
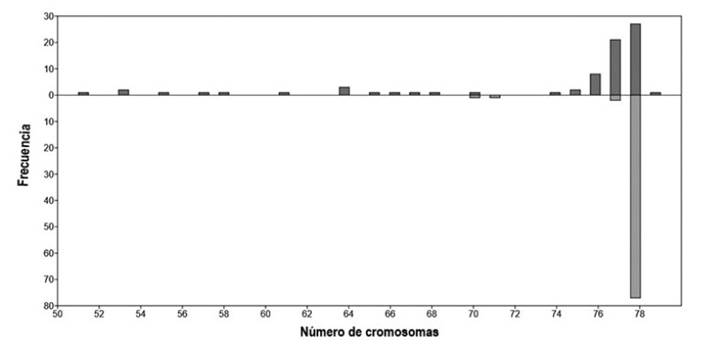
Figura 2 Distribución de los números de cromosomas en dos cachorros hembra Pinscher Miniatura con (arriba de la línea horizontal) y sin meningoencefalocele (debajo de la línea horizontal)
La inestabilidad del cariotipo se ha definido como una alteración progresiva que afecta a una población celular, ya sea in vivo o in vitro (Dutrillaux, 2000). Esta anormalidad cromosómica generalmente ocurre cuando hay un error en la división celular que resulta en células con muy pocas o demasiadas copias de un cromosoma. La mayoría de las anomalías cromosómicas se originan en los gametos, pero algunas ocurren después de la concepción y durante el desarrollo del embrión, lo que resulta en líneas celulares que tienen la anormalidad y otras que no (Coerdt et al., 1997).
En la Figura 3 se muestra el diagrama de caja y bigotes, en el que se indica la mediana y la dispersión de los datos en cada caso, lo que revela un cariotipo diploide predominantemente normal (2n = 78) en el cachorro normal, mientras que en el cachorro afectado con MEC se observa una evidente variabilidad en el número de cromosomas. La prueba U de Man-Whitney para la comparación de las medianas del número de cromosomas entre el neonato normal (mediana = 78; rango medio = 51.81) y el afectado con la patología (mediana = 77; rango medio = 26.69) reveló diferencias significativas (p=2.8192x10-13).
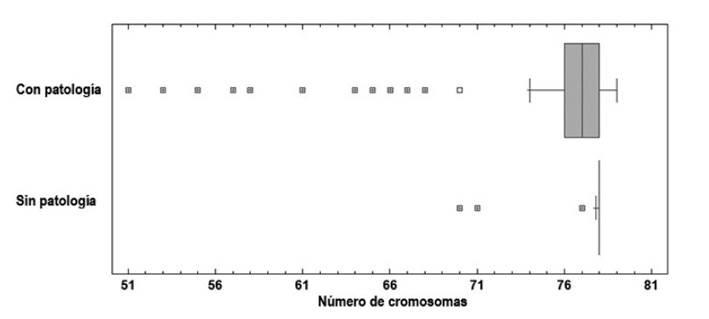
Figura 3 Gráfico de cajas y bigote. Se indica el número de cromosomas por célula en los neonatos hembra Pinscher Miniatura con y sin meningoencefalocele
En las metafases con cariotipos alterados fue posible verificar que la inestabilidad numérica afectó tanto a los cromosomas sexuales (único par metacéntrico) y los más grandes, correspondientes al primer par del complemento (Figura 4). También se pudo constatar que otros elementos cromosómicos diferentes a los anteriores pueden estar afectados, pero estos no pudieron ser identificados al no ser reconocibles debido a diferencias de tamaño, poniendo en evidencia que las alteraciones numéricas observadas podrían ser el resultado de procesos de nodisyunción aleatoria de los cromosomas.

Figura 4 Metafases de células de linfocitos de un cachorro hembra Pinscher Miniatura con meningoencefalocele - MEC (metafases hipodiploides: 4a, 4b, 4c, y diploide: 4d)
El perro es un modelo animal muy similar al humano, tanto del punto de vista fisiológico como clínicamente y cientos de condiciones caninas comunes han sido descritas como análogas a las enfermedades humanas (Hytönen y Lohi, 2016). Si bien en humanos se han identificado un buen número de anomalías cromosómicas en fetos con DTN diagnosticadas ecográficamente, como por ejemplo, la inversión 46, XX, translocación 47, XX, t (13; 14), 46, XY, + mar * y trisomías del cromosoma 13 y 18 (47, XX, + 13; 47, XX, + 18; 47, XY, + 18) (Sepulveda et al., 2004; Kant et al., 2011) entre otras, hasta ahora no se ha informado sobre mosaicismo cromosómico en perros afectados con DTN como el aquí descrito y, por lo tanto, este informe constituiría la primera evidencia de asociación entre MEC e inestabilidad numérica de los cromosomas en perros.












 uBio
uBio 

