INTRODUCCIÓN
La piscicultura es una de las alternativas con posibilidades de desarrollo productivo en la Amazonía (BCRP, 2017), no solo por la abundancia de espejos y cursos de agua, sino por las especies nativas promisorias, como la gamitana (Colosomma macropomum), la cual ha mostrado un mayor desarrollo en piscicultura semi intensiva en las últimas décadas en el Perú (Campos, 2015). Su importancia radica en la demanda por parte de la población rural y urbana, además de representar una alternativa a la pesca en los ríos, captura que se encuentra cada vez más limitada como consecuencia de la fuerte presión de pesca (FAO, 2016).
En la región Ucayali, la gamitana presenta características zootécnicas favorables para la crianza semi-intensiva; sin embargo, su calidad para la venta depende, entre otros, de los componentes sanitarios. En la crianza artificial, los peces se enfrentan a diversos agentes infecciosos, entre los que predominan los parásitos (Conroy, 2006), de allí la importancia de conocer las enfermedades parasitarias que puedan limitar la producción, desarrollo y expansión de la industria piscícola (Collins, 2000, Verján et al., 2001).
Entre los tejidos mayormente afectados por infecciones parasitarias en peces, se encuentran las branquias como parte del sistema respiratorio. Gutierrez y Martorelli (1999) indican que la relación entre las branquias y las enfermedades está determinada por tres factores; a) constante contacto con el ambiente externo; b) rica fuente de nutrientes y oxígeno rápidamente accesibles, y c) estructura histológica simple, con respuesta limitada a estímulos nocivos. La alteración de la función branquial puede ocurrir principal y directamente por un estímulo patogénico a la superficie respiratoria o por el flujo del agua, vía circulación branquial. Esto afecta varias de sus funciones como el intercambio gaseoso, la osmoregulación, el equilibrio ácido-base y la excreción de productos nitrogenados (David y Vasquez, 2010).
Entre los parásitos frecuentes en branquias de peces de cultivo o de río se encuentran los trematodos monogeneos (Dactylogyrus spp y Gyrodactylus spp), protozoarios (Ichthyophthirius multifiliis, Tricodinia sp y Piscinoodinium pillulare), y crustáceos (Ergasilus sp y Perulernaea gamitanae) (Schalch et al., 2005; Conroy, 2006). Los monogeneos ocasionan grandes pérdidas económicas en los sistemas de producción piscícola del mundo (Flores J y Flores R, 2003), siendo los de mayor riesgo los que parasitan las branquias, como los de la familia Dactylogyridae (Thatcher et al., 2006). Infestaciones por protozoarios en la piel y branquias también pueden generar problemas serios (Conroy, 2006).
Estudios sobre identificación de parásitos en branquias de gamitanas en centros piscícolas de Loreto, Perú, han demostrado grados moderados a severos de infección por monogeneos y protozoarios (Alcántara et al., 2015). También se han reportado lesiones histopatológicas en branquias (Vargas et al., 2015) y alteraciones hematológicas (Rocha et al., 2018). A pesar de esto, se carecen de estudios sobre identificación de parásitos frecuentes en branquias en el trópico peruano. El objetivo del presente trabajo fue determinar la frecuencia y carga parasitaria en branquias de alevinos de gamitana mediante exámenes directos, en tres establecimientos piscícolas de crianza semi-intensiva de la región Ucayali.
MATERIALES Y MÉTODOS
Lugar del Estudio
Se seleccionaron tres establecimientos piscícolas de crianza semi-intensiva que proveen a los productores locales de semillas de alevinos de gamitana. Estos criaderos se encuentran ubicados en las márgenes de la carretera Federico Basadre, provincia de Coronel Portillo, departamento de Ucayali, Perú. El procesamiento de muestras se llevó a cabo en el Laboratorio de Parasitología de la Estación Experimental del Instituto Veterinario de Investigaciones Tropicales y de Altura (IVITA Pucallpa) de la Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos. El estudio se desarrolló entre febrero y mayo de 2014.
Los Alevinos y su Manejo
Se evaluaron 60 alevinos de gamitana (Colossoma macropomum) de cada establecimiento piscícola (E1: 35 días; E2: 40 días y E3: 45 días). Los peces estuvieron clínicamente sanos, fueron criados en condiciones similares de densidad de carga por estanque y su alimentación fue a base de alimento balanceado. Las tallas oscilaron entre 4.59 y 5.23 cm. de longitud total (LT), con pesos medios entre 2.14 y 3.05 g para los ejemplares de los tres establecimientos.
Los estanques de los tres establecimientos eran de tierra. En E1 tuvieron poca vegetación y la fuente de agua provino de un embalse, en E2 no tenían vegetación y el agua provino de pozo, y en E3 tuvieron muy poca vegetación y el agua igualmente provino de pozo.
Recolección de los Peces y Tejidos
Los alevinos fueron capturados mediante procedimientos rutinarios de pesca, y luego fueron inducidos a relajación completa por inmersión en una infusión de polvo de clavo de olor (Syzygium aromaticum) (3 g/l) que contiene Eugenol. Esta solución no altera la identificación y viabilidad de los parásitos, tal como menciona Boijink et al. (2017). La concentración de la infusión se obtuvo mediante ensayos previos para determinar la concentración apropiada para mantener una relajación por tres minutos, tiempo suficiente para recolectar los datos biométricos (talla y peso) y realizar el sacrificio.
Para el sacrificio, se realizó un corte medular en la zona dorsal anterior a nivel del borde caudal del opérculo, utilizando una tijera de disección para peces pequeños o un bisturí para peces grandes. Siguiendo las recomendaciones de Conroy (2006), se seccionaron los opérculos y se hizo un corte en la zona ventral a nivel de la inserción de las branquias, se extrajeron todas las capas branquiales con pinzas planas y se colocaron en una placa Petri con 5 ml de agua de transporte o suero fisiológico (NaCl al 0.9%), para la observación directa. Luego se colectó mediante sección, la zona apical de la segunda capa branquial de ambos lados, sin considerar el cartílago branquial, para la observación microscópica.
Evaluación de los Tejidos
Siguiendo la metodología descrita por Conroy (2006), se realizó la observación visual directa con una lupa a 2x para separar los crustáceos de las capas branquiales en la placa Petri, utilizando pinzas quirúrgicas planas. La observación de trematodos monogeneos y protozoarios de la extensión de las secciones de las dos capas branquiales se hizo en láminas portaobjeto con un microscopio Zeiss Standard 20 (Alemania). Se adicionó una gota de suero fisiológico y se observó a 10x para detectar monogeneos; asimismo, se adicionó lugol parasitológico entre las laminillas para determinar formas compatibles con protozoarios.
Para la identificación de los diversos tipos parasitarios y formas libres se usó como guía lo descrito por Martins et al, (2001), Conroy (2006) y Thatcher et al. (2006). La frecuencia de casos positivos se determinó entre el número de alevinos con muestras positivas del total de evaluados por establecimiento. Para la carga parasitaria por monogeneos se realizaron ensayos previos para estandarizar los grados de infestación en nulo (0), leve (1-3 parásitos), moderado (4-7 parásitos) y severo (>8 parásitos), de la suma de parásitos encontrados en los tres campos ubicados en la porción basal, media y apical de las lamelas de las dos secciones apicales colectadas (6 campos); considerando un equivalente a lo reportado por Klinger y Floyd (2002).
Los grados de infestación tuvieron relación con la presencia de mucosidad en las laminillas branquiales y signos clínicos observados en los peces (presencia de mucosidad en infestación severa con boqueo, leve a no presencia de mucosidad en infestación moderada sin signos clínicos y no presencia de mucosidad en infestación leve sin signos clínicos). Si bien, cargas leves a moderadas de parasitosis en branquias no generan respuesta tisular destacable, se ha visto una reacción inflamatoria e hiperplasia leve de células epiteliales en infestaciones moderadas (Laterca y García, 1996)
La carga parasitaria para monogeneos se determinó siguiendo el protocolo mencionado. La carga parasitaria por protozoarios en los tejidos branquiales fue similar, pero sin que se hubieran realizado ensayos previos, debido a la presencia de protozoarios del agua no propios de los tejidos branquiales. Además, estas cargas no se asociaron a las reacciones tisulares observables en las branquias o con algún signo clínico evidente en los peces.
RESULTADOS
No se hallaron formas compatibles de crustáceos a la observación directa de las branquias, pero se hallaron ectoparásitos monogeneos adultos de la familia Dactylogyridae, compatibles al género Dactylogyrus en la observación a 40x. También se observaron estadios inmaduros y huevos de este tipo de parásitos (estructuras de forma ovalada, con presencia de un poro terminal) no considerados en los conteos. Asimismo, a 40x se observaron protozoarios ambientales del agua y protozoarios de la familia Oodiniaceae, compatibles con el género Piscinoodinium (Figura 1).
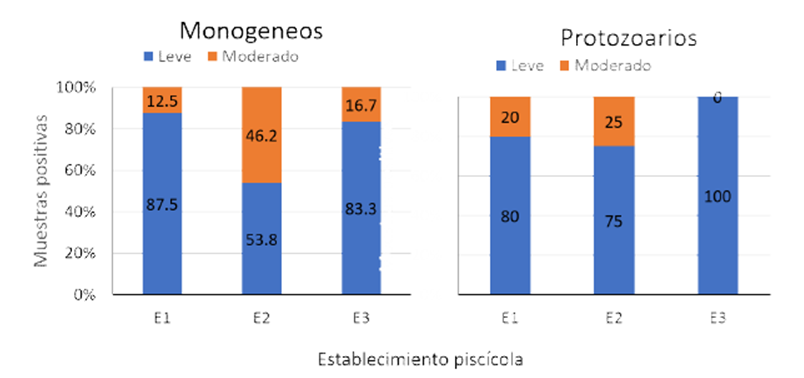
Figura 1 Parásitos encontrados en branquias de gamitana (Colossoma macropomum). a) Parásitos compatibles con monogeneos adultos, 10x; b) Dos ejemplares de monogeneos adultos compatibles al género Dactylogyrus spp, 40x (se observan los cuatro ocelos característicos de monogeneos adultos de este género); c) 1. Formas compatibles a huevos de monogeneos en estadios iniciales, 40x, 2. Formas compatibles con estadios inmaduros de Piscinodinium sp en el agua de transporte del tejido branquial, 40x
El E2 tuvo mayor frecuencia de muestras de branquias con ectoparásitos (87%), en comparación con E1 (28%) y E3 (18%) (p<0.05). Hubo una mayor frecuencia de monogeneos en las muestras de branquias de los E1 y E2, mientras que las frecuencias de monogeneos y protozoarios fueron similares en E3. De otra parte, se encontraron infestaciones mixtas en algunas muestras (Figura 2).
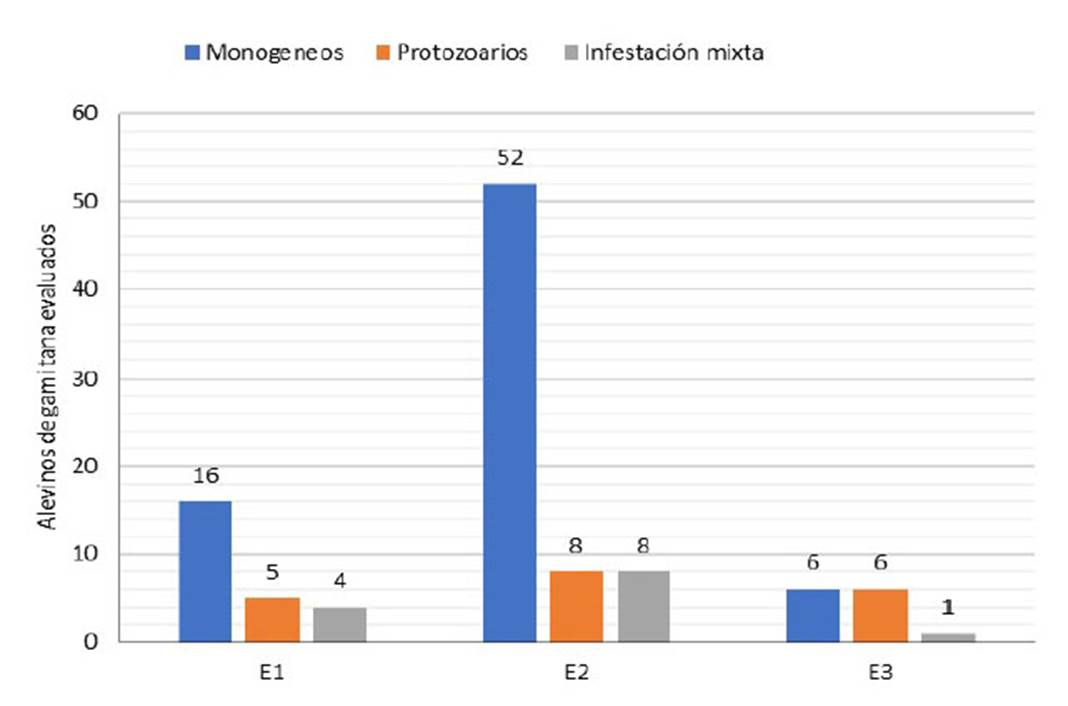
Figura 2 Frecuencia (n) de parásitos encontrados en branquias de alevinos de gamitana (Colossoma macropomum), por establecimiento piscícola (E)
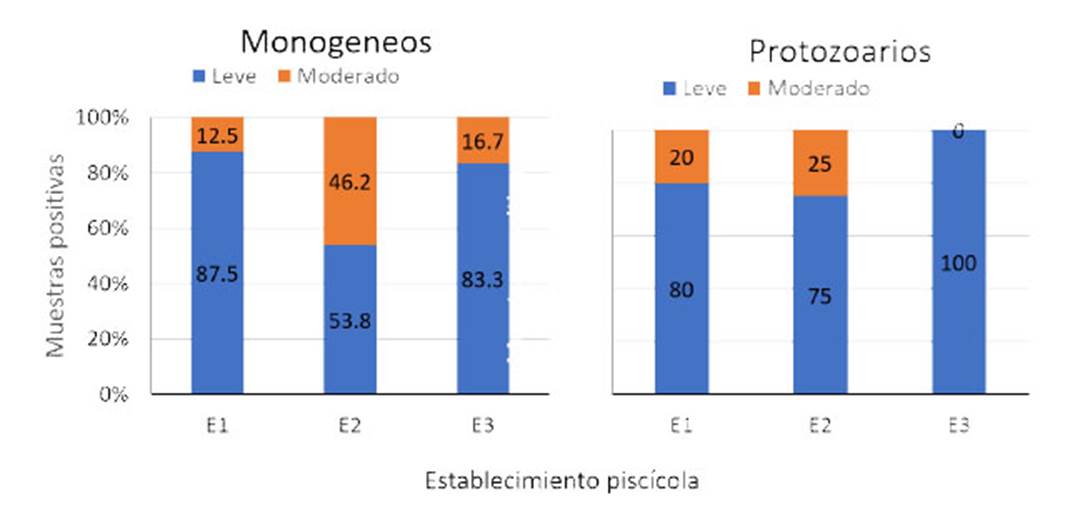
La carga parasitaria leve fue determinada mayormente en las muestras de branquias de los tres establecimientos. En los alevinos de los E1 y E3, igual o más del 80% de las muestras positivas correspondieron a cargas leves para ambos tipos parasitarios, a diferencia del E2, donde la carga leve fue de 53.8 y 75.0% para el total de muestras positivas para monogeneos y protozoarios, respectivamente (Figura 3).
DISCUSIÓN
Los estudios sobre identificación de parásitos en branquias de alevinos por métodos directos son escasos. Alcántara et al. (2016) reportaron trematodos y protozoarios en pacos (Piaractus brachypomus) y gamitanas, pero solo en un centro piscícola de Loreto; asimissimilares a lo descrito por Martins et al. (2001) y Flores J y Flores R (2003), quienes reportaron monogeneos y protozoarios a prevalencias elevadas, lo cual sugiere un peligro potencial de estos parásitos en peces de aguas tropicales y semitropicales.
Considerando que el sistema respiratorio en peces es el tejido más vulnerable para infestaciones parasitarias, Ringo y Bribeck, (1999) mencionan que las enfermedades por estas infestaciones no se manifiestan a menos que las condiciones del medio ambiente permitan la proliferación parasitaria; como en el caso de Mendoza et al. (2019) quienes indicaron que las pobres condiciones del agua de los estanques permitieron la proliferación de Piscinoodinium sp en branquias de gamitanas juveniles en un centro piscícola en Ucayali.
Según Collins (2000), las variedades de parásitos en peces de cultivo fueron mayores a las observadas en peces de río; sin embargo, en estos últimos se han reportado nuevas especies de parásitos de la familia Dactylogyridae en branquias de gamitanas (Morey et al., 2019). Por otro lado, los alevinos del presente estudio no mostraron signos clínicos, evidenciando que el hallazgo de un agente potencialmente patógeno en un hospedador no es sinónimo de enfermedad (Eslava e Iregui, 1999). Así mismo, la carga parasitaria leve encontrada podría explicar la ausencia de signos clínicos, pues como indican Klinger y Francis Floyd (2013), cargas severas de monogeneos en piel o branquias pueden provocar daños y mortalidades significativas.
Si bien, la presencia de monogeneos y protozoarios en branquias sugieren una pobre calidad del agua (Conroy, 2006), se observó la ausencia de crustáceos. Además, el hallazgo de protozoarios de vida libre en el agua, así como de Piscinoodinium sp en las branquias sugeriría que estos no requieren de huéspedes intermediarios para reproducirse (Soulsby, 1987).
La mayor carga parasitaria de monogeneos en E2 (Figura 2) sugiere un manejo sanitario de estanques deficiente (falta o inadecuado encalado antes de la siembra y menor calidad del agua), características consideradas de importancia en la piscicultura (FAO, 2011). Es posible que el agua de los estanques pueda tener una mayor dureza y turbidez, así como menor oxigenación por falta de vegetación, condiciones apropiadas para el desarrollo de ectoparásitos, que podría agudizarse por la alta densidad de peces y la falta de circulación periódica de agua (Flores J y Flores R, 2003).
Las técnicas utilizadas de evaluación microscópica directa de las branquias sonherramientas para determinar familias o géneros parasitarios (Eiras et al. 2006; Scholz, 2008), que pueden ser usadas como pruebas rutinarias en campo para el reconocimiento de parásitos frecuentes (Conroy, 2006), así como para determinar la carga y frecuencia de ectoparásitos en centros piscícolas (Alcántara et al., 2015).
Los resultados enfatizan las recomendaciones de SANIPES (2016) de mantener las condiciones adecuadas en el manejo sanitario de los estanques, el control de la calidad de agua, los niveles de oxígeno, temperatura, pH, flujo de agua y densidad poblacional, para el éxito de la crianza de alevinos en estos ambientes. Finalmente, la infestación de alevinos por parásitos en branquias, si bien no afecta la salud pública (Pulido e Iregui, 2009), los resultados del estudio realzan la importancia de monitorear los peces en los centros piscícolas, con el fin de garantizar que la venta de alevinos para engorde a los pequeños y medianos piscicultores de la región se encuentre sanitariamente óptima.












 uBio
uBio