INTRODUCCIÓN
La distomatosis hepática o fascioliasis es una enfermedad zoonótica de origen parasitario y distribución mundial (López et al., 2017), que afecta mayormente a los rumiantes y ocasionalmente al ser humano (Valderrama Pomé, 2016). Su agente etiológico es el trematodo Fasciola hepatica, un parásito del filo Platyhelminthes, clase Trematoda, orden Echinostomida y familia Fascioloidae (ITIS, 2019).
La fascioliasis es considerada como una de las enfermedades con mayor propagación a nivel mundial (Mas Coma et al., 2009), siendo causante de severas pérdidas económicas, las cuales han sido valoradas por encima de dos millones de dólares al año (Mehmood et al., 2017), mientras que en Colombia se estiman pérdidas anuales de $1.927 millones de pesos (US$ 530 815) (Ortega et al., 2017), debido mayormente a la mortalidad de los animales, el decomiso de los hígados en las plantas de sacrificio, y por reducción en la ganancia de peso, producción de leche y rendimiento reproductivo (Rojo-Vásquez et al., 2012).
La fascioliasis humana tiene una gran importancia en salud pública, debido al aumento de su incidencia en la cordillera andina, cuyos países representan las principales zonas endémicas (Mas-Coma et al., 2005). La distribución geográfica de F. hepatica es amplia, encontrándose principalmente en Europa, América y Oceanía (Marcilla et al., 2002; Pereira et al, 2016). Se reportó una prevalencia de 78.8, 75.8 y 86.9% para Inglaterra, Escocia y Gales en vacas lecheras (Howell et al., 2015), de 27.4% en Egipto (El Damaty et al., 2018), de 42.4% en Irán (Zaraei et al., 2019) y de 60% en Etiopía (Asfaw, 2019), en tanto que para el continente americano se han reportado prevalencias entre 18.3 y 86.8% en ovinos y bovinos (Palacio et al., 2017; Quevedo et al., 2018; Jara et al., 2018). De igual forma en Colombia, se reconocen áreas endémicas de fascioliasis como los departamentos de Boyacá, Nariño, Antioquia y Cundinamarca (Becerra, 2001). Por consiguiente, se han definido prevalencias de 5.9% (Blanco et al., 1996), 42.2% (García Murillo et al., 2009), 74.7% (Castro y Becerra, 2011), 13.1% (Bedoya et al., 2012), 3.7% (Recalde-Reyes et al., 2014), 7.8% (Pulido et al., 2014) y 22.8% (Correa et al., 2016).
El método de diagnóstico común para la fasciolosis en rumiantes es mediante la detección de huevos de F. hepatica en el examen coprológico, principalmente por medio de la técnica de Dennis (Sierra et al., 2017). Sin embargo, la frecuencia de falsos positivos en estas pruebas puede ser elevada debido al periodo de prepatencia y a la ovoposición irregular (Kajugu et al., 2015), así como de falsos positivos debido a la presencia de huevos que permanecen en el ducto biliar luego de las desparasitaciones (Sargison, 2012). De otra parte, se disponen de otros métodos de diagnóstico que pueden permitir la identificación de parásitos adultos en los canalículos hepáticos y de huevos en líquido biliar (Giraldo Forero et al., 2016), los cuales pueden considerarse como diagnósticos tardíos, pero útiles para el control sanitario.
Las pruebas de inmunodiagnóstico tienen una mayor sensibilidad que las pruebas coprológicas, pues permiten revelar la presencia del parásito en los canales hepáticos luego del periodo prepatente (Kajugu et al., 2015). Ante esto, el propósito del estudio fue determinar la prevalencia de distomatosis hepática en bovinos faenados en la planta de beneficio de Sogamoso (Boyacá), así como identificar la técnica diagnóstica más efectiva para establecer la presencia del parásito.
MATERIALES Y MÉTODOS
Lugar de Muestreo
El municipio de Sogamoso está locali-zado en la región centro-oriente del departamento de Boyacá (Colombia). Se encuentra a una altitud de 2569 m y presenta una temperatura promedio anual de 18 °C (Alcaldía Municipal de Sogamoso, 2018).
Tamaño de la Muestra
Se trabajó con bovinos faenados provenientes de la planta de beneficio de Sogamoso, caracterizada por su alto volumen de sacrificio mensual procedente de municipios de los departamentos de Boyacá y Casanare. Se estableció un tamaño muestral de 343 individuos Holstein, Normando y cruzados mayores de 1 año, mediante el programa estadístico Open Epi, teniendo en cuenta una tasa de sacrificio mensual de la planta de 3141 bovinos. Se registraron los datos de los animales en fichas epidemiológicas durante el momento de sacrificio, tales como edad, sexo, raza y origen. Esta información fue proporcionada por las guías de movilización animal emitidas por el Instituto Colombiano Agropecuario (ICA).
Colecta y Procesamiento de Muestras
Las muestras de materia fecal fueron recolectadas directamente del recto y dispuestas en recipientes plásticos y almacenadas en cavas refrigeradas a 4 ºC. Además, se tomaron muestras de sangre (10 ml) en tubos tapa roja por punción yugular. Luego del sacrificio y durante el eviscerado se recolectó el contenido biliar en frascos de plástico y se almacenaron en cavas de icopor a 4 °C. La inspección directa de los hígados permitió la recolección de parásitos alojados en el ducto biliar (García Murillo et al., 2009). Los parásitos fueron preservados en alcohol al 70% (Kooshan et al., 2010).
Las muestras fueron trasladadas al Laboratorio de Parasitología Veterinaria de la Universidad Pedagógica y Tecnológica de Colombia (UPTC). Para la evaluación coproparasitológica se emplearon 4 g de materia fecal y se utilizó la técnica de Ritchie modificada para la identificación de huevos, ooquistes y larvas (Botero y Restrepo, 2005). Las muestras de sangre fueron centrifugadas a 2438 g durante 10 minutos para la obtención del suero (Figueiredo et al., 2017). El contenido biliar fue centrifugado a 3483 g durante 10 minutos y los precipitados se utilizaron para el reconocimiento de los estadios ovales de F. hepatica mediante microscopía directa (Giraldo Forero et al., 2016). Para el diagnóstico serológico se implementó un ELISA in house (Se 96%, Sp 98%, VP+ 96% y VP- 98%) estandarizado a partir de parásitos adultos de F. hepatica colectados de bovinos faenados en Boyacá, los cuales fueron lavados con solución salina y conservados en Buffer Fosfato de Sodio estéril (PBS, pH 7.2) suplementado con antibiótico (Giraldo Forero et al., 2016).
Para la elaboración del extracto antigénico, cada ejemplar de F. hepatica se homogenizó en una solución de PBS estéril (pH 7.2) y se llevó a delipidado con éter anhidro. Cada tratamiento se agitó durante 24 horas a 4 ºC. Finalmente, las muestras se sonicaron con ultrasonido, seguido de ultra centrifugación de la que se conservó el sobrenadante. Se realizó cuantificación proteica por medio de la técnica de Bradford con diluciones seriadas de albumina sérica bovina (ASB) para conocer la concentración del extracto antigénico. Luego se obtuvo un perfil electroforético en gel de Acrilamida-Bisacrilamida. Para el proceso de extracción y purificación de las proteínas se separaron los componentes proteicos en geles de electroforesis de SDS-PEAGE al 10%. Las fracciones antigénicas de interés se obtuvieron por procesos de elución y el corte de los geles producto de perfiles electroforéticos preparativos con fracciones antigénicas de 14 y 19 kDa. Se evaluaron nuevos perfiles electroforéticos para la caracterización de los extractos antigénicos totales en diferentes concentraciones. Las fracciones más antigénicas, dieron lugar a la optimización de la prueba.
Como control positivo se seleccionaron sueros de animales en los que mediante examen post mortem se identificó la presencia del parásito adulto en ducto biliar o de huevos en contenido biliar y que al realizar la titulación en bloque en la prueba de serodiagnóstico seleccionada, se identificaron títulos de anticuerpos valorados por espectrofotometría (tipo IgG) y que además superaran el punto de corte calculado para la prueba. Los sueros control negativo fueron seleccionados de animales que no cumplieron con los criterios establecidos para los sueros control positivo.
El punto de corte para la prueba de Elisa in house se calculó mediante la sumatoria de los valores de absorbancia, y a su promedio aritmético se le sumo dos desviaciones estándar. El punto de corte para la detección de anticuerpos IgG anti F. hepatica fue de 0.300.
RESULTADOS
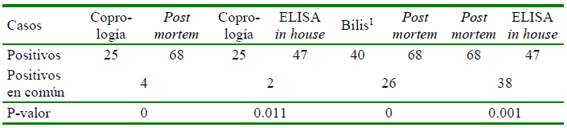
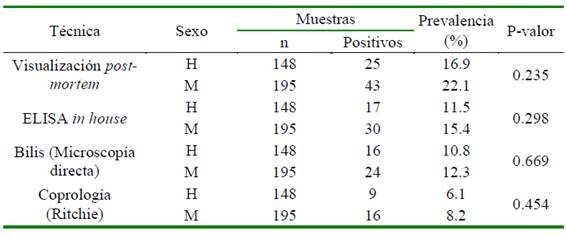
La presencia de F. hepatica en los bovinos del estudio fue mayor al realizar la evaluación post mortem (19.8%; 68/343), seguido por la técnica de ELISA in house (13.7%, 47/343), detección de huevos en bilis (11.7%; 40/343) y la técnica coprológica (7.3%; 25/ 343). Por otra parte, si bien se observó una mayor prevalencia en machos que en hembras, las diferencias no fueron significativas (Cuadro 1).
Cuadro 1 Prevalencia de Fasciola hepatica en bovinos faenados en Boyacá, Colombia de acuerdo con la técnica diagnóstica y el sexo de los animales muestreados
La prueba Q de Cochran determinó una asociación estadística significativa entre las técnicas implementadas. Por otra parte, la prueba de McNemar evidenció diferencias significativas entre el número de casos positivos entre el análisis coprológico y el post mortem (p = 0.000), análisis coprológico y ELISA in house (p = 0.011), análisis biliar y post mortem (p = 0.000) y post mortem y ELISA in house (p = 0.001, mientras que no hubo diferencias significativas entre el análisis coprológico y el análisis biliar (p = 0.64) y el análisis biliar el el ELISA in house (p = 0.324) (Cuadro 2).
DISCUSIÓN
Se han reportado estudios de prevalencia de distomatosis hepática en varios departamentos de Colombia, donde los valores de las prevalencias encontradas estuvieron influenciados por el método diagnóstico. Así, Giraldo Forero et al. (2016) reportaron una prevalencia de 32.4% al detectar los parásitos en los conductos biliares, en tanto que determinando coproantígenos en heces de bovinos faenados en Antioquia se reportaron valores de 5.9% (Blanco et al., 1996) y de 13.1% (Bedoya et al., 2012). Estas diferencias no solo pueden deberse a la técnica empleada, sino además, al número de animales muestreados.
La variabilidad de las prevalencias encontradas puede deberse, asimismo, al potencial del trematodo durante la etapa de desarrollo, así como al huésped y su respuesta inmune (De Ayala et al., 2014). Sumado a esto, intervienen factores como la edad del huésped (Soca Pérez et al., 2016), el contenido de agua en la materia fecal (Iturbe Espinoza y Muñiz Pareja, 2011), la cantidad de muestra y el número de alícuotas analizadas por muestra (Uribe et al., 2012), todos los cuales contribuyen a presentar variaciones en la detección de los huevos de F. hepatica.
La técnica diagnóstica ELISA in house fue la herramienta que presentó el segundo resultado más alto (13.7%). En Colombia, la implementación de la prueba de ELISA ha reportado prevalencias de 40% en Boyacá (García Murillo et al., 2009) y de 5.9% detectando coproantígenos del trematodo (Blanco et al., 1996) y de 80% de positividad en muestras de leche mediante un ELISA indirecto en Antioquia (Uruburu et al., 2013). Resultados diferentes fueron reportados en el Reino Unido (79.7% en muestras de leche) por Howell et al. (2015), de 16-58% en Bolivia por Hillyer et al. (1996) y de 23.1% en Perú por Valencia et al. (2005).
La herramienta diagnóstica que reportó la prevalencia más alta en los bovinos faenados fue el examen post mortem (19.8%); sin embargo, es una técnica de diagnóstico tardío para la detección de la fascioliasis (Espino et al., 2000). En Colombia se reportan prevalencias de 24.4% en Boyacá (García Murillo et al., 2009) y de 32.4% en Cundinamarca (Giraldo Forero et al., 2016) mediante esta técnica, en tanto que en América Latina se reportan valores entre y 35.5% (Chagas et al, 2011; Brito et al., 2012; Palacio et al., 2017). Los resultados del presente estudio no concuerdan con los obtenidos por García Murillo et al. (2009), quienes encuentran más casos positivos con la técnica de ELISA que con la identificación de los parásitos en el hígado.
La ausencia de asociación entre el sexo de los animales con la presentación del pará- sito coincide con otras investigaciones (García Murillo et al., 2009; Afshan et al., 2013; Giraldo Forero et al., 2016), aunque se encontró que los machos presentaron prevalencias numéricas más altas respecto a las hembras en las cuatro herramientas diagnósticas.
Se presentaron diferencias estadísticas significativas entre las cuatro técnicas diagnósticas. Asimismo, se estableció que la concordancia se presentó entre las herramientas que estaban asociadas con el diagnóstico post mortem, lo cual podría deberse a que está técnica es la más efectiva para la detección del parásito en los rumiantes. De otra parte, Blanco et al. (1996) establecieron una relación del 100% entre los casos positivos a ELISA (11/183) y a la inspección directa de hígados (11/183). No obstante, la presencia de la duela adulta en el hígado no garantiza la aparición de huevos en el contenido biliar o en heces (Chirinos et al., 2000; Martínez et al., 2013).
CONCLUSIONES
Se encontraron diferencias significativas entre las cuatro técnicas diagnósticas para Fasciola hepatica, especialmente con la visualización del trematodo en el hígado.
No se encontró relación estadística entre el sexo de los bovinos y la presentación del parásito.
Se pudo determinar que la presencia de los trematodos adultos en el hígado no está completamente relacionada con la detección de huevos y la presencia de seropositividad.












 uBio
uBio