INTRODUCCIÓN
Los protozoarios intraeritrocitarios Babesia bovis y B. bigemina son los agentes causales de la babesiosis bovina, una enfermedad transmitida por la garrapata común del bovino, Rhipicephalus microplus, que provoca importantes pérdidas económicas en la ganadería de las regiones tropicales y subtropicales del mundo (Álvarez y Figueroa, 2007).
Los métodos actuales de control de la enfermedad involucran el tratamiento farmacológico de los animales afectados, el control de la garrapata por medio de acaricidas y la vacunación con cepas atenuadas de Babesia spp que garantiza un fuerte estado de protección inmunológica y dura toda la vida (Martínez et al., 2014). En el merca- do se dispone de vacunas trivalentes que incluyen un tercer hemoparásito, Anaplasma centrale, que provee una inmunidad cruzada sobre A. marginale, rickettsia que, junto a los protozoarios B. bovis y B. bigemina forman el complejo «tristeza bovina». Presentaciones de tipo fresca y ultracongelada se encuentran disponibles para la profilaxis de este complejo, pero ambas presentan ciertos in- convenientes. En el primer caso, por sus características extemporáneas, donde el tiem- po es el factor limitante; en tanto que en el segundo caso se requiere de termos de nitrógeno líquido para su traslado y manipulación (Aguirre et al., 1991).
La formulación de una tercera presentación utilizando merozoitos deshidratados como inmunógenos podría proveer una estrategia que resolvería los problemas de practicidad, durabilidad y seguridad, ya que implicaría un paso más en la atenuación de la cepa vacunal (Gerber et al., 2014) y facilitaría su manipulación por su método de conservación.
Para lograr la deshidratación por liofilización de eritrocitos parasitados es necesaria la incorporación de soluciones lioprotectoras. Las soluciones de polivinil- pirrolinoda (PVP) e hidratos de carbono, en especial los monosacáridos, proporcionan medios que permiten que los eritrocitos sean sometidos a los esfuerzos de congelación y reconstitución, dando lugar a células de sangre roja deshidratadas por congelación que pueden ser reconstituidas y funcionar normal- mente en el mamífero (Goodrich et al., 1989). La obtención de un protocolo ideal para criopreservar depende del conocimiento de las propiedades de las células o tejidos. Este proceso está afectado por variables como especie, tipo y estadio de la célula a congelar. Existen criopreservadores de elevada masa molecular que no son permeables a la membrana y, por lo tanto, actúan en el medio extracelular promoviendo una rápida deshidratación por efecto osmótico. Son ejemplos de ellos la PVP, el polietilenglicol y las lipoproteínas de yema de huevo (Cossio Bayugar et al., 2011).
El secado por pulverización o spray drying consiste en la producción de un polvo seco a partir de un líquido o una suspensión. Implica la pulverización de los glóbulos rojos (GR), creando una mayor superficie de con- tacto, a la que se le aplica calor como método de deshidratación. Es el método preferido de secado para muchos materiales térmicamente sensibles, como alimentos y productos farmacéuticos (Mujumdar, 2007; Tarara et al., 2003). La deshidratación por pulverización de compuestos utilizados en la industria farmacéutica se encuentra reporta- do en la memoria descriptiva de la patente de Tarara et al., 2003.
En el presente trabajo se describen en- sayos con diferentes procesos de deshidratación, así como con sustancias criopreservadoras y reconstituyentes para obtener eritrocitos deshidratados y reconstituidos, altamente parasitados con B. bovis y B. bigemina como alternativa inmunopro-filáctica.
MATERIALES Y MÉTODOS
Cultivo y Mantenimiento de Cepas
Eritrocitos parasitados fueron obtenidos a partir de cultivos in vitro en fase estacionaria en condiciones de microaerofilia de 48 h de B. bovis R1A y B. bigemina S1A, cepas vacunales, según protocolos establecidos por Ristic y Levy (1980). Se iniciaron los cultivos a partir de crioviales proporcionados por el Laboratorio Litoral Biológicos S.R.L. (Puerto Tirol, Chaco), preservados con PVP disuelta en solución Vega y Martínez (VYM) (Vega et al., 1985) en una atmósfera de CO2 5%, O2 5% y balance de N2 90%. Los cultivos in vitro contienen un 10% de paquete globular (PG) y medio completo (MC) formulado con 60% de Medio 199 y 40% de suero normal bovino. El cambio de medio se realizó cada 24 h, desechando el sobre- nadante (SN) que contiene residuos del metabolismo de los eritrocitos y protozoarios, y reemplazándolo con MC nuevo. Cada 48 h se realizaron subcultivos para evitar el exceso de hemoparásitos. Una vez logradas parasitemias superiores a 10 y 7% para B. bovis y B. bigemina, respectivamente, los eritrocitos fueron centrifugados a 2348 g durante 10 min a 4 °C, se desechó el SN y el PG fue colectado para su deshidratación.
Deshidratación por Liofilización
El PG fue fraccionado y mezclado en partes iguales con:
Solución al 10% de PVP disuelta en so- lución VYM.
Tampón liofilizante conteniendo una concentración 2 M de dextrosa en solución de buffer fosfato (PBS) a pH 7.2.
Tampón liofilizante conteniendo una concentración de 1.5 M de glicerol en solución de PBS a pH 7.2.
Tampón liofilizante conteniendo 50% Dimetilsulfóxido (DMSO) en solución de PBS a pH 7.2.
La suspensión de eritrocitos, con la adición de criopreservadores, se transfirió a crioviales en alícuotas de 5 ml. Los viales fueron expuestos a la fase de vapor del nitrógeno líquido, a una tasa de 20 °C/min, en una unidad de congelación programable. Cuando la temperatura alcanzó -80 °C los viales se trasladaron rápidamente al termo de nitrógeno líquido. Las muestras congeladas fueron transferidas a un liofilizador de banco superior (L-T8-A-B3T- RITIFICOR) que funciona a menos de 100 mmHg con una tempera- tura de cámara interior de -56 °C. Las mues- tras fueron dejadas hasta que se deshidraten a fondo (6-24 h). Posteriormente se dejó que los tubos vuelvan a temperatura ambiente. Los liofilizados fueron mantenidos en freezer a -20 °C hasta su uso.
Deshidratación por Spray-drying
El PG mantenido a 4 °C fue fracciona- do en alícuotas y secado por aspersión en un Mini Spray Dryer Buchi B-290 (BÜCHI Labortechnik AG), de la Facultad de Ciencias Químicas de la Universidad de Córdoba (UNC), bajo condiciones controladas, a saber: temperatura de ingreso: 45 °C, aspiración: 75%, bomba: 5%, nozzle cleaner: 2 rotámetro: 50 mmHg. Finalizada la deshidratación, el material se mantuvo a 4 °C hasta su uso.
Reconstitución de las Muestras
El PG se volvió a hidratar a 37 °C usan- do diferentes reconstituyentes: soluciones de sacarosa (0.25, 0.5 y 1 M), solución salina 0.9%, VYM, PBS o agua destilada. Se añadió un volumen de solución rehidratante equivalente al volumen inicial de la muestra antes de la deshidratación.
Microscopía Óptica
Los rehidratados fueron homogeneizados suavemente en placas de 24 pocillos, asegurando la reconstitución completa del deshidratado. Se realizaron extendidos finos, fijados con metanol y teñidos con Giemsa al 10% que fueron observados al microscopio óptico (MO) en aumento 1000x.
Microscopía Electrónica de Barrido
Se procedió a fijar en una membrana 0.22 µm de Nylon, usando formol al 10%. Las muestras fueron deshidratadas, usando alcohol al 70% y secadas a punto crítico con CO2 líquido, durante 15 min. Luego fueron montadas en papel aluminio y metalizadas con oro paladio. Se realizó la observación en un microscopio electrónico de barrido (MEB) JEOL 5800 LV.
Reactivación de las Cepas Deshidratadas en Cultivos in vitro
Se realizó la incubación de GR parasitados con Babesia spp y deshidratados por liofilización o por aspersión en placas de 24 pocillos y botellas de cultivo F25. La reconstitución de los volúmenes fue a partir de 20 ml totales de MC y 5% de GR. La placas y botellas se mantuvieron en cámara incuba-
dora con una mezcla especial de gases (CO2: 5%; O2: 5%; balance de N2: 90%), y se deja- ron cinco días con tres pasajes de gases diarios dentro de una incubadora de CO2 a 37 ºC y humedad del 80%. Cada 24 h, 800 µl y 10 ml del SN, respectivamente, fueron removidos de los cultivos y reemplazado por la misma cantidad de MC. Asimismo, cada 48 h se realizó el cambio de medio hasta completar los cinco días. Para determinar la parasitemia se hicieron frotis diarios teñidos con Giemsa al 10%.
RESULTADOS
Tras el proceso de liofilización, las sus- pensiones de eritrocitos parasitados con Babesia spp utilizando 1.5 M de glicerol en solución de PBS no lograron una adecuada deshidratación, lo cual podría deberse a una posible ebullición del contenido de los crioviales. Similares resultados se obtuvieron con las soluciones de Dextrosa y DMSO. Sin embargo, las muestras en las que se utilizó PVP como lioprotector dieron como resulta- do un polvo adecuadamente deshidratado, con aspecto cristalino y quebradizo al tacto.
A partir del proceso de secado por aspersión se obtuvo un polvo fino, homogéneo y adecuadamente deshidratado. El rendimiento de secado del PG fue de 35.8% para B. bovis y de 35.6% para B. bigemina.
La reconstitución del PG liofilizado con los disolventes evidenció que la solución de sacarosa 0.25 M y el PBS presentaron un alto porcentaje de recuperación «relativa», tras comparar por MO los extendidos de GR rehidratados con los de GR frescos (Figura 1A,B). Se evidenció que hasta un 50% de los eritrocitos liofilizados presentaron una morfología conservada al utilizar solución de sacarosa 0.25 M en su reconstitución (Figura 1C,D), bajando dicha tasa de recuperación a 30% con PBS (Figura 1E,F). Bajo las condiciones ensayadas en el presente trabajo, los demás reconstituyentes no lograron proveer un medio adecuado para la rehidratación del PG liofilizado.
El PG pulverizado no logró un porcentaje de recuperación considerable, siendo el mismo menor al 20% al utilizar solución de sacarosa 0.25 M y por debajo del 10% para las demás soluciones rehidratantes (resulta- dos no mostrados). Por otro lado, la observación del reconstituido utilizando MEB evidenció eritrocitos aislados con una morfología relativamente conservada al usar PBS como disolvente, siendo en segundo lugar la solución de sacarosa 0.25 M y en tercer lugar por la solución salina para ambos deshidratados (Figura 2). El tamaño de los eritrocitos osciló entre 3 a 5 µm, pudiéndose apreciar una reducción de entre 50 a 20% de su tamaño normal. Respecto a la reactivación de los parásitos contenidos en los eritrocitos deshidratados, luego de 5 d de incubación en cámara de gases no fue posible lograr un aumento de la parasitemia en los cultivos iniciados a partir del PG deshidratado por las dos técnicas utilizadas en este trabajo.
DISCUSIÓN
En el presente trabajo se llevó a cabo la deshidratación de eritrocitos parasitados con las dos especies de Babesia causantes de la babesiosis bovina. Para tal fin, se evaluaron dos técnicas, liofilización y secado por aspersión, las que operan bajo principios distintos, y buscan mantener la estructura de las células luego de la reconstitución. A su vez, se ensayaron diferentes soluciones liopreservadoras, para los ensayos de liofilización, y rehidratantes.
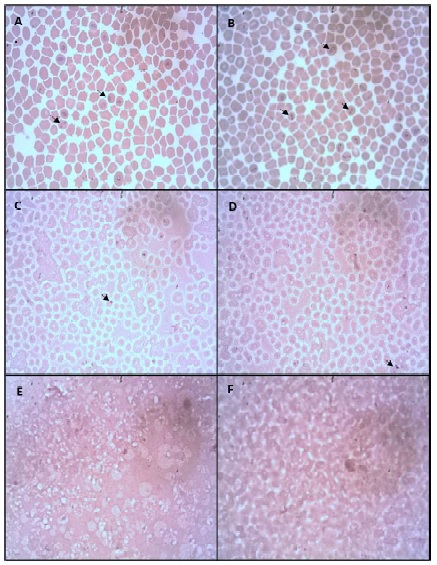
Figura 1 Imágenes de eritrocitos luego del proceso de liofilización. A, B. Frotis de cultivo in vitro de B. bovis (control) y B. bigemina (control), respectivamente. C, D. Frotis de eritrocitos parasitados con B. bovis y B. bigemina, liofilizados y reconstituidos con solución de sacarosa 0.25 M, respectivamente. E, F. Frotis de eritrocitos parasitados con B. bovis y B. bigemina, liofilizados y reconstituidos con buffer fosfato, respectivamente. Las flechas indica merozoitos de Babesia spp. 1000X
La liofilización consiste fundamental- mente en extraer por sublimación, bajo condiciones de alto vacío, el agua de las células congeladas; que pasa directamente a un estado de vapor debido a que no hay presión molecular que lo impida. Las muestras que contienen la suspensión de microorganismos son previamente congeladas en nitrógeno líquido e inmediatamente expuestas al vacío (Morales-García et al., 2010). Bajo las condiciones del presente trabajo, la PVP fue el crioprotector más adecuado durante el pro- ceso de liofilización. Las soluciones de PVP utilizadas como lioprotector dan como resultado eritrocitos capaces de resistir a los esfuerzos de deshidratación y reconstitución.
Figura 2 Imágenes de eritrocitos obtenidas con microscopio electrónico de barrido. A,C,E. Eritrocitos parasitados con B. bovis, liofilizados y reconstituidos con buffer fosfato, solución de sacarosa 0.25 M y con solución fisiológica, respectivamente; B,D,F: Eritrocitos parasitados con B. bigemina, deshidratados por aspersión y reconstituidos con buffer fosfato, con solución de sacarosa 0.25 M, y con solución fisiológica, respectivamente. Las flechas indican glóbulos rojos deshidratados y reconstituidos. 5000X
Su propiedad de no atravesar la membrana proporciona células de sangre roja deshidratas por sublimación que pueden ser reconstituidas (Cossio Bayugar et al., 2011).
Los criopreservadores constituidos por compuestos de baja masa molecular, como DMSO y glicerol, son permeables a la membrana y actúan desplazando el agua del interior de la célula, evitando la formación de cris- tales de hielo intracelulares. Estas sustancias llamadas penetrantes, se utilizan en congelaciones a velocidad muy lenta. En la curva de liofilización se observó una incompleta deshidratación de las muestras al utilizar estas sustancias, posiblemente debido a la temperatura eutéctica de la mezcla de altas concentraciones de glicerol y PG. Según Day y Stacey (2007), si bien es posible lograr la liofilización utilizando glicerol o DMSO como lioprotectores, la curva de fases a la que debe someterse fue incompatible con la curva estandarizada con el liofilizador disponible en el laboratorio.
Por otro lado, los GR deshidratados por aspersión no lograron superar el 20% de recuperación al ser rehidratados. Alves-Filho et al. (2006), utilizando esta técnica lograron no solo mantener la viabilidad de los eritrocitos, sino además que fueran funcionales en un nuevo hospedador. Estos autores elaboraron una patente de secado por aspersión de GR humanos y reportaron condiciones de trabajo donde los eritrocitos fueron sometidos a temperaturas que no superaban la fisiológica para la especie (37 °C), manteniéndose preferiblemente en un rango de 1 a 10 °C, condiciones que no fueron logradas en el presente trabajo donde la temperatura de entrada fue de 45 °C. Asimismo, aquí no se incorporaron adyuvantes de secado en discrepancia con el mencionado estudio.
Otros autores, como Ananta et al. (2005) evaluaron la aplicación del secado por atomización en la producción de preparados a base de leche desnatada conteniendo bacterias probióticas Lactobacillus rhamnosus.
Esto autores obtuvieron mejores resultados cuando se reconstituyeron las colonias al utilizar leche desnatada como vehículo de se- cado por pulverización, logrando una tasa de supervivencia microbiana del 60% a una temperatura de salida de 80 °C. En concordancia con dichos resultados, Barbosa et al. (2015) investigaron la supervivencia de dos bacterias ácido-lácticas en polvo de naranja obtenidos por liofilización, secado por aspersión y secado con aire caliente convectivo, no reportando mermas en el número de células obtenidas por las técnicas de aspersión y liofilización. Sin embargo, la liofilización permitió la supervivencia de un mayor número de células después del periodo de almacena- miento.
El almacenamiento de ambos deshidratados es un factor a tomar en consideración. En el presente trabajo, el PG secado por aspersión fue almacenado a 4 °C y el liofilizado en freezer a -20 °C. Según Zamora et al. (2006), quienes trabajaron con colonias de bacterias ácido-lácticas, el daño celular debido al liofilizado se observó inmediatamente después del secado, mientras que el daño debido al secado por aspersión no se hizo evidente hasta la fase de almacenamiento. Sin embargo, la disminución más rápida de la viabilidad de los cultivos secados por pulverización, en comparación con los cultivos liofilizados, se compensó con el mayor porcentaje de células viables obtenidas después de la deshidratación con agua de triptona estéril, lo que condujo a tasas de supervivencia comparables al final del periodo de almacenamiento.
La observación de la morfología celular por frotis evidenció una recuperación celular mayor para GR liofilizados que para secados por aspersión. Estos resultados coinciden con los obtenidos por Huang et al. (2017), quienes reportan que la liofilización sigue siendo la técnica preferida para preservar las bacterias probióticas, aunque es un proceso cos- toso y demandante de tiempo. Por otro lado, el secado por aspersión es una técnica predominante en la industria láctea (Schuck et al., 2016). El aumento en el área de la interfaz aire-líquido posterior a la pulverización aumenta drásticamente la cinética de secado y, generalmente, se admite que el secado ocurre en unos pocos segundos. En cambio, el secado por aspersión representa un menor costo energético específico y una mayor productividad. Pese a esto, sigue habiendo de- safíos asociados con el uso del secado por atomización para producir cultivos viables, especialmente con cepas probióticas «sensibles» (Broeckx et al., 2016; Fu y Chen, 2011; Peighambardoust et al., 2011).
En el presente trabajo se observaron discrepancias entre los resultados obtenidos con MO y MEB, ya que la recuperación celular fue muy baja en el segundo método, in- dependientemente de la técnica de deshidratación o reconstituyente empleado. Estos resultados podrían explicarse por el estrés celular agregado en los procedimientos de fija- do y secado a punto crítico (SPC) que los GR, previamente deshidratados y reconstituidos reciben al someterse al MEB, no logrando mantener la viabilidad de la membrana. Inoue y Osatake (1988) indican que, a pesar de que el método de SPC se usa ampliamente para secar materiales biológicos para MEB, existen problemas de artefactos inherentes con el mismo. Por otro lado, el método de liofilización también es una técnica para secar muestras biológicas que contienen agua, considerado inclusive superior al de SPC debido a la contracción menos visible de la muestra (Inoue y Osatake, 1988).
Finalmente, en este trabajo no fue posible lograr la reactivación de los GR y merozoitos de Babesia spp, en discrepancia con lo reportado por Marcotty et al. (2003), quienes lograron la reactivación (aunque con una viabilidad marcadamente reducida) de esporozoitos liofilizados de Theileria parva. Es importante destacar que en dicho trabajo se realizó la reactivación en ensayos in vivo, mientras que en este trabajo fue realizado en cultivo in vitro.
En conclusión, el presente estudio muestra un procedimiento para la deshidratación de dos de los componentes de la vacuna trivalente para la profilaxis de la tristeza bovina. El procedimiento de liofilización logró una reconstitución del 50% de eritrocitos parasitados con estructura conservada. No obstante, si bien aún falta probar su inoculación en la especie susceptible, este resultado es promisorio para la producción de una va- cuna liofilizada.












 uBio
uBio 

