INTRODUCCIÓN
La acuicultura de camarón blanco Penaeus vannamei Boone, 1931, se ha enfocado en mejorar los procesos de producción, brindando especial atención a la relación de la microbiota del agua con relación a la salud de los camarones en las diferentes etapas del cultivo (Aguirre et al., 2013). El establecimiento de la relación de la microbiota durante el cultivo del camarón blanco P. vannamei puede ejercer un papel positivo en el desarrollo y supervivencia de la especie, pero a su vez generar un impacto negativo con altas mortalidades si se favorece la proliferación de bacterias patógenas (FAO 2004).
El camarón blanco P. vannamei es la especie más ampliamente cultivada a nivel mundial, y en Ecuador representa el primer renglón exportable no petrolero, con un volumen de producción de 2677 millones de libras en 2023 (CNA, 2024). pero su producción ha enfrentado serios problemas sanitarios relacionados con la prevalencia y la gravedad de una gran cantidad de enfermedades (Lightner, 2011), siendo las de origen bacteriano las más comunes en los ambientes acuícolas. Entre estos patógenos, especies del género Vibrio han sido consideradas responsables del desarrollo de enfermedades infecciosas en los cultivos de camarón, causando altas mortalidades en los laboratorios de producción larvaria, no solo de Ecuador, sino a nivel mundial (Zheng et al., 2016). Las condiciones sanitarias deficientes en un cultivo junto a los protocolos inadecuados de manejo influyen negativamente en la salud de los organismos. La calidad microbiológica desfavorable en el agua ya sea por contaminación industrial, aguas servidas, mal manejo o mala higiene durante el proceso productivo, trae como consecuencia la aparición de enfermedades y mayor mortalidad (Millán y Pérez, 2017).
En sistemas de producción de larvas de camarón, una condición sanitaria adecuada a nivel de unidad productiva exige un manejo diferencial para reducir el ingreso de potenciales patógenos o minimizar el impacto en caso de ingreso. Ante esto, se requiere que los criadores tengan conocimiento sobre las enfermedades y estado sanitario que afectan la crianza, así como la introducción de pruebas diagnósticas en cada ciclo de cultivo (Figueredo et al., 2020). De esta manera, conociendo los problemas sanitarios locales se puede prevenir y controlar el ingreso de patógenos enfatizando los esfuerzos de vigilancia (Galli et al., 2016) durante la producción de larvas de camarón blanco.
Las bacterias heterótrofas tienen múltiples funciones que intervienen en el reciclaje del carbono y el nitrógeno presentes en la materia orgánica, en la biodisponibilidad de nutrientes, nutrición de los organismos cultivados, mejoramiento de la calidad del agua, y en el control de las enfermedades (Beardsley et al., 2011), sobre todo en sistemas con recirculación del agua en sistemas integrados a diferencia de los de monocultivo (MacDonald et al., 2011). La materia orgánica en sistemas de cultivo puede dar como consecuencia una alta tasa de crecimiento de microorganismos, lo cual puede afectar a las especies cultivadas. Asimismo, las bacterias del género Vibrio también se encuentran comúnmente en los ambientes acuícolas afectando los centros productivos del camarón produciendo enfermedades (Regunathan y Wesley, 2004).
La calidad microbiológica en los cultivos larvarios de P. vannamei de la zona norte de Ecuador es poco conocida y reportada. Por lo tanto, el objetivo del estudio fue cuantificar la carga bacteriana de Vibrio spp y bacterias heterótrofas en la fuente de agua que ingresa al cultivo larvario y durante la producción en tres laboratorios con el fin de conocer la concentración que alcanzan estos grupos bacterianos en el sistema de cultivo de tres laboratorios; así como, comparar el manejo sanitario entre ellos mediante encuestas.
MATERIALES Y MÉTODOS
Recolección de Muestras
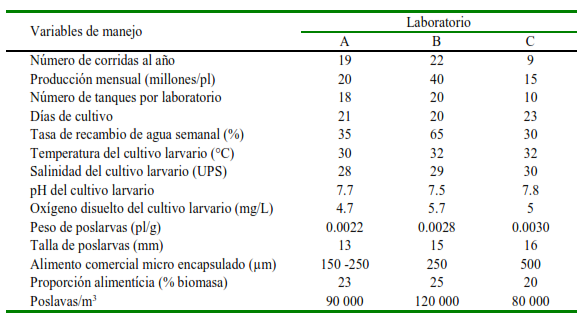
Se seleccionaron tres laboratorios de producción de larvas de camarón P. vannamei del Cantón Sucre, provincia de Manabí, Ecuador, los cuales han sido identificados en el estudio como A (0°38¹1ºS 80°25¹12ºW), B (0°38¹42ºS 80°25¹05ºW) y C (0°47¹24ºS 80°31¹01ºW). En estos laboratorios se llevan controles microbiológicos externos antes de la venta de las larvas, uso de probióticos, y análisis de balance iónico en el agua de cultivo. Cabe señalar que el número de corridas al año en el laboratorio A y B es mayor porque realizan corridas de producción paralelas. Las capacidades de cada laboratorio y variables de manejo acuícola se presentan en el Cuadro 1. La información del cuadro fue recopilada por los autores mediante encuestas al gerente y al biólogo encargado de la producción, y verificada in situ al momento de realizar las encuestas. En los tres laboratorios se analizaron muestras del agua de entrada, agua tratada y agua de dos tanques de cultivo larvario. El agua tratada se refiere a agua desinfectada con hipoclorito de sodio a 10 ppm y mantenida con aireación por 24 h previo a su utilización en el cultivo larval (FAO, 2004). En todos los casos se hicieron muestreos semanales durante ocho semanas consecutivas.
Cuadro 1. Variables de manejo acuícola en tres laboratorios (A, B, C) de larvas de camarón Penaeus vannamei de la provincia de Manabí, Ecuador
Se tomaron tres muestras en cada punto en frascos estériles. Se tomaron a 20 cm de profundidad, sin llenar por completo los envases a fin de poder homogenizarlas. Los frascos fueron trasladados bajo refrigeración al Laboratorio de Microbiología del Departamento de Acuicultura, Pesca y Recursos Naturales Renovables de la Facultad de Ciencias Veterinarias de la Universidad Técnica de Manabí (UTM), extensión Sucre.
Análisis Microbiológicos
En el contaje de bacterias heterótrofas totales y de Vibrio spp se empleó el medio agar marino para bacterias heterótrofas y agar tiosulfato citrato bilis sacarosa para Vibrio spp (Kaysner et al., 2004). Para todos los casos se realizaron tres réplicas con diluciones de hasta 10-7 del homogenizado, los cuales se extendieron en 0.1 mL por dispersión en las placas de cultivo, e incubadas a 30 °C durante 24 h (Heenatigala y Fernando 2016). Se cuantificaron las colonias de Vibrio spp, las fermentadoras de sacarosa (amarillas) y no fermentadoras de sacarosa (verdes), así como también las bacterias heterótrofas como Unidades Formadoras de Colonias (UFC/mL).
Encuestas Estructuradas
En cada laboratorio se realizaron encuestas estructuradas sobre variables sanitarias del cultivo, con base en las buenas prácticas, certificación de larvas y alimento; capacitaciones e instalaciones.
En cada laboratorio se realizaron encuestas estructuradas sobre variables sanitarias del cultivo, con base en las buenas prácticas, certificación de larvas y alimento; capacitaciones e instalaciones, utilizando preguntas con respuestas dicotómicas (Sí/No), de un solo componente, tomando como base el formulario 5 del Plan Nacional de Control (INP, 2017).
Análisis Estadístico
Las concentraciones bacterianas (heterótrofas y Vibrio spp) se presentan como promedio ± desviación estándar. Estos datos fueron transformados a Log10 y comparados entre los laboratorios para cada punto de muestreo y entre los puntos de muestreo de un mismo laboratorio. Para estas comparaciones se utilizaron el análisis de varianza (ANOVA) de una vía, previa comprobación de normalidad mediante la prueba de Kolmogorov-Smirnov y de homogeneidad de varianza mediante la prueba de Levene. Los valores de p<0.05 se consideraron estadísticamente significativos. Los análisis estadísticos fueron realizados en el programa Statgraphics Centurión XIX. Los resultados de las encuestas fueron presentados como porcentaje de cumplimiento respecto al total de preguntas, y comparados entre laboratorios mediante la prueba de Chi cuadrado.
RESULTADOS
Los conteos de bacterias heterótrofas totales y Vibrio spp. en los puntos de monitoreo no mostraron diferencias significativas (p>0.05) entre laboratorios (Cuadro 2). Sin embargo, al analizar los conteos entre los puntos de muestreo de un mismo laboratorio, el laboratorio Amuestra una reducción significativa (p<0.05) de Vibrio spp en el agua tratada respecto a los otros puntos.
Cuadro 2. Conteos (UFC/ml) de Vibrio spp (V) y bacterias heterótrofas (BH) en los diferentes puntos de tres laboratorios de cultivo de camarón Penaeus vannamei (cantón Sucre, provincia de Manabí, Ecuador)
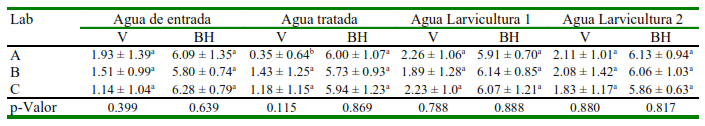
Valores expresados como media ± desviación estándar, transformados a Log10
La carga bacteriana en los puntos analizados mostró fluctuaciones semanales tanto para Vibrio spp, como para bacterias heterotróficas en los tres laboratorios (Figura 1). La carga de bacterias heterótrofas fluctuó entre 4 x 106 UFC mL-1 y 8 x 106 UFC mL-1 para todos los puntos en los tres laboratorios; mientras que la carga de Vibrio spp fluctuó entre 0.35 x 102 UFC mL-1 y 2.26 x 102 UFC mL-1. Los promedios obtenidos en el agua de manera general estuvieron en 7 x 106 UFC mL-1 para el caso de bacterias heterótrofas, y de 4 x 102 UFC mL-1 para el caso de Vibrio spp.
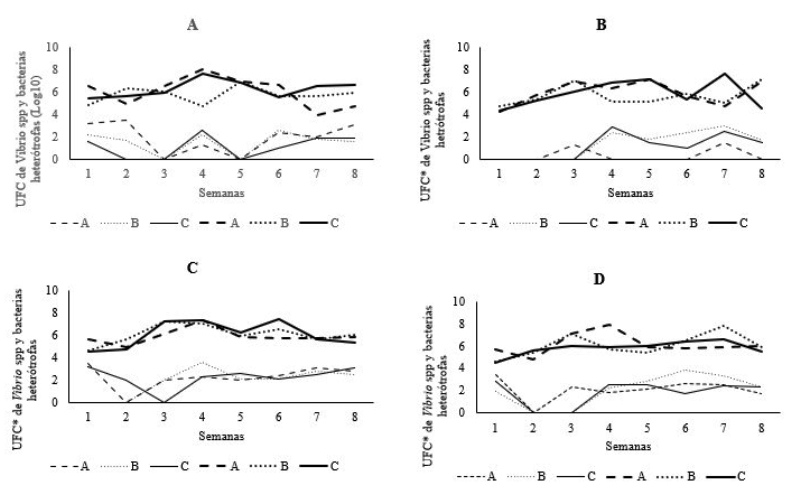
Figura 1. Concentraciones (UFC) semanales de Vibrio spp (líneas inferiores) y bacterias heterótrofas (líneas superiores) en tres laboratorios de cultivo de camarón Penaeus vannamei (- A, ……B, ___C). A. Agua de entrada. B. Agua tratada. C. larvicultura 1. D. Larvicultura 2. * (*) Datos transformados a Log10.
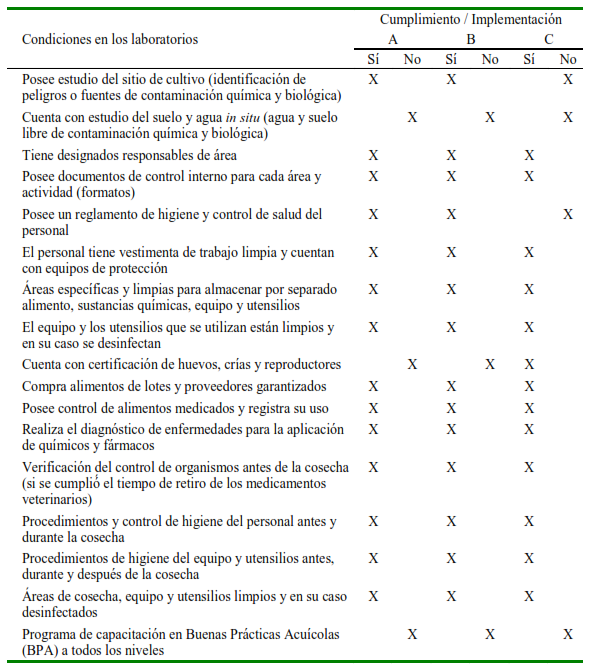
El análisis de las respuestas obtenidas en las encuestas no mostró diferencias significativas (p>0.05) entre los tres laboratorios, evidenciando un manejo sanitario similar. Los laboratorios cumplen con la normativa de higiene del material utilizado en las áreas de cultivo, higiene y control de salud del personal y compran alimentos o medicamentos garantizados (Cuadro 3). Sin embargo, ningún laboratorio cuenta con estudio de suelo y agua, ni desarrollan programas de capacitación en buenas prácticas acuícolas.
DISCUSIÓN
Los conteos de Vibrio spp en el agua de entrada indican una calidad aceptable de la fuente de abasto de los tres laboratorios, considerando que los valores registrados no superan a 3 x 102 UFC/mL-1. Resultados similares de 2.2 x 102 UFC mL-1 (Salcido, 2012) y 3.3 x 102 UFC mL-1 (Cáñez-Figueroa, 2011) han sido reportados en agua de entrada en laboratorios de México con buenas producciones y donde los autores consideran una buena calidad del agua de abasto. Sin embargo, se debe considerar que los laboratorios de este estudio se encuentran en zonas influenciadas por descargas de ríos o estuarios, donde la carga bacteriana se incrementa por los aportes de granjas de producción y/o laboratorios en la zona, a diferencia de zonas costeras (playas o mar abierto) donde la carga tiende a ser más baja (Espinoza, 2014) por un mayor recambio. De allí la importancia de monitorear este parámetro debido a que un incremento de Vibrio spp. generalmente se relaciona con problemas de mortalidad de los organismos cultivados (Regunat-han y Wesley, 2004), pudiendo exacerbarse en los tanques de cultivo por un manejo deficiente (López-Torres y Lizárraga-Partida, 2001).
La similitud de carga de Vibrio spp de los diferentes puntos de muestreo entre laboratorios sugiere un manejo similar entre ellos. En general, la carga de Vibrio spp fue mayor (2.23 x 102 UFC mL-1) en el agua de larvicultura 1 en el laboratorio A, probablemente debido a una acumulación de bacterias asociado al incremento de materia orgánica por los residuos de los alimentos y desechos de los camarones, tal como lo señala Espinoza (2014). En todo caso, la carga de Vibrio spp aun en los tanques de larvicultura estuvieron dentro de los valores de referencia recomendados por Cuéllar-Ángel (2013), quien menciona que valores ≤102 UFC mL-1 en el agua de tanques listos para la siembra se consideran de buena calidad. Por otro lado, Heenatigala y Fernando (2016) reportan casos de vibriosis en cultivos larvarios a partir de conteos superiores a 5 x 103 UFC mL-1.
La carga promedio de bacterias heterótrofas en el agua de entrada de los tres laboratorios fue muy elevada (9x106UFC/mL-1). Se suele considerar que la concentración bacteriana en el agua cultivo de camarón o en aguas costeras heterotróficas es inferior a 1 x 106 UFC/mL-1 (Maeda y Liao, 1992). Los resultados del estudio superan reportes en Ecuador (101-103 UFC/mL-1) por Espinoza (2014), en cultivos de P. monodon en India (1 x 102 UFC/mL-1) por Otta et al. (2001) y en P. vannamei en México (1.3 x 104 UFC/mL-1) por Salcido (2012). Estas cargas elevadas fueron similares entre los tres laboratorios, y podría estar asociada a la ubicación de las instalaciones. Estos estaban ubicados en una zona estuarina que tiende a tener mayor acumulación de bacterias heterótrofas por efecto de las escorrentías y aportes de los ríos, y por un menor recambio diario (Seoánez, 2000), a diferencia de las zonas marino-costeras, sobre todo con plataformas profundas, donde las bacterias heterótrofas tienen mayor oportunidad de distribuirse tanto vertical como horizontalmente en la columna de agua, reduciendo la carga por unidad de área (Cifuentes et al., 2003).
Los resultados no mostraron diferencias significativas entre laboratorios ni entre los diferentes puntos dentro de un mismo laboratorio para el caso de bacterias heterótrofas, sugiriendo un manejo deficiente debido a que no reducen la carga bacteriana una vez ingresa las instalaciones. Otros estudios reportan valores de bacteria heterótrofas de 1 x 103 UFC/mL-1 (Reyes, 2009) y 1 x 104 UFC/mL-1 (Otta et al., 2001) incluso en tanques de cría, lo que refuerza la idea de que el tratamiento de agua en los laboratorios del estudio no es eficiente. Se tendría que evaluar factores como sobrealimentación, características de las dietas y las prácticas de manejo entre otras que pueden incrementar la materia orgánica y favorecer la proliferación bacteriana, aun cuando el agua de entrada sea de buena calidad (Viera, 2003).Aun cuando las bacterias heterótrofas tienen funciones relevantes en el reciclaje del carbono y el nitrógeno presentes en la materia orgánica y en la biodisponibilidad de nutrientes, entre otras propiedades benéficas (Beardsley et al., 2011), su incremento descontrolado en los sistemas de cultivos puede contribuir al estrés y afectar a los camarones (Drennan II et al., 2006).
Las encuestas no muestran diferencias significativas en el manejo entre laboratorios, lo cual es corroborado por los resultados bacteriológicos realizados (Vibrio spp y bacterias heterótrofas totales). En los tres laboratorios se utilizan probióticos para mejorar la calidad de agua al descomponer la materia orgánica y prevenir enfermedades inhibiendo el crecimiento de bacterias patógenas (Gullian et al., 2001), lo cual podría responder a la baja carga de Vibrio spp. Lo más llamativo en las encuestas fue la falta de capacitación de los operarios de los laboratorios, lo que indica un alto nivel de empirismo o falta de actualización de conocimientos; sin embargo, esto debe ser visto como una oportunidad para incrementar la productividad a través de la adquisición de criterios técnicos considerando la alta productividad y experiencia del sector en Ecuador.
CONCLUSIONES
Los conteos promedios en el agua de cultivo larvario estuvieron en 7 x 106 UFC/ mL-1 para las bacterias heterótrofas y 4 x 102 UFC/mL-1 para Vibrio spp.
Los conteos de bacterias heterótrofas totales y Vibrio spp no mostraron diferencias significativas (p>0.05) entre laboratorios para cada punto de muestreo ni entre puntos de muestreo dentro de un mismo laboratorio.
Los valores de bacterias heterótrofas superan los rangos considerados como aceptables.
Las encuestas no muestran diferencias de manejo sanitario entre los laboratorios, pero si falta de capacitación al personal en bioseguridad y buenas prácticas acuícolas (BPA).












 uBio
uBio