Introducción
El cultivo del algodonero es tradicional en el Perú. Gossypium barbadense L. es oriundo del centro de origen andino y es la especie de algodón más importante en el Perú, destacándose por su longitud larga y extra larga (McGregor, 1976). Históricamente de importancia económica, décadas atrás fue el principal cultivo de exportación (Campos et al. 2017). Es un cultivo en el que se ejemplifica la acción del control biológico, donde los enemigos naturales ejercen cierto control sobre la mayoría de sus plagas (Beingolea, 1959). Por este motivo, fue objeto pionero en el manejo integrado de plagas a nivel mundial, en el que se diversificaron los métodos de control fitosanitario debido a la catástrofe ecológica y económica tras la introducción y uso indiscriminado de insecticidas orgánico sintéticos (Herrera, 2010). A pesar de su importancia, hay pocos estudios sobre la fluctuación poblacional de sus plagas y enemigos naturales en Perú (González, 1962; de Ingunza & González, 1964; Korytkowski et al., 1966; Sánchez & Vergara, 1995; Del Águila, 2008). El objetivo de la presente investigación fue determinar la fluctuación poblacional de las principales plagas y de sus enemigos naturales en el cultivar Tangüis de Gossypium barbadense L. en condiciones de La Molina, Lima, Perú.
Materiales y métodos
Área de estudio
La investigación se realizó en el cultivar Tangüis (variedad UNA N°1) de Gossypium barbadense L. bajo un manejo agronómico convencional, en la Universidad Nacional Agraria La Molina (UNALM), Lima (12°05'06.5"S, 76°56'42.7"W, 238 m de elevación), en un campo con una extensión de 15 000 m2 (Figura 1).
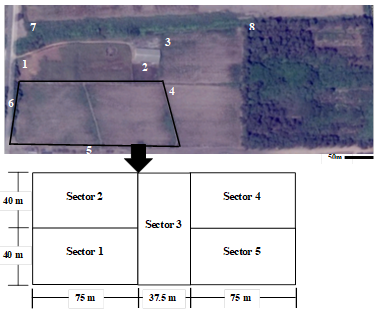
Figura 1 Área rectangular delimitada en la foto representa la zona de estudio y los números indican las áreas adyacentes (1= cultivo de ‘pasto de elefante’ Pennisetum purpureum, 2= malezas, 3= híbridos de algodón, 4= líneas de algodón, 5= árboles de mimosa, 6= árboles de plátano, 7= cultivos de panllevar, 8= bosque de árboles de pino Pinus sp.). Por último, la flecha señala la distribución de sectores en el cultivo de algodonero en la campaña 2013 - 2014, en La Molina-Lima.
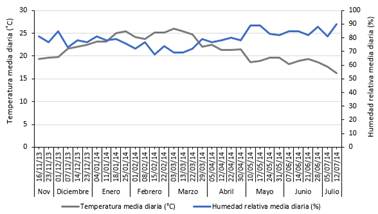
Las evaluaciones se ejecutaron por la mañana (8:00 - 12:00 h) cada siete días, de noviembre de 2013 a julio de 2014 a lo largo de toda la campaña agrícola. Las condiciones meteorológicas fueron registradas por la Estación Meteorológica Alexander Von Humboldt-UNALM (Figura 2).
Técnicas de muestreo
El campo se dividió en cinco sectores de 3 000 m2 cada uno (Figura 1) y se aplicaron tres técnicas de muestreo: evaluación directa de la planta, caída por sacudida de la planta y trampas de caída.
- Evaluación directa de la planta: Se escogieron 20 plantas al azar en cada uno de los cinco sectores, siendo un total de 100 plantas evaluadas en cada muestreo. Esta evaluación consistió en el examen minucioso de los órganos de la planta (brote terminal, hojas, botones florales, flores y bellotas) de acuerdo con el desarrollo fenológico del cultivo. En la etapa de desarrollo vegetativo, se evaluó en cada planta un brote terminal. A partir de la etapa de botón, se evaluó cada planta por tercios. En el tercio superior se evaluó un botón y una flor, en el tercio medio, una hoja, un botón, una flor y una bellota, y en el tercio inferior, una hoja, un botón, una flor, una bellota y la base de planta. Esta técnica se utilizó para todas las cinco plagas evaluadas (Aphis gossypii, Chloridea virescens, Anthonomus vestitus, Dysdercus peruvianus y Pectinophora gossypiella) y sus enemigos naturales respectivos, como se detallará más adelante.
- Caída por sacudida de la planta: Se escogieron cuatro plantas al azar en cada uno de los cinco sectores, siendo un total de 20 plantas evaluadas en cada muestreo. Esta técnica se realizó inclinando cuidadosamente la planta de algodonero y sacudiéndola de manera constante (10 batidas aproximadamente) sobre una manta blanca (0.75 x 1 m) extendida en el suelo. Esta técnica se empleó solo para tres plagas evaluadas (Chloridea virescens, Anthonomus vestitus y Dysdercus peruvianus) y sus enemigos naturales respectivos, como se especificará con mayor detalle en la siguiente sección.
- Trampas de caída: Se colocaron dos trampas distribuidas equitativamente por sector, siendo un total de 10 trampas instaladas en cada muestreo. Estas trampas consistieron en envases de polipropileno de 9 cm de altura, 9 cm de diámetro y 450 ml de capacidad, a los que se les colocó agua hasta la mitad de su altura, 10 g de sal común al ras, para evitar la descomposición de las muestras colectadas y 5 ml de champú inodoro e incoloro para romper la tensión superficial. Con la ayuda de una lampa pequeña las trampas fueron instaladas al ras del suelo y cambiadas cada siete días. Esta técnica se utilizó para los enemigos naturales de las plagas evaluadas.
Plagas y enemigos naturales evaluados
Se evaluaron las plagas con mayor importancia en el cultivo de algodonero: Aphis gossypii (Hemiptera: Aphididae), Chloridea virescens (Lepidoptera: Noctuidae), Anthonomus vestitus (Coleoptera: Curculionidae), Dysdercus peruvianus (Hemiptera: Pyrrhocoridae) y Pectinophora gossypiella (Lepidoptera: Gelechiidae). Los enemigos naturales fueron evaluados simultáneamente, empleando complementariamente trampas de caída para tal fin.
La metodología de evaluación utilizada fue de acuerdo a Sarmiento & Sánchez (2012), con adaptaciones en el número de muestras por planta en función al comportamiento y localización de las plagas y enemigos naturales en este cultivo.
A. gossypii y sus enemigos naturales: Las ninfas y adultos se evaluaron en forma directa. En la etapa de desarrollo vegetativo se evaluó el brote terminal y a partir de la etapa de botoneo, solo una hoja del tercio medio y una hoja del tercio inferior. El parasitoidismo se calculó en base al número de pulgones momificados, del total de todos los pulgones contabilizados por hoja, para determinar el porcentaje.
C. virescens y sus enemigos naturales: La evaluación de las larvas se realizó mediante dos técnicas, evaluación directa y caída por sacudida. En la evaluación directa, durante la etapa de desarrollo vegetativo se evaluó un brote terminal, y a partir de la etapa de botoneo, solo se evaluaron, un botón y una bellota tanto del tercio medio como del tercio inferior. También se evaluó su parasitoidismo, criando en laboratorio las larvas colectadas para la obtención de adultos de la plaga o de sus parasitoides.
A. vestitus y sus enemigos naturales: Se realizó mediante dos técnicas, evaluación directa (larvas y adultos) y caída por sacudida (adultos). En la evaluación directa, se revisaron un botón y una flor del tercio superior, del tercio medio y del tercio inferior. Los botones evaluados fueron abiertos para detectar presencia de larvas, verificándolo con la característica “hinchazón” externa; los adultos fueron registrados, examinando las flores. La evaluación de parasitoides se realizó colectando los botones infestados por la plaga para su acondicionamiento en el laboratorio y recuperación.
D. peruvianus: Se registraron tanto ninfas como adultos, mediante dos técnicas, evaluación directa (nidos: primeros estadios ninfales) y caída por sacudida (ninfas y adultos) durante todo el periodo del cultivo. En la evaluación directa los nidos fueron evaluados al pie de la planta, buscándolos debajo de la hojarasca o terrones, contabilizando el número de individuos.
P. gossypiella y sus enemigos naturales: Las larvas se evaluaron en forma directa, de una flor en el tercio superior, una flor y una bellota tanto en el tercio medio como en el tercio inferior. Para registrar la presencia de larvas y de sus parasitoides en las bellotas, éstas fueron colectadas para poder abrirlas, examinarlas y criarlas en laboratorio. Como muestra representativa se tomaron 10 bellotas por sector (5 del tercio medio y 5 del tercio inferior, escogidas al azar, haciendo un total de 50 bellotas).
Procesamiento de muestras colectadas
Se realizó en frascos de vidrio o envases de polipropileno, dependiendo del tipo de muestra, debidamente rotulados para su posterior traslado al laboratorio. Las ninfas y larvas de las plagas colectadas fueron acondicionadas para la obtención de adultos, tanto de las plagas como de sus parasitoides. Además, se realizó la separación y cuantificación de los fitófagos, depredadores y parasitoides para su posterior montaje e identificación. La colección obtenida fue incorporada a la colección del Museo de Entomología Klaus Raven Büller -UNALM.
Identificación de plagas y enemigos naturales
Con la ayuda de un estereoscopio y microscopio, colecciones de ejemplares en el museo, y claves dicotómicas de libros y publicaciones específicas, se identificaron las plagas y sus enemigos naturales. Las plagas fueron reconocidas hasta el nivel de especie, y los enemigos naturales hasta el nivel de especie en algunos casos o de género.
Resultados
Aphis gossypii (Hemiptera: Aphididae)
A. gossypii estuvo presente durante casi todo el periodo del cultivo, con una infestación máxima registrada de 34.64 individuos por planta en la primera semana de evaluación de diciembre (tercera evaluación del cultivo, desarrollo vegetativo), seguida de una disminución progresiva de su población conforme a la maduración del cultivo, resaltando un segundo registro alto con 31.44 individuos por planta en la primera semana de evaluación de abril (decimonovena evaluación del cultivo, fructificación). Se observó una coincidencia temporal entre la máxima infestación del pulgón y las densidades máximas de sus parasitoides (2.33 individuos por planta) y depredadores (0.7 individuos por planta), ambos en la segunda y tercera semana de evaluación de diciembre, respectivamente (cuarta y quinta evaluación del cultivo, desarrollo vegetativo), y también en la cuarta semana de evaluación de febrero y tercera semana de evaluación de marzo (decimocuarta y decimoséptima evaluación del cultivo, fructificación) con dos niveles altos de los depredadores (1.33 y 1.17 individuos por planta cada uno). A diferencia de los parasitoides, los depredadores se registraron durante casi todo el periodo del cultivo (Figura 3).
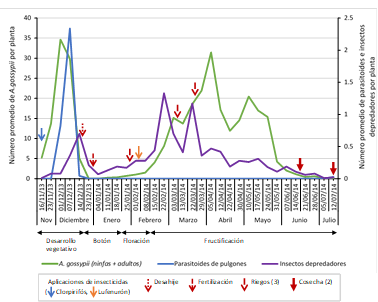
Figura 3 Fluctuación poblacional de A. gossypii (ninfas + adultos), parasitoides de pulgones e insectos depredadores (Coccinellidae, Chrysopidae, Hemerobiidae y Syrphidae) mediante la técnica de evaluación directa de la planta en el cultivo del algodonero en la campaña 2013-2014, en La Molina-Lima.
Tres especies de parasitoides de A. gossypii fueron recuperadas, Aphidius colemani, Lysiphlebus testaceipes y Praon volucre (Hymenoptera: Braconidae), siendo L. testaceipes la más abundante (53 individuos (Tabla 1), durante las tres primeras semanas de evaluación de diciembre (desde la tercera hasta la quinta evaluación del cultivo, desarrollo vegetativo). Se reconocieron cuatro familias (Coccinellidae, Chrysopidae, Hemerobiidae y Syrphidae) y 14 especies de depredadores, destacando por su abundancia Coccinellidae (Coleoptera) (762 individuos) y Chrysopidae (Neuroptera) (442 individuos), con Hippodamia convergens (359 individuos) y Chrysoperla externa (100 individuos) como las especies más numerosas, respectivamente (Tabla 2). Se observó que Coccinellidae se estableció rápidamente al inicio del cultivo, con una densidad máxima de 0.66 individuos por planta en la tercera semana de evaluación de diciembre (quinta evaluación del cultivo, desarrollo vegetativo), registrándose después dos niveles altos de su población de 0.66 y 0.57 individuos por planta en la cuarta semana de evaluación de febrero y tercera semana de evaluación de marzo cada uno (decimocuarta y decimoséptima evaluación del cultivo, fructificación). Chrysopidae se estableció, efectivamente, a partir de la floración, aumentando su población progresivamente hasta alcanzar dos niveles altos de 0.67 y 0.6 individuos por planta en la cuarta semana de evaluación de febrero y tercera semana de evaluación de marzo, respectivamente (decimocuarta y decimoséptima evaluación del cultivo, fructificación) (Figura 4).
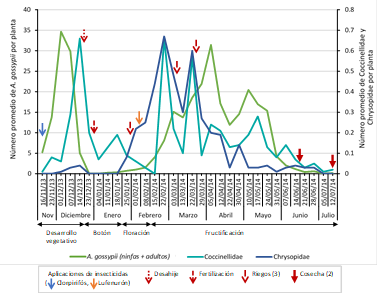
Figura 4 Fluctuación poblacional de A. gossypii (ninfas + adultos), Coccinellidae y Chrysopidae mediante la técnica de evaluación directa de la planta en el cultivo del algodonero en la campaña 2013-2014, en La Molina-Lima.
Tabla 1 Parasitoides emergidos (familias, especies y abundancia) de las plagas evaluadas en el cultivo del algodonero en la campaña 2013-2014, en La Molina-Lima.
| Plaga hospedera | Parasitoide | ||
| Familia | Especie | Abundancia | |
| A. craccivora y A.gossypii | Braconidae | Aphidius colemani | 6 |
| A. craccivora y A.gossypii | Braconidae | Lysiphlebus testaceipes | 53 |
| A. gossypii | Braconidae | Praon volucre | 1 |
| C. virescens | Ichneumonidae | Temelucha sp. | 1 |
| A. vestitus | Pteromalidae | Pteromalus sp. | 1 |
Tabla 2 Órdenes, familias, especies y sus respectivas abundancias de insectos depredadores registrados en el cultivo del algodonero en la campaña 2013-2014, en La Molina-Lima.
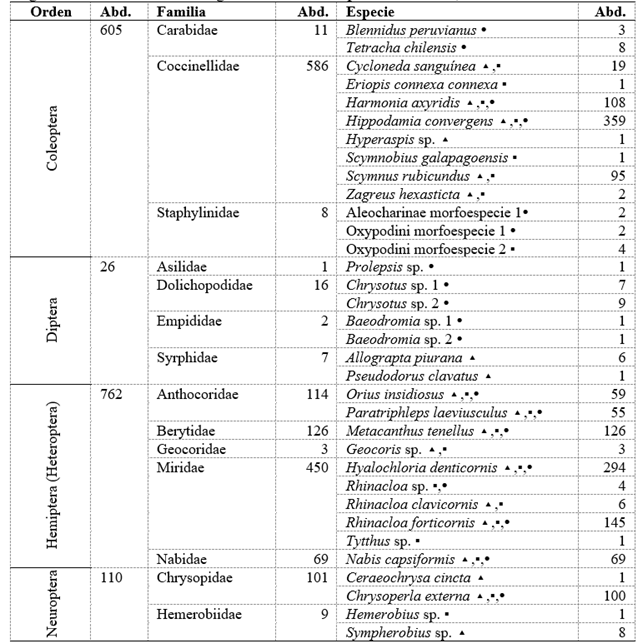
▴ = colectado mediante la técnica de evaluación directa de la planta, ▪ = colectado mediante la técnica de caída por sacudida de la planta, ( = colectado mediante la técnica de trampas de caída. Abd.: Abundancia.
Chloridea virescens (Lepidoptera: Noctuidae)
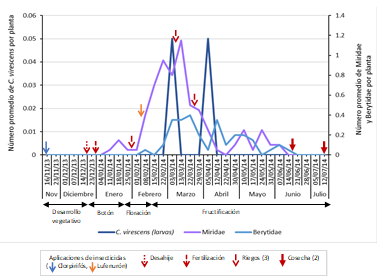
Se encontraron valores muy bajos de C. virescens a lo largo del periodo del cultivo, registrándose como máximo 0.04 y 0.05 larvas por planta mediante la evaluación directa y caída por sacudida, respectivamente; ambas durante la fructificación. En el caso de la evaluación directa, se hallaron 0.04 larvas por planta en la primera semana de evaluación de abril (decimonovena evaluación del cultivo), y en el caso de la caída por sacudida se colectaron 0.05 larvas por planta en dos periodos de evaluación, en la primera semana de evaluación de marzo y primera semana de evaluación abril (decimoquinta y decimonovena evaluación del cultivo). La presencia y abundancia de los depredadores fueron notablemente mayores que la fluctuación de la plaga, alcanzando niveles máximos de 1.27 y 1.7 individuos por planta mediante las técnicas de evaluación directa y caída por sacudida en la tercera y segunda semana de evaluación de marzo, respectivamente (decimoséptima y decimosexta evaluación del cultivo, fructificación) (Figura 5).
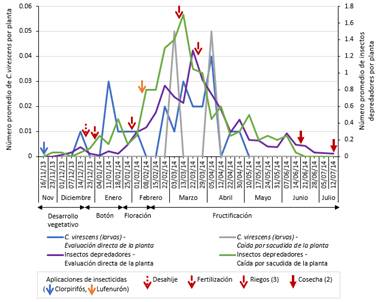
Figura 5 Fluctuación poblacional de larvas de C. virescens y sus insectos depredadores (Anthocoridae, Berytidae, Chrysopidae, Geocoridae, Hemerobiidae, Miridae y Nabidae) mediante las técnicas de evaluación directa de la planta y caída por sacudida de la planta en el cultivo del algodonero en la campaña 2013-2014, en La Molina-Lima.
Se recuperó solo un individuo parasitoide, Temelucha sp. (Hymenoptera: Ichneumonidae) en la quinta semana de evaluación (diciembre - desarrollo vegetativo) (Tabla 1). De los grupos depredadores, se colectaron siete familias (Anthocoridae, Berytidae, Chrysopidae, Geocoridae, Hemerobiidae, Miridae y Nabidae) y 14 especies, destacando por su abundancia Miridae (Hemiptera) (455 individuos), Chrysopidae (Neuroptera) (442 individuos) y Berytidae (Hemiptera) (126 individuos), siendo las especies más predominantes Hyalochloria denticornis (294 individuos), Chrysoperla externa (100 individuos) y Metacanthus tenellus (126 individuos) en cada familia respectivamente (Tabla 2). Las familias más abundantes de insectos depredadores fueron Miridae y Chrysopidae mediante la evaluación directa, y Miridae y Berytidae mediante la técnica por sacudida. Chrysopidae, con una abundancia total de 442 individuos, alcanzó el nivel más alto en la cuarta semana de evaluación de febrero, con 0.67 individuos por planta (decimocuarta evaluación del cultivo), y luego un segundo nivel alto en la tercera semana de evaluación de marzo, con 0.6 individuos por planta (decimoséptima evaluación del cultivo). Miridae, con una abundancia total de 455 individuos, registró niveles altos de 0.56 y 1.15 individuos por planta en la tercera y segunda semana de evaluación de marzo (decimoséptima y decimosexta evaluación del cultivo cada uno), mediante la evaluación directa y caída por sacudida, respectivamente. Finalmente, Berytidae, con una abundancia total de 126 individuos, exhibió dos niveles altos, el más alto de 0.4 individuos por planta en la tercera semana de evaluación de marzo (decimoséptima evaluación del cultivo), y después 0.35 individuos por planta en la segunda semana de evaluación de abril (vigésima evaluación del cultivo). Todos estos niveles se registraron en la fructificación (Figuras 6y7).
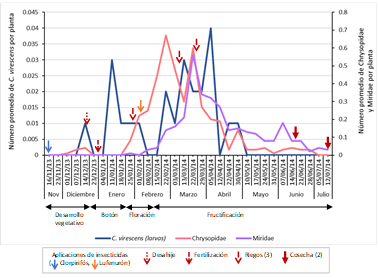
Figura 6 Fluctuación poblacional de larvas de C. virescens, Chrysopidae y Miridae mediante la técnica de evaluación directa de la planta en el cultivo del algodonero en la campaña 2013-2014, en La Molina-Lima.
Anthonomus vestitus (Coleoptera: Curculionidae)
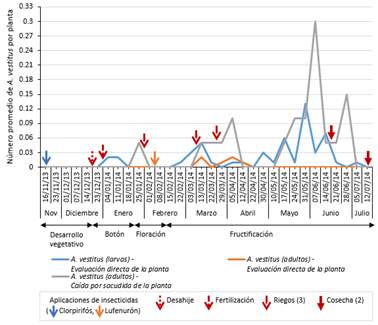
La evaluación de A. vestitus para ambas técnicas registró una baja población. Las larvas fueron observadas desde la primera evaluación de botones (con 0.02 individuos por planta en la primera semana de evaluación de enero, séptima evaluación del cultivo, en la etapa de botón) y estuvieron presentes durante casi todo el periodo del cultivo, siendo su mayor población de 0.13 individuos por planta en la cuarta semana de evaluación de mayo (vigesimosexta evaluación del cultivo, fructificación). Mientras que los adultos registrados mediante la misma técnica (evaluación directa) resultó en una más escasa población, detectándose solamente en marzo y abril (fructificación), y como máximo 0.02 individuos por planta en la segunda semana de evaluación de marzo y primera semana de evaluación de abril (decimosexta y decimonovena evaluación del cultivo). La población de adultos registrados mediante la técnica de caída por sacudida fue mayor y se prolongó intermitentemente a lo largo del periodo de evaluación, donde su mayor densidad se halló en la primera semana de evaluación de junio con 0.3 individuos por planta (vigesimoséptima evaluación del cultivo, fructificación) (Figura 8). Se recuperó solo un individuo parasitoide, Pteromalus sp. (Hymenoptera: Pteromalidae) en la veinticuatroava semana de evaluación (mayo - fructificación) (Tabla 1).
Dysdercus peruvianus (Hemiptera: Pyrrhocoridae)
La población de ninfas y adultos de D. peruvianus se presentó a partir de febrero en escasa cantidad (floración), con 0.05 individuos por planta en la primera semana de evaluación de ese mes (undécima evaluación del cultivo), incrementándose rápidamente en abril con una densidad máxima de 7.45 individuos por planta, en la cuarta semana de evaluación del mes respectivo (vigesimosegunda evaluación del cultivo, fructificación), a pesar del control mecánico empleado mediante su colecta manual desde marzo. Se mantuvo una población de 4 a 6 individuos por planta por fecha de evaluación durante los dos meses siguientes antes de decrecer al final del cultivo. La presencia de nidos de D. peruvianus se registró a partir de marzo en bajos niveles (fructificación), con 0.1 individuos por nido en la primera semana de evaluación del mes (decimoquinta evaluación del cultivo), alcanzando dos densidades altas, en mayo (5.66 individuos por nido en la tercera semana de evaluación del mes, vigesimoquinta evaluación del cultivo) y en junio (6.46 individuos por nido en la segunda semana de evaluación del mes, vigesimoctava evaluación del cultivo) y disminuyendo notablemente al término del cultivo (Figura 9).
Pectinophora gossypiella (Lepidoptera: Gelechiidae)
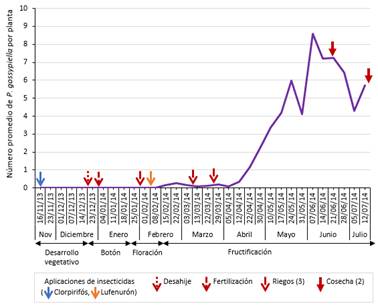
No se encontraron larvas de P. gossypiella en flores, pero sí en bellotas (Figura 10). Desde la primera aparición de bellotas (fructificación), se registraron larvas en muy bajos niveles de población, iniciando su infestación en el campo con 0.16 individuos por planta en la tercera semana de evaluación de febrero (decimotercera evaluación del cultivo), sin embargo, a partir de abril se incrementó rápidamente alcanzando una densidad máxima en junio (8.6 individuos por planta en la primera semana de evaluación del mes, vigesimoséptima evaluación del cultivo). Respecto a sus enemigos naturales, no se recuperó ningún parasitoide.
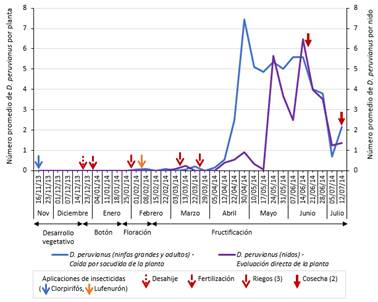
Figura 9 Fluctuación poblacional de ninfas + adultos y nidos de D. peruvianus mediante las técnicas de caída por sacudida de la planta y evaluación directa de la planta respectivamente, en el cultivo del algodonero en la campaña 2013-2014, en La Molina-Lima.
Insectos depredadores y arañas
En esta sección solo se consideró la población de insectos depredadores sin los estados de huevo y pupa de Coccinellidae y Chrysopidae, para analizar a los insectos y arañas en sus estados depredadores activos. Las poblaciones de insectos depredadores y arañas fueron registradas durante todo el periodo del cultivo. En los insectos depredadores se halló solo un nivel alto con 3.79 individuos por planta en la tercera semana de evaluación de diciembre (quinta evaluación del cultivo, desarrollo vegetativo), mientras que en las arañas se reconocieron dos poblaciones altas con 8.89 individuos por planta en la cuarta semana de evaluación de enero (décima evaluación del cultivo, floración) y 10.58 individuos por planta en la segunda semana de evaluación de abril (vigésima evaluación del cultivo, fructificación). En general, ambas poblaciones crecieron con el desarrollo fenológico del algodonero y decrecieron al final (Figura 11).
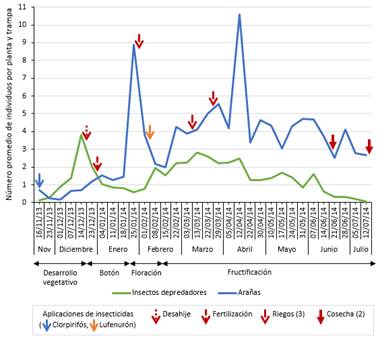
Figura 11 Fluctuación poblacional de insectos depredadores y arañas (mediante las técnicas de evaluación directa, caída por sacudida de la planta y trampas de caída) en el cultivo del algodonero en la campaña 2013-2014, en La Molina-Lima.
Los insectos depredadores más abundantes fueron Hippodamia convergens (Coleoptera: Coccinellidae) (359 individuos - 23.88%), Hyalochloria denticornis (294 individuos - 19.55%) y Rhinacloa forticornis (145 individuos - 9.64%) (Hemiptera: Miridae) (Tabla 2), siendo el porcentaje en base al total de insectos depredadores colectados durante todo el periodo del cultivo del algodonero. Y en las arañas Misumenops sp. morfo 1 (93 individuos - 26.65%) (Thomisidae), Zelotes laetus (55 individuos - 15.76%) (Gnaphosidae) y Theridion volubile (47 individuos - 13.47%) (Theridiidae) (Tabla 3), así mismo como en el caso anterior, el porcentaje fue en base al total de arañas colectadas durante todo el periodo del campo evaluado. Es relevante señalar que la identificación de arañas hasta el nivel de especie se realizó principalmente con los individuos adultos.
Tabla 3 Familias y especies de arañas, y sus respectivas abundancias registradas en el cultivo del algodonero en la campaña 2013-2014, en La Molina-Lima.
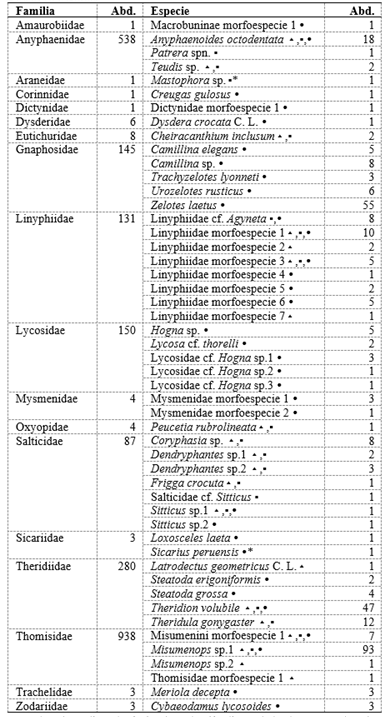
▴ = colectado mediante la técnica de evaluación directa de la planta, ▪ = colectado mediante la técnica de caída por sacudida de la planta, ( = colectado mediante la técnica de trampas de caída. * Identificado en estado juvenil. Abd.: Abundancia
Discusión
Aphis gossypii (Hemiptera: Aphididae)
La presencia y densidad de A. gossypii durante casi todo el periodo del algodonero se correspondieron con estudios previos donde registraron la plaga en las diferentes etapas fenológicas del cultivo (Wille, 1952; González, 1962; de Ingunza & González, 1964; Velarde et al. 1968; Afshari et al. 2009; Fernandes et al. 2012).
El aumento inicial se atribuyó a su preferencia por brotes jóvenes (Velarde et al., 1968), su posterior desarrollo a las condiciones climáticas favorables (Wille, 1952; Sánchez & Sarmiento, 2002; Vásquez-Castro, 2004) y al estado fisiológico de las plantas (Velarde et al., 1968; Ebert & Cartwright, 1997; Sánchez & Sarmiento, 2002; Vásquez-Castro, 2004). La disminución al final del cultivo coincidió con lo citado por Beingolea (1997).
Las prácticas agronómicas efectuadas no parecieron tener un impacto en el desarrollo poblacional de la plaga, inclusive la aplicación de insecticidas dirigida hacia otras plagas en el cultivo, ya que después de las aplicaciones se incrementó su densidad poblacional. Por su parte, los enemigos naturales (parasitoides y depredadores) sí contribuyeron en disminuir la población de A. gossypii durante todo el cultivo, tal como lo hallaron Wille (1952), González (1962), González (1966), de Ingunza & González (1964), Beingolea (1997), Sánchez & Sarmiento (2002) y Fernandes et al. (2012).
La sensibilidad de los parasitoides a temperaturas altas explicó su ausencia durante el verano y su retorno en invierno (Beingolea, 1997). La presencia continua de Coccinellidae y Chrysopidae coincidió con lo observado por González (1962); de Ingunza & González (1964) y Cárdenas & Valencia (1970). La presencia de estas familias estuvo correlacionada con la población de A. gossypii, como indicaron Beingolea (1959), Wells et al. (2001) y Rathod & Bapodra (2004), para Coccinellidae y A. gossypii, controlando al pulgón, a pesar de su naturaleza polífaga (Beingolea, 1959; Knutson & Ruberson, 1996; Wells et al. 2001).
La aplicación de los insecticidas hacia otras plagas, al parecer, no influyó fuertemente de manera negativa en las poblaciones de los parasitoides e insectos depredadores de A. gossypii. Podría ser porque la aplicación de clorpirifós fue al inicio del cultivo y de manera localizada, no permitiendo una mayor agresión hacia sus enemigos naturales; o porque haya retrasado un poco la aparición de estos, pero que visiblemente pudieron manifestarse y establecerse en el cultivo; o por lo detallado por De Ingunza & González (1964), por una disminución de los enemigos naturales después de la aplicación de insecticidas orgánicos (oxidemeton metil, paratión, DDT y BHC).
Chloridea virescens (Lepidoptera: Noctuidae)
La escasa población larval de C. virescens a lo largo del cultivo fue similar a lo reportado por Sánchez & Vergara (1995), y su ausencia a partir del séptimo mes, en mayo, se relacionó con el desarrollo avanzado del algodonero, conforme con Wille (1952).
Un correcto manejo agronómico, mediante la fertilización y riego limitando el desarrollo de plantas suculentas (Wille, 1952; Bagley, 1958; Sánchez & Sarmiento, 2002; Vásquez-Castro, 2004) y la aplicación de lufenurón limitaron su población. Factores ecológicos como el clima y factores biológicos (Wille, 1952; Herrera, 1963, 1987; Korytkowski et al. 1966; Aguilar, 1969; Sánchez & Sarmiento, 2002; Vásquez-Castro, 2004), fueron determinantes en la escasa población de C. virescens, siendo el más importante en este estudio la abundancia y diversidad de sus insectos depredadores, con mayor relevancia Miridae y Chrysopidae (por su mayor abundancia).
La ausencia de parasitoides concordó con lo reportado por Sánchez & Vergara (1995); sin embargo, es contrario a lo registrado por De Ingunza & González (1964). Aunque los niveles de C. virescens fueron bajos, su crecimiento poblacional coincidió con el de sus depredadores en ambas técnicas de evaluación. A pesar de la aplicación de clorpirifós, los insectos depredadores aumentaron gradualmente, debido posiblemente a la aplicación localizada del insecticida. Fue resaltable la sensibilidad de los chinches depredadores a los insecticidas orgánicos, ya que la mayoría tiene un régimen de alimentación mixto (Beingolea, 1959; Herrera, 1963; Sánchez & Sarmiento, 2002).
Se observó una correlación entre las familias depredadoras más abundantes, como Miridae, y la presencia de C. virescens, especialmente desde la floración, sugiriendo que Miridae desempeña un papel crucial en su control, coincidiendo con hallazgos previos de Herrera (1961, 1963, 1987).
Anthonomus vestitus (Coleoptera: Curculionidae)
La baja población de larvas y adultos de A. vestitus concordó con reportes de Aguilar (1969) y Sánchez & Vergara (1995), que indicaron que un efectivo manejo agronómico (fertilización, riegos controlados y una adecuada densidad de plantas) limita el crecimiento excesivo del algodonero (Vásquez-Castro, 2004). A pesar de la escasa presencia de la plaga, se observó un leve aumento entre mayo y junio (correspondientes al séptimo y octavo mes del cultivo), atribuido a condiciones climáticas favorables, como las continuas neblinas y alta humedad relativa, conforme a lo descrito por Wille (1952) para la costa central. El escaso parasitoidismo coincidió con los reportes de Vásquez-Castro (2004) y Sánchez & Sarmiento (2002).
Dysdercus peruvianus (Hemiptera: Pyrrhocoridae)
La presencia inicial de D. peruvianus, o “arrebiatado”, que pasó desapercibida por su escasa población desde la floración coincidió con Lamas (1966). En la fructificación, su población aumentó rápidamente por la disponibilidad de semillas de algodón, su principal fuente de alimentación (Wille, 1952; Sánchez & Sarmiento, 2002; Vásquez-Castro, 2004). Posteriormente, su población disminuyó tras la cosecha debido a la escasez de semillas.
El desarrollo del "arrebiatado" también fue favorecido por las condiciones climáticas, como una alta humedad relativa y baja temperatura registradas en abril-junio (correspondiente desde el sexto al octavo mes del cultivo), coincidiendo con Wille (1952, 1958) y Sánchez & Sarmiento (2002). En contraste, un manejo agronómico adecuado, con densidad controlada de plantas y ausencia de malezas (para evitar microclimas propicios), limitaron su propagación, como lo referido por Wille (1952). Sin embargo, el retraso en la oportunidad de cosecha contribuyó al aumento poblacional de la plaga. Este retraso, de 45 días aproximadamente (la primera y segunda cosecha tuvieron que haber sido a inicios de mayo e inicios de junio), se debió a la falta de personal para realizar la cosecha. Realizar cosechas en fechas adecuadas habría evitado una mayor infestación, ya que la población de nidos recién estaba desarrollándose en marzo (en el quinto mes del cultivo). Este aspecto es crucial, ya que sus enemigos naturales tienen una influencia muy limitada (Wille, 1952; Sánchez & Sarmiento, 2002; Vásquez-Castro, 2004).
Pectinophora gossypiella (Lepidoptera: Gelechiidae)
La ocurrencia inicial de la plaga coincidió con Korytkowski (1984), ya que la infestación en el campo apareció con las bellotas recién formadas, mientras que su densidad poblacional contrastó con Sánchez & Vergara (1995), donde registraron la plaga en poblaciones muy bajas y solo en las últimas tres evaluaciones del cultivo. A pesar del manejo agronómico adecuado, la cosecha retrasada en junio y julio favoreció el incremento poblacional de Pectinophora gossypiella (por su alimentación de las semillas de algodonero), alcanzando una densidad máxima de 8.6 individuos por planta en junio (octavo mes del cultivo). Con cosechas oportunas, la infestación no habría proliferado de tal forma. En la cuarta semana de evaluación de abril (sexto mes del cultivo) se registraron sólo 2.2 individuos, y la población suele disminuir rápidamente tras la primera cosecha.
La ausencia de parasitoides coincidió con Sánchez & Vergara (1995), en contraste con Tejada-Rodríguez (1993). Los insectos depredadores no afectaron significativamente la población de P. gossypiella debido a su ineficacia frente a las características biológicas de la plaga, como lo señalan Sánchez & Sarmiento (2002). Es importante destacar que las larvas registradas del "gusano rosado" escaparon de la depredación inicial de estos controladores biológicos, ya que solo eran susceptibles en el estado de huevo. Las larvas dentro de las bellotas están fuera del alcance de los enemigos naturales.
Insectos depredadores y arañas
La presencia continua de insectos depredadores y arañas coincidió con Sánchez & Vergara (1995) y Dippenaar-Schoeman et al. (1999), siendo las arañas conocidas por su gran habilidad de dispersión y colonización (Marc et al. 1999). Comparado con resultados previos, Lobatón (1959), Beingolea (1962), Aguilar (1977) y Sánchez & Vergara (1995) registraron diversas cantidades de insectos depredadores y arañas, siendo el mínimo 4 (Beingolea, 1962) y máximo 30 (Aguilar, 1977) arañas por mata.
El crecimiento de las poblaciones de insectos depredadores y arañas se relacionaron con el desarrollo del algodonero, como señaló Aguilar (1974, 1976, 1977), Almada et al. (2012), y Shrestha & Parajulee (2013), influenciado por la disponibilidad de presas y la naturaleza del hábitat (Aguilar, 1977; Van den Berg, 1989; Van den Berg & Dippenaar-Schoeman, 1991; Dippenaar-Schoeman et al. 1999; Jiménez-Valverde & Lobo, 2007; Rodrigues et al. 2009; Almada et al. 2012; Shrestha & Parajulee, 2013). La densidad máxima de insectos depredadores (conformado por todos los insectos depredadores registrados en el campo evaluado) coincidió con la máxima infestación de A. gossypii, gracias al gran complejo de enemigo naturales que posee la plaga. Además, en el caso de las arañas, los dos periodos de máxima densidad (8.89 y 10.58 individuos por planta en enero y abril respectivamente, correspondientes al tercer y sexto mes del cultivo) se vieron influenciados por la colecta de hembras adultas de Lycosidae y sus numerosas crías juveniles mediante trampas de caída en esas dos evaluaciones, siendo característico de Lycosidae su distintivo cuidado maternal (Nyffeler, 2000; Ubick et al. 2005; Jocqué & Dippenaar-Schoeman, 2006).
Las prácticas agronómicas efectuadas no afectaron significativamente a los artrópodos benéficos, inclusive la aplicación de insecticidas en el cultivo, ya que se observó una constante presencia de los mismos a través de las diferentes etapas de manejo del cultivo, contrario a lo citado por Aguilar (1977), donde el manejo afectó negativamente a las diversas familias de arañas. El establecimiento de la fauna benéfica a pesar de la aplicación de insecticidas también coincidió con lo reportado por De Ingunza & González (1964) y Aguilar (1974, 1976, 1977) para los insectos depredadores y arañas, respectivamente.
Probablemente la primera aplicación de insecticida (clorpirifós) pudo retrasar su establecimiento, especialmente la población de arañas, ya que clorpirifós es muy perjudicial para las arañas (Amalin et al. 2000; Pekár, 2002, 2012; Fountain et al. 2007), sin embargo, lograron manifestarse en este campo evaluado. Esto se debió a que la aplicación fue de manera localizada y también al tiempo de efecto del insecticida en la superficie del suelo, de 3 a 14 días aproximadamente (Fountain et al. 2007). Con relación a la segunda aplicación de insecticida (lufenurón), no se registró disminución en la población de los insectos depredadores luego de la misma, y hubo una ligera disminución de la población de arañas, quizás por la misma fluctuación, ya que se trata de un insecticida selectivo hacia larvas de Lepidoptera, tal como lo señalaron Sechser et al. (2001) y Desuky et al. (2012). Este resultado coincidió con Javaid et al. (1999), Sechser et al. (2001) y Mansfield et al. (2006), sin tener mucho impacto negativo en la fauna benéfica.
La disminución poblacional de los insectos depredadores y arañas al final del cultivo se debió a la manipulación de las plantas durante la cosecha, afectando negativamente a los artrópodos, como lo reportado por Aguilar (1977), Marc et al. (1999), Liljesthröm et al. (2002), y Butt & Muhammad (2012).
La mayor población de arañas tiene importancia como parte del control biológico de las plagas en el algodonero (como complemento de los insectos depredadores), lo cual coincidió con Aguilar (1965, 1968, 1974, 1975, 1976, 1977, 1978, 1979a, 1979b, 1988) y Aguilar & Güérovich (1978). Es notable resaltar lo citado por Marc & Canard (1997), en el cual redefinieron la importancia de las arañas en el agroecosistema, ya que, si se toma en cuenta sus estrategias de caza y localización en la vegetación, pueden considerarse como depredadoras especialistas. Así mismo, indicaron que no todas las especies de arañas son útiles contra una plaga particular, pero considerando su diversidad podrían ser importantes para controlar diversas plagas. Cabe mencionar que las técnicas de evaluación directa, y caída por sacudida de la planta, registraron un mayor número de familias y especies de arañas con preferencia de localización en el follaje por sus estrategias de caza (por lo tanto, con mayor control sobre las plagas evaluadas en el estrato superior o de follaje del algodonero), mientras que las trampas de caída registraron un mayor número de familias y especies de arañas de los estratos inferiores de la vegetación y en general del suelo (descrito como el método más eficiente para capturar arañas epigeas), como lo mencionado por Álvares et al. (2004), Ubick et al. (2005) y Jocqué & Dippenaar-Schoemann (2006).
La abundancia de Hippodamia convergens se relacionó con su eficacia en el control de A. gossypii, como lo mencionaron Flint & Dreistadt (2005), Scarpellini & Andrade (2010), Bahy et al. (2013) y Shrestha & Parajulee (2013). Por su parte, la abundancia de Hyalochloria denticornis se debió a su dependencia alimenticia y reproductiva de las plantas de algodonero, y a que es clave en el control de A. texana y pulgones, como lo indicado por Beingolea (1959), Herrera (1987) y Sánchez & Sarmiento (2002). Respecto a Rhinacloa forticornis, se correspondió a una dependencia alimenticia hacia las plantas de algodonero en sus primeros estadíos y a su depredación de diversas plagas del cultivo, siendo importante en el control de C. virescens (Beingolea, 1959; Herrera, 1963; Sánchez & Sarmiento, 2002).
La mayor abundancia de Thomisidae en el algodonero también fue registrado por Almada et al. (2012). Su predominancia en este estudio se debió a dos características importantes: su depredación sobre diversas plagas de lepidópteros del algodonero (componente valioso dentro de los depredadores generalistas), según lo citado por Aguilar (1977, 1988) y Almada et al. (2012), y a su estrategia de caza o gremio, viviendo y cazando al acecho en las flores, siendo el algodonero propicio para albergar este tipo de arañas, como lo mencionado por Pérez-Guerrero et al. (2009). La predominancia de Misumenops sp. coincidió con Almada et al. (2012) y se relacionó con el posible refugio de la especie en el bosque cercano al cultivo evaluado, debido al prolongado ciclo de vida del género (145 a 531 días para alcanzar la madurez) y con ello la necesidad de un hábitat cercano estable, como lo señalado por Plagens (1983).
Conclusiones
De las cinco plagas evaluadas, tres fueron más importantes por su abundancia, siendo la más predominante A. gossypii, de mayor relevancia en la etapa de desarrollo vegetativo, seguida por D. peruvianus y P. gossypiella, ambas en la etapa de fructificación. Respecto a los insectos depredadores y arañas, se registró una notable diversidad y abundancia de los mismos, los cuales se presentaron durante todas las etapas fenológicas del algodonero, y contribuyeron significativamente en el control de A. gossypii y C. virescens. En el caso de los insectos depredadores, los más predominantes fueron Hippodamia convergens, Hyalochloria denticornis y Rhinacloa forticornis, y en las arañas Misumenops sp. morfo 1, Zelotes laetus y Theridion volubile. El parasitoidismo fue bajo o escaso en la mayoría de las plagas, resaltando por su abundancia Lysiphlebus testaceipes como parasitoide de A. gossypii en el desarrollo vegetativo del algodonero.
Por último, se resalta la importancia del manejo agronómico del cultivo del algodonero, el cual puede influir significativamente de manera positiva o negativa en la infestación de las plagas, y la presencia y abundancia de sus enemigos naturales. En el caso de las plagas evaluadas, la cosecha tardía favoreció el crecimiento poblacional de D. peruvianus y P. gossypiella; y respecto a los enemigos naturales, la aplicación del insecticida clorpirifos al inicio del cultivo pudo haber retrasado el establecimiento de los artrópodos depredadores y parasitoides en el campo, y la cosecha disminuyó rápidamente la población de artrópodos depredadores al final del cultivo.












 uBio
uBio