Introducción
Las carreteras son infraestructuras que facilitan la interconexión entre pueblos y mejoran la calidad de vida humana. Sin embargo, sus construcciones requieren la evaluación de sus posibles impactos ambientales, debido a que tienen un efecto fragmentador del hábitat, pudiendo generar amenazas a la diversidad biológica de los ecosistemas circundantes (Ferrante et al., 2021; Maffei & Cossios, 2021). Por otro lado, contribuyen a la colonización de nuevos espacios de bosques con fines agrícolas y de expansión urbana, con escaso criterio de normas adecuadas de uso del territorio; que consecuentemente ocasionan una reducción significativa de la cobertura boscosa y aumento de las emisiones de CO2; extracción irracional de los recursos; así como contaminación, principalmente por residuos sólidos orgánicos (Kibblewhite, 2018; Honorio et al., 2020).
La carretera Iquitos-Nauta es una vía asfaltada de 94 km de longitud, cuya construcción se extendió por casi 30 años (Mäki et al., 2001). Conecta a las capitales de las provincias de Maynas (Iquitos) y Loreto (Nauta), en la región Loreto-Perú. Su área de influencia se caracteriza por presentar una vasta red hidrológica conformada por decenas de quebradas (riachuelos) que desembocan en ríos como el Nanay, Itaya y Marañón, todos ellos tributarios del río Amazonas (IIAP, 2002). Con el asfaltado de esta carretera se desarrolló un rápido proceso de ocupación poblacional en su área de influencia, sin considerar un plan de ordenamiento territorial (IIAP, 2002). Pocos estudios reportan los impactos de este proceso de ocupación, dentro de los que podemos mencionar la extracción ilegal de madera redonda y sustrato mineral (arena) de los ecosistemas de varillal de arena blanca (Honorio et al., 2020); el riesgo de extinción local de tres especies de primates: Lagothrix poeppigii, Callicebus torquatus y Alouatta seniculus, relacionado con la alta presión de caza y deforestación (Aquino et al., 2014); cambios de uso de la tierra y una tasa de deforestación de 1 756.89 ha/año para el periodo de 1989-2017 (Castro-Medina, 2020).
En la selva baja peruana se denominan como quebradas a los riachuelos de aguas ácidas, de color marrón claro a oscuro, que drenan suelos arenosos y pantanosos de la llanura amazónica y cuyo color característico se debe a la presencia de substancias fúlvicas y húmicas disueltas en sus aguas como resultado de la desintegración de la materia orgánica (Maco, 2006). Estas características les proporcionan un valor ecológico particular; además, son fuente de diferentes actividades socioeconómicas como la pesca, el turismo, la recreación y el transporte, para la población de comunidades cercanas.
Considerando la vasta red hidrológica que recorre el área de influencia de la carretera Iquitos-Nauta (Honorio et al., 2020), sumado a los impactos que ocasionan la ocupación poblacional, se torna necesario que estos cuerpos de agua sean evaluados desde un enfoque ambiental, utilizando herramientas que permitan conocer su estado de calidad ambiental y establecer una línea base de monitoreo. En ese sentido, los macroinvertebrados bentónicos tienen un gran potencial, al ser excelentes bioindicadores del estado de calidad ambiental de los ambientes acuáticos (Roldán-Pérez, 2016).
En el Perú, el conocimiento de estos organismos ha permitido evaluar la calidad ambiental en diferentes cuencas hidrográficas, principalmente de la zona costera y andino-amazónica (Trama et al., 2020; Purihuamán-Leonardo & Sánchez-Bustamante, 2022; Niño-de-Guzman & Vásquez-Ramos, 2022; Vilca-Carhuapoma, 2022); desarrollar algunos protocolos e índices de evaluación de la calidad ambiental, como el protocolo de evaluación de la Calidad Ecológica de Ríos Andinos (Acosta et al., 2009) y el Índice Biótico Andino (Ríos-Touma et al., 2014); así como validar una herramienta de vigilancia ambiental ciudadana en zonas mineras (Flores & Huamantinco, 2017).
Salvo algunos estudios realizados en peces (Correa & Ortega, 2010; Yalán et al., 2018) y organismos planctónicos (Ismiño et al., 2018; Chávez-Veintemilla et al., 2020), la biodiversidad existente en las quebradas de la selva baja peruana ha sido poco estudiada y, particularmente, estudios sobre macroinvertebrados bentónicos son escasos, destacándose apenas el registro de una nueva especie de crustáceo, Macrobrachium nattereri (García-Dávila et al., 1996), la caracterización del hábitat de dicha especie (Vásquez-Rimachi et al., 2000) y la distribución espacio-temporal de insectos acuáticos (Alvan-Aguilar et al., 2021).
Considerando lo poco que se conoce sobre los macroinvertebrados bentónicos de quebradas de la selva baja peruana, el presente trabajo busca sentar un precedente sobre el conocimiento de la estructura de las comunidades de estos organismos en ambientes acuáticos con influencia antropogénica, vinculados a la construcción de una carretera. En ese sentido, el objetivo del presente estudio fue evaluar la composición, riqueza, abundancia, diversidad y dominancia de macroinvertebrados bentónicos en cinco quebradas ubicadas dentro del área de influencia de la carretera Iquitos-Nauta (AICIN), Loreto, Perú, durante cuatro épocas de colecta (vaciante, seca, creciente y llena). Esta información será de gran utilidad para futuros planes de monitoreo de la calidad de quebradas en la selva baja peruana.
Materiales y métodos
Área de estudio
El estudio fue realizado en las quebradas Paujil, Tocón, Pintuyacu, Lindero y Habanillo, ubicadas entre los kilómetros 26 y 52 de la carretera Iquitos - Nauta, en Loreto, Perú. La quebrada Paujil forma parte de la cuenca hidrográfica del río Nanay, mientras que las restantes pertenecen a la cuenca del río Itaya (Tabla 1; Figura 1 al final).

Figura 1 Mapa de ubicación de las quebradas Paujil, Tocón, Pintuyacu, Lindero y Habanillo en el Área de influencia de la carretera Iquitos-Nauta, Loreto, Perú.
Tabla 1 Coordenadas geográficas de las quebradas evaluadas en el área de influencia del eje carretero Iquitos-Nauta, Loreto, Perú.
| Quebrada | Coordenadas UTM | |
| X | Y | |
| Paujil | 676058.00 | 9562471.65 |
| Tocón | 672190.94 | 9549237.00 |
| Pintuyacu | 671407.56 | 9547551.00 |
| Lindero | 669210.69 | 9541697.00 |
| Habanillo | 668931.14 | 9537116.03 |
Colecta
Las colectas se realizaron en junio (vaciante), setiembre (seca) y diciembre (creciente) del 2019 y en marzo (llena) del 2020. En cada quebrada, se seleccionaron tres puntos de muestreo de 10 m de extensión cada uno, separados por una distancia de 30 m entre ellos. Como herramienta de colecta se utilizó una red de bentos tipo D-net de 1.75 m de largo de mango, 20 x 30 cm de malla y 180 µm de abertura de malla. Las muestras fueron tomadas realizando un barrido a lo largo de las orillas, sobre la vegetación y el fondo de cada punto de muestreo, siempre en sentido contrario a la dirección de la corriente de agua. El material colectado fue acondicionado en frascos de plástico conteniendo alcohol al 96% y luego transportados al laboratorio para su correspondiente determinación.
Determinación de la estructura de las comunidades de macroinvertebrados bentónicos
Composición
En el laboratorio, los organismos fueron separados y determinados hasta el nivel taxonómico posible, utilizando las claves taxonómicas de Merritt & Cummins (1996), Roldán-Pérez (1996) y Hamada et al. (2014).
La composición fue representada por los especímenes determinados hasta el nivel más inferior posible y analizada considerando su presencia de forma exclusiva o compartida entre las quebradas.
Riqueza, Abundancia, Diversidad y Dominancia
La riqueza observada se determinó mediante el número de taxones identificados. La abundancia mediante el número de individuos colectados por quebrada; mientras que la diversidad y dominancia mediante los índices de Shannon-Wiener (H ́) y Simpson (D), respectivamente, utilizando el software estadístico PAST 3.17 (Hammer et al., 2001).
Similitud entre unidades de muestreo
Con la finalidad de identificar los taxones con mayor variabilidad entre las unidades de muestreo (quebradas/periodos de colecta), se realizó el Análisis de Componentes Principales (ACP) con matriz de covarianza. Para determinar si existen diferencias entre las unidades de muestreo, se utilizó el análisis de Similitud (ANOSIM) con el índice de Bray Curtis, sugiriendo diferencias significativas cuando P ˂ 0.05. Estos análisis fueron realizados utilizando los softwares estadísticos PAST 3.17 (Hammer et al., 2001) y Community Analysis Package-CAP 4.0 (Seaby & Henderson, 2007).
Resultados y discusión
Composición
Los muestreos realizados en las cinco quebradas (Paujil, Tocón, Pintuyacu, Lindero y Habanillo) y cuatro periodos de colecta (vaciante, seca, creciente y llena) lograron registrar un total de 4 556 individuos y 68 taxones de macroinvertebrados bentónicos, distribuidos en 4 filos (Arthropoda, Annelida, Mollusca y Nematoda). El filo Arthropoda está conformado por 6 clases, 16 órdenes y 63 familias, de los cuales destaca la clase Insecta por la mayor abundancia de individuos dentro de las muestras analizadas (3 481 individuos, 76.40%), seguida por la clase Malacostraca (548 individuos, 12.03%), Arachnida (16 individuos, 0.35%) y Diplopoda (2 individuos, 0.04%); mientras que los filos Annelida (373 individuos), Mollusca (134 individuos) y Nematoda (2 individuos) representaron el 8.19%, 2.94% y 0.04%, respectivamente (Figura 2). La abundancia del filo Arthropoda, representada por los insectos acuáticos, corrobora la afirmación de que estos organismos representan del 70 al 90% de los macroinvertebrados presentes en los ambientes dulceacuícolas (Rosenberg & Resh, 1993).
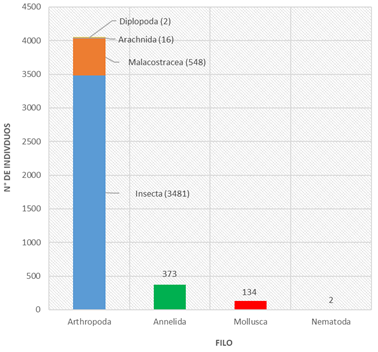
Figura 2 Abundancia total de macroinvertebrados bentónicos/filo: Arthropoda, Annelida, Mollusca y Nematoda; de cinco quebradas del área de influencia del eje carretero Iquitos-Nauta, Loreto, Perú.
Un total de 18 taxones (Elmidae, Scirtidae, Ceratopogonidae, Chironomidae, Tipulidae, Baetidae, Caenidae, Leptophlebiidae, Polymitarcyidae, Coenagrionidae, Gomphidae, Perlidae, Hydropsychidae, Polycentropodidae, Palaemonidae, Oligochaeta, Hirudinea y Bivalvia) estuvieron presentes en las cinco quebradas evaluadas. Esto refleja la amplia distribución de estos organismos en la zona de estudio, además de caracterizar taxonómicamente a estas quebradas, que comparten la particularidad de estar expuestas a un tipo de perturbación antrópica, como es la conectividad a una carretera. La presencia de estos organismos indica que poseen cierto nivel de tolerancia a ambientes perturbados. Está información es muy útil para elaborar índices bióticos de calidad ambiental específicos para las quebradas de la selva baja amazónica que permita, al sector competente, monitorear y establecer planes de gestión con fines de conservación de estas.
Por otro lado, tres taxones (Empididae, Mesoveliidae y Hydroptilidae) fueron reportados como exclusivos para la quebrada Paujil; seis (Dryopidae, Phoridae, Psychodidae, Notonectidae, Poduridae y Diplopoda) para Pintuyacu; cuatro (Amphizoidae, Heteroceridae, Megapodagrionidae, Hydrobiosidae) para Lindero y tres (Helodidae, Limnichidae y Aeshnidae) para Habanillo. La quebrada Tocón fue el único cuerpo de agua que no presentó taxones exclusivos (Tabla 2).
Tabla 2. Composición taxonómica de macroinvertebrados bentónicos presentes en las quebradas Habanillo, Lindero, Pintuyacu, Tocón y Paujil área de influencia del eje carretero Iquitos-Nauta, Loreto, Perú.
| TAXONES | QUEBRADAS | ||||
| HAB | LIN | PIN | TOC | PAU | |
| ARTHROPODA | |||||
| INSECTA | |||||
| Coleoptera | |||||
| Amphizoidae | X | ||||
| Chrysomelidae | X | X | X | ||
| Dryopidae | X | ||||
| Dytiscidae | X | X | X | X | |
| Elmidae | X | X | X | X | X |
| Gyrinidae | X | X | |||
| Helodidae | X | ||||
| Heteroceridae | X | ||||
| Hydrophilidae | X | X | X | X | |
| Limnichidae | X | ||||
| Scirtidae | X | X | X | X | X |
| Staphylinidae | X | X | |||
| Lampyridae | X | X | X | ||
| Noteridae | X | X | X | ||
| Diptera | |||||
| Ceratopogonidae | X | X | X | X | X |
| Chironomidae | X | X | X | X | X |
| Ephydridae | X | X | |||
| Culicidae | X | X | X | ||
| Dolichopodidae | X | X | |||
| Empididae | X | ||||
| Phoridae | X | ||||
| Muscidae | X | X | X | X | |
| Psychodidae | X | ||||
| Sciomyzidae | X | X | X | ||
| Tipulidae | X | X | X | X | X |
| Ephemeroptera | |||||
| Baetidae | X | X | X | X | X |
| Euthyplociidae | X | X | X | X | |
| Caenidae | X | X | X | X | X |
| Leptophlebiidae | X | X | X | X | X |
| Polymitarcyidae | X | X | X | X | X |
| Potamanthidae | X | X | X | X | |
| Tricorythidae | X | X | X | ||
| Hemiptera | |||||
| Corixidae | X | X | |||
| Gerridae | X | X | |||
| Mesoveliidae | X | ||||
| Veliidae | X | X | X | ||
| Notonectidae | X | ||||
| Lepidoptera | |||||
| Pyralidae | X | X | X | ||
| Megaloptera | |||||
| Corydalidae | X | X | |||
| Sialidae | X | X | X | ||
| Odonata | |||||
| Aeshnidae | X | ||||
| Calopterygidae | X | X | X | X | |
| Coenagrionidae | X | X | X | X | X |
| Gomphidae | X | X | X | X | X |
| Libellulidae | X | X | X | X | |
| Megapodagrionidae | X | ||||
| Blattodea | |||||
| Blatellidae | X | X | X | X | |
| Plecoptera | |||||
| Perlidae | X | X | X | X | X |
| Trichoptera | |||||
| Calamoceratidae | X | X | X | X | |
| Hydroptilidae | X | ||||
| Hydrobiosidae | X | ||||
| Helicopsychidae | X | X | |||
| Hydropsychidae | X | X | X | X | X |
| Leptoceridae | X | X | X | ||
| Polycentropodidae | X | X | X | X | X |
| Collembola | |||||
| Poduridae | X | ||||
| Isotomidae | X | X | |||
| CRUSTACEA | |||||
| Branchiopoda | |||||
| Diplostraca | X | X | |||
| Decapoda | |||||
| Palaemonidae | X | X | X | X | X |
| Astacidae | X | X | X | X | |
| CHELICERATA | |||||
| Arachnida | |||||
| Trombidiformes | X | ||||
| Araneae | X | X | X | X | |
| MYRIAPODA | |||||
| Diplopoda | X | ||||
| NEMATODA | |||||
| * | X | X | |||
| ANNELIDA | |||||
| Clitellata | |||||
| Oligochaeta | X | X | X | X | X |
| Hirudinea | X | X | X | X | X |
| MOLLUSCA | |||||
| Gastropoda | X | X | X | X | |
| Bivalvia | X | X | X | X | X |
PAU: Paujil, TOC: Tocón, PIN: Pintuyacu, LIN: Lindero, HAB: Habanillo. *Taxones no identificados.
Riqueza y Abundancia
En todas las quebradas, la riqueza y abundancia media fueron mayores en época seca (24 a 34 taxones y 422.8 individuos/quebrada), seguida por vaciante (15 a 29 taxones y una abundancia media de 267.6 individuos/quebrada) y creciente (13 a 24 taxones y 153 individuos/quebrada); mientras que en llena, los valores fueron los más bajos, con 5 a 8 taxones y 67.8 individuos/quebrada (Figura 3).
La quebrada Paujil se destacó por presentar la mayor riqueza y abundancia en las épocas de vaciante, seca y llena; mientras que Habanillo lo fue en la época de creciente (Figura 3).
La variación de la riqueza de taxones y abundancia de estos organismos puede estar influenciada a los factores fisicoquímicos que caracterizan a las quebradas en cada época, tales como la concentración de oxígeno disuelto, precipitación pluvial, conductividad, velocidad de corriente, caudal, temperatura, etc.; así como a los ciclos biológicos de los organismos en estudio (Roldán-Pérez, 2016).
Diversidad y Dominancia
Para todas las quebradas, la diversidad media fue mayor en las épocas de vaciante y seca con valores de 2.39 y 2.27, respectivamente; mientras que las épocas de creciente y llena registraron valores de 1.90 y 1.62, respectivamente. Habanillo y Paujil fueron las quebradas con los mayores valores de diversidad reportada en vaciante, Lindero en seca y Tocón en creciente y llena (Figura 3).
Por el contrario, la dominancia media fue mayor en las épocas de creciente y llena, con valores de 0.27 y 0.24, respectivamente; mientras que las épocas de vaciante y seca registraron valores de 0.15 y 0.18, respectivamente. Pintuyacu fue la quebrada con los mayores valores de dominancia en época seca, creciente y llena; mientras que Tocón lo fue en vaciante (Figura 3).
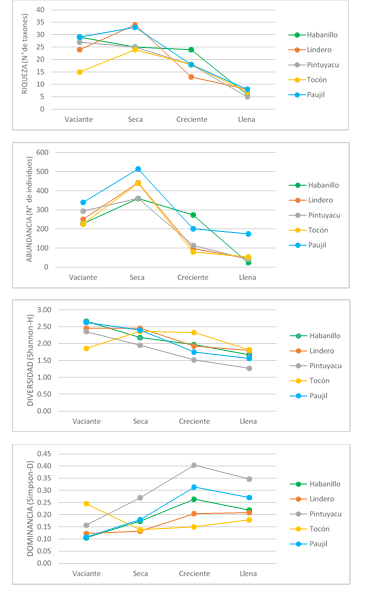
Figura 3 Riqueza, abundancia, diversidad y dominancia de macroinvertebrados bentónicos de las quebradas Habanillo, Lindero, Pintuyacu, Tocón y Paujil por época de colecta (vaciante, seca, creciente y llena), Loreto, Perú.
Los taxones que representaron la dominancia encontrada fueron los insectos de las familias Chironomidae, Leptophlebiidae y Elmidae y crustáceos de la familia Palaemonidae. Entre épocas de colecta, Chironomidae fue el taxón más dominante en época seca (438 individuos), en creciente (364 individuos) y en llena (111 individuos), mientras que Paleomonidae (240 individuos) lo fue en vaciante (Figura 4). Entre quebradas, Chironomidae fue el taxón más dominante en las quebradas Habanillo (223 individuos), Lindero (184 individuos) y Paujil (423 individuos), mientras que Leptophlebiidae (186 individuos) lo fue para Pintuyacu y Elmidae (174 individuos) para Tocón (Figura 5).
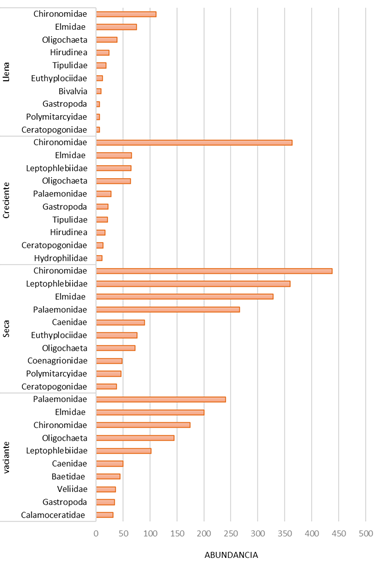
Figura 4 Abundancia de macroinvertebrados bentónicos por época de colecta (vaciante, seca, creciente y llena) de cinco quebradas del área de influencia de la carrera Iquitos-Nauta, Loreto, Perú.
La dominancia de Chironomidae, Leptophlebiidae, Elmidae y Palaemonidae, en las distintas épocas de colecta y quebradas evaluadas, podría ser un reflejo de las condiciones del hábitat donde se encuentran estos organismos. Las larvas de la familia Chironomidae, por lo general, son consideradas indicadoras de contaminación por materia orgánica (Adler et al., 2019) y metales pesados (Loayza-Muro et al., 2010). Tienen habilidad de vivir en lugares con muy bajos niveles de oxígeno, donde el sedimento es fino (Goretti et al., 2020; Villamarín et al., 2021); y suelen presentar deformidades morfológicas durante su desarrollo larval cuando están expuestas a ambientes contaminados (Goretti et al., 2020). Las ninfas de Leptophlebiidae son indicadoras de aguas limpias o ligeramente contaminadas (Roldán-Pérez, 1996; Salcedo et al., 2013). De Elmidae, tanto sus larvas como la mayoría de los adultos son acuáticos, siendo comunes en aguas corrientes con buen contenido de oxígeno. Sin embargo, algunos géneros se pueden encontrar en arroyos moderadamente contaminados (González-Córdoba et al., 2020). Los Palaemonidae viven en aguas someras de fondo arenoso, con escasa disponibilidad de nutrientes, alto contenido de material húmico en suspensión y abundante vegetación ribereña (Vásquez-Rimachi et al., 2000); además que son considerados bioindicadores de aguas no contaminadas (Triana & Campos, 2007).
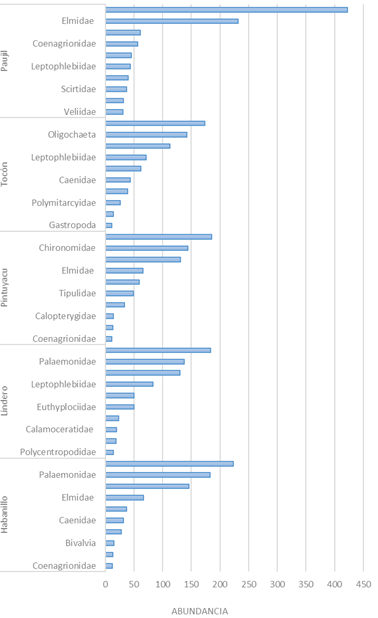
Figura 5 Abundancia total de macroinvertebrados bentónicos por quebrada evaluada (Habanillo, Lindero, Pintuyacu, Tocón y Paujil), en al área de influencia del eje carretero Iquitos-Nauta, Loreto, Perú.
En el Perú, algunos estudios también evidenciaron una mayor abundancia de la familia Chironomidae en diferentes tipos de cuerpos de agua. Podemos destacar lo reportado en el río Cunas, Junín (Custodio & Chanamé, 2016), en el río Huallaga entre Cerro de Pasco y Huánuco (Alomía et al., 2017), en la laguna de Quistococha, Iquitos (Alvan et al., 2018), en los humedales altoandinos de la región Junín (Custodio et al., 2018), en las lagunas altoandinas de las cuencas de los ríos Rímac y Mantaro (Tapia et al., 2018), y en el rio alto Madre de Dios (Arana-Maestre et al., 2021). Esto evidencia una amplia distribución y dominancia de la familia Chironomidae en diferentes cuerpos de agua y zonas geográficas del Perú.
Similitud entre unidades de muestreo
De acuerdo con el análisis de componentes principales (Figura 6 al final), la variabilidad entre las unidades de muestreo se explica al 66.38% en dos componentes principales. El componente principal 1 (Axis 1) explica la variabilidad a un 37.62%, donde las unidades taxonómicas más importantes fueron Chironomidae (-0.78) y Elmidae (-0.45) quienes fueron más abundantes en Paujil y Tocón durante la época seca, respectivamente. El componente principal 2 (Axis 2) explica la variabilidad a un 28.76% y las unidades taxonómicas más importantes fueron Leptophlebiidae (-0.75) y Palaemonidae (-0.47), quienes fueron más abundantes en Pintuyacu y Habanillo durante la época seca, respectivamente.
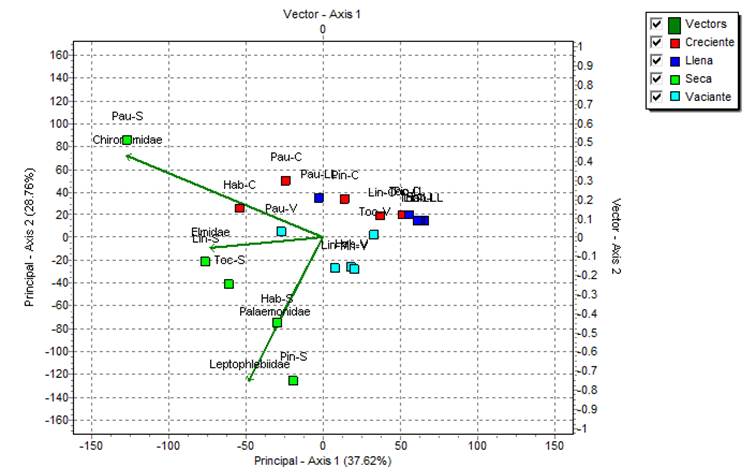
Figura 6 Análisis de Componentes Principales (ACP) con matriz de covarianza de las comunidades de macroinvertebrados bentónicos por unidades de muestreo (quebrada-época de colecta), Loreto, Perú. Hab: Habanillo, Lin: Lindero, Pin: Pintuyacu, Toc: Tocón, Pau: Paujil, V: vaciante, S: seca, C: creciente y LL: llena.
Las comunidades colectadas en las épocas de vaciante y seca fueron significativamente diferentes con las colectadas en creciente y llena (ANOSIM, P = 0.004). Mientras que, entre vaciante/seca y creciente/llena no se reportan diferencias significativas (ANOSIM, P = 0.067).
En los meses de menor pluviosidad (en vaciante y principalmente en seca), el agua quedó restringida al canal principal de las quebradas, brindando un substrato y vegetación marginal más estable para el mantenimiento de los macroinvertebrados; dando como resultado un mayor registro de la riqueza, abundancia y diversidad de estos organismos, mientras que la dominancia fue baja. En los meses con mayor pluviosidad (en creciente principalmente, y en llena), debido al aumento de la velocidad y caudal del agua, el substrato necesario para el mantenimiento de estos organismos es lavado y los propios organismos removidos; dando como resultado un menor registro de la riqueza, abundancia y diversidad; mientras que surge la aparición de grupos más dominantes que resisten esas alteraciones. Resultados similares fueron reportados por Maicelo et al. (2014) en un inventario realizado en el río Utcubamba (Amazonas); por Custodio & Chanamé (2016) en el río Cunas, Junín, Perú; y por Arana & Cabrera (2017) en Ica y Huancavelica.
Por otro lado, las comunidades de macroinvertebrados de la quebrada Paujil fueron significativamente diferentes con Habanillo (ANOSIM, P = 0.014) y Pintuyacu (ANOSIM, P = 0.043). Entre Habanillo con Lindero-Pintuyacu-Tocón; Lindero con Paujil-Pintuyacu-Tocón; y Tocón con Paujil-Pintuyacu; no hubo diferencias significativas.
Conclusiones
La estructura de las comunidades de macroinvertebrados bentónicos en las cinco quebradas de la selva baja peruana (Paujil, Tocón, Pintuyacu, Lindero y Habanillo) evaluadas durante cuatro épocas del régimen hidrológico de los ríos amazónicos (creciente, llena, vaciante y seca) se caracteriza por estar compuesta de 68 taxones distribuidos en 4 filos (Arthropoda, Annelida, Mollusca y Nematoda) y comparten en común 18 taxones.
La riqueza, abundancia, diversidad y dominancia de macroinvertebrados bentónicos se encuentran influenciadas por el régimen hidrológico de los ríos amazónicos, existiendo diferencias significativas entre las épocas de vaciante-seca con las de creciente-llena, siendo la época seca la de mayor valor de riqueza, abundancia y diversidad; y la época creciente la de mayor dominancia.
Los taxones más dominantes en los ambientes evaluados fueron los Chironomidae, Leptophlebiidae, Elmidae y Palaemonidae; de los cuales, Chironomidae fue el más representativo.












 uBio
uBio 


