Introducción
En el año 2021, el Perú se constituyó como el segundo mayor productor mundial de cobre con una producción de 2 299 277 toneladas métricas finas (TMF), después de Chile que mantuvo el liderazgo en la producción de cobre con 5 600 000 TMF, esta producción fue obtenida por los procesos de Flotación (2 219 652 TMF), Lixiviación (76 201 TMF) y Gravimetría (3 424 TMF) (MINEM, 2021).
En la planta de lixiviación de la empresa minera Southern Cooper Corporation (SCC) ubicada en Toquepala, Tacna - Perú, a 3 200 msnm, el proceso de biolixiviación es a través de pilas del mineral calcopirita (CuFeS2), donde el ácido sulfúrico diluido favorece el desarrollo de bacterias acidófilas encargadas de la recuperación del cobre en solución, denominada “pregnant leach solution” (PLS); luego de recuperado el cobre se obtiene una solución intermedia conocida como “intermediate leach solution” (ILS) rica en microorganismos, la cual se utiliza de nuevo como solución de ácido sulfúrico para regar por aspersión el mineral (Harrison et al., 2007).
El proceso de biolixiviación involucra la disolución de minerales por acción directa e indirecta de microorganismos, que pueden formar consorcios para la recuperación de metales preciados, como el cobre, en estado de solución (You et al., 2020; Benzal et al., 2021; Bobadilla & Poblete, 2021; Castro et al., 2021; Ma et al., 2021). Los consorcios están compuestos de microorganismos autótrofos, heterótrofos obligados o mixotróficos que catalizan las oxidaciones de hierro y compuestos de azufre reducido (Johnson et al., 2009; Benzal et al., 2021), favoreciendo la acción biolixiviante, porque se adaptan más fácilmente al proceso, en comparación a una sola especie microbiana (Joulian et al., 2020; Benzal et al., 2021). Los consorcios biolixiviantes están formados por especies microbianas mesófilas o termófilas, y su población aumenta con la temperatura (Watling et al., 2016; Hedrich et al., 2018).
En el proceso de biolixiviación es importante evaluar la cinética del crecimiento microbiano, que se determina a través de la velocidad específica de crecimiento y la biomasa obtenida en un determinado sustrato (Madigan et al., 2015). Esto se puede expresar a través de modelos matemáticos que dependen del sustrato, como los modelos Logístico y Maltusiano, que son utilizados en un crecimiento no acotado, y el modelo de Gompertz, cuando el sustrato es acotado (Melchor, 2015). El modelo poblacional de Malthus se ajusta a contextos de modelos biológicos (Malthus, 1926), el cual permite evaluar la etapa exponencial de los microorganismos, donde se asume que no existen restricciones de sustrato ni inhibición; esta se relaciona con la fase logarítmica de la cinética microbiana expresada en una constante (k) de velocidad de crecimiento (Parra et al., 2019).
El proceso de lixiviación mejora con una mayor población microbiana (Joulian et al., 2020; Benzal et al., 2021) y mayor velocidad de crecimiento que depende de los factores medioambientales; su incremento se consigue mejorando estas condiciones (Braddock et al., 1984; Coll et al., 2001; Zárate, 2015).
En la biolixiviación de cobre, la flora microbiana nativa biolixiviante está formada por consorcios microbianos cuyas capacidades varían en función de la curva de crecimiento. En cada proceso de reactivación se hace posible determinar la velocidad específica de crecimiento y la máxima concentración microbiana de cada consorcio; asimismo, en qué número de reactivación un consorcio presenta la mayor velocidad específica de crecimiento y de concentración microbiana que permita su selección para investigaciones posteriores.
Hay una limitada información sobre la velocidad de crecimiento y la concentración de biomasa de consorcios microbianos biolixiviantes no cultivables en reactivaciones sucesivas. Por esta razón, se planteó determinar la velocidad específica de crecimiento de los consorcios microbianos en cuatro reactivaciones sucesivas para establecer cuáles de los consorcios provenientes de las muestras de mineral calcopirita, PLS e ILS son los que presentan la mayor velocidad de crecimiento y estabilidad para ser seleccionados en estudios posteriores de aplicación como inóculos en la optimización del proceso de biolixiviación de cobre.
Materiales y métodos
Muestreo
El muestreo se realizó de forma dirigida de diferentes tipos de muestras (Figura 1) de la Planta de Lixiviación, Extracción por Solventes y Electrodepositación (LESDE) de Toquepala de la empresa minera SCC en Tacna - Perú, ubicada a 3 200 msnm. Los puntos de muestreo fueron descritos considerando las características físicas y de elevación (Tabla 1).
Se eligieron ocho muestras de diferentes características, y se registró la temperatura con una cámara termográfica marca Flir Sistem AB (Sweden) y la altitud. Las muestras fueron de mineral lixiviable sólido (M), líquidas (ILS y PLS) y de biofilm (BF) (Tabla 1). Las sólidas se tomaron de zonas activas (coloración amarilla-anaranjada-rojiza) y zonas inactivas (coloración plomiza con betas azuladas) de las pilas de lixiviación; el mineral se recolectó con la ayuda de una pala de acero, picota y baldes de plástico. Las líquidas se obtuvieron introduciendo frascos colectores en la solución de PLS de la poza de colección proveniente de las pilas, y en la solución de ILS del estanque de refino. El biofilm se tomó de la superficie del mineral sólido de la parte superior del botadero (Figura 1).
Las muestras fueron codificadas (Tabla 1), selladas y transportadas a temperatura ambiente al Laboratorio de Investigación en Biotecnología Microbiana (LIBIM) de la Universidad Nacional Jorge Basadre Grohmann en Tacna - Perú.
Procesamiento de las muestras
Las muestras fueron inoculadas por triplicado en medio líquido 9K según Leathen et al. (1956) como base y modificado por Amaro et al. (1991), a pH 1.8, e incubadas a 26 °C (temperatura ambiente) durante 15 días y 1 vvm de aireación. Las muestras sólidas se redujeron a un diámetro de 3 a 5 cm con un triturador mecánico.
El conteo directo de células se hizo cada ocho horas desde el tiempo cero hasta las 360 horas, en una cámara de Petroff-Hausser con ayuda de un microscopio de campo claro. La concentración celular se determinó en función del tiempo, y se obtuvo el crecimiento celular, la velocidad y la máxima concentración microbiana en cada consorcio (Delgado & Castillo, 2019; Castillo et al., 2021).
Tabla 1 Descripción y localización de las muestras colectadas en la planta de lixiviación de Toquepala, Tacna -Perú.
| Código de muestra | Características | T (°C) | Elevación msnm |
|---|---|---|---|
| M-1 | Muestra sólida de mineral lixiviable de la zona de lixiviación LESDE, con zonas rojas en el mineral de la pila, que fue indicativo de un estado activo. | 35 | 2 982 |
| M-2 | Muestra sólida de mineral de color amarillo y rojo pardo, procedente del depósito lixiviable de una pila inactiva. | 21 | 2 984 |
| PLS-3 | Muestra líquida del vertedero de la poza de sedimentación Run of Mine (ROM) del depósito lixiviable Quebrada Honda (QH- PLS). | 34 | 2 796 |
| PLS-4 | Muestra líquida de la poza de colección en la zona de lixiviación LESDE. | 20 | 2 771 |
| M-5 | Muestra sólida de color amarillo y azul plomizo del depósito lixiviable de una zona en reposo ripeada. | 39-43.6 | 3 106 |
| M-6 | Muestra sólida de mineral lixiviable de color rojizo y naranja con áreas pequeñas de color verde claro de la zona de lixiviación LESDE. | 45 | 3 137 |
| BF-7 | Muestra viscosa, semilíquida de fango sobre el mineral sólido, con biofilm de color pardo rojizo del depósito lixiviable (botadero). | 26 | 3 019 |
| ILS-8 | Muestra líquida de color pardo rojizo de la zona de bombeo de refino (ILS RAF “solución pobre”). | 20 | 3 052 |
Estudio de consorcios microbianos
Los consorcios fueron reactivados, en el medio líquido 9K modificado, agregando un 10% de inóculo de este medio a otro, y así sucesivamente por cuatro veces, para obtener los consorcios microbianos con más actividad en el crecimiento y menor fase de adaptación en cada cultivo sucesivo (Miyamoto et al., 2008; Saavedra & Corton, 2014; Domínguez-Ordóñez, 2019; Delgado & Castillo, 2019).
Análisis estadísticos
Se evaluó la biomasa producida, y la velocidad de crecimiento, de los consorcios en cada muestra por reactivación; el análisis se realizó con el programa Graphad Prisma 8.0 usando el modelo de crecimiento de poblaciones Malthusiano para determinar la velocidad en la fase logarítmica (K) y el modelo de Gompertz para obtener la curva de crecimiento.
Resultados y discusión
La cinética de la curva de crecimiento de cada consorcio microbiano, en sus cuatro reactivaciones, permitió conocer la máxima concentración microbiana y la velocidad de crecimiento en la fase logarítmica, donde se da el incremento exponencial de la biomasa celular (Braddock et al., 1984; Zárate, 2015). Este estudio se realizó en diferentes tipos de muestras (Figura 1).
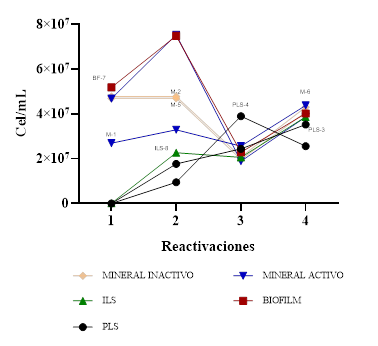
En la Figura 2 se muestra la máxima concentración microbiana en cuatro reactivaciones. Los consorcios microbianos provenientes de mineral sólido M-1, M-2, M-5, M-6 y de biofilm BF-7, lograron una concentración microbiana superior a 7 unidades logarítmicas de cel/ml desde la primera reactivación; este incremento se atribuye a la proliferación de microorganismos nativos heterótrofos que aún disponen de nutrientes orgánicos provenientes del mineral, en donde se encontraron, además, microorganismos heterótrofos biolixiviantes (Tupikina et al., 2014). Durante la primera reactivación, los diversos microorganismos, inicialmente adheridos al mineral, se desprenden para formar parte de un inóculo microbiano con concentraciones más elevadas.
En el grupo de microorganismos que se identificaron adheridos al mineral en forma de biopelícula están Acidithiobacillus ferrooxidans, Leptospirillum ferrooxidans y A. thiooxidans, siendo este último el que se adhirió más fácilmente al mineral (Okibe et al., 2003).
Las muestras de PLS (Figura 3) e ILS-8 (Figura 4) llegaron a la fase logarítmica en la primera reactivación, con un recuento menor a 105 cel/ml, debido a la inhibición del cobre, como lo comprobaron Eyzaguirre & Castillo (2019). El desarrollo de los microorganismos depende de la composición del mineral, las condiciones fisicoquímicas y la distribución de los microbios acidófilos; es así que, en un biolixiviado, se reportó la presencia de Acidithiobacillus caldus (65%) y Leptospirillum sp. (29%), así como bacterias oxidantes del hierro y Sulfobacillus sp. (3%) (Govender et al., 2015).
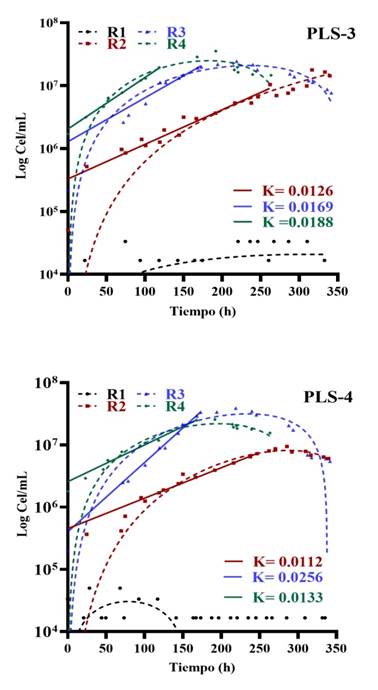
Figura 3 Cinética de crecimiento de los consorcios microbianos provenientes de PLS-3 y PLS-4 utilizando el modelo de Gompertz y el modelo de Malthus para determinar la velocidad de crecimiento (K).
En las muestras de mineral activo M-1, M-6, al igual que la BF-7 y las líquidas PLS-3, PLS-4 e ILS-8, se observó un incremento de la concentración celular en la segunda reactivación, a diferencia de las muestras del mineral inactivo M-2 y M-5, las cuales mantuvieron la biomasa estable. En la tercera reactivación, la única muestra que incrementó la concentración celular provino del PLS-4, a diferencia de las otras muestras que disminuyeron ligeramente; sin embargo, todas las muestras se mantuvieron en concentraciones cercanas a 2 x 107cel/ml y en la cuarta reactivación todas las muestras volvieron a incrementar su biomasa obteniendo recuentos muy similares, cercanos a 4 x 107 cel/ml, a diferencia de PLS-4 que disminuyó su biomasa (Figura 2). El incremento de biomasa que se observó en la segunda, tercera y cuarta reactivación indica que la población microbiana se adaptó al medio 9K modificado. Estos microorganismos fueron capaces de utilizar las fuentes de hierro y azufre para su metabolismo y aprovechar los nutrientes químicos del medio similar al de un mineral sulfurado, en el cual los microorganismos lograron desarrollarse utilizando los recursos derivados de la disolución de hierro y azufre presentes en el mineral (Haghshenas et al., 2009; Zárate, 2015). Esto sugiere que la diversidad microbiana disminuye en la tercera reactivación, sobre todo la población de microorganismos heterótrofos, que para ser aislados fue necesario utilizar medios de cultivo con sales de amoniaco y cloruros. Estos microorganismos también fueron importantes en la biolixiviación y los procesos de biorremediación (Wang et al., 2014).
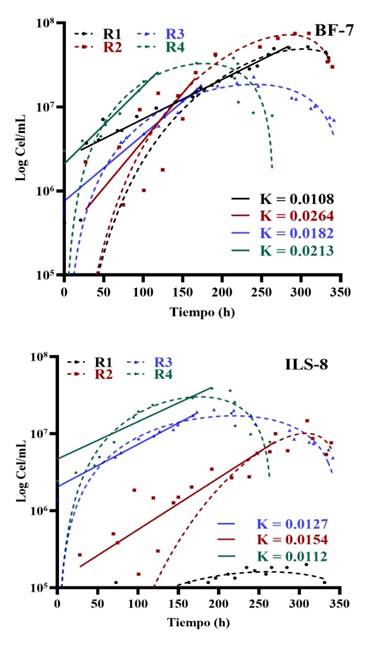
Figura 4 Cinética de crecimiento de los consorcios microbianos provenientes de biofilm (BF-7) e ILS-8 utilizando el medio de Gompertz y el modelo de Malthus para determinar la velocidad de crecimiento (K).
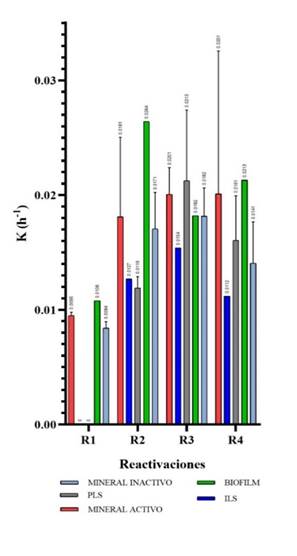
La primera reactivación tuvo una velocidad de crecimiento significativamente menor a las subsiguientes reactivaciones (Figura 5) porque constituyó una fase de adaptación para el crecimiento (Coll et al., 2001), y las muestras líquidas PLS-3, PLS-4 e IlS-8 no presentaron un crecimiento exponencial durante esta reactivación (Figura 5). Esto indica que las células no soportaron elevadas concentraciones de cobre y de otros metales tóxicos presentes en estas soluciones que pueden afectar la velocidad del crecimiento microbiano (Harrison et al., 2007; Saavedra, 2019).
La máxima concentración celular de 7.49x107 cel/ml y 7.7x107 cel/ml para los consorcios M-6 (Figura 6) y BF-7 (Figura 4), respectivamente, durante la segunda reactivación, evidencian una biomasa mayor, en comparación con los 107 cel/ml observada para Acidithiobacillus ferrooxidans en un concentrado de calcopirita (Xia et al., 2008); sin embargo, estos valores son similares a los encontrados para biolixiviantes de la arsenopirita (8x107 cel/ml), de acuerdo a los hallazgos de Ospina et al. (2012). Esto sugiere una diversidad microbiana capaz de prosperar en el medio de cultivo 9K modificado, enriquecido con trazas de minerales, que demostró ser eficaz para el crecimiento de microorganismos biolixiviantes (Kim et al., 2002; Muñoz et al., 2003; Arias et al., 2013).
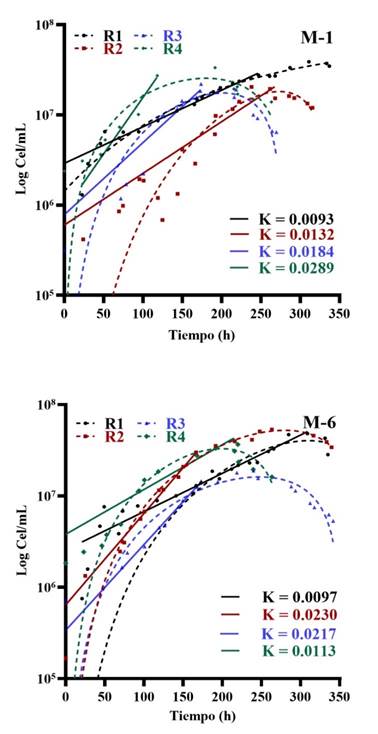
Figura 6 Cinética de crecimiento de los consorcios microbianos provenientes de mineral sólido activo utilizando el modelo de Gompertz y el modelo de Malthus para determinar la velocidad de crecimiento (K).
La máxima velocidad de crecimiento, entre todos los consorcios y reactivaciones, se observó en la muestra M-1 durante la cuarta reactivación, con un valor K de 0.0289/h (Figura 6); sin embargo, la muestra M-6 fue más estable durante todas las reactivaciones, logrando una mayor biomasa en la segunda reactivación. Este valor indica que los microorganismos se encuentran activos durante las primeras 100 horas, en comparación con los valores relativamente más bajos de otros consorcios microbianos biolixiviantes como los reportados por Govender et al. (2015) con valores de 0.035, 0.039, 0.040, 0.044, 0.065 y 0.74/h, o los descritos por Braddock et al. (1984) y Zárate (2015) con cepas aisladas de Thiobacillus ferrooxidans con velocidades de 0.070 y 0.092/h y de Thiobacillus thiooxidans con 0.067/h. El valor de K obtenido puede ser optimizado variando los factores de temperatura y composición química del medio debido a que la velocidad de crecimiento es única a cada especie microbiana, según las condiciones medioambientales en las que se encuentre (Coroller et al., 2005; Magaña & Villareal, 2006; Jin et al., 2018; Koukou et al., 2021); al incrementar la tasa de crecimiento microbiano en un menor tiempo se optimizó el proceso de biolixiviación (Delgado & Castillo, 2019; Eyzaguirre & Castillo, 2019).
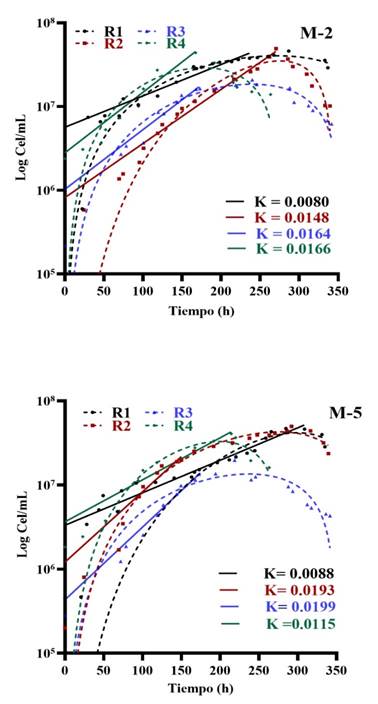
Figura 7 Cinética de crecimiento de los consorcios microbianos provenientes de mineral inactivo M-2 y M-5 utilizando el modelo de Gompertz y el modelo de Malthus para determinar la velocidad de crecimiento (K).
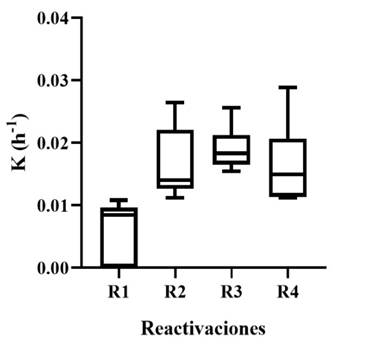
Figura 8 Gráfico de cajas y bigotes de la velocidad de los consorcios microbianos en cuatro reactivaciones.
Los consorcios microbianos de las muestras de mineral inactivo M-2 y M-5 (Figura 7) lograron biomasas altas en la primera reactivación, pero estas descendieron en las sucesivas reactivaciones y la velocidad de crecimiento fue más baja, comparada con los consorcios del mineral activo. Esto se relaciona con la coloración del mineral que se describe en la Tabla 1 y se visualiza en la Figura 1.
La cinética de las muestras de PLS alcanzó velocidades de crecimiento diferentes (Figura 3) debido a que PLS-3, que provino de una muestra de escorrentía -a diferencia de la muestra PLS-4, que se obtuvo de un depósito de líquido biolixiviado (Figura 1)- hizo que los microorganismos tuvieran una demanda de oxígeno disponible diferente, comparado con la microbiota que se desarrolló en sistemas lénticos y lóticos, donde la diferencia radicó en las adaptaciones de los microorganismos a las condiciones de flujo, movimiento del agua y a la disponibilidad de oxígeno (Madigan et.,al 2015). Las velocidades de crecimiento (K) de los microorganismos, que procedieron de muestras líquidas, presentaron incrementos significativos en la segunda y tercera reactivación, como se observa en PLS-3 y PLS-4 (Figura 3) e ILS-8 (Figura 4). La muestra PLS-4 (Figura 3) logró la máxima velocidad de crecimiento, con una K de 0.0256/h en la tercera reactivación, siendo la más activa de las muestras líquidas; esta muestra se extrajo de la zona de biolixiviación de refino LESDE, a diferencia de la muestra PLS-3 que se obtuvo del vertedero de la poza de sedimentación Run of Mine, e ILS-8 RAF “solución pobre” (Tabla 1 y Figura 1).
El consorcio microbiano de la muestra biofilm BF-7 mantuvo una cinética más estable durante las cuatro reactivaciones (Figura 4), esto indica que los microorganismos de este consorcio se encuentran activos desde la primera reactivación y posteriormente se adaptan a las condiciones de laboratorio y a la composición del medio 9K modificado.
Al comparar la velocidad por tipo de muestra (Figura 5) se comprueba que el mineral activo y el biofilm son las muestras con mayor potencial para obtener consorcios activos y microorganismos aislados para el proceso de biolixiviación, a diferencia de las muestras del mineral inactivo; sin embargo, las muestras de PLS e ILS podrían tener microorganismos altamente resistentes a concentraciones de metales pesados y adaptados a condiciones extremas.
La mayor velocidad de crecimiento y estabilidad se observa en la tercera reactivación para el conjunto de consorcios (Figura 8), esto indica que después de la segunda y tercera reactivación es más probable aislar microorganismos con potencial de biolixiviación. En este trabajo serían los consorcios M-6 y BF-7 los indicados para continuar con estudios de aplicación como inóculos para el mejoramiento de la biolixiviación. Según Amar et al. (2021), un biofilm está formado por células microbianas dentro de una matriz de sustancias poliméricas extracelulares (EPS) constituido en su mayoría por proteínas, ADN y polisacáridos. Estas células adheridas contribuyeron a una mayor eficiencia en la biolixiviación del mineral (Feng et al., 2015). Asimismo, Liu et al. (2019) demostraron que un consorcio de Leptospirillum ferriphilum, Acidithiobacillus caldus y Ferroplasma thermophilum,pudo formar una biopelícula y favorecer la biolixiviación por contacto de calcopirita.
Conclusiones
Las diferentes velocidades de crecimiento observadas entre los consorcios microbianos y el número de reactivaciones sugieren que la composición de las especies varía según las condiciones del medio y el tiempo.
Los consorcios de muestras de mineral activo M-1, M-6 y del biofilm BF-7 demuestran una adaptación más rápida a las condiciones de laboratorio en comparación con las muestras de mineral inactivo y de los líquidos PLS e ILS. Las muestras con mayor potencial para aislar una mayor diversidad de microorganismos fueron M-6 y BF-7 durante la segunda reactivación, siendo el consorcio de procedencia del biofilm el más estable durante las cuatro reactivaciones.
Los consorcios microbianos obtenidos de muestras líquidas no alcanzaron la fase logarítmica durante la primera reactivación debido a la alta concentración de metales del medio de procedencia. La muestra PLS-4 de la poza de biolixiviación LESDE tuvo el consorcio microbiano más activo en la tercera reactivación, comparada con las muestras PLS-3 e ILS-8 que se encontraron en escorrentía. De la muestra PLS-4 fue posible aislar microorganismos resistentes a metales debido a la concentración de cobre que contuvo este biolixiviado.












 uBio
uBio