Introducción
Los inhibidores de la bomba de protones (IBP) son los medicamentos más potentes para inhibir la secreción gástrica ácida; se utilizan en el tratamiento de la mayor parte de las afecciones inflamatorias de la mucosa gástrica 1.
Se encuentran entre los medicamentos más recetados y sobreprescritos en todo el mundo. Según la Encuesta nacional de salud y nutrición, en los Estados Unidos, entre 1999 y 2012, el porcentaje de adultos entre 40 a 60 años recetados con un IBP casi se duplicó del 4,9 % al 8,3 %. Por otra parte, varios estudios han demostrado que del 50 %-70 % de los pacientes a los que se les prescribe un IBP no tienen la indicación correcta, especialmente los ancianos hospitalizados 2.
Si bien se han considerado que los IBP son, en general, bien tolerados, algunos estudios epidemiológicos que extraen información a partir de grandes bases de datos han reportado una serie de efectos adversos asociados con el uso prolongado de los IBP, como son el desarrollo del deterioro cognitivo, enfermedad renal crónica, infarto de miocardio, accidente cerebrovascular, fracturas óseas, trastornos hidroelectrolíticos e incluso la muerte, entre otros 3-5.
En muchos casos, la calidad de la evidencia subyacente a estas asociaciones es baja, dado que estos estudios, por su diseño, no pueden atribuir una relación causa-efecto, sin embargo, generan hipótesis. A pesar de lo anterior, en muchos contextos, tanto por parte de los profesionales de la salud como de los pacientes, se ha optado por no usar los IBP en situaciones clínicas en las que claramente están indicados como, por ejemplo, para prevenir y tratar las complicaciones de las diferentes formas de la enfermedad ácido-péptica.
En contraste a lo anterior, recientemente se han descrito algunas propiedades neuroprotectoras de los IBP, como se mencionará más adelante.
Entonces, se pretende hacer una revisión narrativa que incluya los aspectos farmacológicos relevantes de los IBP, para entender, desde el punto de vista biológico, los posibles mecanismos que pudieran influir en el funcionamiento cerebral y, finalmente, contrastarlos con la evidencia clínica disponible con respecto al uso crónico de estos medicamentos y el deterioro cognitivo.
Estrategia de búsqueda
Se realizó una búsqueda de la literatura para dar respuesta a la pregunta: ¿cuál es el efecto del uso crónico de los IBP sobre el deterioro cognitivo en adultos mayores? Las palabras clave de búsqueda fueron efecto adverso neurológico, demencia, depresión, deterioro cognitivo e IBP (omeprazol [OPZ], esomeprazol, pantoprazol, lansoprazol [LPZ]). Las bases de datos consultadas fueron PubMed, Scopus y Scielo, que incluyeron tanto artículos en inglés como en español. La búsqueda no se limitó a ningún periodo específico. La información encontrada en los estudios seleccionados se evaluó cuidadosamente y se describe a continuación.
Inhibidores de bomba de protones (IBP)
Para entender el mecanismo de acción de los IBP, es importante conocer aspectos fisiológicos de la secreción ácida en las células parietales gástricas a partir de la enzima hidrógeno-potasio-adenosina trifosfato (H+/K+-ATPasa), la cual crea un gradiente de concentración de hidrogeniones (H+) en la luz gástrica de 1 millón de veces, en comparación con el interior de la célula parietal. Para esto, la enzima que normalmente permanece en estado de reposo en forma túbulo-vesicular en el citoplasma celular, al ser activada por diferentes ligandos tales como la acetilcolina (estímulo neural), la histamina (estímulo paracrino) o la gastrina (estímulo endocrino) ―principalmente como respuesta a la ingesta de comida―, sufre cambios conformacionales que conllevan a la liberación intracelular de segundos mensajeros como son el calcio y el adenosín monofosfato cíclico (AMPc), que producen la secreción ácida como vía final común. La enzima H+/K+-ATPasa intercambia H+ por K+ (expulsa H+, introduce K+), mientras se produce una secreción basolateral de bicarbonato (HCO₃) para mantener la electroneutralidad intracelular. La enzima H+/K+-ATPasa se une al magnesio-adenosina-5´-trifosfato (MgATP), que le proporciona la energía para fusionarse con las microvellosidades apicales en la membrana luminal del canalículo secretor de la célula parietal (bomba activa).
Estructuralmente, la H+/K+-ATPasa es un heterodímero con una subunidad alfa y una subunidad beta. Contiene 28 moléculas de cisteína (CYS) localizadas en diferentes regiones de la enzima, 10 de estas moléculas son el punto de unión de los IBP una vez la bomba está activa, en especial de la CYS 813 6.
Los IBP son prodrogas que requieren activación en un medio ácido una vez que han sido absorbidos; son los inhibidores más potentes de la secreción gástrica ácida, que logran una disminución diaria basal y estimulada de la secreción entre un 80 % a 95 %. Son bases débiles, lábiles al medio ácido, por lo cual necesitan de una cubierta que los proteja del medio ácido y que permita su absorción en un ambiente más alcalino, en el intestino delgado. Los IBP comparten una estructura básica muy similar que combina un anillo de bencimidazol y un anillo de piridina a través de un enlace sulfinilo. Para que el sulfinilo se una químicamente a la porción CYS de la ATPasa, tiene que ganar energía del ambiente ácido dentro de la célula parietal, es decir, el IBP debe activarse, lo cual se da mediante la adición de 2 protones a los nitrógenos a cada lado del grupo sulfinilo. Una vez que se activa, el IBP puede inactivar la bomba de protones al unirse a las moléculas CYS en la ATPasa para formar enlaces disulfuro. Los IBP pueden unirse a diferentes sitios CYS de la enzima dependiendo de la velocidad con la que se activen. Esta diferencia en los sitios de unión explica algunas de las diferencias farmacodinámicas entre los IBP según aquellos con unión reversible y aquellos que son inaccesibles a la reducción de los enlaces disulfuro, así, por ejemplo, la inhibición de la secreción ácida por OPZ puede ser de 24 horas y con pantoprazol, hasta 46 horas 1,6,7.
Si bien los IBP producen relativamente pocos efectos adversos y tienen un buen perfil de seguridad, la inhibición prolongada de la secreción de ácido gástrico conduce a una hipergastrinemia prolongada y que puede conllevar a hiperplasia de células similares a enterocromafines, la formación de tumores carcinoides, deficiencia de vitamina B12, deficiencia de hierro, hipomagnesemia, enterocolitis necrotizante, osteoporosis, gastritis atrófica y aumento de infecciones por cambios en la microbiota intestinal, entre otros 4,6,8.
Deterioro cognitivo
El deterioro cognitivo consiste en una pérdida progresiva de las funciones mentales superiores, en un espectro que va desde el deterioro cognitivo leve a la demencia; los límites para definir la separación entre estos se basan en la preservación o pérdida de la independencia en la vida diaria. La demencia consiste en una pérdida progresiva de las funciones mentales superiores, que involucra uno o más dominios cognitivos (aprendizaje y memoria, lenguaje, función ejecutiva, atención compleja, percepción-motora, cognición social), que limita en diferente grado la capacidad de pensar, memorizar, razonar y de realizar actividades de la vida diaria, que se debe a un trastorno en el funcionamiento cerebral. También pueden acompañarse de cambios en la personalidad, el estado de ánimo y en el comportamiento, pero sin alteración del nivel de conciencia 9,10.
La mayoría de las demencias se deben a alteraciones neurodegenerativas, como es el caso de la enfermedad de Alzheimer (EA, 60 %-80 % de los casos), demencia por cuerpos de Lewy, demencia frontotemporal, demencia por enfermedad de Parkinson y, en casos más raros, por la parálisis supranuclear progresiva, la degeneración corticobasal, la atrofia multisistémica y la enfermedad de Huntington. También puede estar asociada a causas vasculares (segunda causa más frecuente), en especial en pacientes de raza negra, pacientes con diabetes, hipertensión y otros factores de riesgo cardiovascular. Otras etiologías menos comunes incluyen la demencia relacionada con el alcoholismo, la encefalopatía traumática crónica, la hidrocefalia de presión normal, el hematoma subdural crónico y otras enfermedades del sistema nervioso central (SNC) como, por ejemplo, las enfermedades priónicas y la infección por VIH, entre otras. La demencia mixta es frecuente, se refiere a la coexistencia de más de una patología origen de la demencia, más comúnmente encontrada con la EA y la demencia vascular 11-15.
Si bien la demencia afecta principalmente a personas mayores, ha habido un aumento en los casos diagnosticados antes de los 65 años. Se estima que la prevalencia mundial de la demencia aumentará de 43,8 millones de pacientes en la actualidad, a alrededor de 100 millones para el 2050; se registran 10 millones de casos nuevos por año a escala mundial. Se estima que el número de personas con demencia casi se duplicará cada 20 años, y que la mayoría de los casos tendrá lugar en los países de ingresos medios en rápido desarrollo; en América Latina se puede esperar un aumento de entre 134 %-146 % 16-18.
Actualmente, el diagnóstico de la EA se basa en pruebas neuropsicológicas (criterios cognitivos), neuroimagen (resonancia magnética nuclear y depósitos de amiloide por tomografía por emisión de positrones) y por presencia de proteína tau/amiloide en líquido cefalorraquídeo (criterios de biomarcadores), que descartan otras causas de demencia. Sin embargo, un diagnóstico definitivo solo puede confirmarse histopatológicamente por la presencia extensa de beta amiloide (βA) y ovillos neurofibrilares de la proteína tau (NFT) en la neocorteza del tejido cerebral post mortem19.
Inhibidores de bomba de protones y deterioro cognitivo
Mecanismos fisiopatológicos
A continuación, se describen los mecanismos fisiopatológicos que pueden explicar los efectos de los IBP sobre la función cerebral, teniendo en cuenta las bases neurobiológicas descritas en la EA.
Existe evidencia de actividad de la bomba de protones H+/K+-ATPasa en el SNC, con ciertas isoformas específicas (ATPasas de tipo P) que tienen varias funciones fisiológicas en las neuronas y contribuyen a la homeostasis ácido-base y del potasio, además, crean el gradiente de protones que se requiere para el empaquetamiento del neurotransmisor en vesículas sinápticas. Recientemente, se ha descrito que la bomba de protones H+/K+-ATPasa vesicular también juega un papel importante en los procesos de exocitosis como en la endocitosis en las terminales nerviosas 17.
Las ATPasas de tipo P (Ca2+-ATPasa, Na+/K+-ATPasa y H+/K+-ATPasa) comparten la estructura primaria de la subunidad α (H+/K+-ATPasa gástrica, 98 % de homología) y la subunidad catalítica (63 % de homología) y de la Ca2+-ATPasa retículo sarcoplásmico/endoplásmico (25 % de homología).
Los IBP, como se expuso antes, bloquean eficazmente la secreción de ácido mediante la unión covalente a los residuos de CYS de la bomba H+/K+-ATPasa activada en las células parietales gástricas, en especial de la CYS 813; teniendo en cuenta la alta homología entre las ATPasas de tipo P, es posible que los IBP puedan inhibir otras bombas iónicas en diferentes órganos e inducir cambios fisiológicos a nivel sistémico. El SNC puede verse afectado, si se considera la presencia de condiciones facilitadoras como son diferentes condiciones patológicas que mantienen un pH reducido en el cerebro, en el líquido cefalorraquídeo y en la sangre (estrés metabólico).
En estudios de farmacocinética se ha encontrado que el coeficiente de distribución de sangre a cerebro del OPZ luego de una dosis única intravenosa es de 0,15, es decir, el 15 % de este medicamento, puede llegar al SNC y afectar potencialmente la función cerebral con el uso agudo o prolongado 14. También se ha demostrado, in vitro e in vivo, que el LPZ también puede penetrar en la barrera hematoencefálica 20.
Es así como se ha reportado que algunos IBP, como LPZ, esomeprazol y pantoprazol pueden causar efectos neurológicos adversos, principalmente cefaleas y mareos/vértigo y, en menor proporción (<1 %), depresión, diplopía, trastornos del sueño, somnolencia, insomnio, nerviosismo, temblor y anomalías sensoperceptivas (alucinaciones) y delirio 21.
Estos efectos secundarios neurológicos inducidos por el uso crónico de los IBP podrían estar relacionados indirectamente con alteraciones sistémicas secundarias a su uso (deficiencia de magnesio y vitamina B12) o efectos directos sobre las neuronas después del paso a través de la barrera hematoencefálica, sin embargo, los mecanismos exactos de los circuitos cerebrales no se han descrito completamente 20.
Efectos fisiopatológicos de los IBP en la demencia
Los IBP pueden facilitar la neurotoxicidad inducida por la proteína tau y βA, lo que puede aumentar la progresión de la EA y el deterioro cognitivo; por otra parte, el uso prolongado puede facilitar el desarrollo de deficiencia de vitamina B12, que juega un papel importante en la función cognitiva 17,22.
Beta amiloide
Una de las principales características de la EA es la acumulación extracelular de placas βA, que provocan daño oxidativo e inflamatorio en el cerebro. Los IBP producen aumento en la producción de βA. El βA se produce por una escisión anómala de la proteína precursora de amiloide (PPA), la cual es una proteína integral de las membranas celulares. Cuando la PPA es escindida por la α-secretasa, que es la vía normal, el producto resultante es un péptido soluble, eliminado después por el organismo con facilidad; pero en la EA predomina la escisión consecutiva de la PPA por parte de la β-secretasa primero y de la γ-secretasa después, entonces se forma el péptido β-amiloide, insoluble, que las neuronas excretan a su exterior y que las células de la glía (astrocitos y microglía) intentan eliminar sin lograrlo. Por tanto, se genera un proceso inflamatorio que, junto con el propio efecto tóxico del β-amiloide, contribuye a lesionar a las neuronas 23.
Recientemente, Badiola et al. investigaron el efecto de los IBP en la producción de βA utilizando modelos celulares y animales, y sugirieron que los IBP actúan como moduladores inversos de α-secretasa (iGSM), que cambian el sitio de escisión por la γ-secretasa y, por lo tanto, aumentan los niveles de βA tipo 42, que es la principal especie amiloide patológica. Por otra parte, los IBP alteran el pH del medio y amplifican la actividad de otras proteasas, como memprin-β, por lo que se generan otros péptidos Aβ2 (Aβ2-37, Aβ2-40 y Aβ2-42) 24.
También se ha demostrado que los IBP pueden atravesar la BHE e inhibir las bombas de protones vacuolares (V-ATPasas) de la microglía y macrófagos, que normalmente acidifican los lisosomas mediante el bombeo de protones desde el citoplasma a la luz de las vacuolas, lo que permite un medio ácido en los lisosomas para degradación del βA fibrilar; al bloquear este efecto, los IBP producirían una menor degradación del βA fibrilar y, por consiguiente, una reducción de su eliminación 25.
Proteína tau
La proteína tau desempeña un rol importante como proteína asociada a microtúbulos en los axones neuronales, pues los estabiliza e induce su ensamblaje. Los NFT son formaciones intraneuronales secundarias a la hiperfosforilación de proteínas tau, que en este estado es incapaz de unirse y estabilizar los microtúbulos, por lo que se forman filamentos helicoidales apareados (FHP), que son el reflejo de la destrucción de microtúbulos y neurofilamentos; posteriormente, se produce la degeneración de las neuronas afectadas con posterior muerte celular 26,27.
De acuerdo con la teoría de la neuroinmunomodulación de la EA, los primeros cambios del SNC antes del inicio clínico (presencia de síntomas) son el resultado de una respuesta inflamatoria crónica, que conduce a una fosforilación anormal de la proteína tau que induce la formación de FHP y agregados de proteínas tau 28.
Varios estudios han encontrado que los NFT se correlacionan con el deterioro cognitivo y la gravedad en la EA, lo que posiciona a los NFT tau como objetivos adecuados para una potencial terapia y para el diagnóstico en pacientes con EA 20.
Se ha descubierto que la quinolina y los derivados bencimidazoles tienen una alta afinidad por la proteína tau, en especial por los NFT en placas neuronales 29. Algunos IBP tienen un anillo bencimidazol en su estructura, como es el caso del LPZ. Se ha encontrado una alta afinidad por los compuestos NFT de la tau y, al ser lipofílico y atravesar la BHE, se ha investigado su utilidad como radiotrazador para la obtención de imágenes por tomografía por emisión de positrones (PET); sin embargo, no se ha documentado su utilidad en todos los casos, lo que indica posiblemente diferente afinidad según el tipo de isoforma de la proteína tau expresadas en el SNC, según los dominios de unión a microtúbulos, que pueden variar en diferentes condiciones patológicas 30. Se necesitan más investigaciones para comprender específicamente las interacciones de los IBP con la proteína tau.
Deficiencia de vitamina B12
La vitamina B12 (cobalamina), que se obtiene de diferentes fuentes de alimento, en especial de origen animal como carne, pescado, derivados lácteos y en algunos cereales fortificados, requiere de acidez gástrica para poder ser absorbida. En los seres humanos, las reservas totales de cobalamina (2-5 mg) son mucho mayores que los requerimientos diarios, por lo que se plantea que las reservas corporales son suficientes para cubrir los requerimientos diarios por un período de 3 a 4 años después de que se ha instaurado un régimen de baja ingesta o malabsorción de vitamina B12 31.
Durante el proceso de la digestión, la vitamina B12 se une a las proteínas R salivales (cobalofilinas) y luego, en el intestino delgado, al factor intrínseco, una glucoproteína de alta afinidad a un pH ácido producido por las células parietales gástricas del fundus y cardias, y continúa su recorrido hasta llegar al íleon terminal, donde se absorbe. Por otra parte, la vitamina B12 está firmemente unida a las proteínas de los alimentos, por lo que requiere una digestión proteolítica activada por ácido. Dado que los IBP promueven el desarrollo de hipoclorhidria, disminuyen la absorción de esta vitamina, ya que la B12 permanece fuertemente unida a las proteínas en el estómago y no se une eficazmente al factor intrínseco 31.
La vitamina B12 es necesaria para las reacciones de transferencia de un carbono, como la metilación, requeridas para el procesamiento y la producción de nucleótidos, fosfolípidos y neurotransmisores monoamínicos. Interviene en la producción de metionina a partir de la homocisteína, por lo que se elimina un grupo metilo del tetrahidrofolato y se produce metilcobalamina más un grupo metilo, el cual es presentado a la homocisteína que, por acción de la metionina sintasa, produce metionina. Por lo anterior, la deficiencia de vitamina B12 es una de las principales causas de hiperhomocisteinemia. Tanto la hiperhomocisteinemia como la deficiencia de B12 se consideran factores de riesgo para la atrofia cerebral, el deterioro cognitivo y la demencia 32-34.
La hiperhomocisteinemia puede activar varias proteínas quinasas, como la glucógeno sintasa quinasa 3β (GSK-3β), la quinasa dependiente de ciclina-5 (Cdk-5), la quinasa N-terminal c-Jun (JNK), la regulada por señales extracelulares cinasa (ERK) y la proteína cinasa activada por mitógenos p38 (MAPK), e inhibe la proteína fosfatasa 2A (PP2A), enzimas fundamentales en la regulación del estado de fosforilación de la proteína tau 32.
Por lo tanto, la vitamina B12 es uno de los inhibidores de la polimerización de tau y su deficiencia está relacionada con la inactivación (disminución de la metilación) de la proteína fosfatasa 2A, que desempeña un rol muy importante por ser la principal enzima fosfatasa de serina/treonina del SNC. Cataliza reacciones de desfosforilación, por lo cual se favorece la hiperfosforilación de la proteína tau, que conlleva a su agregación, producción de NFT y desarrollo de neurodegeneración 35,36.
También se han descrito mecanismos alternativos para vincular la EA con la deficiencia de vitamina B12, que son distintos de la inactivación de PP2A, y es que la cobalamina puede unirse directamente a la proteína tau a través de residuos de CYS en dicha proteína, e inhibe su fibrilación y agregación 35.
En modelos animales, la hiperhomocisteinemia, además de inducir la hiperfosforilación de la proteína tau, puede aumentar la producción de βA, aunque la suplementación con folato/vitamina B12 puede atenuar estos efectos 37.
Si bien se ha descrito la asociación entre la disminución de la absorción de B12 y el uso de IBP en estudios a corto plazo, esto no ha sido evidente en todos los estudios con pacientes con uso prolongado de IBP. Cabe resaltar que la mayoría de estos estudios muestran asociación y no causalidad. Es probable que existan otros factores contribuyentes para estos hallazgos, además de la terapia supresora de ácido con IBP 22.
Si se tiene en cuenta, como se describió antes, que los IBP no inhiben completamente la secreción gástrica de ácido y que las reservas fisiológicas de vitamina B12 generalmente son suficientes en la población general, los controles séricos de rutina de los niveles de B12 en los pacientes que usan IBP pueden no ser siempre requeridos; sin embargo, es un aspecto para considerar según el contexto clínico del paciente.
Para concluir esta parte, se puede decir que se han descrito diferentes mecanismos para explicar los efectos de la deficiencia de vitamina B12 en la demencia; sin embargo, los estudios de intervención con suplementación de ácido fólico, vitamina B12 y/o B6 sobre placebo en adultos mayores con deterioro cognitivo secundario a EA no ha demostrado beneficio 34.
Se necesitan más ensayos clínicos para comprender esta relación de una forma más precisa, así como para establecer si la deficiencia de vitamina B12 es un evento causal en la demencia o un factor asociado (Figura 1).
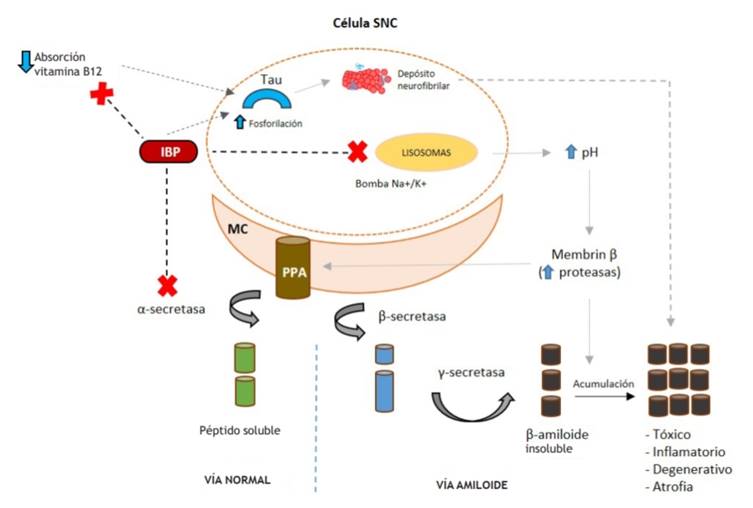
MC: membrana central; PPA: proteína precursora de amieloide; IBP: inhibidor de la bomba de protones; SNC: sistema nervioso central.
Figura 1 Mecanismos postulados de los IBP sobre el SNC y su relación con el deterioro cognitivo
Se presenta la vía normal de metabolismo de la PPA que forma parte integral de las membranas celulares, mediada por la α-secretasa, enzima bloqueada por los IBP, lo que activa de forma consecutiva la vía de la generación de amiloide por acción de la β-secretasa y γ-secretasa sobre el PPA, que produce péptido β-amiloide, el cual es insoluble y no se elimina adecuadamente por las células de glía. Por tanto, se acumula y genera un efecto tóxico directo sobre las membranas celulares neuronales, inflamación, degeneración neuronal y atrofia cerebral. Otro mecanismo de los IBP involucra efectos directos sobre la hiperfosforilación de la proteína tau y efectos indirectos mediados por la deficiencia de vitamina B12 debido a la malabsorción por hipoclorhidria gástrica. Finalmente, ocurre un aumento en el pH del medio por la inhibición de la bomba de Na+/K+ en los lisosomas, lo que genera la activación de proteasas como la membrin β, que degradan otras proteínas entre ellas la PPA, por lo que se genera acumulación de péptidos insolubles.
Estudios experimentales que muestran potencial beneficio de los IBP
Como se mencionó líneas arriba, se ha reportado recientemente, por el contrario, un efecto neuroprotector de los IBP, pero a nivel experimental.
Para explorar si los IBP poseen efectos antiinflamatorios sobre la microglía, se investigó el efecto de LPZ y OPZ sobre la acción tóxica en cultivos celulares de microglía humana y monocitos THP-1, expuestos a células de neuroblastoma SH-SY5Y, por lo que se midió la producción de las citocinas proinflamatorias factor de necrosis tumoral (TNF)-alfa e interleucina (IL)-6. Encontraron que ambos IBP redujeron significativamente la secreción de TNF-alfa de las células THP-1 estimuladas de una manera dependiente de la concentración y que había una tendencia hacia dicha reducción de la IL-6. Los autores llegaron a la conclusión de que los IBP poseen efectos antiinflamatorios y pueden disminuir la neurotoxicidad microglial y monocítica humana 38.
Teniendo en cuenta que varios procesos inflamatorios, incluida la activación astrocítica, han sido implicados en la patogenia de diferentes enfermedades neurodegenerativas, entre ellas la EA, y que la neurotoxicidad astrocítica inducida por interferón (IFN)-γ está mediada, al menos en parte, por la fosforilación del transductor de señal y el activador de la transcripción (STAT) 3, se realizó un estudio a partir de cultivos celulares de astrocitos humanos expuestos a células de neuroblastoma SH-SY5Y, con el fin de evaluar los efectos de los IBP sobre la neurotoxicidad inducida por el IFN-γ mediante activación de STAT3. Se encontró que tanto el lansoprazol como el OPZ inhibieron significativamente la fosforilación inducida por IFN-γ por activación de STAT3, pero no por STAT1. Además, se redujo significativamente la secreción del quimioatrayente α de
células T inducible por IFN-γ. Estos resultados sugieren que los IBP atenúan la neurotoxicidad de los astrocitos humanos inducida por IFN-γ mediante la inhibición de la vía de señalización STAT3. Los autores concluyen que los IBP poseen propiedades anti neurotóxicas y que podrían ser una opción útil de tratamiento para la EA y otros trastornos neuroinflamatorios asociados con activación astrocítica 39.
Estudios clínicos que encuentran asociación con el deterioro cognitivo
Varios estudios han reportado una asociación entre el uso de los IBP y el deterioro cognitivo. A continuación, se han considerado los estudios más relevantes.
En el estudio alemán sobre el envejecimiento, la cognición y la demencia en pacientes de atención primaria (AgeCoDe), estudio de cohorte multicéntrico longitudinal en 3327 pacientes ancianos de 75 o más años, con seguimiento de hasta 72 meses con intervalos de cada 18 meses, se identificó un total de 431 con incidencia de demencias; de ellos, 260 tenían EA. Se utilizó una regresión de Cox dependiente del tiempo para estimar los cocientes de riesgo de incidencia de cualquier demencia y EA. Los posibles factores de confusión incluidos en el análisis incluyeron edad, sexo, educación, estado del alelo de la apolipoproteína E4 (ApoE4), polifarmacia y las comorbilidades depresión, diabetes, cardiopatía isquémica y accidente cerebrovascular. Los pacientes que recibieron IBP tenían un riesgo significativamente mayor de cualquier demencia (Hazard ratio [HR] 1,38, intervalo de confianza [IC] del 95 %: 1,04-1,83) y EA (HR 1,44, IC 95 %: 1,01-2,06) en comparación con los que no usaban IBP 40.
En otro estudio de cohorte prospectivo para examinar la asociación entre el uso de los IBP y el riesgo de demencia incidente en los ancianos, se obtuvo datos derivados de la aseguradora de salud más grande de Alemania, Allgemeine Ortskrankenkassen (AOK), con relación a las prescripciones de medicamentos y diagnósticos, incidente de demencia, mediante regresión de Cox dependiente del tiempo, ajustada por edad, sexo, comorbilidades y polifarmacia. Los datos recopilados correspondieron al periodo 2004-2011 tanto de pacientes hospitalizados como ambulatorios. Se analizaron un total de 73 679 participantes de 75 años o más y que no sufrían de demencia al inicio del estudio. Los pacientes que recibieron los IBP de forma regular (n = 2950; edad media 83,8 años [DE: 5,4]; 77,9 % fueron mujeres) tuvieron un riesgo significativamente mayor de aparición de demencia, en comparación con los pacientes que no recibieron un IBP (HR 1,44, IC 95 %: 1,36-1,52; p < 0,001) 41.
Un tercer estudio realizado para examinar esta asociación en una población asiática incluyó pacientes sin antecedente de demencia que iniciaron la terapia con IBP entre el 1 de enero de 2000 y el 31 de diciembre de 2003, los cuales fueron identificados a partir de la base de datos de los seguros de salud nacional de Taiwán. El resultado de interés fue la incidencia de demencia por todas las causas. De forma similar, se aplicaron modelos de regresión de Cox para estimar el índice de riesgo (HR) de la demencia. La dosis acumulada de IBP fue estratificada por cuartiles de dosis diarias definidas y ajustada por la puntuación de riesgo de enfermedad. Se analizaron datos de un total de 15 726 participantes de 40 años o más y libres de demencia al inicio del estudio. Los usuarios de IBP (n = 7863; seguimiento promedio de 8,44 años) tenían un riesgo significativamente mayor de demencia que los que no usaban IBP (n = 7863; seguimiento promedio de 9,55 años; HR ajustada [aHR] 1,22; IC 95 %: 1,05-1,42). El análisis de subgrupos mostró una frecuencia excesiva de demencia en usuarios de IBP diagnosticados con depresión (aHR 2,73 [1,91-3,89]), hiperlipidemia (aHR 1,81 [1,38-2,38]), cardiopatía isquémica (aHR 1,55 [1,12-2,14]) e hipertensión (aHR 1,54 [1,21-1,95]) 42.
En otro estudio en la población adulta mayor de la ciudad de Bogotá, Colombia, que formaron parte del estudio SABE (Salud, Bienestar y Envejecimiento), realizado en el año 2012, incluyeron una muestra significativa de 2000 personas mayores de 60 años. Aquí se describió la asociación entre la presencia de alteración cognoscitiva evaluada por medio del puntaje obtenido en el miniexamen del estado mental modificado (MMSE-M, por sus siglas en inglés) validado al español como variable dependiente y el consumo de IBP y tiempo de uso como variables independientes. Con base en la curva ROC, se seleccionó el tiempo de uso del IBP mayor o igual a 24 meses y se realizó un modelo de regresión logística multivariada. Se utilizó una variable de interacción entre la edad y el tiempo de uso del medicamento. Se encontró que la edad promedio fue de 71,17 ± 8,05, con una prevalencia de consumo del IBP del 20,7 %, con un tiempo de uso promedio en meses de años 74,8 ± 93,7. El MMSE-M estaba alterado en el 12,6 % de los entrevistados. En el análisis multivariado, el uso del IBP durante 24 o más meses, ajustando a las variables de edad, sexo, nivel educativo y estado civil, mostró un aumento en el riesgo de asociación de 1,90 veces (OR: 1,90; IC: 1,11-3,24; p = 0,018) 43.
Evidencia a partir de metaanálisis y revisiones sistemáticas
Según una revisión sistemática del 2017 en cuatro estudios observacionales europeos que investigaron la asociación entre el uso del IBP y la demencia, se encontró en tres de ellos una asociación positiva entre demencia y el uso de OPZ, esomeprazol, lansoprazol y pantropazol, con un riesgo aproximadamente 1,4 veces mayor de cualquier demencia en las cohortes que utilizan IBP (IC del 95 %: 1,36-1,52; p < 0,001) 44.
En el año 2019 se publicaron un metaanálisis y dos revisiones sistemáticas y metaanálisis cuyo objetivo era determinar la asociación del uso de IBP y el riesgo de demencia. En dos de ellos no se encontró asociación y en uno, sí.
En el primero de ellos, Li et al. incluyeron estudios de cohortes que reportaban el riesgo de demencia o EA entre los usuarios de IBP, en comparación con los que no lo usaban, publicados hasta febrero del 2018. A partir de seis estudios de cohorte, encontraron un riesgo relativo (RR) de 1,23 (IC del 95 %: 0,90 a 1,67) para demencia y de 1,01 (IC del 95 %: 0,78 a 1,32) para EA, en comparación con los que no usaban IBP. En esta revisión sistemática y metaanálisis, no hubo una asociación estadísticamente significativa entre el uso de IBP y el riesgo de demencia o EA (p > 0,05) 45.
Song et al., en otro metaanálisis publicado en 2019 a partir de diez estudios independientes que incluyeron 642 305 participantes, encontraron que en los usuarios de IBP no hubo una asociación significativa con demencia (cociente de riesgo agrupado [HR] = 1,04, IC del 95 %: 0,92-1,15; I2 índice de heterogeneidad = 95,6 %, p < 0,001) y EA (HR = 0,96, IC del 95 %: 0,83-1,09; I2 = 80,7 %, p < 0,001). Los análisis de sensibilidad no mostraron diferencias importantes en las estimaciones de los efectos; sin embargo, resaltaron la notable heterogeneidad entre los estudios analizados 46. Zhang et al., en otro metaanálisis publicado a finales del 2019 a partir de seis estudios de cohorte, dos de Alemania y uno de Estados Unidos, Rumania, China y Corea, respectivamente, calcularon los cocientes de riesgos agrupados (HR). En un total de 166 146 participantes, el resultado general mostró un aumento significativo en el riesgo de demencia con el uso de IBP (HR = 1,29, IC del 95 %: 1,12-1,49). En los análisis de subgrupos, se detectó una asociación significativa entre el uso de IBP y el riesgo de demencia en Europa (HR = 1,46, IC del 95 %: 1,23-1,73) y entre los participantes de 65 años o más (HR = 1,39, IC del 95 %: 1,17-1,65). Para el tiempo de seguimiento ≥5 años, el HR combinado fue 1,28 (IC del 95 %: 1,12-1,46), es decir, un aumento de 1,28 veces en el riesgo de desarrollar demencia entre los usuarios de IBP. En cuanto al impacto regional, los participantes de Europa mostraron una estimación global de HR combinada de 1,46 (IC del 95 %: 1,23-1,73). No hubo evidencia de sesgo de publicación. En este metaanálisis, los resultados apoyan que el uso de IBP aumenta el riesgo de demencia 47.
Finalmente, en dos metaanálisis y revisiones sistemáticas recientemente publicados, en uno de los cuales solo se incluyeron estudios prospectivos, una vez más se pone en duda el efecto negativo de los IBP en el desarrollo de demencia.
Hussain et al. realizaron otro metaanálisis y revisión sistemática para investigar la asociación entre el uso de IBP y el riesgo de demencia. Incluyeron estudios de cohorte y de casos y controles publicados hasta el 31 de marzo de 2019 que evaluaban dicha asociación. El desenlace primario fue el riesgo combinado de demencia entre los usuarios de IBP en comparación con los que no los usaban. Los desenlaces secundarios incluyeron el riesgo de demencia según los subgrupos. A partir de 12 estudios (8 de cohortes y 4 de casos y controles), se registró un RR combinado de 1,05 (IC del 95 %: 0,96-1,15), p = 0,31. El análisis de subgrupos se basó en el diseño del estudio (cohorte: p = 0,14; casos y controles: p = 0,14), sexo (RR 1,25 [IC del 95 %: 0,97-1,60], p = 0,08), antagonistas del receptor de histamina 2 (p = 0,93) y la EA (RR 1,00 [IC del 95 %: 0,91-1,09], p = 0,93). Lo anterior indica que no se encontró una asociación significativa entre el uso de IBP y el riesgo de demencia o EA 48.
Desay et al. realizaron un metaanálisis y revisión sistemática solo de estudios prospectivos que examinaran el riesgo de deterioro cognitivo y demencia entre los usuarios de IBP versus los que no los usaban. El resultado primario fue el HR de cualquier demencia entre los usuarios de IBP en comparación con los que no lo usaban. Los resultados secundarios fueron HR agrupado para EA con estudios de seguimiento de IBP a largo plazo (más de 5 años). Se incluyeron en el análisis un total de 6 estudios (un ensayo clínico aleatorizado y cinco prospectivos) con 308 249 sujetos, con una edad promedio de 75,8 ± 5,2 años y un seguimiento de 5 (rango 1,5-11) años. El HR agrupado de cualquier demencia fue 1,16 (n = 6, IC del 95 %: 0,86-1,47). Los resultados se mantuvieron sin cambios cuando solo se analizaron los estudios con el uso de IBP a largo plazo (más de 5 años) (n = 4, HR agrupado 1,10, IC del 95 %: 0,66-1,53). El HR agrupado para la EA fue de 1,06 (n = 3, IC del 95 %: 0,70-1,41). Se encontró una heterogeneidad considerable entre los estudios de inclusión (I2 = 93 %). La metarregresión no demostró un papel significativo de la edad al inicio del estudio (p = 0,1) o la duración del uso de IBP (p = 0,62) en la incidencia de demencia 49.
Así pues, estos resultados consolidados junto con otros más no muestran una relación significativa entre el uso de los IBP y la demencia en estudios prospectivos con cinco años de seguimiento, por lo menos 50.
Conclusiones
Los IBP son los medicamentos más prescritos, en especial en los adultos mayores. Si bien es clara su utilidad para la prevención y manejo de diferentes formas de la enfermedad ácido-péptica, no están exentos de eventos adversos por su uso crónico. En el contexto de la presencia frecuente de comorbilidad en este grupo poblacional, algunos de estos se han postulado como efectos causales, otros como de asociación, como es el caso del deterioro cognitivo.
La evidencia al respecto es limitada y conflictiva, por una parte, dado que en la mayoría de los estudios no se especifica ni el espectro ni el tipo de deterioro cognitivo evaluado; por otro lado, debido a la disparidad metodológica entre los diferentes estudios, así, por ejemplo, no se evaluó la reversibilidad de los hallazgos encontrados, dado que en la mayoría de ellos los datos fueron obtenidos de forma retrospectiva a partir de una historia de exposición crónica a los IBP o de forma prospectiva durante la exposición a los mismos por un periodo determinado, sin describirse en estos casos evaluaciones posteriores neurocognitivas sin exposición a los IBP.
De acuerdo con lo anterior, se describen los resultados globales de los efectos descritos de los IBP sobre la función cognitiva. Por esto, a la fecha, con la evidencia consolidada disponible en los más recientes metaanálisis y revisiones sistemáticas de la literatura, no se ha encontrado una asociación significativa entre el uso de los IBP y el riesgo de demencia o deterioro cognitivo, teniendo en cuenta que la calidad de la evidencia no es robusta.
Es posible que los efectos cognitivos de los IBP se deban también a interacciones medicamentosas, especialmente en pacientes ancianos polimedicados, que no se han considerado como factores de confusión, así como también factores como la presencia de hipertensión, los antecedentes familiares de demencia, la diabetes mellitus, el grado de actividad física, la contaminación del aire, los cuales se han descrito recientemente como factores de riesgo de deterioro cognitivo y demencia.
Por lo tanto, para aclarar mejor los efectos del uso crónico de los IBP en el funcionamiento cerebral y poder tomar una postura clara para el uso de los IBP en diferentes contextos clínicos en los adultos mayores, se necesitan estudios de cohortes bien diseñados, con parámetros establecidos de evaluación de los diferentes dominios mentales y espectros del deterioro cognitivo, con tamaños de muestra representativos y con períodos de seguimiento prolongados, donde se utilice un método confiable de análisis para ajustar los factores de confusión como la comorbilidad, las interacciones y reacciones adversas de otros medicamentos y la polifarmacia, muy frecuentes en este grupo poblacional.
Por otra parte, es importante aclarar que la evidencia disponible sobre los efectos antiinflamatorios y neuroprotectores de los IBP solo es a partir de pocos estudios experimentales en cultivos celulares de microglía y astrocitos; son resultados generadores de hipótesis para quizás futuras investigaciones en escenarios clínicos concretos, pero no pueden extrapolarse como efectos clínicos pleiotrópicos demostrados.
En conclusión, en los adultos mayores, la terapia con IBP debe reevaluarse constantemente y restringir su uso a escenarios clínicos apropiados, durante un periodo establecido y no de forma prolongada como parte del tratamiento habitual de estos pacientes, que en su mayoría tienen varias patologías crónicas, siempre y cuando se determine que los beneficios superan los riesgos potenciales.











 texto en
texto en 



