Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.19 no.3 Lima dic. 2012
TRABAJOS ORIGINALES
Efecto neuroprotector del extracto hidroalcohólico de Piper aduncum “matico” en un modelo in vitro de neurodegeneración
The neuroprotective effect of a hydroalcoholic extract of Piper aduncum “matico” in an in vitro model of neurodegeneration
César Zaa 1, Martha Valdivia 2 y Álvaro Marcelo 1
1 Laboratorio de Química Bioorgánica, Centro de Investigación de Bioquímica y Nutrición, Facultad de Medicina, Universidad Nacional Mayor de San Marcos.
2 Laboratorio de Fisiología de la Reproducción animal, Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos.
Resumen
Durante los procesos neurodegenerativos la función y viabilidad de las neuronas se reduce. En particular, el incremento patológico en la concentración de calcio intracelular, la alteración de la plasticidad sináptica y apoptosis están implicados en la Enfermedad de Alzheimer (EA), paradigma de un proceso neurodegenerativo, relacionado con la pérdida progresiva de las funciones cognitivas. Para evaluar el efecto neuroprotector de Piper aduncum "matico" se indujo el daño con el péptido Aβ a células cultivadas. Igualmente, células hipocampales fueron tratadas con el Aβ, y se evaluó viabilidad celular, niveles de caspasa-3 y expresión de receptores NMDA en sinapsis. También se registró el influjo de calcio intracelular en tratamientos con agonista NMDA y P. aduncum. En la evaluación neuroprotectora hay una reducción de un 20,6% de caspasa-3; un aumento del 9,6% por encima del control y una recuperación del 20,86% para las proteínas NR1 y SV2 respectivamente. Además hay una reducción de más del 50% del calcio celular. Estos resultados evidencian efecto neuroprotector de P. aduncum para el modelo estudiado.
Palabras clave: Piper aduncum; neuroprotección; neurodegeneración; apoptosis; sinapsis.
Abstract
During the neurodegenerative processes there is a reduction of the function and viability of neurons. The pathological increase in the intracellular calcium concentration, the alteration of the synaptic plasticity and the apoptosis are implicated in Alzheimer disease (AD, a paradigm of a neurodegenerative process, related with the progressive loss of cognitive functions. To evaluate neuroprotector effect of Piper aduncum damage was induced with Aβ1-42 and NMDA to cultured cells. So hippocampal cells were treated with Aβ1-42 1 uM and cellular viability, levels of caspasa-3 and expression of NMDA receptors in synapses were evaluated. Also, intracellular calcium influxe (sobreestimulation with NMDA) of was registered in treatments with P. aduncum. In the neuroprotector evaluation there is a reduction of 20.6% of caspasa-3; one increase of 9.6% over control and recovery of 20.86% for NR1 and SV2 proteins respectively. Besides, there is a reduction of more than 50% of cellular calcium. These results demonstrate neuroprotector effect of P. aduncum for the studied model.
Keywords: Piper aduncum; neuroprotection; neurodegeneration; apoptosis; synapses
Introducción
La Enfermedad de Alzheimer (EA) es considerada como paradigma de un proceso neurodegenerativo, afectando a unos 30 millones de individuos en el mundo (Weggen et al. 2007). Se estima que un 5% de la población mayor de 65 años es afectada y que la prevalencia es aproximadamente el doble cada cinco años (Klafki et al. 2006). Su diagnóstico comúnmente es basado en la evaluación clínica y la determinación definitiva requiere un examen patológico en autopsia (Craig-Schapiro et al. 2009). En pacientes con la EA el péptido β-amiloide (Aβ) se encuentra en concentraciones elevadas formando depósitos fibrilares en las regiones cortical y temporal del cerebro incluyendo el hipocampo, una región implicada en el procesamiento de la información necesaria para la formación de la memoria (Stéphan et al. 2001). De las especies amiloides, la isoforma Aβ1-42 es considerada como la principal especie patogénica, además de ser altamente hidrofóbica y acumularse extracelularmente formando placas neuriticas (Weggen et al. 2007).
Diversos cambios moleculares y celulares han sido implicados en la regulación de la homeostasis sináptica, pero una característica común es la alteración en el número de receptores de glutamato tipo NMDA (R-NMDA), distribuidos sobre la superficie celular con localización en las regiones sinápticas, cumpliendo un rol crítico en la plasticidad sináptica y excitotoxicidad en el sistema nervioso central (SNC) (Pérez-Otaño y Ehlers 2005).
Caspasa-3 es uno de los principales operadores en la fase de ejecución final de la apoptosis, además de ser un importante mediador de la muerte celular en numerosas enfermedades y daños del SNC (Liu et al. 2011). Otros estudios mostraron un incremento significante de los niveles de activación de caspasa-3 en neuronas tratadas con el péptido Aβ (Li et al. 2010).
Por otro lado, en condiciones normales el calcio intracelular constituye un segundo mensajero que promueve la supervivencia neuronal. Su incremento está asociado con la activación temprana de R-NMDA. Éstos canales glutamatérgicos son estructuras responsables de la permeabilización de membrana a calcio (Pellistri et al. 2008). En la EA, la excesiva activación de R-NMDA está considerada para causar un incremento en las concentraciones de calcio intracelular ([Ca2+]i), el cual luego activa eventos que en última instancia llevan a la neurodegeneración.
El glutamato representa el principal neurotransmisor excitatorio en el SNC, y un nivel fisiológico de la actividad de receptores glutamatérgicos (principalmente tipo NMDA) es esencial para la función cerebral normal. La excitotoxicidad mediada por glutamato está considerada para jugar un rol crítico en la muerte neuronal observada en la EA y otras condiciones neurodegenerativas (Doble 1999).
Por lo tanto, la búsqueda de terapéuticas neuroprotectoras para la EA ha sido ampliamente basada en la hipótesis del amiloide. Una predicción explícita de esta hipótesis es que los componentes (aquellos que bloquean la formación del Aβ) pueden retrasar o incluso detener los cambios patológicos y así disminuir o poner fin a la emergencia de los síntomas clínicos. Sin embargo, no hay un soporte de datos clínicos debido a que los fármacos candidatos no han resultado para mostrar una eficacia terapéutica.
Para la determinación de la capacidad neuroprotectora se empleó Piper aduncum L. una planta leñosa perenne conocida también como "matico", de distribución pantropical, principalmente en América, Asia y el Pacífico del Sur (Ramos et al. 2003). Se le atribuyen propiedades antihemorrágica, astringente, analgésica, antiséptica, antirreumática, tónico, entre otras (Jantan et al. 2005).
De Piper aduncum se han descrito fenilpropanoides, flavonoides y derivados de ácido benzoico (Baldoqui et al. 1999), y se determinó su capacidad antioxidante (Ramos et al. 2008) e importancia como eventual fuente de nuevos antagonistas del factor de activación plaquetario, involucrado en reacciones alérgicas, inflamación, etc. (Jantan et al. 2005). Además, P. aduncum fue evaluado para la reducción y captura de radicales libres e inhibición in vitro de la peroxidación lipídica (Ramos et al. 2003). Por lo tanto, si bien no hay estudios específicos de actividad neuroprotectora, indicios de su capacidad antioxidante y antiinflamatoria permiten evaluar su potencial rol neuroprotector.
La metodología utilizada comprende: viabilidad celular frente al péptido Aβ1-42 mediante el bioensayo MTT (metil-tiazoltetrazolio), usado ampliamente para medir la sobrevivencia celular (Vistica et al. 1991); evaluación de niveles de caspasa-3 (involucrado en la apoptosis celular) por western blot; determinación de la presencia de receptores NMDA en sinapsis (homeostasis neuronal) mediante inmunocitoquímica; y registro de niveles de calcio intracelular (niveles aumentados están implicados en la excitotoxicidad celular).
Por ello, el objetivo general del presente trabajo fue evaluar el efecto neuroprotector del extracto hidroalcohólico de Piper aduncum en neuronas hipocampales sometidas al péptido amiloide y agonista NMDA como agentes injuriantes.
Material y métodos
Material biológico.- Las muestras de Piper aduncum L. "matico" fueron recolectadas en el distrito de Huariaca, provincia de Cerro de Pasco, región Pasco. Se utilizaron las hojas las cuales fueron enjuagadas y secadas en sombra para luego ser pulverizadas. Las muestras se procesaron en solución hidroalcohólica (90%) en diez veces su volumen (1:10) durante una semana a temperatura ambiente. Los extractos fueron concentrados en rotaevaporador para remover el solvente, luego se liofilizaron y almacenaron en el desecador hasta su utilización.
Arroyo et al. (2012) reportaron que el extracto hidroalcohólico de P. aduncum produce una disminución del marcador de estrés oxidativo y presenta efecto protector frente a la cirrosis hepática inducida en ratas. Además, otros estudios indican una no toxicidad in vitro (sin daño al ADN y baja toxicidad aguda) del extracto etanólico crudo de las partes aéreas de P. aduncum (Santin et al. 2011). Por el contrario, según Passos et al. (2012) el extracto alcohólico P. aduncum muestra efecto antioxidante sugiriendo como fuente de antioxidantes de potencial reemplazo a partir de extracto vegetal.
Cultivo de neuronas hipocampales.- Ratas Sprague Dawley fueron tratadas de acuerdo a las guías éticas de manejo y cuidado de animales de experimentación. Ratas preñadas de 18 días fueron anestesiadas en una cámara con CO2 y sacrificadas por dislocación cervical. Luego se removieron los fetos y fueron rápidamente decapitados para disecar el hipocampo. Las neuronas obtenidas fueron sometidas a disociación mecánica y enzimática (con tripsina al 0,25%) para luego ser sembradas a una densidad de 400 000 células/mL en placas de 35 mm recubiertas con poli-L-lisina (0,25% P/V). Los cultivos fueron mantenidos a 37 ºC y 5% CO2 en incubador con CO2y humedad controlados (NUAIRE), y el medio fue reemplazado cada 3 días.
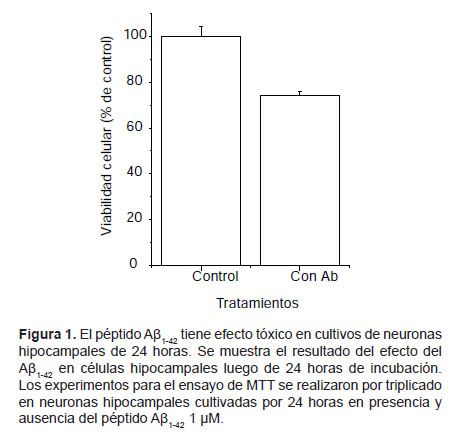
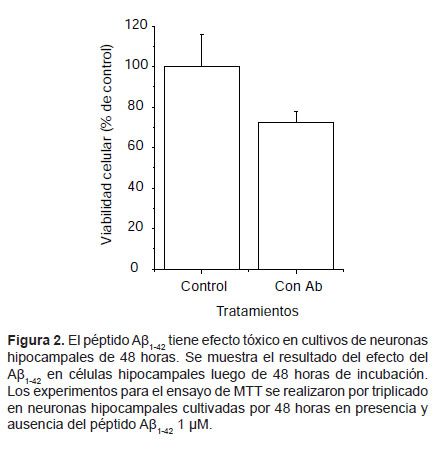
Evaluación de la viabilidad celular en cultivos tratados con el péptido β-amiloide.- El MTT (3-(4,5- dimetiltiazol-2-ilo)-2,5-difeniltetrazol o tetrazolio) amarillo es reducido a formazan púrpura en la mitocondria de células vivas. Brevemente, neuronas hipocampales de 10-13 días in vitro (10-13 DIV) fueron tratadas con agregados del péptido Aβ1-42 1 μM durante 24 y 28 h para evaluar su efecto en procesos agudo y crónico respectivamente. Luego se agregó el reactivo de MTT 1X (0,5 mg/mL), incubando la reacción 30 minutos a 37 ºC. Posteriormente se lisaron las neuronas y se disolvió el colorante con isopropanol. El volumen total del lisado fue traspasado a una placa de pocillos para la medición de sus absorbancias a 550 nm y 650 nm (en lector de placas NOVOSTAR). Los valores obtenidos fueron graficados como unidades D.O. y presentados como porcentaje del control.
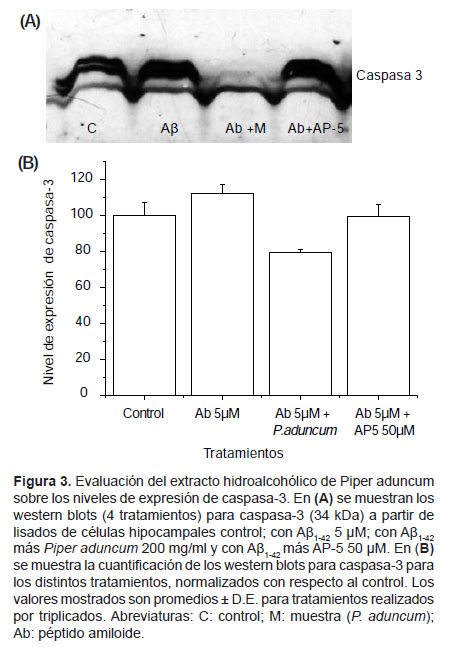
Expresión de caspasa-3.- Se incubaron células hipocampales (10-13 DIV) según los siguientes tratamientos: con medio control, con el péptido Aβ1-42 5 μM, con el péptido Aβ1-42 más el extracto de P. aduncum 200 mg/mL (al 10% del volumen final), y con el péptido Aβ1-42 más el AP-5 50 μM como referencia positiva, todos por 24 h. Las células fueron lisadas para liberar el contenido total y así determinar los niveles de la proteína caspasa-3 (34 Kd) mediante western blot que a continuación se resume. Se preparó el gel separador (acrilamida 30%, buffer de separación 2,5 mL, agua destilada 0,8 mL, TEMED 10 μL, persulfato de amonio 12,5%) y gel concentrador (acrilamida 30%, buffer concentración 1,5 mL, agua destilada 0,9 mL, TEMED 7 μL, persulfato de amonio 12,5%). La transferencia de proteínas se realizó desde el gel a una membrana de nitrocelulosa a amperaje constante a 250 mA, 90 minutos. Se procedió a incubación con anticuerpo primario monoclonal anti-caspasa-3 (diluido 1:500 en leche descremada al 5%) por toda la noche. Se recuperó el anticuerpo primario y la membrana se incubó con anticuerpo secundario anti-conejo IgG-HRP (diluido 1:2500 en leche) durante 1 h. Finalmente, en cuarto oscuro se colocó un film sobre la membrana y el conjunto se llevó dentro de un casette por 3 minutos, para luego pasar el film en solución de revelado y de fijado. Se registraron las manchas del film (por scanner) y mediante software libre ImageJ v14.3 (http://rsb.info.nih.gov/ij/) se evaluó los niveles de expresión de caspasa-3.
Inmunocitoquímica, niveles de expresión de R-NMDA sinápticos.- Los tratamientos fueron células con: medio de cultivo (control), el Aβ1-42 1 μM y el Aβ1-42más el extracto extracto de P. aduncum 200 mg/mL a una dilución 1:500. Todas las condiciones fueron incubadas durante 1h. Brevemente, neuronas hipocampales crecidas en cubreobjetos (10-13 DIV) fueron fijadas en paraformaldehído al 4% en PBS por 30 minutos y permeabilizadas con tritón X-100 (0,3% en PBS) por 15 minutos. Luego se bloqueó por 1 h con suero de caballo con el fin de disminuir la inmunoreactividad no específica, para luego incubar los distintos anticuerpos primarios durante 12 h. Los anticuerpos utilizados fueron anti-SV2 (proteína asociada a vesícula sináptica, 1:200), anti-NR1 (subunidad del receptor NMDA, 1:500). Se enjuagó con PBS y se incubó con anticuerpos secundarios anti-ratón conjugados con FITC (fluorescencia isotiocianato, 1:100) para NR1 y anti-conejo conjugado con Cy3 (1:200) para SV2. Finalmente, los cultivos fueron cubiertos con medio de montaje para preservar la señal fluorescente. Las imágenes obtenidas por microscopía confocal (Nikon, Eclipse) fueron procesadas mediante el software libre ImageJ v14.3 para analizar la cantidad de puntos fluorescentes para los canales rojo (SV2) y verde (NR1).
Medición de las transitorias de calcio intracelular
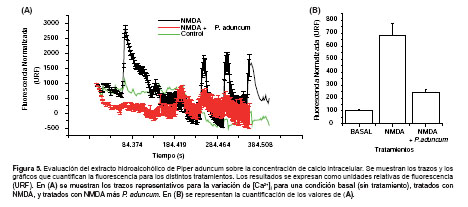
Microscopía y análisis de fluorescencia para FLUO-4.-Los tratamientos consistieron en baterías de soluciones NMDA de 0,1 μM, 10 μM, 100 μM y 1 mM; la misma batería NMDA más el extracto (dilución 1:500 de 200 mg/mL) y neuronas con solución externa normal (control).
Neuronas hipocampales crecidas en cubreobjetos (10-13 DIV) fueron cargadas por 30 minutos a 37 ºC con la sonda fluorescente Fluo-4 AM (0,5% en solución externa normal), la cual al ingresar a la célula pierde su grupo AM uniéndose al calcio y actuando como indicador de las variaciones intracelulares en células vivas. Las células fueron lavadas y montadas en una cámara de perfusión, luego llevadas al microscopio invertido Nikon (Eclipse TE, Nikon) equipado con lámpara de Xenón y rueda de filtros controlada por el software Axon Workbench 2.2. Las neuronas se localizaron por microscopía de contaste de fase para luego ser observados bajo fluorescencia. Se seleccionaron diferentes regiones de interés (ROIs) correspondientes a regiones somáticas. Se determinó y analizó los registros de variación para los niveles de calcio intracelular en los distintos tratamientos.
Análisis de datos.- Los datos fueron estimados usando ANOVA, y según los casos fueron analizados, registrados y graficados usando el programa estadístico ORIGIN 6.0. (Microcal, Inc. Northampton, MA, USA, versión 1.0.0.1). Los datos son presentados como el promedio ± la desviación estándar (D.E.) con p<0,05 considerado estadísticamente significativo.
Resultados
Actividad del péptido amiloide Aβ1-42 en cultivos de neuronas hipocampales.- En neuronas hipocampales incubadas con el péptido Aβ1-42 por 24 h se observó una disminución del 26% en la viabilidad celular comparado con células control (Fig. 1). En células hipocampales incubadas con el péptido Aβ1-42 por 48 h, hay una disminución del 27% en el porcentaje de viabilidad celular comparada con células control (Fig. 2).
Efecto de Piper aduncum sobre los niveles de expresión de caspasa-3.- En cultivos tratados con el péptido Aβ1-42 se observa un incremento de 12,4% en los niveles de caspasa-3. En cultivos incubados con el Aβ1-42 más P. aduncum, hay una reducción del 20,6% de caspasa-3. Los cultivos incubados con Aβ1-42 más AP-5 presentan prácticamente los mismos resultados que el control (Fig. 3).
Efecto de Piper aduncum en el restablecimiento de la alteración de la homeostasis celular.- Con el fin de averiguar si el extracto hidroalcohólico de Piper aduncum posee la capacidad de inhibir y/o atenuar la disminución de R-NMDA sinápticos en neuronas hipocampales inducidos por el Aβ, se llevó a cabo la prueba inmunocitoquímica para evaluar los niveles de expresión del R-NMDA en sinapsis.
Expresión de receptores NMDA sinápticos en células hipocampales.- En células control tratadas sólo con su propio medio de cultivo, se observa una distribución de R-NMDA en densidades sinápticas, lo cual refleja un parámetro de homeostasis neuronal. Los resultados muestran una distribución homogénea en la co-expresión de ambos marcadores, esto es R-NMDA (marcado para la subunidad NR1) en sinapsis (marcado para SV2) (Fig. 4 a-c).
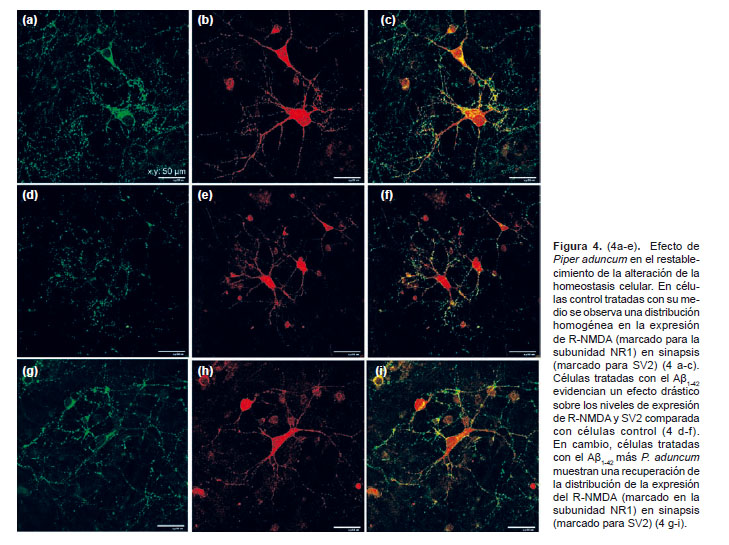
Inhibición de receptores sinápticos NMDA en células hipocampales tratadas con Aβ1-42.- Para el receptor NMDA (subunidad NR1), las células tratadas con el Aβ1-42 presentan una drástica disminución de un 75,5% en la distribución de su fluorescencia respecto al control. Esto es concordante con hallazgos previos sobre el efecto del péptido amiloide en la distribución del R-NMDA (Fig. 4 d-f). Éstos resultados evidencian efecto del Aβ1-42 sobre los niveles de R-NMDA y SV2. La disminución de la inmunoreactividades es más evidente en células marcadas para R-NMDA comparado con SV2.
Evaluación del extracto hidroalcohólico de Piper aduncum sobre la inhibición de receptores sinápticos NMDA en células hipocampales tratadas con Aβ1-42.- En cambio, células co-incubadas con el Aβ1-42 más P. aduncum presentan un aumento del 9,6% para R-NMDA, evidenciando no sólo una reversión del efecto del Aβ1-42 sobre la disminución de R-NMDA, sino también un ligero aumento en su distribución con respecto al control (Fig. 4 g-i).
Para el caso de la proteína sináptica SV2, células tratadas con el Aβ1-42 presentan una disminución del 34,7% en la distribución de la inmunoreactividad respecto al control. Además, los tratamientos con P. aduncum mostraron una recuperación del 20,86% respecto a las tratadas con el amiloide. Asimismo, en células tratadas con Aβ1-42 y P. aduncum se observa una recuperación del 60,12% respecto a las tratadas sólo con Aβ1-42 para llegar al nivel control.
Los resultados muestran una normalización en la distribución de la expresión del R-NMDA (marcado en la subunidad NR1) en sinapsis (marcado para SV2). Es evidente una distribución homogénea en la co-expresión de ambos marcadores comparada al tratamiento control. Esto indicaría una inhibición, por parte del extracto, de los efectos del péptido Aβ1-42 sobre los R-NMDA en procesos sinápticos en neuronas hipocampales.
Evaluación de Piper aduncum en la sobreestimulación del influjo de calcio.- Se muestran trazos representativos para la variación de los niveles [Ca2+]i. Se observa que células tratadas con NMDA presentan una intensidad de fluorescencia aumentada en un 582,6% comparado con el nivel basal. En cambio, células tratadas con NMDA mas P. aduncum muestran una reducción de la intensidad de fluorescencia en un 74,95% respecto a las tratadas con NMDA (para llegar a un nivel basal) (Fig. 5).
Discusión
Neuroprotección de Piper aduncum frente al Aβ1-42 y a la excitotoxicidad por NMDA.- Se observa una disminución de la viabilidad celular para las 24 y 48 h de incubación con el péptido Aβ1-42. Esto es compatible con otros estudios que muestran la toxicidad del péptido agregado en cultivos neuronales (Lorenzo et al. 2000, Ueeda et al. 1994), además corrobora el efecto citotóxico del amiloide para cumplir un rol relevante en procesos neurodegenerativos (Deshpande et al. 2006).
Está reportado que caspasa-3 causa disfunción sináptica en un modelo de la EA, lo cual le sindica como potencial blanco para una terapia farmacológica durante estadios tempranos de la enfermedad (D’Amelio et al. 2011). En relación a ello, los resultados muestran que células tratadas con el péptido Aβ1-42 presentan un incremento en los niveles de caspasa-3. Sin embargo, en células tratadas con el Aβ1-42 más el extracto hidroalcohólico de P. aduncum, los niveles de caspasa-3 se reducen significativamente. Esto podría indicar una posible alteración de P. aduncum en las vías de expresión de caspasa-3 inducida por Aβ1-42.
Dado a que AP-5 como antagonista del R-NMDA puede inhibir la excitoxicidad, se quiso determinar si también mostraba disminución de los niveles de caspasa-3. Sin embargo, células hipocampales co-incubadas con Aβ1-42 y AP-5 no mostraron variación alguna de los niveles de caspasa-3 respecto al control. Esto podría deberse a la diferencia del tiempo de incubación y el tipo de células ensayadas.
La EA está correlacionada con la disminución de proteínas sinápticas como la SV2 (específica para vesículas secretoras en neuronas) mientras que la regulación dinámica de R-NMDA (expresados altamente en el hipocampo) contribuye a los procesos sinápticos (Scott et al. 2004). Debido a ello nos propusimos evaluar el efecto del extracto hidroalcohólico de P. aduncum sobre la expresión de R-NMDA durante sinapsis en cultivos hipocampales tratados con el péptido amiloide Aβ1-42. De los resultados, neuronas hipocampales controles muestran una distribución típica del R-NMDA en sitios sinápticos, lo cual está acorde con lo descrito en condiciones normales de homeostasis neuronal (Snyder et al. 2005); neuronas tratadas con el péptido Aβ1-42 presentan una marcada disminución del R-NMDA y de la proteína sináptica SV-2, lo cual sugiere una alteración de la distribución de los niveles de R-NMDA en regiones sinápticas. Además, el porcentaje relativo de R-NMDA afectados es mayor que la proteína SV-2, lo cual le asignaría una actividad al péptido Aβ1-42 sobre el R-NMDA; y neuronas hipocampales incubadas con el péptido Aβ1-42 más el extracto hidroalcohólico de P. aduncum, presentan una recuperación en la distribución tanto para el R-NMDA como para SV-2.
De acuerdo a los resultados obtenidos se puede inferir que el extracto hidroalcohólico de P. aduncum responde significativamente en el restablecimiento de la inhibición del péptido Aβ1-42 sobre la distribución de R-NMDA en sinapsis. Esto indicaría una posible inhibición por parte del extracto de los efectos del péptido Aβ1-42 sobre los R-NMDA en procesos sinápticos en neuronas hipocampales.
Los R-NMDA sobreactivados por estimulación prolongada constituyen una de las mayores rutas de la excesiva entrada de calcio en las neuronas por lo que pueden ser responsables del daño neuronal. De los resultados se observa que neuronas tratadas con el agonista sintético NMDA resultan en un aumento significativo en la intensidad de fluorescencia para los niveles de calcio intracelular. Esto concuerda respecto a estudios que indican que iones Ca2+ entran a las neuronas a través de varias vías en los que R-NMDA activados constituyen una de las mayores rutas del excesivo influjo, lo cual a su vez puede conllevar a cambios en la plasticidad sináptica (Yu et al. 2010). Sin embargo, éstos valores disminuyen significativamente (sin llegar al nivel basal) cuando las neuronas son tratadas con NMDA más P. aduncum, lo cual evidencia una tendencia de P. aduncum hacia el restablecimiento de la homeostasis del calcio celular. Esto potencialmente podría traducirse en un efecto protector, posiblemente por modulación de la actividad de canales de calcio, por antagonismo de receptores excitatorios y/o por quelación del Ca2+.
Estudios similares muestran la toxicidad inducida por glutamato en cultivos neuronales, y cómo principios activos ejercen actividad neuroprotectora (Godkar et al. 2004), sugiriendo una protección contra la excitotoxicidad celular por glutamato.
Por lo tanto, Piper aduncum muestra efecto neuroprotector para el modelo de neurodegeneración presentado. Se corrobora los efectos citotóxicos del péptido Aβ;1-42 en neuronas hipocampales; y el efecto protector de P. aduncum frente a paradigmas de daño neuronal inducido por el péptido amiloide como la disrupción de la homeostasis neuronal (por inhibición del R-NMDA sinápticos) y la apoptosis neuronal (por elevación de niveles de caspasa-3); además del incremento de calcio intracelular (por sobreestimulación de receptores excitatorios). Es decir, existe la posibilidad de un potencial rol inhibidor de mecanismos que alteran la comunicación sináptica, perjudicial para la célula neuronal.
Finalmente, ciertos AINEs han sido sugeridos para retrasar la progresión de la EA basado en evidencias epidemiológicas (Weggen et al. 2007), sin embargo, en recientes ensayos clínicos no han mostrado protección alguna. De allí que surge la necesidad del desarrollo de alternativos a los AINEs convencionales, que muestren efectividad en la reducción del daño oxidativo, pérdida de marcadores sinápticos y deposición del Aβ, evitando el daño y muerte neuronal.
Agradecimientos
Al Fondo de Promoción de Trabajo de Tesis de Pregrado del Vicerrectorado de Investigación de la Universidad Nacional Mayor de San Marcos por el apoyo otorgado a César Zaa para la realización de su Tesis. Al CONCYTEC por la subvención brindada para una estadía en el Laboratorio de Neurofisiología, Facultad de Ciencias Biológicas, Universidad de Concepción, Chile; al Dr. Luis G. Aguayo del Laboratorio de Neurofisiología, Facultad de Ciencias Biológicas, Universidad de Concepción, Chile por su facilidad y apoyo brindados.
Literatura citada
Arroyo J., Y. Almora, M. Quino et al. 2012. Efecto protector en cirrosis hepática inducida en ratas del extracto etanólico de las hojas de Piper aduncum comparado con silimarina. Anales de la Facultad de medicina. 73(2): 85-91 [ Links ]
Baldoqui D.C., M.J. Kato, A.J. Cavalheiro, et al. 1999. A chromene and prenylated benzoic acid from Piper aduncum. Phytochemistry. 51: 899 – 902. [ Links ]
Craig-Schapiro R., A.M. Fagan & D.M. Holtzman. 2009. Biomarkers of Alzheimer's disease. Neurobiology of Disease. 35: 128 – 140. [ Links ]
D’Amelio M., V. Cavallucci, S. Middei, et al. 2011. Caspase-3 triggers early synaptic dysfunction in a mouse model of Alzheimer’s disease. Nature Neuroscience. 14(1): 69 – 78. [ Links ]
Deshpande A., E. Mina, Ch. Glabe, et al. 2006. Different Conformations of Amyloid β Induce Neurotoxicity by Distinct Mechanisms in Human Cortical Neurons. The Journal of Neuroscience. 26(22): 6011 – 6018. [ Links ]
Doble A. 1999. The Role of Excitotoxicity in Neurodegenerative Disease: Implications for Therapy. Pharmacology & Therapeutics. 81(3): 163 – 221. [ Links ]
Godkar P.B., R.K. Gordon, A. Ravindran, et al. 2004. Celastrus paniculatus seed water soluble extracts protect against glutamate toxicity in neuronal cultures from rat forebrain. Journal of Ethnopharmacology. 93: 213 – 219. [ Links ]
Jantan I., I.A.A. Rafi & J. Jalil. 2005. Platelet-activating factor (PAF) receptor-binding antagonist activity of Malaysian medicinal plants. Phytomedicine. 12: 88 – 92. [ Links ]
Klafki H.W., M. Staufenbiel, J. Kornhuber, et al. 2006. Therapeutic approaches to Alzheimer’s disease. Brain. 129: 2840 – 2855. [ Links ]
Li S., G.M. Shankar & D.J. Selkoe. 2010. How do soluble oligomers of amyloid β-protein impair hippocampal synaptic plasticity? Frontiers in Nellular Neuroscience. 4(5):1 – 2. [ Links ]
Lorenzo A., M. Yuan, Z. Zhang, et al. 2000. Amyloid β interacts with the amyloid precursor protein: a potential toxic mechanism in Alzheimer’s disease. Nature Neuroscience. 3(5): 460 – 464. [ Links ]
Liu M.Ch., F. Kobeissy, W. Zheng, et al. 2011. Dual vulnerability of tau to calpains and caspase-3 proteolysis under neurotoxic and neurodegenerative conditions. ASN NEURO. 3(1): 25 – 36. [ Links ]
Passos L., H. de O. Silva, L. Silva et al. 2012. Evaluation of antioxidant activity and chromatographic profile of extracts from the false jaborandi (Piper aduncum). Revista Eletrônica em Gestão, Educação e Tecnologia Ambiental. 6(6): 1248-1260 [ Links ]
Pellistri F., M. Bucciantini, A. Relini, et al. 2008. Nonspecific Interaction of Prefibrillar Amyloid Aggregates with Glutamatergic Receptors Results in Ca2+ Increase in Primary Neuronal Cells. The Journal Of Biological Chemistry. 283(44): 29950 – 29960. [ Links ]
Pérez-Otaño I. & M.D. Ehlers. 2005. Homeostatic plasticity and NMDA receptor trafficking. TRENDS in Neurosciences. 28(5): 229 – 238. [ Links ]
Ramos A., A. Visozo, J. Piloto, et al. 2003. Screening of antimutagenicity via antioxidant activity in Cuban medicinal plants. Journal of Ethnopharmacology. 87: 241 – 246. [ Links ]
Ramos M., D.F. Ramos, C.M. Remsberg, et al. 2008. Identification of Polyphenols and Anti-Oxidant Capacity of Piper aduncum L. The Open Bioactive Compounds Journal. 1: 18 – 21. [ Links ]
Santin J., A. Silveira, E. Muller, V. D. Claudino et al. 2011. Evaluation of the acute toxicity, genotoxicity and mutagenicity of ethanol extract of Piper aduncum. Journal of Medicinal Plants Research. 5(18): 4475-4480 [ Links ]
Scott D.B., I. Michailidis, Y. Mu, et al. 2004. Endocytosis and Degradative Sorting of NMDA Receptors by Conserved Membrane-Proximal Signals. The Journal of Neuroscience. 24(32): 7096 – 7109. [ Links ]
Snyder E.M., Y. Nong, C.G. Almeida, et al. 2005. Regulation of NMDA receptor trafficking by amyloid- β. Nature Neuroscience. 8(8): 1051 – 1058. [ Links ]
Stéphan A., S. Laroche & S. Davis. 2001. Generation of Aggregated β-Amyloid in the Rat Hippocampus Impairs Synaptic Transmission and Plasticity and Causes Memory Deficits. The Journal of Neuroscience. 21(15): 5703 – 5714. [ Links ]
Ueeda K., Y. Fukui & H. Kageyama. 1994. Amyloid β protein-induced neuronal cell death: neurotoxic properties of aggregated amyloid β protein. Brain Research. 639: 240 – 244. [ Links ]
Vistica D., P. Skehan, D. Scudiero, et al. 1991. Tetrazolium-based Assays for Cellular Viability: A Critical Examination of Selected Parameters Affecting Formazan Production. Cancer Research. 51: 2515 – 2520. [ Links ]
Weggen S., M. Roger & J. Eriksen. 2007. NSAIDs: small molecules for prevention of Alzheimer’s disease or precursors for future drug development? TRENDS in Pharmacological Sciences. 28(10): 536 – 543. [ Links ]
Yu X.M., B.R. Groveman, X.Q. Fang, et al. 2010. The role of Intracellular Sodium (Na+) In the regulation of calcium (Ca2+)-mediated signaling and toxicity. Health. 2(1): 8 – 15. [ Links ]
Correspondencia: Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos, Ciudad Universitaria, Av. Venezuela Cdra. 34 s/n. Apartado 110058, Lima 11, Perú.
Email: César Zaa: aalcesarzl@hotmail.com
Martha Valdivia: marthavaldiviacuya@gmail.com
Álvaro Marcelo: alvaromarcelo@hotmail.com
Presentado:11/06/2012
Aceptado: 13/10/2012
Publicado online: 15/01/2013