Introducción
Los estudios sobre ecología espacial de la fauna son esenciales para entender aspectos clave como la historia natural de las especies, el uso de recursos y las interacciones intraespecíficas, todos ellos relevantes para su conservación y manejo (González-Borrajo et al. 2017, Fletcher et al. 2018). Dentro de la ecología espacial, se destacan tres componentes interrelacionados: el ámbito de hogar, la preferencia de hábitat y los patrones de actividad (Fletcher et al. 2018). El ámbito de hogar se refiere al área en la cual un individuo realiza sus funciones ecológicas, que incluyen alimentación, descanso, exploración, refugio y reproducción, y los desplazamientos máximos que realiza para cumplir estas funciones (Powell 2000). Por su parte, la preferencia de hábitat indica los recursos y condiciones necesarios para la supervivencia y reproducción de la especie a largo plazo (Montenegro & Acosta 2008). Finalmente, los patrones de actividad responden a variables tanto abióticas (como luminosidad y temperatura) como bióticas (distribución y abundancia de recursos) (Frey et al. 2017). Es crucial comprender la ecología espacial de mamíferos endémicos y poco estudiados para garantizar su conservación (Cossíos et al. 2012).
El zorro de Sechura, Lycalopex sechurae (Thomas, 1900) es un carnívoro endémico que habita en el desierto de Sechura y el Bosque Tropical Estacionalmente Seco del noroeste de Perú y suroeste de Ecuador (Cossíos 2010). Se trata de una especie generalista, omnívora y de actividad principalmente catemeral (activa a lo largo de las 24 horas del día), aunque con mayor actividad nocturna (Asa & Wallace 1990, Cossíos 2010). Lycalopex sechurae ha sido registrado en diversos tipos de hábitats, incluidos desiertos, humedales costeros, matorrales, bosques secos de llanura y colina, bosques secos interandinos e incluso en campos de cultivo cercanos a áreas rurales (Cossíos 2010, García-Olaechea et al. 2021). A pesar de ser una especie relativamente común, está categorizada como Casi Amenazada a nivel internacional (Cossíos 2017), y aún se desconocen aspectos de su historia natural, como su ámbito de hogar y preferencia de hábitat (Cossíos et al. 2012).
En Perú, L. sechurae se distribuye únicamente en dos de las 11 ecorregiones: el Bosque Seco Tumbesino (o Bosque Tropical Estacionalmente Seco) y el Desierto Costero (Cossíos 2010). En el Desierto Costero, este cánido habita tanto zonas de humedales como áreas completamente áridas, lo que motivó la selección de dos localidades representativas para este estudio: los Manglares de San Pedro de Vice (MSPV) y la Reserva Nacional Illescas (RNI). El MSPV es un humedal compuesto por bosque de mangle, bosque seco, totorales y la desembocadura de un río (Charcape & Moutarde 2005), mientras que la RNI es una zona árida, con escasez de agua y predominio de matorral desértico (SERNANP 2021).
Estudios previos sobre los patrones de actividad de esta especie en el desierto de Sechura se llevaron a cabo mediante cámaras trampa y collares de VHF (Asa & Wallace 1990, García-Olaechea & Hurtado 2020). Sin embargo, el uso de cámaras trampa presenta una limitación, ya que su ubicación fija puede no coincidir con las áreas de mayor actividad de los individuos estudiados (Frey et al. 2017). De manera similar, la telemetría tradicional puede inducir comportamientos atípicos en los animales debido a la presencia del investigador (Fuller & Fuller 2012). Para reducir estas limitaciones, en este estudio se utilizaron collares de GPS con acelerómetros, que permiten detectar si el individuo está activo o no y proporcionan datos de ubicación sin sesgo por intervención humana. Esto facilita, además, el cálculo preciso del ámbito de hogar y la preferencia de hábitat (Fuller & Fuller 2012).
La información obtenida mediante estos collares de GPS será fundamental para futuros estudios ecológicos y contribuirá a las actividades de manejo y conservación L. sechurae (Fuller & Fuller 2012). Por lo tanto, los objetivos del presente estudio fueron determinar el ámbito de hogar, la preferencia de hábitat y los patrones de actividad del zorro de Sechura en dos localidades del desierto de Sechura.
Material y métodos
Área de estudio. El estudio se realizó en dos localidades del desierto de Sechura en el noroeste del Perú, en los Manglares de San Pedro de Vice (MSPV; 5°32’10”S, 80°52’33”W) y en la Reserva Nacional de Illescas (RNI; 5°57’35”S, 81°07’13”W; Fig. 1).
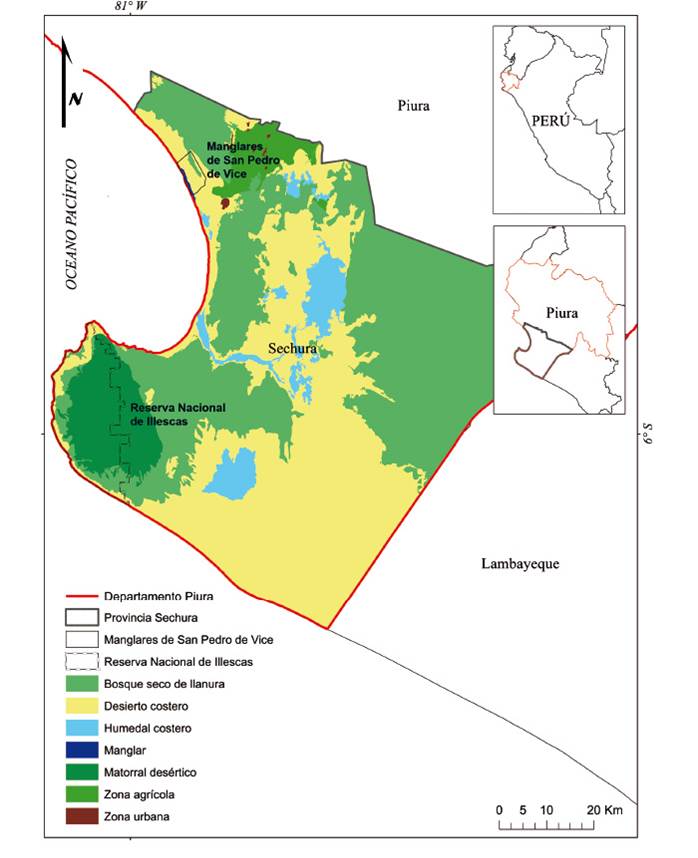
Figura 1 Área de estudio donde se muestran los Manglares de San Pedro de Vice y la Reserva Nacional de Illescas. Además, se representan las principales formaciones vegetales de la Provincia de Sechura, Piura.
El MSPV es un Humedal Ramsar que tiene una extensión de 3013 ha y presenta siete formaciones vegetales (TRCW 2010): a) bosque seco formado por árboles de algarrobo (Neltuma pallida y Prosopis juliflora), b) un matorral desértico con sapotes (Morisonia scabrida) y faiques (Vachellia macracantha) dispersos en monticulos arenosos, c) el gramadal formado principalmente por grama salada (Distichlis spicata) con algunos algarrobos dispersos, d) el totoral formado por totoras (Scirpus maritimus) y eneas (Typha angustifolia), e) los manglares formado por dos especies de mangle (Laguncularia racemosa y Avicennia germinans) dispuestos a ambos lados del canal de marea, f) un canal de marea con sus orillas inundables de acuerdo al régimen de mareas y f) una playa arenosa que colinda con el mar. La elevación media es de 5 m y se caracteriza por un clima seco con precipitaciones muy escasas (menos de 50 mm/año). La temperatura media anual es de 26 °C (TRCW 2010).
La RNI es un área natural protegida marino-costera con una extensión de 36550.70 ha y presenta seis formaciones vegetales (SERNANP 2021): a) bosque seco caracterizado por abundantes algarrobos (N. pallida) a ambos lados de las quebradas, b) bosque seco ralo de llanura caracterizado por algarrobos y sapotes (M. scabrida) dispersos, c) matorral desértico caracterizado por sapotes, faiques (Vachellia macracantha) achaparrados y algarrobos dispersos, d) matorral seco caracterizado por escaza vegetación en el macizo de algarrobos y sapotes dispersos y achaparrados, e) sin vegetación con dispersas gramíneas y f) playa arenosa que colinda con el mar. La elevación media es de 12 m, también se caracteriza por un clima seco y la temperatura media anual es de 25 °C (SERNANP 2021).
Captura e inmovilización. El procedimiento de captura, inmovilización y liberación estuvo alineado con las directrices de la Sociedad Americana de Mastozoólogos (Gannon & Sikes 2007). Se realizó en marzo y julio del 2021 en el MSPV y en marzo del 2022 en la RNI.
En cada localidad se colocaron estratégicamente 10 trampas tipo Tomahawk (45 cm × 45 cm × 110 cm) y 10 trampas de tipo cepo (Victor Soft Catch 1½ Oneida) en senderos utilizados por mamíferos medianos (Luengos 2009, Tellaeche 2015). Las trampas Tomahawk incluyeron un compartimiento adyacente que contenía un pollo vivo de aproximadamente 250 g. Las trampas se revisaron auditivamente cada 2 o 3 horas utilizando transmisores de VHF conectados a cada trampa, y empleando una antena de telemetría y un receptor (ATS©, modelo R410). Estos transmisores cuentan con un pin metálico que es retirado de su posición al activarse la trampa, emitiendo con mayor intensidad una señal de VHF (“beeps”), lo que indica que una trampa ha sido activada y consecuentemente se procede a su verificación visual. Los individuos de L. sechurae fueron inmovilizados utilizando Ketamina (100 mg/mL), Dexmedetomidina (0.5 mg/mL), Midazolam (5 mg/mL) y una reversión parcial con Atipamezol (5 mg/mL) (Sánchez et al. en prep.). Se registraron medidas corporales, peso, sexo y edad estimada. Antes de la liberación, a cada individuo se le colocó un collar GPS (e-Obs©, modelo 1A; Luengos 2009, Tellaeche 2015). Cada collar estuvo programado para registrar localizaciones cada 10 minutos cuando el individuo estaba activo y cada dos horas cuando estaba inactivo.
Telemetría. El tipo de collar utilizado permitía la descarga remota de los datos, utilizando la estación base (e-Obs©), a partir de aproximadamente 50 metros del animal. Este equipo permitió dos tipos de descarga: 1) búsqueda exhaustiva de individuos con antena de telemetría Yagui de tres elementos y la estación base para descarga, y 2) posicionando la estación base en posibles lugares de paso de los individuos durante varias noches. Una vez que los individuos se acercaban a la estación base, los datos del collar de GPS eran descargados automáticamente (e-Obs 2020). Los datos fueron: número de serie del collar, coordenadas geográficas de cada localización con la respectiva temperatura, fecha, hora y aceleración. Para efectos comparativos y no contar con diferencias estacionales, solo se utilizaron los datos de julio a octubre del 2021 en el MSPV y de julio a octubre del 2022 en la RNI.
Análisis de datos. El ámbito de hogar (AH) fue calculado usando dos métodos. Primero, el método de Polígono Mínimo Convexo (PMC), que consiste en el cálculo del polígono más pequeño que encierra todos los puntos de desplazamiento de cada individuo, cuyos ángulos internos son menores a 180° (Mohr 1947). Segundo, el estimador de densidad de Kernel (K), que consiste en estimar la densidad de probabilidad sobre cada registro espacial utilizando la cantidad obtenida de localizaciones sobre una grilla (Worton 1987, Burgman & Fox 2003). Para ambos casos se usaron datos al 50% (área núcleo) y 95% (excluyendo el 5 % de localizaciones). Utilizando los resultados del estimador de Kernel al 95%, la preferencia de hábitat se calculó a través del número de localizaciones obtenidas por cada una de las formaciones vegetales categorizadas, el cual fue expresado en porcentajes (Luengos 2009). Asimismo, se utilizó la Prueba exacta de Fisher, en la cual se tuvieron como variables las formaciones vegetales, zorros muestreados y localizaciones/hectáreas totales de las formaciones vegetales. Para los análisis se utilizó el paquete Rhr (Signer & Balkenhol 2015) del programa R (R Core Team 2022).
Para determinar el patrón de actividad se utilizaron únicamente los registros (i.e., horas) en que el GPS indicaba intervalos de 10 minutos (actividad de acuerdo con el acelerómetro). Para el análisis se utilizó las categorías de Gómez et al. (2005), siendo: diurno (< 10% de los registros en la oscuridad), nocturno (> 90% de los registros en la oscuridad), mayormente diurno (entre 10 y 30% de los registros en la oscuridad), mayormente nocturno (entre 70 y 90% de los registros en la oscuridad), crepuscular (50% de los registros durante la fase crepuscular). Los periodos de actividad entre las 8:00 am y las 5:59 pm fueron considerados diurnos; entre las 8:00 pm y las 5:59 am, nocturnos; y la entre las 06:00 am y las 07:59 am, y 6:00 pm y 7:59 pm crepusculares. Se consideraron individuos camerales a los individuos cuyos registros no cumplieron con las categorías anteriores y estuvieron activos durante la noche, el crepúsculo y en horas del día.
Resultados
Ámbito de hogar. Se registraron un total de 14612 localizaciones entre los cuatro individuos monitoreados, siendo Z1 y Z2 los del MSPV, y Z3 y Z4 los de la RNI. Todos los individuos capturados fueron hembras adultas. El ámbito de hogar varió con el método de PMC 95% desde 0.52 km2 hasta 23.5 km2 y con el de K95% varió desde 0.6 km2 hasta 25.13 km2 (Figs 2 y 3). Z1 y Z2 tuvieron un AH de por lo menos tres veces menor que los individuos de la RNI, y Z4 resalta por su notoriamente mayor AH en comparación con los otros individuos (Tabla 1). En promedio, el AH de los individuos del MSPV fue de 0.82 km2 con K95%, mientras que el AH de los individuos de la RNI fue de 14.34 km2 con K95%.
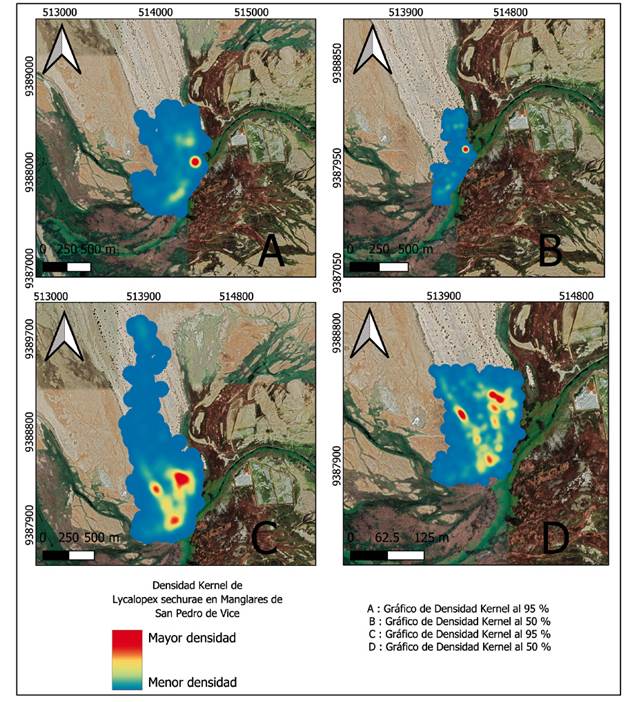
Figura 2 Ámbito de hogar de dos individuos hembras de Lycalopex sechurae en el Manglar de San Pedro de Vice. Se muestra con la metodología de Kernel, tanto al 50% (área núcleo) como al 95%.
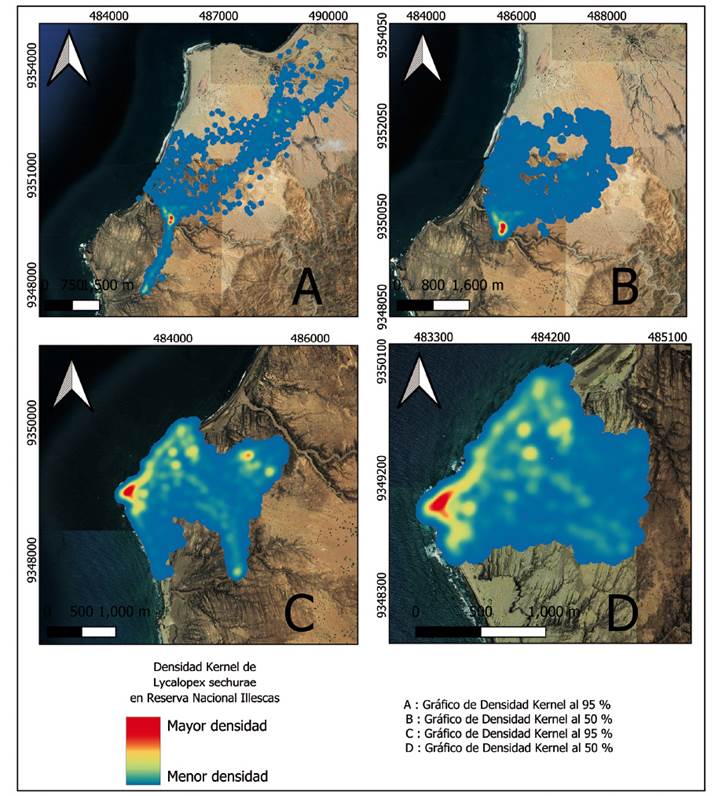
Figura 3 Ámbito de hogar de dos individuos hembras de Lycalopex sechurae en la Reserva Nacional de Illescas. Se muestra con la metodología de Kernel, tanto al 50% (área núcleo) como al 95%.
Tabla 1 Tamaño del ámbito de hogar en km2 de los 4 individuos de acuerdo con los métodos del Polígono Mínimo Convexo (PMC) y Kernel (K) al 50% y 95%. Z1 y Z2 son individuos del Manglar San Pedro de Vice, mientras que Z3 y Z4 son de la Reserva Nacional de Illescas.
| ID | Total de registros | PMC 50% Km2 | PMC 95% Km2 | K 50% Km2 | K 95% Km2 |
|---|---|---|---|---|---|
| Z1 | 1584 | 0.15 | 0.52 | 0.11 | 0.60 |
| Z2 | 4192 | 0.14 | 1.24 | 0.16 | 1.05 |
| Z3 | 3267 | 7.52 | 23.50 | 4.87 | 25.13 |
| Z4 | 5569 | 1.54 | 3.78 | 0.80 | 3.56 |
El área de solapamiento entre las hembras del MSPV fue estimada en 0.40 km2, lo que representa el 23.3% del área ocupada por Z1 y Z2; mientras el área para RNI fue estimada en 0.97 km2, lo que representa el 3.6% del área ocupada por Z3 y Z4 (Figura 4).
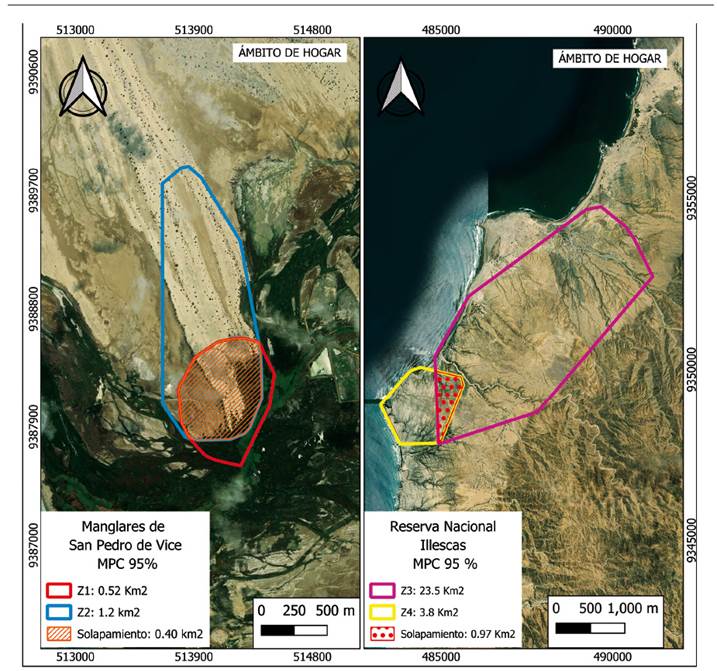
Figura 4 Solapamiento del ámbito de hogar con el método del PMC de cuatro hembras de Lycalopex sechurae en las dos localidades evaluados, el Manglar de San Pedro de Vice y la Reserva Nacional de Illescas.
Preferencia de hábitat. De las siete formaciones vegetales presentes en el MSPV, se obtuvieron localizaciones de Z1 y Z2 en el “bosque seco”, “matorral desértico” y “totoral”. De estas, la mayor cantidad de localizaciones se dieron en el “bosque seco” (54.8% y 76.1% registros, respectivamente), siendo la formación vegetal más utilizada que lo esperado por el azar (PEF= 335,084/100ha, p<0.001). De las seis formaciones vegetales en la RNI, se obtuvieron localizaciones de Z3 y Z4 en el “matorral desértico”, “matorral seco”, “bosque seco ralo de llanura”, “playa” y “sin vegetación”. De estas, la mayor cantidad de localizaciones fueron en “matorral desértico” (con 64.3% y 64.5% registros, respectivamente), siendo la formación vegetal más utilizada que lo esperado al azar (PEF=129,387/100ha, p<0.001) (Tabla 2).
Tabla 2 Porcentaje de localizaciones por tipo de formación vegetal para los cuatro individuos de Lycalopex sechurae. Z1 y Z2 son individuos del Manglar San Pedro de Vice, mientras que Z3 y Z4 son de la Reserva Nacional de Illescas. *representa significancia estadística.
| Tipo de formación vegetal | Z1 (%) | Z2 (%) | Z3 (%) | Z4 (%) |
|---|---|---|---|---|
| Bosque seco | 54.8* | 76.1* | - | - |
| Bosque seco ralo de llanura | - | - | 13.3 | 0.8 |
| Matorral desértico | 11.4 | 20 | 64.3* | 64.5* |
| Matorral seco | - | - | 18.5 | - |
| Totoral | 33.8 | 3.9 | - | - |
| Playa | - | - | 0.9 | 34.3 |
| Sin vegetación | - | - | 3 | - |
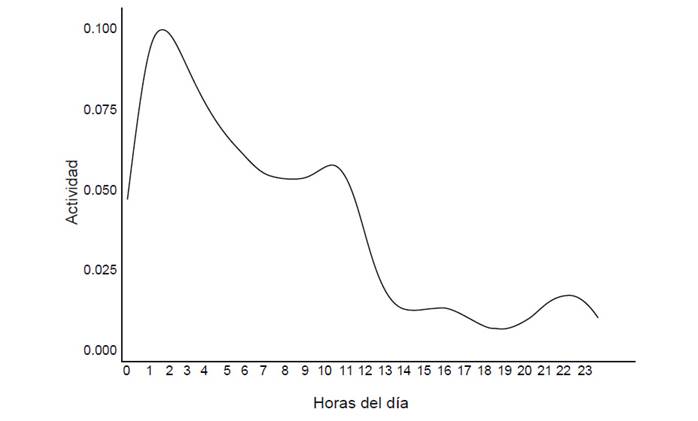
Patrones de actividad. Se registraron un total de 12898 registros de actividad (Z1: 1068, Z2: 3711, Z3: 2919 y Z4: 5200). Los individuos mostraron un patrón de actividad catemeral, es decir estuvieron activos durante las 24 horas del día, pero tuvieron mayor porcentaje de actividad en la noche. El 56.9% de registros fueron en la noche, el 30.84% fueron en el día y el 12.26% fueron en el crepúsculo (Fig. 5).
Discusión
Hasta donde conocemos, este es el primer estudio sobre el ámbito de hogar y la preferencia de hábitat de Lycalopex sechurae, abordando un vacío de información previamente señalado (Cossíos et al. 2012). Hemos confirmado que el patrón de actividad de esta especie es catemeral, con mayor actividad durante la noche, en concordancia con estudios previos (Asa & Wallace 1990, García-Olaechea & Hurtado 2020, Sánchez et al. 2023). Además, hallamos que el ámbito de hogar varía considerablemente entre las zonas de humedales y las zonas áridas extremas del desierto de Sechura.
El ámbito de hogar de los individuos del MSPV (Z1 y Z2) fue al menos 75% menor que el de los individuos de la RNI (Z3 y Z4). Asimismo, el solapamiento del ámbito de hogar entre los individuos del MSPV fue mayor que el de los de la RNI. Estas diferencias podrían estar relacionadas con la mayor disponibilidad de recursos alimenticios en el MSPV, en comparación con la RNI, donde los individuos deben recorrer mayores distancias para obtener los recursos necesarios (Charcape & Moutarde 2005, SERNANP 2021, Carrasco-Escudero et al. 2024). Aunque la diversidad de roedores, principales presas de L. sechurae, es mayor en la RNI, el MSPV tiene una mayor abundancia de presas y también de frutos, como el algarrobo y el sapote, lo que podría explicar las diferencias observadas (Charcape & Moutarde 2005, SERNANP 2021). Debido a que el solapamiento del ámbito de hogar representa solo un dato por localidad, sería necesario obtener un tamaño de muestra mayor para caracterizar claramente este aspecto sobre la ecología espacial de L. sechurae.
En cuanto a la preferencia de hábitat, observamos que las hembras en ambas localidades seleccionaron tipos de vegetación donde los recursos alimenticios son más abundantes. En el MSPV, los individuos Z1 y Z2 mostraron una preferencia por el bosque seco, mientras que, en la RNI, los individuos Z3 y Z4 seleccionaron el matorral desértico, donde se alimentaban de frutos de Marisonia scabrida (sapote), un recurso clave en su dieta (Cossíos 2010).
Nuestros resultados sobre el patrón de actividad son consistentes con estudios previos realizados mediante cámaras trampa y telemetría en el desierto de Sechura y en el Bosque Tropical Estacionalmente Seco (Asa & Wallace 1990, García-Olaechea & Hurtado 2020, Sánchez et al. 2023). El estudio con cámaras trampa de García-Olaechea y Hurtado (2020) fue también realizado en la RNI, habiendo concordancias a pesar de la diferente metodología empleada. Además, la consistencia con los resultados de Sánchez et al. (2023) en un remanente del Bosque Tropical Estacionalmente Seco en Perú, indican que este patrón catemeral podría ser común a lo largo de toda la distribución de la especie, independientemente del ecosistema. Aunque el estudio de Asa y Wallace (1990) no utilizó la misma clasificación de patrones de actividad, también encontraron una actividad predominantemente nocturna, lo que es coherente con nuestros hallazgos. Esta preferencia de L. sechurae por la actividad nocturna podría estar relacionada con la actividad nocturna de sus principales presas, los roedores (Cossíos 2010), pero tambien podría deberse a la necesidad de evitar las altas temperaturas diurnas, como se ha observado en el pecarí de labios blancos en el bioma del Pantanal brasileño (Peterson et al. 2023).
Cabe señalar que este estudio se centró en individuos hembras, ya que fueron las únicas capturadas. Al respecto debemos considerar que, en general, las hembras de la orden Carnívora tienden a tener ámbitos de hogar más pequeños que los machos (González-Borrajo et al. 2017), por lo que es probable que los machos de L. sechurae tengan ámbitos de hogar aún mayores. Además, este estudio se realizó durante la estación seca, lo que sugiere que el ámbito de hogar observado podría representar los desplazamientos máximos, asumiendo que, durante la estación húmeda, cuando los recursos son más abundantes, los individuos se desplacen menos (Richte & Ise 2005). Esta hipótesis debería ser evaluada en estudios futuros. Asimismo, sería relevante investigar el impacto de eventos de El Niño en el ámbito de hogar, la preferencia de hábitat y el patrón de actividad de L. sechurae. Por otro lado, observaciones con mayor número de individuos permitirán dar mayor solvencia a nuestro conocimiento del porcentaje de solapamiento y del ámbito de hogar de esta especie.
Nuestros resultados subrayan la importancia del bosque seco y el matorral desértico como formaciones vegetales clave para la supervivencia de L. sechurae en el desierto de Sechura. Además, demostramos que el ámbito de hogar varía en función de la disponibilidad de recursos y que los patrones de actividad son consistentes con los observados en otras ecorregiones y utilizando distintas metodologías. Estos hallazgos proporcionan una base valiosa para la comprensión de la ecología de L. sechurae y constituyen un punto de partida para futuras investigaciones y estrategias de conservación en el desierto de Sechura y otros ecosistemas áridos.












 uBio
uBio