Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.76 n.2 Lima abr./jun. 2010
TRABAJOS ORIGINALES
Cuantificación de taninos condensados en Triplaris americana L. (Tangarana colorada)
Quantification of condensed tannins in Triplaris americana L. (Tangarana colorada)
Miguel Angel Inocente Camones*a , César Fuertes Ruitonb , Bertha Jurado Teixeiraa , Iris Giovana Mondragon Tarrilloa , Evelyng del Rosario Taype Espinozaa .
*a Laboratorio de Farmacognosia y Medicina Tradicional. Facultad de Farmacia y Bioquímica. Universidad Nacional Mayor de San Marcos. Jr. Puno 1002.Jardín Botánico. Lima. Perú. minocente@farmaceuticos.com ayrucosmetic@empresarios.com
b Instituto de Investigación en Ciencias Farmacéuticas y Recursos Naturales Juan de Dios Guevara. Facultad de Farmacia y Bioquímica. Universidad Nacional Mayor de San Marcos. Jr. Puno 1002. Jardín Botánico. Lima. Perú
RESUMEN
Se desarrollo y valido la cuantificacion de taninos del extracto hidroalcoholico, mediante espectrofotometria ultravioleta-visible, donde el metodo resulto ser selectivo, lineal, preciso (repetible y reproducible) y exacto; se obtuvo como resultado para compuestos fenolicos totales: 13,5158 0,1825 g de acido tanico/100 g de corteza; para taninos: 11,8590 0,5453 g de acido tanico/ 100 g de corteza; y para taninos condensados: 1,62368 0,0784 g de acido tanico/ 100 g de corteza.
Palabras clave: Triplaris americana L., cuantificacion, taninos condensados, validacion.
ABSTRACT
It was developed and validated the quantification of tannins of the hydroalcoholic extract, by means of ultraviolet-visible spectrophotometry, where the method turned out to be selective, lineal, precise (repeat and reproduce) and exact; they were obtained as a result for compound total phenolic: 13,5158 0,1825 g of tannic acid/ 100 g of bark; for tannins: 11,8590 0,5453 g of tannic acid/ 100 g of bark, and for condensed tannins: 1,62368 0,0784 g of tannic acid/ 100 g of bark.
Key words: Triplaris Americana L., quantification, tannins condensed, validation.
INTRODUCCIÓN
Triplaris americana L., conocida vulgarmente como tangarana colorada, santo palo, cumbi, palo de hormiga, arbol de hormiga, es un arbol mirmecofilo de casi 16 metros de altura. Triplaris americana L. es una especie endemica de America; crece a los 350 msnm, en los departamentos de San Martin, Amazonas, Lima, Pasco, Junin, Huanuco, Loreto y Madre de Dios; tambien crece en paises como Panama, Guyana, Guyana Francesa, Surinam,Venezuela, Brasil, Bolivia, Colombia y Ecuador1 .
En la medicina tradicional peruana se utiliza la decoccion o infusion de su corteza por via oral para curar infecciones intestinales, fiebre, diarrea, dolor de muelas2 . El PRODAPP(Programa de Desarrollo Alternativo en las Areas de Pozuzo y Pacalzu) para la atencion primaria de la salud (APS) recomienda el uso de esta planta para el tratamiento de la malaria, en la region Huanuco3 .
El presente trabajo de investigacion tiene como objetivo determinar la presencia de taninos condensados y para realizar la cuantificacion de fenoles totales, taninos y validacion del metodo de cuantificacion se utilizo el metodo de Lastra, H., 20004 , y para taninos condensados, el metodo deWaterman, P.
PARTE EXPERIMENTAL
Lugar de ejecución
El presente trabajo de investigacion se realizo en los laboratorios de Farmacognosia y Medicina Tradicional, Bioquimica y Botanica de la Facultad de Farmacia de la Universidad Nacional Mayor de San Marcos.
Materiales y reactivos
Muestra
El material objeto de nuestro estudio estuvo constituido por la corteza de la especie Triplaris Americana L. (polygonaceae), planta femenina, recolectada en el pueblo de Chazuta, provincia de Tarapoto, departamento de San Martin, en epoca de verano (etapa de floracion). La recoleccion se realizo conGPSde 900 a 1000 metros y coordenadas: 06.50'S 076. 60'W.
Reactivos
Cloruro de fierro (III), tungstato de sodio dihidratado (Merck) gelatina (Aldrich Chemical Co.) carbonato de sodio acido fosfomolibdico hidratado (Merck caolin cloruro de sodio, acido clorhidrico qp. (Merck) acido fosforico 85% (Merck) sulfato ferroso heptahidratado. Se utilizo agua desionizada pasteurizada para todos los experimentos.
Equipos
Espectrofotometro UV-visible (Spectroquant Pharo 300 Merck), estufa (Memmert), microscopio optico, balanza analitica de capacidad de 1mg - 200 g (Ohaus Pioneer).
Métodos de análisis
Elaboración de extracto
Mil cuatrocientos gramos (1400 g) de la corteza seca y molida de la planta fueron macerados en aproximadamente 5 Lde alcohol etilico 70. durante 10 dias; la solucion resultante se filtro y se llevo a sequedad total, obteniendose 400 gramos de extracto seco.
Análisis histoquímico
En el estudio micromorfologico de la corteza, se realizaron cortes transversales a mano libre, en los cuales se observaron los caracteres anatomicos internos. El analisis fue realizado en colaboracion del laboratorio de Botanica de la Facultad de Farmacia y Bioquimica de UNMSM; se empleo para el analisis un microscopio optico.
Con el objeto de determinar la localizacion de las proantocianidinas, se efectuaron cortes sobre partes de la corteza de tangarana colorada. Posteriormente se efectuo sobre ellos la reaccion de la vainillina-HCl. Las celulas que contienen proantocianidinas tomaron un intenso color rojizo6 .
Ensayos de caracterización para taninos7
Para determinar la presencia de taninos en el extracto hidroalcoholico desecado, se realizaron las siguientes reacciones caracteristicas:

Caracterización y conversión de proantocianidinas en antocianidinas
La conversion de proantocianidinas en antocianidinas se efectuo mediante tratamiento acido. Se tomo 1 gramo del extracto hidroalcoholico desecado en un tubo de ensayo y se disolvio en 50 mLde HCl 2N. Luego se coloco el tubo con la solucion en baño Maria a 100°C durante una hora. Las proantocianidinas se transformaron asi en antocianidinas, y fueron extraidas en alcohol amilico8 .
Cuantificación de compuestos fenólicos mediante método espectrofotométrico
Para la cuantificacion de los compuestos fenolicos del extracto hidroalcoholico desecado de la corteza de tangarana colorada, se utilizo el metodo de Lastra, H., 2000 ; el extracto hidroalcoholico desecado fue diluido en agua desionizada pasteurizada (30 mg %). El metodo consta de dos etapas: la etapa A donde se cuantifican los polifenoles totales en el extracto hidroalcoholico desecado, y la etapaBdonde se cuantifican los polifenoles residuales despues del secuestro de los taninos con gelatina.
- EnsayoA: Cuantificación de polifenoles totales
Se midieron exactamente 4mL del extracto y fueron transferidos a un matraz aforado de 250 mL, diluyendo con agua desionizada pasteurizada hasta enrase. De la solucion anterior se tomaron porciones de 1, 2, 3,4y5mLyse llevaron a matraces aforados de 25 mL.
- Ensayo B: Cuantificación de polifenoles residuales
Se midieron exactamente 20 mLdel extracto y fueron transferidos a un matraz aforado de 250 mL con tapa, adicionandole posteriormente 60 mL de agua desionizada pasteurizada, 50 mL de solucion de gelatina al 25 %, 100mLde solucion saturada de cloruro de sodio acidificado y 10 g de caolin; la mezcla se enraso con agua desionizada pasteurizada. Se tapo y agito durante 1 hora, dejandose reposar para posteriormente filtrar. Del filtrado se toman 10 mL y se transfirieron a un matraz aforado de 50 mL completando con agua desionizada pasteurizada. Luego se tomaron 1, 2, 3,4y5mLyse llevaron a matraces aforados de 25 mL.
- Sustancia de referencia
Se peso 25 mg de acido tanico, se transfirieron a un matraz aforado de 100mLy se completo el volumen con agua desionizada pasteurizada. Posteriormente se midieron exactamente 20 mL y se pasaron a un matraz aforado de 100 mL, la mezcla se enraso con agua desionizada pasteurizada. De la solucion anterior se transfirieron 0,5; 1; 2; 3; 4; 5; 6; 7; 8; 9 y 10 mL a matraces aforados de 25 mL.
- Blanco (métodoA)
Se añaden 1, 2, 3,4y5mLde agua desionizada pasteurizada a matraces aforados de 25 mL.
- Blanco (método B)
Se adicionaron 80 mL de agua desionizada pasteurizada, 50 mL de solucion de gelatina al 25%, 100 mL de solucion saturada de cloruro de sodio acidificada y 10 g de caolin, la mezcla se enraso con agua en un matraz aforado de 250mLcon tapa. Se tapo y agito durante 1 hora, se dejo reposar y posteriormente se filtro. Del filtrado se tomaron 10 mL y se transfirieron a un matraz aforado de 50 mL, la mezcla se enraso con agua desionizada pasteurizada, del que se tomaron 1, 2, 3,4y5mLyse llevaron a matraces aforados de 25 mL.
Solución tungstato-fosfomolíbdico
Se disolvieron 10 g de tungstato de sodio dihidratado, 0,2 g de acido fosfomolibdico hidratado y 5,0mL de acido fosforico al 85% en 75mLde agua desionizada pasteurizada. La solucion se llevo a reflujo por 2 horas (hasta aparicion de color amarillo; no verde, ni azul) y se completo con agua desionizada pasteurizada a 100 mL.
Desarrollo de color
A cada matraz, se agrego 2 mL de solucion tungstato-fosfomolibdico, se agito y se dejo reposar durante 5 minutos. Luego se anadio 1mLde solucion de carbonato de sodio al 20%, se agito, enraso con agua desionizada pasteurizada y homogenizo. La absorbancia de las soluciones se leyeron a 700nm despues de transcurridos 2 minutos de la reaccion.
Validación del metodo analitico
Para la validacion del metodo propuesto se siguieron normativas reconocidas de validacion .9.13
Especifidad
La especificidad del metodo esta basada en la especificidad de la gelatina por los taninos12 , por lo cual los taninos son determinados por la diferencia del contenido total de fenoles y fenoles residuales luego del secuestro por gelatina.
Con el objetivo de corroborar la eficacia del secuestro de los taninos por la gelatina, se realizo un analisis por cromatografia en capa fina. Se aplicaron microlitros del extracto hidroalcoholico, el extracto tratado con gelatina 5% y el acido tanico, como el patron tratado con gelatina 5% en cromatofolios con silicagel GF254 , para luego realizar la separacion de sustancias por la fase movil: acetato de etilo: metanol: agua (100: 13.5: 10 v/v). Luego fueron evaluados con reveladores como el cloruro de hierro (III) 1%, acido fosfomolibdico 5% y el reactivo de Folin, el cual se emplea en el desarrollo de color del presente método.
Linealidad
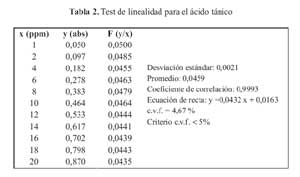
Para comprobar la linealidad del metodo analitico se probo la linealidad de la sustancia de referencia (acido tanico) en un rango de concentraciones de 1 a 20 ppm, calculandose la recta de regresion, el coeficiente de correlacion, el coeficiente de variacion de los factores respuestas, y los tests de linealidad y proporcionalidad. Los resultados fueron procesados por el programa microsoft excel 2007 y stat plus 2008.
La linealidad para las etapas A y B del metodo fueron analizadas realizandole las mismas evaluaciones.
Precisión
Este parametro incluye la repetibilidad y reproducibilidad.
- Repetibilidad
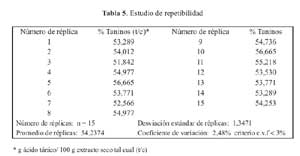
La repetibilidad se comprobo con 15 replicas de ensayo, evaluandose el coeficiente de variacion.
- Reproducibilidad
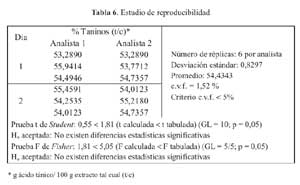
Para el analisis de la reproducibilidad se realizaron 6 replicas por analista, en 2 dias de analisis; realizandose 12 determinaciones en total, a las cuales se les determino el coeficiente de variacion y las pruebas estadisticas de Fisher y Student
Exactitud
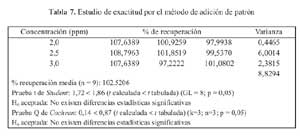
Para el estudio de la exactitud se empleo el metodo de adicion de patron a diferentes niveles: 2,0; 2,5 y 3,0 ppm (80, 100 y 120%). Aplicandose las pruebas "t" de Student y la "G" de Coshran para determinar si existen diferencias significativas entre la recuperacion media y el 100% y si el factor concentracion tiene alguna influencia en los resultados.
Cuantificación de taninos condensados
- Determinación de taninos condensados (método de la proantocianidina)
Se siguio el metodo de Waterman, P.5.14
- Solución reactivo para taninos condensados
Se prepara agregando 0,7 gramos de sulfato ferroso heptahidratado a 50 mL de acido clorhidrico concentrado, llevando a 1000mLcon butanol.
- Obtención de muestra y estándar para análisis
Se preparo una solucion de extracto hidroalcoholico desecado en agua desionizada pasteurizada (100 mg %). Se colocan 100, 250, 500 L del extracto diluido en tubos con tapa rosca. Se peso 15 mg de acido tanico, se transfirieron a un matraz aforado de 100 mL; la mezcla se enraso con agua desionizada pasteurizada. Posteriormente se midieron exactamente 10 mLy se pasaron a un matraz aforado de 100 mL, la mezcla se enraso con agua desionizada pasteurizada. De la solucion anterior se transfirieron 100, 200, 300, 400 y 500 L, en tubos con tapa rosca.
- Tratamiento de la muestra y estándar
Luego se agregaron 7 mL del reactivo a cada tubo (estandar y extracto) y se llevo a ebullicion en bano de agua por 40 minutos. Se enfrio y midio la absorbancia a 550 nm.
Análisis estadístico
Los resultados fueron procesados usando los programas microsoft excel 2007 (windows office) y Minitab statistical software english (version 15.00 para windows XP). Todos los experimentos se realizaron por triplicado y los resultados expresados como valores promedios ± desviacion estandar.
RESULTADOS Y DISCUSIÓN
Del análisis histoquímico
En el estudio micromorfologico se visualizo en el corte transversal de la corteza: parenquima cortical, parenquima medular, xilema, floema, colenquima y epidermis.
En el floema se observo una coloracion rojiza, debido a la reaccion de vainillina con las celulas que almacenan taninos; se demuestra la presencia de proantocianidinas.
Del ensayo para caracterizar taninos
En el extracto seco se analizo la presencia de taninos con reacciones cromogenicas y de precipitacion (tabla 1)
Del análisis de las antocianidinas
El color rojo en la fase amilica sugiere la presencia de antocianidinas.
De la cuantificación de compuestos fenólicos
Se obtuvieron 13,5158 0,1825 g de acido tanico/ 100 g de corteza para compuestos fenolicos totales; y 11,8590 0,5453 g de acido tanico/ 100 g de corteza para taninos.
-De la especificidad
En el caso de ambos secuestros (acido tanico y extracto hidroalcoholico), se obtuvo leve coloracion para el acido tanico mas no para el extracto, con los reactivos empleados.
-De la linealidad
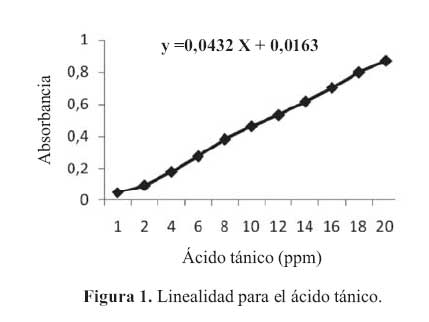
La curva de calibracion del acido tanico en el rango de concentraciones estudiadas responde a la ecuacion y = 0,0432 x + 0,0163 y un coeficiente de correlacion igual a 0,9993.Al realizar la significacion estadistica de la varianza de la pendiente se rechazo la hipotesis Ho: (b=0) y el cero quedo incluido en el intervalo de confianza del termino independiente. Los factores respuestas fueron similares entre si y cercanos al valor de la pendiente y su coeficiente de variacion fue de 4,67% (tabla 2). De igual modo, en el grafico absorbancia versus acido tanico, se muestra la linealidad del acido tanico. (figura 1)
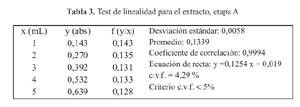
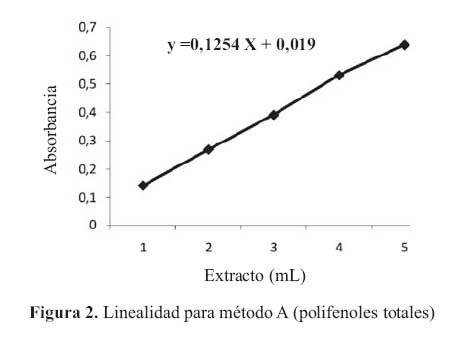
La curva de calibracion para la etapa A en el rango de concentraciones estudiadas responde a la ecuacion y= 0,1254 x + 0,019 y a un coeficiente de correlacion igual a 0,9994. Al realizar la significación estadistica de la varianza de la pendiente se rechazo la hipotesis Ho: (b = 0) y el cero quedo incluido en el intervalo de confianza del termino independiente.
Los factores respuestas fueron similares entre si y cercanos al valor de la pendiente y su coeficiente de variacion fue de 4,29% (tabla 3). De igual modo en el grafico absorbancia versus extracto, se muestra la linealidad del extracto, en la etapaA. (figura 2)
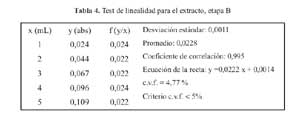
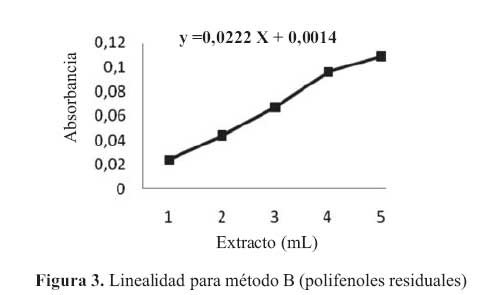
La curva de calibracion para la etapa B en el rango de concentraciones estudiadas responde a la ecuacion y = 0,0222 x + 0,0014 y a un coeficiente de correlacion igual a 0,9950. Al realizar la significacion estadistica de la varianza de la pendiente se rechazo la hipotesis Ho: (b = 0) y el cero quedo incluido en el intervalo de confianza del termino independiente.
Los factores respuestas fueron similares entre si y cercanos al valor de la pendiente y su coeficiente de variacion fue de 4,77% (tabla 4). De igual modo en el grafico absorbancia versus extracto, se muestra la linealidad del extracto, en la etapa B. (figura 3)
-De la precisión
El coeficiente de variacion de las 15 replicas de ensayo para el estudio de repetibilidad fue de 2,48 % (tabla 5) y 1,52 % (tabla 6) en el caso de la reproducibilidad; realizandose en este ultimo los tests de Fisher y Student de los cuales se obtuvieron los valores 0,55 y 1,81, respectivamente.
-De la exactitud
De los resultados de recuperacion en porcentaje se obtuvo una "t" de Student igual a 1,72. Al aplicar la prueba de Cochran el valor de la "G" experimental resulto 0,14 (tabla 7).
De la cuantificación de compuestos fenólicos
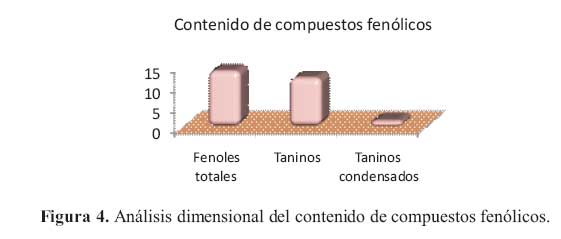
Como resultado de la cuantificacion de los compuestos fenolicos, taninos y taninos condensados, se obtuvieron los resultados mostrados en la tabla 8 y figura 4.
CONCLUSIONES
La cuantificacion del extracto hidroalcoholico dio como resultado: para compuestos fenolicos totales: 13,5158 0,1825 g de acido tanico/ 100 g de corteza; para taninos: 11,8590 0,5453 g de acido tanico/ 100 g de corteza; y la determinacion de taninos condensados: 1,62368 0,0784 g de acido tanico/ 100 g de corteza.
AGRADECIMIENTOS
Mi profundo agradecimiento a las siguientes personas: Ing. Quim. Violeta Leon, QF. Gloria Gordillo y QF. Andres Revilla, docentes de la Facultad de Farmacia y Bioquimica de la UNMSM,por la asesoria y orientacion brindada.
BIBLIOGRAFÍA
1. Mostacero, L.; Mejia, F.; Gamarra, O. Taxonomia de las Fanerogamas utiles del Peru. CONCYTEC.Volumen I. Editorial Normas Legales S.A.C.Trujillo. 2002.
2. Desmarchelier, C.; Alonso, J. Plantas medicinales para la atencion primaria en la salud. Vademecum de Fitoterapia.PRODAPP. Lima. 2005.
3. Desmarchelier, C; Witting, F. Sixty Medicinal Plants from the Peruvian Amazon: Ecology, Ethnomedicine and Bioactivity. Primera edicion. Ediciones PROTERRA. Lima. 2000.
4. Lastra, H.; Rodriguez, E.; Ponce, H.; et al. Metodo analitico para la cuantificacion de taninos en el extracto acuoso de romerillo. Revista Cubana de Plantas Medicinales .2000; 5(1): 17-22.
5. Waterman, P.; Mole, S. Analysis of phenolic plant metabolites. Blackwell Scientific Publications. Ed. Cambridge,MA.USA. 1994: 67-133.
6. Ricco, R.; Vai, M.; Sena, G.; Wagner, M.; Gurni, A. Taninos condensados de Ephedra Ochreata Miers (Ephedraceae). . 2003; 22 (1): 33-7. Acta Farmacéutica Bonaerense
7. Gorriti, A.; Jurado, B.; Quispe, F. Manual de Laboratorio I y II. UNMSM. Facultad de Farmacia y Bioquimica. Catedra de Farmacognosia y Medicina Tradicional. Lima. 2004.
8. Ricco, R.; Sena, G.; Vai, V.; Wagner, M.; Gurni, A. Taninos condensados de Ephedra Chilensis K. Presl (=E. andina Poepp. Ex May.) –Ephedraceae-. Catedra de Farmacobotanica. Departamento de Farmacologia. Facultad de Farmacia y Bioquimica. UBA. BuenosAires. 2002.
9. Gutierrez, Y.; Miranda, M.; Varona, N.; Rodriguez, A. Validacion de 2 metodos espectrofotometricos para la cuantificacion de taninos y flavonoides (quercetina) en Psidium guajaba L. Revista Cubana de Farmacia . 2000; 34 (1): 50-5.
10. Asociacion Espanola de Farmaceuticos de la Industria. Validacion de Metodos Analiticos. Segunda edicion. Barcelona.AEFI. 2001.
11. ICH International Conference on Harmonisation (ICH): Q2 (R1) Validation of Analytical Procedures: Text and Methodology Note: In November 2005, the ICH incorporated Q2B on methodology with the parent guidance Q2A and retitled the combined Q2 document. The contents of the two guidances were not revised. Disponible en: : http://www.fda.gov/cber/gdlns/ichq2bmeth.pdf
12. Ministerio de Salud. Guia de validacion de metodos analiticos. Disponible en: http://www.ministeriodesalud.go.cr/protocolos/guiavalidacionmetodosanaliticos.pdf
13. Makkor, H. Protein precipitation methods for quantitation of tannins. J. Agric Food Chem.1989; 37(4):197-202.
14. Nitao, J.; Birr, B.; Nair, M.; Herms, D.; Mattson, W. Rapid quantification of proanthocyanidins (condensed tannins) with a continuous flow analyzer. J. Agric. Food Chem. 2001; 49: 2207-14.
Recibido el 29-10-2009