Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.77 n.2 Lima abr./jun. 2011
TRABAJOS ORIGINALES
Caracterización de una quitinasa extracelular producida por Serratia sp. BIOMI-363706 usando quitina coloidal como sustrato
Characterization of a extracellular chitinase produced by Serratia sp. BIOMI-363706 using colloidal chitin as substrate
Castro, Rocío1*; Álvarez, Adriana1; Machado, Elwi1; Mendoza, Mónica1; Gómez, Rubén2; García, Pablo1
1* Laboratorio de Biotecnología de Microorganismos Sixto David Rojo, Departamento de Biología, Facultad de Ciencias, Universidad de los Andes, Sector La Hechicera, Núcleo Universitario Pedro Rincón Gutiérrez, Ciudad Mérida 5101 Venezuela, rociojcm@gmail.com
2 Laboratorio de Ciencia, Ingeniería y Biotecnología de los Alimentos, Universidad de los Andes, Sector La Hechicera, Núcleo Universitario Pedro Rincón Gutiérrez, Ciudad Mérida 5101 Venezuela.
RESUMEN
La quitinasa es una enzima capaz de hidrolizar quitina en sus componentes oligo y monoméricos. Los quito-oligosacáridos, el dímero acetilquitobiosa y los monómeros de N-acetilglucosamina son de gran interés para la industria debido a su amplio rango de aplicaciones médicas, agrícolas e industriales. En el presente trabajo se realizó la caracterización de una enzima quitinolítica extracelular obtenida del aislado bacteriano BIOMI-363706, caracterizado molecularmente como Serratia sp. Esta bacteria usa la quitina coloidal como única fuente de carbono y nitrógeno. Al ser inoculada en un medio que contenía 2% de quitina coloidal (QC), 0,1% K2HPO4 y 0,05% MgSO4.7H2O, a pH 7,2, la bacteria produjo óptimamente quitinasa extracelular después de 72 horas de incubación a 37 °C. La temperatura y pH óptimos, así como la termoestabilidad de la enzima, fueron 50 °C, pH 6,5 y < 70 °C. La quitinasa fue activada por Mn+2 y Co+2. La actividad sobre diferentes sustratos siguió este orden: quitina coloidal > polvo de quitina (<1mm) > glicol-quitina. La enzima presentó un valor de Vmax de 0,015 µmol/min y un Km de 1,278 mg/ml, utilizando quitina coloidal como sustrato. La enzima estudiada mostró, entre sus características, una termoestabilidad que puede ser una ventaja para la maximización de reacciones en escalas industriales que mejoren y potencien la degradación enzimática de la quitina.
Palabras clave: Quitina coloidal, N-acetilglucosamina, actividad quitinasa.
ABSTRACT
Chitinase is an enzyme able to hydrolyze chitin into its oligo and monomeric components. The chitin-oligosacharids, the acetylchitobiose dimer and the acetylglucosamine monomers are very important to industry due their wide range of medical, agricultural and industrial applications. In the present report was made the characterization of an extracellular chitinolitic enzyme obtained from BIOMI-363706 bacterial isolate, molecularly characterized as Serratia sp. This bacterium uses colloidal chitin as unique carbon and nitrogen source. While inoculated into a media containing 2% colloidal chitin (QC), 0,1% K2HPO4 and 0,05% MgSO4.7H2O, at pH 7,2, the bacteria yields optimally extracellular chitinase after incubation along 72 hours at 37 ºC. Optimal temperature, pH as well as thermostability of the enzyme were 50 ºC, pH 6,5 and < 70 ºC. Chitinase was activated by Mn+2 y Co+2. Activity upon different subtracts was according the following order: Colloidal chitin > chitin powder (< 1mm) > glycol-chitin. The enzyme showed a Vmax value of 0,015 mol/min and a Km of 1,278 mg/ml, using colloidal chitin as substrate. The studied enzyme shown, as one of their characteristics, an thermostability that can be an advantage in order to maximize the reactions at industrial scales that improve and potentiate the enzymatic chitin degradation.
Key words: Colloidal chitin, N-acetylglucosamine, chitinase activity.
INTRODUCCIÓN
La quitina -el polímero más abundante en la naturaleza, después de la celulosa1-2 -está formada por aminoazúcares unidos entre sí por enlaces glicosídicos ß-(1→4), que forman una cadena lineal de unidades de N-acetil-2-amino-2-desoxi-D-glucosa, algunas de las cuales se encuentran desacetiladas3-4 y que desempeñan un papel importante en su estructura molecular, ya que le permiten formar auténticos tejidos que confieren resistencia y soporte -como componente estructural- al exoesqueleto de artrópodos, arácnidos, insectos, nematodos, anélidos y otros invertebrados; a la concha exterior de crustáceos, braquiópodos y moluscos, así como a las paredes celulares de muchos hongos, como ascomicetos, basidiomicetos, ficomicetos e imperfectos. Está también presente en algunos tunicados y algas clorofíceas1-2-5. Por su insolubilidad en agua, tamaño, complejidad molecular y composición heterogénea, la quitina no se degrada dentro de la célula, sino que los microorganismos recurren a la secreción de enzimas quitinolíticas con diferente especificidad para transformarla o hidrolizarla como fuente de carbono y nitrógeno6. La quitinasa (EC 3.2.11.14) es una enzima capaz de hidrolizar quitina insoluble en sus componentes oligo y monoméricos. La actividad de la quitinasa ha sido encontrada en numerosas bacterias y Streptomicetos, hongos, plantas, invertebrados y vertebrados. Desempeña una función importante en el proceso de muda de los insectos y la digestión de alimentos quitinosos, y puede también servir como enzima potencialmente defensiva contra patógenos quitinosos2.
Los quito-oligosacáridos producidos por hidrólisis enzimática de quitina han estimulado recientemente la investigación debido a su amplio rango de aplicaciones y propiedades médicas, agrícolas e industriales. El interés comercial en la utilización de quitina y sus derivados ha llevado a la necesidad de buscar fuentes estables, seguras y baratas de enzimas quitinolíticas aisladas de organismos, como alternativa a los métodos químicos1.
En el presente trabajo, se reporta la caracterización de una quitinasa extracelular producida por Serratia sp. BIOMI-363706 empleando la quitina coloidal como sustrato, que se obtuvo del procesamiento de exoesqueletos de camarón.
PARTE EXPERIMENTAL
Microorganismo
Se utilizó la bacteria Serratia sp. BIOMI-363706, perteneciente al cepario del Laboratorio de Biotecnología de Microorganismos «Sixto David Rojo» de la Universidad de los Andes. Esta cepa fue aislada de una fuente hidrotermal azufrada en Aguas Calientes, Ureña, estado del Táchira, Venezuela.
Para la reactivación de la cepa, que se encontraba conservada en viales con glicerol al 60% v/v -siguiendo la metodología por Meza et al.7-, se usó agar nutritivo, cuya composición en g l-1 fue: 3 g de extracto de malta, 3 de extracto de levadura, 5 de peptona, 10 de glucosa y 18 de agar. Este medio fue utilizado tanto en su modalidad sólida -para la conservación de la cepa a tiempos cortos y confirmación de su pureza- como líquida (sin agar), todo lo cual fue mantenido en refrigeración.
Preparación de quitina coloidal (QC)
La quitina coloidal fue preparada por modificación del método de Hsu y Lockwood8, el cual consiste en disolver 40 g de quitina en 400 ml de HCl concentrado en agitación constante durante 50 min. Posteriormente, se añadieron 2 litros de agua destilada fría. La mezcla fue dejada en agitación continua durante 12 horas a temperatura ambiente. Después se procedió a filtrar al vacío el precipitado obtenido y se efectuaron sucesivos lavados con agua destilada de acuerdo con el volumen inicial usado, con el fin de eliminar el ácido. La pasta obtenida, de consistencia gelatinosa, se esterilizó durante 15 min a 15 psi; luego, se almacenó a 4 °C hasta su posterior uso.
Microorganismo y la producción de enzima
El crecimiento de Serratia sp. BIOMI-363706 tuvo lugar en un medio modificado, el cual contiene1 en g l-1: 0,5 de extracto de levadura, 1,0 MgSO4H2O, 1,36 KH2PO4, QC al 2% (p/v) con pH 7,2, durante 24 horas. Diez por cierto (10%) del preinóculo fue transferido a 100 ml de medio mínimo, cuyo contenido es el siguiente5: 0,1% K2HPO4, 0,05% MgSO4.7H2O y 2% (p/v) de QC con pH 7,2; dicho porcentaje se dejó incubando 120 horas a 37 °C en agitación constante de 120 rpm. Después de la incubación, la biomasa fue separada por centrifugación a 12,000 x g, a 4 °C durante 15 min; el sedimento se descartó, mientras que el sobrenadante fue colectado para la medición de la actividad enzimática.
Determinación de la actividad enzimática
El procedimiento utilizado -que se basa en evaluar colorimétricamente la N-acetil-D- glucosamina (NAG), liberada por la acción hidrolítica de la quitinasa sobre el sustrato quitina coloidal, según el método de Morgan-Elson modificado (Reissig et al.9)- se realizó como sigue: La mezcla de la reacción se compuso con 1 ml del extracto crudo enzimático y 1 ml de QC al 10% (p/v), y se suspendió en buffer fosfato 0,2 M a pH 7. Se incubó a 50 °C durante 1 hora, en baño metabólico. La reacción se detuvo adicionando 1 ml de NaOH al 1%. Posteriormente, a 250 µL del sobrenadante obtenido se les adicionaron 40 µL de tetraborato de potasio 0,8 M a pH 9,1, y se incubaron durante 3 min. Se dejó enfriar la mezcla en baño de hielo; a continuación, se le agregó 1 ml de p-dimetilaminobenzaldehído (DMAB) al 10% en ácido acético glacial al 87,5% (el cual contiene 12,5 ml de HCl 10N) antes de ser incubada a 37 °C durante 1 hora.
Los resultados se interpolaron en una curva tipo preparada con NAG, en una concentración de 0 a 200 ìg/ml, y se expresó la actividad en unidades de quitinasa (UQUITINASA), siendo una unidad la cantidad de enzima que produce un µmol de NAG por minuto, bajo las condiciones antes descritas10.
Determinación de proteína
El contenido de proteína se determinó por el método Bradford11, que usa concentrado de reactivo colorante Bio-Rad Protein Assay y albúmina de suero bovino como estándar. En el ensayo, se utilizaron 1000 µl del reactivo y 100 µl de la muestra de extracto crudo enzimático. Se incubaron a temperatura ambiente durante 15 min. Se midió la absorbancia a una longitud de onda de 595 nm. La concentración de proteína se extrapoló mediante una recta de regresión obtenida de cotejar valores crecientes de albúmina.
Caracterización parcial de la enzima producida por Serratia sp. BIOMI-363706
La caracterización parcial de la quitinasa de Serratia sp. BIOMI-363706 se realizó utilizando el extracto crudo enzimático, y del modo como se menciona a continuación:
Efecto del pH, la temperatura y estabilidad térmica en la actividad de la enzima quitinasa
Para la determinación del pH óptimo, se hizo reaccionar 1 ml de extracto crudo enzimático con 1 ml de quitina coloidal al 10% (p/v), mezcla que fue suspendida en los siguientes amortiguadores de pH: glicina-HCl (50 mM, pH 3), acetato (50 mM, pH 4-5), fosfato (50 mM, pH 6-8) y Na2CO1-NaHCO3 (50 mM, pH 9-11)5. La incubación duró 30 min a 50 ºC. Luego, se centrifugó a 3500 rpm durante 5 min. Posteriormente, se determinaron las unidades quitinolíticas utilizando el método definido antes. Teniendo en cuenta el pH óptimo, se realizó la determinación de la temperatura óptima. Se utilizaron las mismas condiciones anteriores, la reacción se llevó a cabo a diferentes temperaturas (20, 30, 40, 50, 60 y 70 ºC) durante 30 min, y se detuvo colocándola en un baño de hielo durante 5 minutos. Se llevó a centrifugar a 3500 rpm durante 15 min y, finalmente, se determinaron las unidades quitinolíticas (UQ).
La estabilidad de la temperatura se consiguió sometiendo el extracto enzimático a diferentes gradientes de temperatura: de 10 a 30 ºC, de 40 a 60 ºC y de 70 a 90 ºC durante 5 min. Las muestras fueron mantenidas a 4 ºC durante 10 min. Posteriormente, se llevó a cabo la reacción con 500 µL de extracto enzimático y 500 µL de quitina coloidal al 10% (p/v), mezcla suspendida en buffer fosfato 0,2 M, a pH y temperatura óptimos durante 30 min. Se centrifugó a 3500 rpm durante 15 min, y se realizó la cuantificación de la actividad quitinasa en la forma indicada anteriormente para determinar las unidades quitinolíticas luego del tratamiento térmico.
Efecto de varios compuestos químicos
Con la finalidad de determinar el efecto inhibidor de algunos metales divalentes sobre la actividad quitinasa, se procedió a preincubar la enzima en 50 mM de buffer fosfato, pH 6,5, durante 30 min a 50 ºC, en presencia de las siguientes sales de cloruro: CaCl2, CoCl2, MgCl2, MnCl2, ZnCl2, en concentración 2 M. Se realizaron controles negativos sin añadir ninguna de las sales. La actividad residual de la enzima se determinó bajo las condiciones mencionadas con anterioridad1.
Actividad en diferentes sustratos
Se evaluó la actividad quitinasa sobre los siguientes sustratos: quitina coloidal al 1% (p/v), como control positivo, quitina en polvo (QP) al 1% (p/v) y glicol-quitina (GQ) al 1% (p/v). Las preparaciones enzimáticas fueron incubadas a 50 ºC durante 0, 30, 60, 90, 120, 150 y 180 min. El montaje se realizó por triplicado para cada uno de los tratamientos. La actividad fue determinada como se indicó anteriormente.
Cinética de la enzima en el sustrato quitina coloidal
Se efectuaron cinéticas de la enzima quitinasa empleando quitina coloidal en distintas concentraciones: de 2,5, 5, 7, 10 y 15% (p /v). Una vez conformadas las mezclas enzima/sustrato, fueron incubadas a 50 ºC durante tiempos variables de: 0,5, 15, 30, 45, 60 y 75 min para determinar la actividad enzimática como se indicó anteriormente.
RESULTADOS Y DISCUSIÓN
El medio reportado por Wang et al.5, que contenía 2% de quitina coloidal como única fuente de carbono y nitrógeno, permitió que la Serratia sp. BIOMI-363706 degradara el polímero, lo cual favoreció la expresión de la actividad quitinolítica. Al comienzo de la incubación, se detectó un incremento en el crecimiento del cultivo, pero, después de 24 h de incubación, se observó una aceleración en el crecimiento celular (fase exponencial). Posteriormente, el cultivo entró en la fase de muerte, sin evidenciarse una fase estacionaria clara. Esto puede deberse a cambios fisicoquímicos en el medio, como el agotamiento de nutrientes o la aparición de metabolitos secundarios que inhibieron el crecimiento (figura 1).
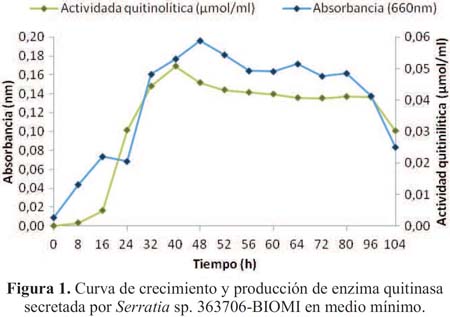
En cuanto a la actividad quitinolítica, como se observa en la figura 1, la producción de la enzima estuvo asociada al crecimiento y se detectó actividad a partir de las 8 h hasta las 48 h, y fue significativamente observada y se mantuvo durante 72 h. Esto es concordante con la quitinasa producida por Bacillus sp. 13,26, como fue reportado por Purwani et al.1
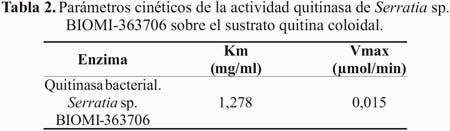
La caracterización parcial de las muestras del extracto crudo enzimático de Serratia sp. 363706-BIOMI mostró que la enzima tenía un pH óptimo de 6,5 (figura 2), una temperatura óptima de 50 ºC (figura 3) y una termoestabilidad menor que 70 ºC (figura 4).
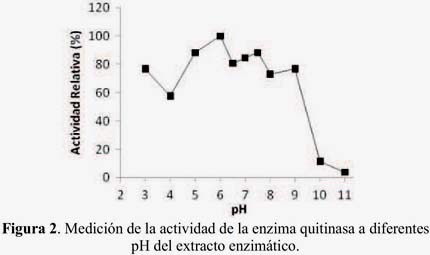
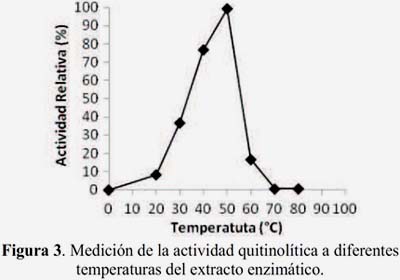
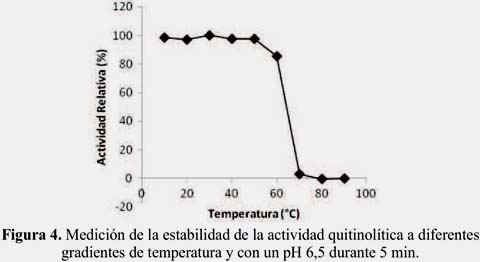
Estos resultados son similares a los reportados con la enzima purificada de la línea TKU015 de Pseudomona sp., usando concha de camarón como sustrato, y la caracterización de dos isoformas de quitinasa de Vibrio alginolyticus5-12. La quitinasa purificada de Bacillus sp. 13.26 fue también óptima a pH cerca del neutro (pH 7), la temperatura óptima fue 60-65 ºC, y su termoestabilidad se mantuvo a 80 ºC1. Estos datos pueden ser de utilidad -siempre que existan condiciones neutrales- para aplicaciones industriales, tales como la producción de quito- oligosacáridos con propósitos médicos.
La actividad de la quitinasa fue incrementada por Mn+2 y Co+2 con 100 y 88%, respectivamente, y ligeramente incrementada con Mg+2, Ca+2 y Zn+2 (tabla 1).
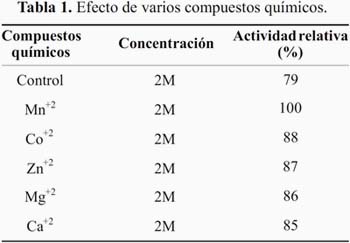
Reportes del efecto de iones metálicos sobre quitinasa purificada de Bacillus sp. 13.26 señalan que es activada por Mg+2 y Ni+2 en 131 y 116%, respectivamente1, mientras que es completamente inhibida por Mn+2 y Co+2, y casi en un 50% inhibida por la adición de Ca+2, en una concentración de 2 mM. Por otra parte, la actividad de la enzima purificada de la línea TKU015 de Pseudomona sp. fue inhibida completamente por Fe+2 y Mn+2, usando concha de camarón como sustrato5. Ni2+ y Mn2+ fueron encontrados como inhibidores de quitinasa de C. lindermuthianum13.
La actividad sobre diferentes sustratos siguió este orden: quitina coloidal > polvo de quitina (<1mm) > glicol-quitina (figura 5). La diferencia entre estos tipos de sustratos va a depender del tamaño y la forma de sus partículas, la concentración de quitina, la facilidad de contacto y el reconocimiento por parte de la enzima, lo cual desempeña un papel fundamental en la rapidez y las diferencias en la degradación que se manifiestan en la disparidad de los tiempos de concentración de N-acetilglucosamina liberada14.
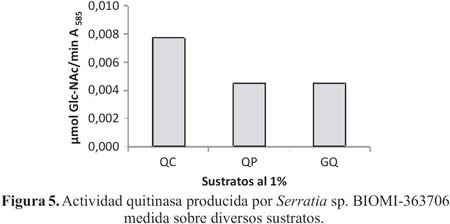
El empleo de medios basados en quitina coloidal ha sido reportado por Gómez et al.10, y en ellos la actividad de la quitinasa sobre sustratos quitinosos sólidos y coloidales coloreados con Remazol Azul Brillante (RBB) muestra mejores resultados con quitina coloidal, ya que las moléculas de sustrato son más accesibles a la enzima que en la más densa y cerrada organización molecular presente en la estructura de los sustratos sólidos, como la quitina molida.
El comportamiento de la expresión de la enzima con respecto a diferentes concentraciones del sustrato quitina coloidal puede afectar o favorecer la producción de N-acetilglucosamina bajo condiciones óptimas. Los resultados obtenidos en este ensayo están representados en la tabla 2, mostrando la enzima su máxima actividad a pH 6,5.
CONCLUSIONES
Utilizando quitina coloidal como sustrato, la enzima producida por Serratia sp. BIOMI- 363706 mostró, entre sus características, un rango de termoestabilidad que puede ser una ventaja para la maximización de reacciones en escalas industriales que mejoren y potencien la degradación enzimática de la quitina.
AGRADECIMIENTO
Este proyecto, identificado con el código número PO05AE-06-12-15, fue financiado por La Fundación Centro de Investigaciones del Estado para la Producción Experimental y Agroindustrial, CIEPE, San Felipe - estado del Yaracuy, Venezuela; y el Laboratorio de Biotecnología de Microorganismos «Sixto David Rojo», Facultad de Ciencias, Universidad de los Andes, Mérida - estado de Mérida, Venezuela.
BIBLIOGRAFÍA
1. Purwani, E. Y., Suhartono, M. T., Rukayadi, Y., Hwang, J. K., Pyunb, Y. R. Enzyme and Microbial Technology, 2004, 35, 47–153. [ Links ]
2. Trudel, J., Asselin, A. Analytical Biochemistry, 1989, 178:362-366. [ Links ]
3. Peniche, C. Estudios sobre Quitina y Quitosana. [Tesis doctoral]. La Habana- Cuba: Facultad de Química, Universidad de La Habana; 2006. [ Links ]
4. Tokura, S., Tamura, H. Chitin and Chitosan. Eds.; Birkhaus Verlag: Boston, 2007, pp- 449-468. [ Links ]
5. Wang, S. L., Chen, S. J., Wang, C. L. Carbohydrate Research, 2008, 343, 1171-1179 [ Links ]
6. Cotrell, T. M., Moore, A. J., Kirchman, L. D. Applied and Environmental Microbiology, 1999, pp 2553-2557. [ Links ]
7. Meza, R. A., Monroy, A. F., Mercado, M., Poutou, R. A., Rodriguez, P. et al. Universitas Scientiarum, 2004, 9, 235-42. [ Links ]
8. Hsu, S., Lockwood, J. Applied Microbiology, 1975, 29 (3): 422-426. [ Links ]
9. Reissig, J. L., Strominger, J. L., Leloir, L. F. J. Biol. Chem. 1955, 217:959-966. [ Links ]
10. Gómez-Ramírez, M., Rojas-Avelizapa, L. I., Rojas-Avelizapa, N. G., Cruz-Camarillo, R. J. Microbiol. 2004, 56: 213– 219. [ Links ]
11. Bradford, M. M. Analytical Biochemistry, 1976, 72, 248-254. [ Links ]
12. Suginta, W. Enzyme and Microbial Technology, 2007, 41: 212–220. [ Links ]
13. Patil, R. S., Ghormade, V., Deshpande, M. V. Enzyme Microb Technol, 2000; 26:473–83. [ Links ]
14. Sastoque, C. «Aislamiento y selección de microorganismos productores de quitinasas a partir de residuos de concha de camarón con potencial biocontrolador». Tesis para optar el título de microbiólogo industrial, agrícola y veterinario, Pontificia Universidad Javeriana, 2005. [Tesis de grado]. [ Links ]
Recibido el 27-10-2010
Aprobado el 04-01-2011













