Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú vol.79 no.3 Lima jul./set. 2013
TRABAJOS ORIGINALES
Equilibrio de biosorción de plomo (II) y caracterización mediante FT-IR y SEM-EDAX en pectina reticulada proveniente de cáscaras de naranja
Lead (II) biosorption equilibrium and characterization through FT-IR AND SEM-EDAX crosslinked pectin from orange peels
Víctor R. García Villegasa*, Neptalí Ale Borjaa, Enrique G. Guzmán Lezamaa,b, Andrea G. Yipmantin Ojedab, y Holger J. Maldonado Garcíaa,b
a* Facultad de Quím. e Ing. Quím., Universidad Nacional Mayor de San Marcos, Lima 1. Vrgv03@gmail.com
b Facultad de Ciencias y Filosofía Alberto Cazorla Talleri. Departamento de Ciencias Exactas - Sección Química, Universidad Peruana Cayetano Heredia, Lima 31
RESUMEN
El material péctico extraído a partir de cáscaras de naranja se reticuló previamente para disminuir su capacidad de hidratación e hinchamiento cuando se encuentra en medio acuoso. La determinación del grado de metoxilación (DM), el porcentaje de ácido galacturónico anhidro (%AGA) y el pKa permitieron caracterizar al biosorbente. El rango de pH en el cual se obtuvo la máxima capacidad de sorción fue de 4,5 – 5,5. Para el procesamiento de datos y tratamiento estadístico se empleó el programa estadístico Origin versión 6.0. En el equilibrio de biosorción se obtuvo un mejor ajuste en la isoterma de Langmuir, alcanzando una capacidad de sorción máxima de qmax = 186 mg/g. El análisis por espectroscopía infrarrojo con transformada de Fourier (FT-IR) permitió reconocer los grupos funcionales característicos presentes y las modificaciones realizadas en la biomasa. La morfología de la superficie del biosorbente fue estudiada por el método de microscopía electrónica de barrido, (SEM) y la composición elemental de la biomasa antes del proceso de biosorción se obtuvo mediante análisis con espectroscopía de rayos X con energía dispersiva (EDAX).
Palabras clave: biosorción, pectina, plomo, isoterma, Langmuir.
ABSTRACT
Pectic material extracted from orange peels was previously cross-linked to diminish hydration and swelling capacity when pectin is found in aqueous solution medium. Degree of metoxilation (DM), galacturonic acid anhydrous (%AGA) and pKa determination allowed characterizing biosorbent. Maximum sorption capacity was obtained at pH between 4.5 and 5.5. For data processing and statistical treatment informatics Orign 6.0 version program was used. Data from biosorption equilibrium had a better fit on Langmuir sorption equation model, obtaining qmax = 186 mg/g as a maximum adsorption capacity. Fourier transform infrared spectroscopy analysis (FT-IR) allowed recognizing characteristic functional groups presents as well as biomass modifications. Biosorbent surface morphologic was studied by scanning electron microscope (SEM) and elemental composition biomass before biosorpton process was obtained through Energy-dispersive X-ray spectroscopy (EDAX).
Key word: biosorptión, pectin, lead, isotherm, Langmuir.
INTRODUCCIÓN
El incremento de las actividades industriales ha intensificado la contaminación ambiental y el deterioro de algunos ecosistemas mediante la acumulación de metales pesados. Las aguas residuales provenientes de las actividades mineras y metalúrgicas son consideradas como la mayor fuente de contaminación de metales pesados y la necesidad de métodos económicos y efectivos para la remoción de estos metales ha conllevado al desarrollo de nuevas tecnologías de separación.1 Muchas de estas sustancias tóxicas que contienen metales pesados tienden a persistir indefinidamente en el medio ambiente, comprometiendo la salud de animales y personas mediante su acumulación e ingreso a la cadena alimenticia.2
Debbaudt et al.3 mencionaron que las sustancias adsorbentes, como el carbón activado, son empleadas para remover materia orgánica de alta masa molecular o sustancias inorgánicas presentes en aguas residuales. Las resinas de intercambio iónico también son efectivas para la remoción de metales pero tienen alto costo. Los materiales de origen biológico, tales como la pectina empleada como biosorbente en esta investigación, que se utilizan para la remoción de contaminantes se obtienen de materiales de desecho.
La pectina es un buen biosorbente de plomo, considerando que presenta unidades de ácido galacturónico como uno de sus principales componentes. Los grupos carboxílicos presentes en dichos componentes tienden a desprotonarse en solución acuosa conforme aumenta el pH del medio. A mayor pH de la solución, mayor será también su ionización, predominando la forma aniónica del grupo carboxilo. La biosorción de sustancias en la pectina tendrá lugar en la carga negativa de los grupos carboxílicos desprotonados, los cuales interactuarán con especies cargadas positivamente, como el caso de los metales cuya interacción puede ser de naturaleza electrostática o mediante la formación de complejos.
La captación en la pectina de dos cationes metálicos (Pb2+ y Zn2+) ha sido estudiada por Dronnet et al.4 En aquel trabajo observaron que el entrecruzamiento de las cadenas pécticas de la pulpa de betarraga, cuando se trata con epiclorohidrina, tiene más eficiencia que cuando es tratado con formaldehído. La reticulación o entrecruzamiento de las cadenas permite una mayor resistencia a la hidratación.
En un estudio teórico para el cálculo de entalpía para las posibles interacciones entre Pb2+ y los grupos funcionales presentes en el ácido galacturónico Ferreira & Gschaider5 sugirieron que los sitios más favorables para la adsorción del metal se encuentran en los grupos carboxilo en su forma aniónica y el oxígeno etéreo externo a las unidades de ácido galacturónico; el segundo mejor ligante está conformado por el oxígeno etéreo interno. Balaria& Schiewer6 observaron que el mecanismo de la biosorción del plomo en pectinas provenientes de cítricos está determinado principalmente por el números de grupos de ácidos carboxílicos presentes, el cual es mayor en pectina de bajo grado de metoxilación y se encuentra en menor cantidad cuando se tienen altos grados de metoxilación.
García et al.7 realizaron la extracción de la pectina que se empleó como biosorbente a partir de cáscaras de naranja y se estableció un modelo matemático para describir la cinética de biosorción de plomo en pectina reticulada en función de las condiciones de trabajo. Usando soluciones con igual concentración de metal e igual cantidad de biosorbente, pero a diferente pH, se verificó que la biosorción de especies catiónicas como el Pb2+ en pectina se ve favorecida cuando el pH se incrementa a 4,5 – 5,5.7
En este artículo se muestran los ajustes de los resultados de biosorción de Pb2+ en pectina reticulada para diferentes concentraciones de metal y biosorbente mediante los modelos de Langmuir y Freundlich. Los análisis FT-IR ySEM – EDAX y la determinación del DM, %AGAy pKa permitieron el reconocimiento de los principales grupos funcionales característicos, morfología, composición y grado de acidez del biosorbente
PARTE EXPERIMENTAL
Caracterización del biosorbente
Las muestras secas de pectina (0-125 ìm) antes del tratamiento con formaldehído y después fueron analizadas por el método de FT-IR.
El DM y el %AGA para el material péctico, antes del tratamiento con formaldehido y después, fueron determinados en base al método de valoración ácido-base de Schultz y Schweiger (1965), citado por Pagan, J.8
Los pKa para ambas muestras fueron obtenidos a partir del pH correspondiente al momento en que el volumen de solución de NaOH añadido es la mitad del volumen de la neutralización.9
Obtención de la isoterma de biosorción de Pb 2+
Se preparó soluciones de Pb(NO3)2 de 20, 40, 60 y 80 ppm, ajustando al pH óptimo (5,0 3 2 – 5,5) y poniendo en contacto cada solución con 15mg de biosorbente (material péctico reticulado, 0125 ìm)/150 mL. De manera simultánea se realizó la misma operación para 20, 25 y 30 mg de biosorbente y se sometieron a agitación durante 72h en un agitador orbital. Una vez transcurrido el tiempo, el biosorbente se separó de las muestras, se filtró y midió el pH final de las soluciones y se determinó Ceq de acuerdo a
El procesamiento de los datos experimentales para la obtención de los parámetros de las isotermas de Langmuir y Freundlich se realizó con el programa estadístico Origin 6.0.
RESULTADOS Y DISCUSIÓN
DM, %AGAy pKa
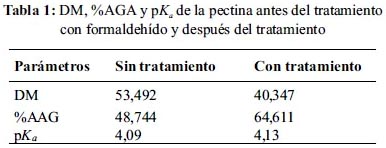
El DM es una característica química muy importante relacionada tanto con el mecanismo de biosorción como con la velocidad de gelificación. La tabla 1 muestra los resultados del DM obtenidos para las pectinas antes del tratamiento con formaldehído y después. Los porcentajes obtenidos (53,5% para pectina antes del tratamiento con formaldehído y 40,3% para la pectina después del tratamiento) se encuentran en un rango medio entre los criterios considerados para la denominación de la pectina de LM y HM.10,11
Estudio del equilibrio de biosorción
La isoterma de sorción de plomo en pectina está representada en la figura 1. El pH óptimo (5,5) descendió al final del proceso a valores comprendidos entre 3,5 y 3,8. La línea continua representa el ajuste a la ecuación de la isoterma de Langmuir y la línea punteada representa el ajuste a la ecuación de la isoterma de Freundlich. La tabla 2 resume los parámetros para ambos modelos obtenidos a partir del procesamiento de datos empleando el programa estadístico Origin 6.0. El coeficiente de correlación no lineal del ajuste al modelo de Langmuir es mayor al que se obtiene cuando se hace el ajuste al modelo de Freundlich. Este valor confirma la alta afinidad que presentan las sustancias pécticas por el Pb(II) en la monocapa (qmax: 185,9 mg/g).
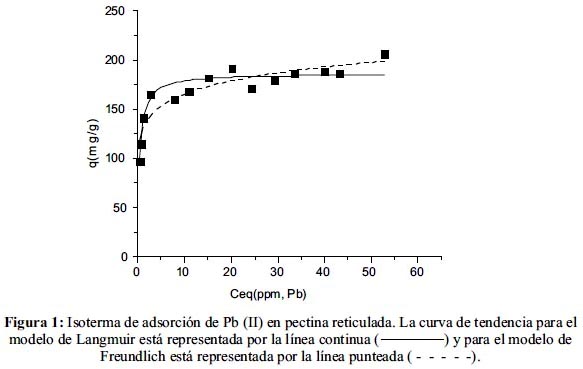
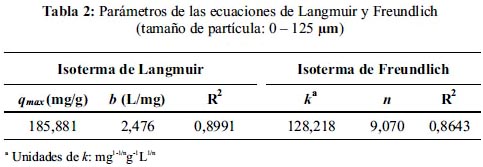
A diferencia de la curva ajustada al modelo de Langmuir, en donde la tendencia converge hacia el valor de la qmax a medida que aumenta Ceq, la curva ajustada al modelo de Freundlich no presenta una región de convergencia por tratarse de una función creciente. Por este motivo, el modelo de isoterma de Freundlich es válido únicamente para sistemas en donde aún no se ha alcanzado el equilibrio.
Estos resultados demuestran que la adsorción química no va más allá de una monocapa en la superficie, por lo que la isoterma de Langmuir es más apropiada para interpretar estos datos.12
La afinidad de la pectina por el plomo puede explicarse por la teoría de los ácidos y bases duros y blandos.13 El tipo de interacción que posiblemente domine podría ser de naturaleza culómbica por tratarse de un ácido medianamente blando (de frontera) como el plomo (II) y bases duras como los oxígenos etéreos internos y externos y los grupos carboxilato de las unidades de ácido galacturónico.
Análisis por FT-IR
La caracterización de la superficie del biosorbente antes del tratamiento con formaldehído, después del tratamiento y después de la biosorción de plomo fue realizada mediante el análisis por Espectroscopía de infrarrojo con transformada de Fourier (FTIR). En general, los cambios producidos en las bandas de un espectro IR para una muestra luego de un proceso determinado, están relacionados con los cambios en la composición de la estructura de dicha muestra.
La espectroscopía FT-IR es un excelente método para el análisis cuantitativo y estructural de pectinas.11 En las figuras 2 y 3 se muestra los espectros obtenidos de la pectina antes del proceso de biosorción del metal y después. La tabla 3 compara las principales vibraciones obtenidas en los espectros característicos para ambas pectinas. Después de la biosorción de PbII, los espectros FT-IR han cambiado poco. La amplia banda mostrada a 3430,26 cm-1 correspondiente al grupo funcional OH y que se encuentra sobre la de 2939,45 cm-1 correspondiente a la absorción del enlace C-H alifático da la apariencia de un pico amplio con picos agudos superpuestos sobre él, característicos en los espectros de los ácidos carboxílicos.14 Mientras que para las muestras reticuladas antes de la biosorción con el metal y después se obtuvieron señales de 3403,75 y 3317,56 cm-1 para el grupo OH y 2937,87 y 2941,44 cm-1 para el enlace C-H alifático, respectivamente. La banda que aparece a 1741,69 cm-1 presenta una frecuencia relativamente alta, característica en los grupos carbonilo de los ésteres.
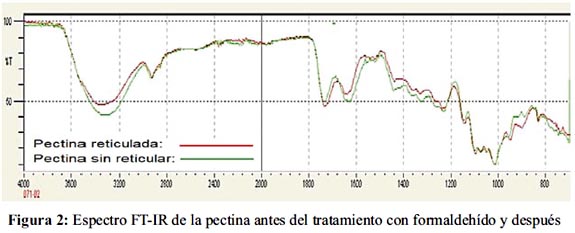
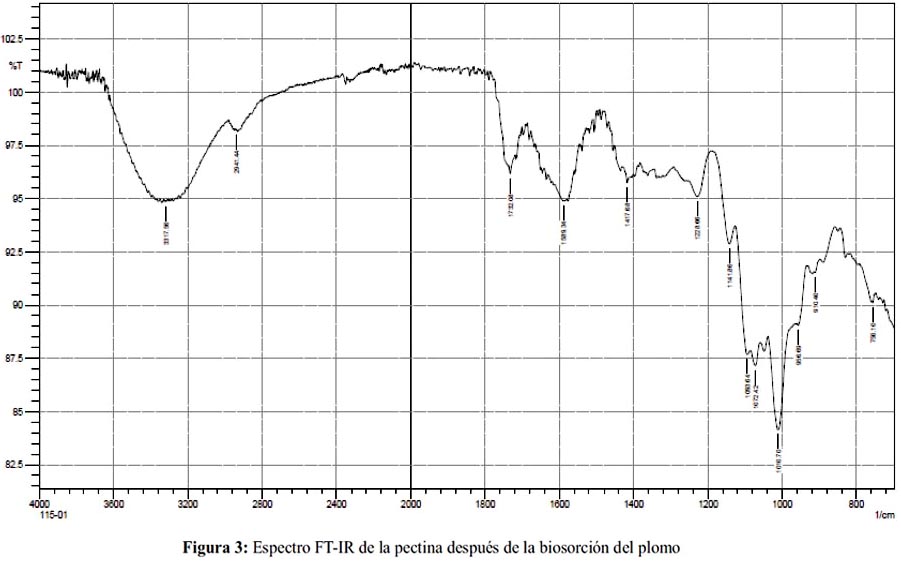
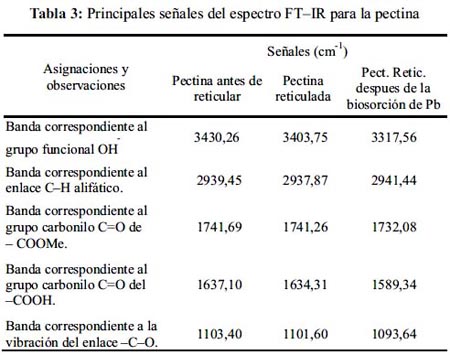
La banda que aparece a 1637,10 cm-1, corresponde a grupos carbonilo de ácidos carboxílicos con dobles enlaces conjugados; sin embargo Franco et al. 15 comentaron que el espectro de la pectina comercial presenta una banda a 1630,17 cm-1 perteneciente al grupo carbonilo del –COO. Las pequeñas disminuciones que se observan en torno a 1600 cm-1 para el grupo carbonilo del COOH de la muestra reticulada antes de la biosorción y después (1634,31 cm-1 y 1589,34cm-1) se deben probablemente a que la densidad de carga, el radio y el peso atómico del catión cambian, creando un nuevo ambiente en torno al grupo carbonílico. Sin embargo, no se observó variaciones significativas en los picos correspondientes a los grupos carbonilo del COOMe debido a la ausencia del protón ácido.
Análisis por SEM-EDAX
El método de microscopía electrónica de barrido, SEM (scanning electron microscope) puede ser empleado para estudiar la morfología de las superficies y mediante el análisis con espectroscopía de rayos X con energía dispersiva, EDAX (Energy-dispersive X-ray spectroscopy) se puede estudiar la composición elemental de los elementos existentes de un material determinado. Con ambas técnicas se caracterizó la superficie del biosorbente reticulado antes de la biosorción de plomo y después.
Las figuras 4 y 5 muestran las microfotografías SEM y el espectro EDAX para la pectina reticulada antes y después de la biosorción de plomo. En el espectro EDAX que se muestra en la figura 4 se observa una señal muy intensa de C y otra de menor intensidad de O, características en el biopolímero. El pico del elemento plomo puede observarse en la figura 5. También se determinó picos de Au en ambos espectros debido al tratamiento con polvo de oro utilizado antes de la medición.


CONCLUSIONES
Los valores obtenidos para DM, %AGA y pKa demuestran que las fuertes propiedades ácidas que presenta el material péctico obtenido de cáscaras de naranja lo convierten en un potencial biosorbente para la eliminación de metales pesados.
Cuando la solución de plomo presenta mayor concentración se favorece el proceso, aumentando la capacidad de sorción de la pectina en el equilibrio debido a que la mayor cantidad de iones del metal que presenta el medio aumenta la probabilidad de ocupación de sitios activos.
La superficie de contacto conformada por los sitios activos del biosorbente es mayor cuando aumenta la concentración del mismo, por lo que se produce una mayor disminución de la concentración del metal en la solución, en comparación con aquellos sistemas en donde se emplean concentraciones menores de biosorbente.
La sustitución de un protón ácido por el metal en la pectina reticulada después del proceso de biosorción produce un cambio en la densidad de carga y el radio iónico que se refleja, principalmente, en la disminución de la frecuencia de vibración IR en el grupo carbonilo del –COOH en la pectina.
El análisis por SEM-EDAX permitió determinar la composición elemental antes del proceso de biosorción y después.
REFERENCIAS
1. Veglio, F. &Beolchini F. Rev. Removal of metals by biosorption. Hydrometallurgy 1997; 44: 301-316.
2. Volesky, B. &Holan Z. R. Rev. Biosorption of Heavy Metals. Biotechnol. Prog 1995; 11: 235-250.
3. Debbaudt, A.L., Ferreira, M.L. & Gschaidera, M.E. Theoretical and experimental study of M2+ adsorption on biopolymers. III. Comparative kinetic pattern of Pb, Hg and Cd. Carbohydrate Polymers 2004; 56: 321-332.
4. Dronnet, V.M., Axelos, M.A.V., Renard, C.M.G.C. & Thibault, J. Improvement of the binding capacity of metal cations by sugar-beet pulp. 1. Impact of cross-linking treatments on composition, hydration and binding properties. CarbohydratePolymers 1998; 35: 29-37.
5. Ferreira, M. L. & Gschaider Theoretical and Experimental Study of Pb and Hg Adsorption on Biopolymers, 1. Macromolecular Bioscience 2001; 6: 233-248.
6. Balaria, A. & Schiewer, S. Assessment of biosorption mechanism for Pb binding by citrus pectin. Separation and Purification Technology 2008; 63: 577-581.
7. García, V., Yipmantin, A., Guzmán, E., Pumachagua, R. & Maldonado, H. Estudio de la cinética de biosorción de iones plomo en pectina reticulada proveniente de cáscaras de cítricos. RevSocQuím Perú. 2011; 77 (3): 173-181.
8. Pagan, J Degradacion enzimática y características físicas y químicas de la pectina del bagazo de melocotón. 1999; Biblioteca Virtual Miguel de Servantes. En http://www.cervantesvirtual.com/ Leído el 19/07/11.
9. Skoog, D. A., West, D., M., Holler, F., J. & Crouch, S., R. Fundamentos de Química Analítica. Ed. Thomson, S. A. Octava edición, 2005.
10. El-Nawawi, S.A. & Heikal, Y.A., Factors affecting gelation of high-ester citrus pectin. Process Biochemistry 1997; 32(5): 381-385.
11. Sinitsya, A., Èopíková, J., Prutyanov, V., Skoblya, S. & Machoviè, V. Amidation of highly methoxylated citrus pectin with primary amines. Carbohydrate Polymers 2000; 42: 359-368.
12. Castellan, G.W. Physical Chemistry. Massachusetts. Addison-Wesley Publishing Company, 1983.
13. Atkins, P., Overton, T., Rourke, J., Weller, M. & Armstrong, F. Shriver & Atkins Química Inorgánica. Ed. McGraw Hill / Interamericana Editores, S. A. de C. V. 2008.
14. Wade, L. Química Orgánica. Ed. Prentice Hall Hispanoamericana, S. A. 2002.
15. Franco, M., Ramírez, M., García, R., Bernal, M., Espinosa, B., Solís, J., & Duran, C. () Aprovechamiento integral de residuos agroindustriales: Cáscara y pulpa de cacao para la producción de pectinas. Revista Latinoamericana el Ambiente y las Ciencias 2010; 1(2): 45-66.
Recibido el 27-06-2013
Aprobado el 23-08-2013













