Introducción
Las úlceras cutáneas son problemas de salud frecuentes cuya cronicidad es el principal detonante de complicaciones, como las infecciones. Por la composición del estrato córneo, el pH superficial basal de la piel está cerca de 51. Sin embargo, ante un daño tisular (o herida) la concentración efectiva de iones hidronio en el medio varía hasta terminar la fase de granulación o proliferación, donde el pH se encuentra alrededor de 7,52. Si la herida llega a esta fase, se la clasifica como aguda o fisiológica; por otro lado, si continúa desordenadamente entre la fase inflamatoria y la proliferativa por más de tres semanas, se la considera crónica o patológica1. Este tipo de herida no logra normalizar los valores de pH ácidos debido a las deficiencias en el mecanismo reparador; por lo que se mantiene en medio alcalino, propenso al crecimiento bacteriano1,2.
Ante la problemática, diversas terapias que se asemejan al mecanismo reparador natural son estudiadas, como lo es el uso de factores de crecimiento. El factor de crecimiento derivado de plaquetas-BB (PDGF-BB) es una glicoproteína catiónica con punto isoeléctrico a pH 9,8; que ha demostrado efectividad en acelerar el proceso de cicatrización in vitro con el aumento en la proliferación de fibroblastos3,4. Sin embargo, los efectos terapéuticos de su aplicación en monoterapia no se comparan con el sinergismo junto a otros factores de crecimiento4. Además, uno de los principales inconvenientes del uso de este tratamiento en úlceras cutáneas crónicas, es la inactivación de los factores de crecimiento por altos niveles de metaloproteasas. Es por ello que una liberación funcional con la adecuada matriz que no solo sea compatible, sino que promueva la actividad de los factores de crecimiento, es crucial5.
Este trabajo propone un hidrogel como forma farmacéutica que pueda retardar la liberación del PDGF-BB usando una matriz de β-quitosano. La estructura tridimensional estará formada por una red de polímeros entrecruzados con un alto número de grupos o dominios hidrofílicos que, al atraer agua, se “hinchan” hasta llegar a un equilibrio entre la fuerza que ejercen las moléculas del medio al entrar a la matriz (fuerza expansiva) y la fuerza de atracción entre las cadenas del polímero (fuerza retráctil)6. El β-quitosano es un polímero con muchas propiedades dependiendo del grado de desacetilación y el peso molecular promedio: antibacteriano, antifúngico, mucoadhesivo, analgésico, hemostático, biodegradable, biocompatible y promotor de la proliferación celular mediada por factores de crecimiento5. Estas redes de quitosano pueden seguir tres mecanismos de encapsulación dependiendo de la IFA cargada: difusión, atrapamiento o unión covalente6. Los enlaces covalentes son las uniones por excelencia en la formación de la red, aunque no son las únicas. Los puentes de hidrógeno y las interacciones hidrofóbicas juegan un rol importante en la formación de un hidrogel de interacciones físicas7.
El objetivo del trabajo es estudiar la influencia del pH (6,5 y 7,4) en la liberación de uno de estos factores de crecimiento (PDGF-BB) a partir de una matriz de β-quitosano bajo dos concentraciones de lisado plaquetaria o LP (6 % y 12 %). Con ello, se sabrá si el diseño de la forma farmacéutica es teóricamente efectivo en el tratamiento de úlceras cutánea. Se espera que la formulación contenga suficientes uniones covalentes y/o iónicas entre la proteína y el polímero para que, al exponerse a variaciones en el pH del medio, como ocurre en las úlceras cutáneas, retarde la liberación de PDGF-BB.
Parte experimental
El polímero de β-quitosano fue provisto por el Laboratorio de la Unidad de Biominería y Medio Ambiente de la Universidad Peruana Cayetano Heredia. La muestra de PRP se obtuvo de un individuo sano sometido a plasmaféresis posterior al consentimiento informado, en cumplimiento a las buenas prácticas clínicas a cargo del Laboratorio de Inmunología de la Universidad Peruana Cayetano Heredia. Para la cuantificación de PDGF-BB humano se usó el Kit DuoSet ELISA Development Systems: R&D Systems (Número de catálogo: DY220).
Caracterización del β-Quitosano
La materia prima fue triturada con un molino analítico modelo 4301 - 02, 50/60 Hz, 180 W, 20 000 RPM, marca Cole-Parmer Instrument Co. y tamizada por malla de acero W.S. TYLER n°60, para tener un tamaño de partícula homogéneo. El % humedad relativa se determinó por gravimetría, llevando a peso constante (diferencia de 0,05 g) una cantidad de muestra expuesta a 105 °C(8).
El grado de desacetilación (GD) se determinó mediante una valoración potenciométrica. Se disolvió β-quitosano en un exceso conocido de HCl 0,2N; la misma que fue titulada con una solución de NaOH 0,05N. Las medidas de pH fueron graficadas identificando dos puntos de inflexión; la diferencia en mililitros entre ambos puntos corresponde al ácido consumido para la protonación de grupos amino, los que permiten determinar el GD del quitosano8.
 Donde: V es la diferencia de volúmenes (litros) entre el segundo y primer punto de inflexión y PEq (NH2) es 16,02258 g/Eq.
Donde: V es la diferencia de volúmenes (litros) entre el segundo y primer punto de inflexión y PEq (NH2) es 16,02258 g/Eq. Para hallar el peso molecular promedio se aplicó su relación a la viscosidad intrínseca. Para ello se usó un viscosímetro de Ostwald con diámetro 0,5 mm y a condiciones ambientales controladas (25°C ± 0,1). El solvente usado fue Ácido acético 0,3M / Acetato de Sodio 0,2M8,9.
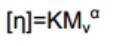 Donde (η) es la viscosidad intrínseca, Mv es el peso molecular promedio, K y α son constantes dadas para un sistema soluto-solvente. Para la ecuación se consideraron los valores de 0,076 mLg-1 y 0,76 para α y K, respectivamente; en función del GD, origen del quitosano y solvente usado.
Donde (η) es la viscosidad intrínseca, Mv es el peso molecular promedio, K y α son constantes dadas para un sistema soluto-solvente. Para la ecuación se consideraron los valores de 0,076 mLg-1 y 0,76 para α y K, respectivamente; en función del GD, origen del quitosano y solvente usado. Elaboración del hidrogel, incubación y cuantificación de PDGF-BB
El experimento sigue un diseño factorial fraccionado de dos niveles: %LP y pH del medio de liberación.
El LP derivó del PRP obtenido tras someter a un donante sano a una plasmaféresis por centrifugación de flujo discontinuo. Este procedimiento permite la separación del plasma de los otros componentes sanguíneos, logrando obtener al finalizar un pool de plasma puro y rico en plaquetas, que para este trabajo tuvo una concentración de 1,5 X 106 plaquetas.
Para obtener el LP, se tomó 10 mL del PRP y sometió a un shock de temperatura para lisar de plaquetas. Para esto, se congeló a -70 °C por 12 horas y descongeló a 37 °C (aproximadamente 10 minutos), lo que se denomina un ciclo. Después de tres ciclos, se centrifugó la muestra a 2500 rpm durante 15 minutos; el sobrenadante es el LP11.
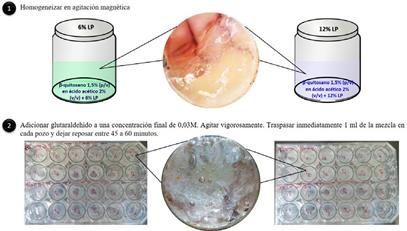
Para la elaboración del hidrogel, se preparó la solución de β-quitosano 1,5% (p/v) en ácido acético 2% (v/v)12,13, luego se adicionó LP al 6 % o 12 % (v/v) hasta homogeneizar con ayuda de un agitador magnético. Por último, se adicionó glutaraldehído al 25 % con una concentración final de 0,03M12 e inmediatamente agitar vigorosamente. Sin dejar reposar más de un 1 minuto, se traspasó 1 ml de la mezcla en cada pozo de la placa de 24 pozos y se dejó reposar entre 45 a 60 minutos.
En referencia al pH del medio, a cada pozo con el hidrogel de la placa se agregó 400 µL del PBS a un pH determinado (6,5 o 7,4). Es importante cumplir con el tiempo de reposo para la completa formación del hidrogel antes de colocar el PBS; de lo contrario, la consistencia del mismo puede destruirse.
Una vez colocado el PBS, la placa permaneció en la incubadora (5 % CO2) hasta llegar el tiempo para las cuantificaciones de PDGF-BB, las cuales se realizaron por triplicado de cada pozo, bajo las especificaciones del producto DuoSet® ELISA para PDGF-BB (Número de Catálogo: DY220).
Pruebas estadísticas para el contraste de hipótesis
Se comparó la concentración de PDGF-BB como variable numérica en dos grupos no relacionados en base al porcentaje de lisado plaquetario. Los datos en ambos grupos fueron sometidos a pruebas de normalidad, linealidad y homogeneidad de varianzas, habiéndose decidido usar la prueba no paramétrica de Kruskal-Wallis.
Resultados y discusión
Caracterización del β-Quitosano:
El β-Quitosano usado como materia prima se caracterizó por un tamaño de partícula de 250 µm como máximo y un porcentaje de humedad relativa promedio de 12,47 ± 0,24. El grado de desacetilación promedio (GD) expresado en porcentaje, una de sus principales características, fue de 94,53 ± 0,84. Mientras que el peso molecular promedio estimado fue de 145,94 kDa (R2 = 0,9876).
Cuantificación de la concentración de PDGF-BB in vitro:
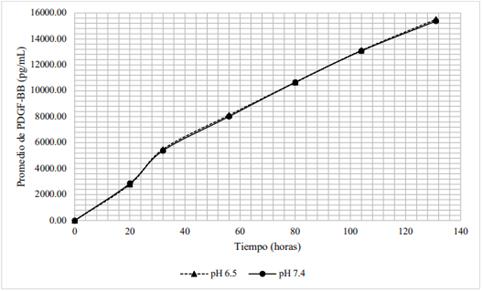
La cantidad de PDGF-BB liberada en el tiempo a partir del hidrogel con 6 % de lisado plaquetario difiere al variar el pH de 6,5 a 7,4. Tal y como muestra la tabla 1, durante las 32 horas, las concentraciones de PDGF-BB alcanzadas a pH de medio 6,5, fueron superiores a aquellas concentraciones halladas a pH de medio 7,4. Como se observa en la figura 3, ambas curvas siguen una tendencia similar; además, transcurrida una hora las concentraciones difieren en un 27 %; a las 3 horas, 33 %; a las 7 y 10 horas, 31 %; a las 20 horas, 29 % y a las 32 horas, 26 %.
Tabla 1 Concentraciones promedio de PDGF-BB (pg/mL) a partir de hidrogeles con 6 % de lisado plaquetario en medios con pH 6,5 y pH 7,4.
| Tiempo (horas) | Concentración promedio de PDGF-BB (pg/mL) liberado | ||
|---|---|---|---|
| En medio con pH 6,5 | En medio con pH 7,4 | ||
| 0 | 0,00 | 0,00 | |
| 1 | 1827,14 | 1321,61 | |
| 3 | 3852,28 | 2555,97 | |
| 7 | 5986,64 | 4091,70 | |
| 10 | 8370,75 | 5780,86 | |
| 20 | 10604,03 | 7566,17 | |
| 32 | 12687,66 | 9396,58 | |
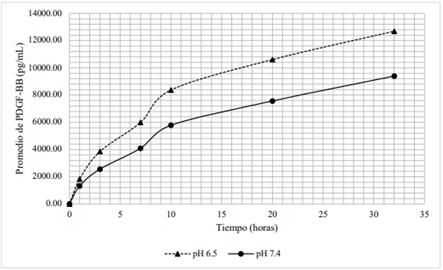
Figura 6 Distribución de las concentraciones promedio de PDGF-BB (pg/mL) a partir de hidrogeles con 6 % de lisado plaquetario en medios con pH 6,5 y pH 7,4.
Por el contrario, de acuerdo a la tabla 2 y la figura 4, la cantidad de PDGF-BB liberada en el tiempo a partir del hidrogel con 12 % de lisado plaquetario no difiere al variar el pH de 6,5 a 7,4.
Tabla 2 Concentraciones promedio de PDGF-BB (pg/mL) a partir de hidrogeles con 12 % de lisado plaquetario en medios con pH 6,5 y pH 7,4.
| Tiempo (horas) | Concentración promedio de PDGF-BB (pg/mL) liberado | |
|---|---|---|
| En medio con pH 6,5 | En medio con pH 7,4 | |
| 0 | 0,00 | 0,00 |
| 20 | 2784,36 | 2856,95 |
| 32 | 5491,42 | 5387,39 |
| 56 | 8123,47 | 8014,33 |
| 80 | 10647,11 | 10655,14 |
| 104 | 13111,28 | 13079,27 |
| 131 | 15503,00 | 15372,99 |
Contraste de hipótesis
Los datos para los dos grupos: hidrogel con 6 % de LP e hidrogel con 12 % de LP, siguen una distribución normal, mas no presentan linealidad ni homogeneidad de varianza. Es así que se usó la prueba de Kruskal-Wallis para contrastar la hipótesis nula en ambos grupos. Los resultados, como muestra la tabla 3, respaldan las figuras 3 y 4.
Tabla 3 Contraste de hipótesis con la prueba Kruskal-Wallis.
| Hidrogel con | Hipótesis nula | Significancia (p) | Decisión |
|---|---|---|---|
| 6 % LP | La distribución de concentración de PDGF-BB (pg/mL) es la misma entre las categorías de pH. | < 0,05 | Rechaza la hipótesis nula |
| 12 % LP | La distribución de concentración de PDGF-BB (pg/mL) es la misma entre las categorías de pH. | > 0,05 | Conserva la hipótesis nula |
Se muestran significancias asintóticas. El nivel de significación es 0,05.
Trabajos como el de Yang et al, 2011 argumentan que la aplicación de PRP en úlceras inducidas en ratas no tiene actividad cicatrizante; esto debido a la liberación instantánea de factores de crecimiento (FCs) y el número limitado de receptores. Como consecuencia, la fracción de FCs que no llegó a unirse a su receptor, se inactiva, influyendo negativamente en el proceso cicatrización14. Es por ello la importancia de usar quitosano como matriz de formas farmacéuticas, y así lograr retardar la liberación12,13.
El quitosano no es una entidad química, por lo que es necesario caracterizar la muestra usada en cada investigación. Como se aprecia en la figura 2, las características del β-quitosano como GD elevado (94,53 %) y PM bajo (145,94 kD)9,10, otorgan al β-quitosano propiedades particulares como buena solubilidad, mayor participación en interacciones iónicas, actividad antimicrobiana y fungistática; todas ellas basadas en la presencia de mayor cantidad de grupos amina. Estos grupos funcionales son potencialmente protonables, lo que mejora la solubilidad, interacciones iónicas y la actividad fungistática. Por otro lado, la actividad antimicrobiana depende más del PM, el cual mientras menor sea, facilita el movimiento e interacción con la membrana celular del microbio15,16.
La forma farmacéutica propuesta hace uso de este β-quitosano como matriz en el hidrogel para retardar la liberación de PDGF-BB, cuya medición con respecto al tiempo se muestra en las figuras 3 y 4. La figura 3 muestra que la liberación de PDGF-BB del hidrogel elaborado con 6 % de LP sí está influenciada por el pH. La tendencia de ambas curvas es similar, pues la liberación de PDGF-BB se da de manera muy rápida, conocido como efecto burst. La influencia del pH en la liberación de PDGF-BB se explica al considerar la composición de aminoácidos y su punto isoeléctrico (pH 9,8). Expuestos a un medio ligeramente ácido (pH 6,5), la gran cantidad de aminoácidos básicos y polares estarán en su forma catiónica; algunos de los aminoácidos polares estarán en su forma neutra y/o cargados positivamente; los aminoácidos ácidos estarán en su forma neutra y/o cargado positivamente; mientras que los aminoácidos básicos, estarán cargados positivamente. Todo conlleva a una repulsión de cargas entre PDGF-BB y la matriz de β-quitosano de manera brusca.
La figura 4 demuestra que la liberación de PDGF-BB del hidrogel elaborado con 12 % de LP no está influenciada por el pH. En este caso las curvas además de seguir la misma tendencia, llegan a superponerse. Estos resultados no pueden ser explicados solo por interacciones iónicas, pues de ser así se verían influenciados por el pH. Es válido pensar que el aumento en el porcentaje de LP implica un aumento de los grupos reactivos para generar nuevos enlaces covalentes. Pero, no todos estos enlaces son fuertes. La formación de bases de Schiff es otra posible reacción entre los grupos ceto o carboxilo, presente en aminoácidos de PDGF-BB con las aminas secundarias del β-quitosano para generar enlaces imina. Estos enlaces son fácilmente hidrolizables a pH ácidos y estables en pH neutros o alcalinos7,15.
En el mismo trabajo de Yang et al, 2011 la liberación sostenida de PDGF-BB a partir de un gel de fibrina-heparina lo atribuye a interacciones electrostáticas entre los FCs y la heparina (macromolécula aniónica)14. Esta es la razón por la cual esta forma farmacéutica incluye glutaraldehído en pequeñas concentraciones con la finalidad de asegurar la liberación retardada. Sin embargo, los resultados obtenidos en este trabajo dan motivos para no excluir la formación de enlaces imina ni interacciones iónicas, abriendo la posibilidad de prescindir el uso de glutaraldehído.
La figura 4 consolida el logro de diseñar una forma farmacéutica que retarde la liberación de PDGF-BB usando un hidrogel cuya matriz de β-quitosano carga 12 % de LP. No obstante, una de las grandes interrogantes es conocer realmente cómo es que PDGF-BB se entrampa a la matriz de β-quitosano. Los argumentos previos son especulaciones hechas a partir de la teoría, pues se requerían de otros equipos para demostrar la formación de nuevos enlaces.
Conclusiones
El β-quitosano con el que se trabajó, tiene 12,47 % de humedad, un grado de desacetilación de 94,53 % y peso molecular promedio de 145,94 kD.
La liberación del factor de crecimiento derivado de plaquetas-BB del hidrogel de β-quitosano con 6 % de lisado plaquetario sí está influenciada por el pH (p < 0,05).
La liberación del factor de crecimiento derivado de plaquetas-BB del hidrogel de β-quitosano con 12 % de lisado plaquetario no está influenciada por el pH (p > 0,05).