INTRODUCCIÓN
Los metales pesados son altamente perjudiciales para la salud humana1, incluso a bajas concentraciones debido a su bioacumulación. La variedad de técnicas y procesos de tratamiento químico desarrollados para eliminar a los metales pesados del agua contaminada incluyen principalmente a los procesos de: precipitación2, intercambio de iones3, nanofiltración y ósmosis inversa4, sin embargo, la adsorción se presenta como una mejor alternativa debido a su bajo costo, alta eficiencia, baja probabilidad de formación de productos secundarios y una alta posibilidad de reuso de los materiales adsorbentes5.
El uso de partículas magnéticas es un recurso muy utilizado y atractivo por la facilidad de poder usarlos y recuperarlos mediante un campo magnético externo y por su comportamiento superparamagnético a temperatura ambiente con alta magnetización de saturación2, por ello, la magnetita está siendo usada en trabajas que involucran la remoción de metales pesados tóxicos provenientes de terrenos mineros o muy aledaños, que es una problemática actual y de gran interés6.
La hidroxiapatita ya antes ha sido utilizada en diferentes ámbitos como: producción de materiales fluorescentes7, portadores de fármacos8, aplicaciones en el campo de biomedicina9 y medioambiental10. Estos usos mencionados se producen debido a que posee ciertas propiedades como: alta estabilidad, compatibilidad ambiental, alta área superficial, actividad fotocatalítica11.
Por otra parte, los nanotubos de carbono (CNT), representan materiales de interés actual utilizados como complementos12 (recipientes con filtros basados en nanotubos de carbono) o en la elaboración de materiales aplicados al tratamiento de una amplia variedad de contaminantes debido a que las nanoestructuras de carbón presentes en ellos le conferirían una mayor superficie de contacto con el contaminante. Estudios revelan la preferencia de utilizar nanotubos de carbono de pared múltiple (MWCNT) sobre los de pared simple, debido a que estos últimos presentan fuertes tendencias hacia una aglomeración, lo cual disminuiría su efectividad como material adsorbente13.
Finalmente, en este trabajo se ha realizado la síntesis de magnetita (Fe3O4) recubierta con citrato, síntesis de la hidroxiapatita (HAp) y la preparación de diferentes biosorbentes (compósitos) basados en la combinación de los materiales de partida mencionados, con el fin de poder aplicarlas en la resolución y mejora de problemas relacionados con la calidad del agua.
PARTE EXPERIMENTAL
Materiales
Los reactivos FeCl3.6H2O y FeCl2.4H2, NH4OH y citrato de sodio y N2 ultrapuro fueron utilizados en la síntesis de la magnetita. El Ca(NO3)2.4H2O, (NH4)2HPO4, NH 4OH, H3PO4, Ca(OH)2, Ca(NO3)2.4H2O, C6H5Na3O7.2H2O y Na3PO4.12H2O fueron utilizados por diversos métodos para la síntesis de la hidroxiapatita (HAp) y la preparación de los compósitos. Todos los reactivos químicos usados en las síntesis fueron de grado analítico y adquiridos en Merck Peruana S.A. Los nanotubos de carbono de pared múltiple (MWNCT), utilizados en este trabajo, son de uso comercial y fueron suministrados por Sigma-Aldrich Co., Ltd, Estados Unidos.
Síntesis de magnetita mediante coprecipitación y estabilización con citrato2
La magnetita fue sintetizada utilizando al FeCl3.6H2O y FeCl2.4H2O como precursores metálicos. La preparación consistió básicamente en la precipitación a partir de la mezcla de cloruros (relación molar Fe3+:Fe2+ de 2:1) añadiendo gota a gota NH4OH al 25 % (10 mL) en agitación continua. El NH4OH fue utilizado como agente precipitante. La mezcla resultante se lavó cuatro veces con agua ultrapura, se dejó en reposo y finalmente se separó el precipitado de color negro (magnetita) utilizando un campo magnético externo de un imán. La magnetita obtenida se secó durante 1 h a 100 °C. El agua utilizada para la preparación de la mezcla de cloruros y para el recubrimiento con citrato fue sometida a una atmósfera inerte de N2 durante 1 h a 25 °C. Para la estabilización con citrato, la magnetita se dispersó en 50 mL de agua ultrapura y se sometió a un baño de ultrasonido durante 5 min. La dispersión obtenida se sometió a un baño María a 70 °C, en esas condiciones, se añadió gota a gota 10 mL de citrato de sodio 0,1 M y se dejó enfriar, manteniendo la agitación por 12 h. La magnetita estabilizada se separó por decantación con ayuda de un imán. Finalmente, se hicieron lavados con agua ultrapura, hasta llevarlo a neutralidad y el material obtenido se secó en estufa.
Preparación de hidroxiapatita mediante método químico14
Se prepararon soluciones de Ca(NO3)2.4H2O 0,33 M y de (NH4)2HPO4 0,12 M. La solución de amonio se adicionó gota a gota sobre la solución de calcio bajo agitación continua durante 1 h a 90 °C. Luego de este tiempo, se añadió por goteo 5 mL de NH4OH al 25 % y se dejó en reposo durante 10 días para la precipitación de la hidroxiapatita. El precipitado obtenido se separó por centrifugación, luego se lavó cuatro veces con agua ultrapura y se secó a 250 °C durante 1 h. Finalmente, el precipitado se calcinó a 1000 °C durante 3 h.
Preparación de hidroxiapatita mediante método sol-gel15
Se prepararon soluciones de H3PO4 0,6 M y Ca(OH)2 1,0 M, las cuales fueron mezcladas a una velocidad de 1,5 mL/min, en agitación continua durante 1 h a 90 °C, luego de ello se agitó la mezcla durante 1 h adicional hasta completar la reacción. La mezcla resultante se dejó en reposo por 72 h para la precipitación, luego de ello, se procedió a lavar con abundante agua ultrapura hasta neutralidad (pH= 7). Finalmente, el polvo de hidroxiapatita se llevó a la mufla a 1000 °C durante 3 h.
Preparación de hidroxiapatita mediante método hidrotermal16
Se prepararon soluciones de Ca(NO3)2.4H2O 0,01 M y C6H5Na3O7.2H2O 0,0133 M, las cuales fueron mezclados en agitación constante durante 10 min. Luego de ello, se añadió lentamente 15 mL de una solución de Na3PO4.12H2O 0,006 M bajo agitación vigorosa. La mezcla resultante se llevó a una autoclave de acero a 150 ° C durante 24 h (tratamiento hidrotermal) y el producto obtenido se centrifugó a 15000 rpm durante 10 min. El precipitado se lavó con agua ultrapura tres veces y finalmente se secó a 100 °C durante 1 h.
Síntesis de compósito Fe3O4/HAp17
Se preparó una solución acuosa de 1,85 mmol de FeCl2.4H2O y 37,0 mmol de FeCl3.6H2O, a la cual se le agregó 12 mL de NH4OH bajo agitación constante. A esta mezcla se le agregó ácido cítrico 0,1 M (pH=10), bajo calentamiento de 90 °C y atmósfera inerte de N2. El sólido resultante fue obtenido mediante separación con un imán, fue lavado con agua ultrapura y se dejó en reposo durante 10 min. Luego de ello, se adicionó 100 mL de una solución de Ca(NO3)2.4H2O y (NH4)2HPO4 1:1 (pH= 11) en agitación continua durante 30 min. La mezcla resultante se sometió a calentamiento a 90 °C durante 2 h. Terminado este proceso, se dejó envejecer el producto por un periodo de 12 h a temperatura ambiente. Finalmente, el compósito obtenido se filtró varias veces con agua ultrapura hasta llegar a neutralidad y fue secado al vacío.
Síntesis de compósito Fe3O4/MWCNT
Se dispersó 250 mg de MWCNT en una solución acuosa de 1,85 mmol de FeCl2.4H2O y 37,0 mmol de FeCl3.6H2O. Luego de ello, se agregó 12 mL de NH4OH, bajo agitación constante; a la mezcla obtenida se le agregó C6H8O7 0.1 M (pH= 10) bajo atmósfera inerte de N2 y en calentamiento a 90 °C. El sólido resultante fue separado por decantación con ayuda de un imán y luego fue lavado con agua ultrapura.
Síntesis de compósito Fe3O4/MWCNT/HAp
Para la preparación del compósito Fe3O4/MWCNT/HAp se utilizó la Fe3O4/MWCNT preparado anteriormente. A este compósito se le añadió 100 mL de solución de Ca(NO3)2.4H2O y (NH4)2HPO4 1:1 (pH= 11) bajo agitación constante durante 30 min. La mezcla resultante se sometió a calentamiento a 90 °C durante 2 h. Una vez terminado el proceso se dejó envejecer el producto por un aproximado de 12 h a temperatura ambiente. El producto obtenido se filtró varias veces con agua ultrapura hasta llegar a neutralidad para luego ser llevado al vacío y posteriormente a la estufa a 150 °C.
Caracterización de los materiales
Las propiedades magnéticas de los materiales fueron analizados mediante un magnetómetro de muestra vibrante (VSM), construido en el Laboratorio de Materiales Nanoestructurados de la Univesidad Nacional de Ingeniería, Perú. Los espectros de infrarrojo con transformada de Fourier (FTIR) fueron obtenidos usando un espectrómetro de reflectancia total atenuada (ATR, IR-Prestige 21, Shimadzu, Europa) en el rango de 4000 a 400 cm-1. Asimismo, los grupos funcionales presentes en los diversos materiales sintetizados fueron obtenidos a partir del espectro Raman utilizando un espectrómetro Raman (XploRA, HORIBA Scientific, Francia) con láser de 532 o 785 nm. La morfología y microestructuras de la superficie de los materiales sintetizados y perlas preparadas fueron examinados utilizando el microscopio electrónico de barrido (SEM EVO MA10, Zeiss, Alemania). Las medidas voltamperométricas se realizaron con un potenciostato/galvanostato PalmSens® y una celda convencional de tres electrodos: electrodo de trabajo: carbón vítreo, electrodo auxiliar: alambre de platino y electrodo de referencia: electrodo Ag/AgCl saturado con KCl. Como electrolito se utilizaron buffer de fosfato.
Pruebas de remoción de metales pesados usando el compósito Fe3O4/MWCNT/HAp
Para este caso, se escogió al As(V) dado que es uno de los metales pesados más contaminantes y de actual interés en la comunidad científica.
La remoción del As(V) se realizó utilizando como adsorbente al compósito de Fe3O4/ MWCNT/HAp. Esto se debe a que la hidroxiapatita mejora la preferencia de un compuesto a la adsorción de metales y la magnetita le conferiría la capacidad de recuperación y un posible reuso18.
Se evaluó el efecto de pH, para lo cual se utilizó una solución de As(V) 1 mg/L en un rango de pH de 6 a 11, a las cuales se le añadió 10 mg de compósito y se dejó en agitación por 4 h, pasado este tiempo se midió la concentración remanente. Se evaluó el efecto de tiempo de contacto, para lo cual se utilizó 20 mL de una solución de arsénico 1 mg/L y se le añadió 10 mg de compósito, se dejó agitando durante 4 h y luego se midió la concentración remanente. Se evaluó el efecto de masa de adsorbente, para lo cual se trabajó con 20 mL de una solución de arsénico 1 mg/L y se agregó 1,5; 6,2; 10,9; 15,6 y 22,1 mg de compósito y se dejó agitando durante 4 h.
Las concentraciones iniciales y remanente (en todas las pruebas) fueron medidas utilizando un espectrofotómetro de absorción atómica (AA). Luego de cada proceso de remoción realizado, los materiales fueron recuperados con un imán mediante procesos de decantación.
RESULTADOS Y DISCUSIÓN
Caracterización de magnetita
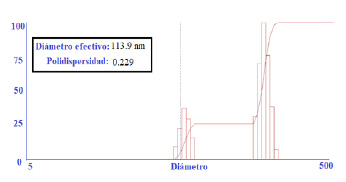
Al utilizar la técnica de dispersión dinámica de luz (DLS) para la magnetita estabilizada con citrato, se obtuvieron partículas con un diámetro efectivo de 113,9 nm y una polidispersidad de 0,229 (figura 1).
La nanomagnetita estabilizada (Fe3O4-citrato) fue caracterizada mediante espectroscopía Raman (figura 2), mediante la cual se pudo obtener sus principales picos característicos: a 219 y 281 cm-1 los picos asociados al enlace Fe-O (T2g), a 398 cm-1 el pico asociado al OH-presente en la superficie del material, a 601 cm-1 el pico asociado al Fe-O (A1g) y finalmente el pico más intenso a 1311 cm-1 asociado al magnón. Por otra parte, se realizó la caracterización de Fe3O4 mediante magnetometría de muestra vibrante, obteniéndose la curva mostrada en la figura 2, la cual indica que el material obtenido muestra un comportamiento ferromagnético19 y de la cual se obtuvo además los siguientes parámetros: magnetización de saturación (Ms) de 64,2 Am2kg-1, coercitividad cero y magnetización remanente (Mr) de 9,81 Am2kg-1.
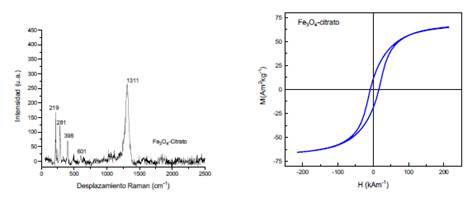
Figura 2 Espectro Raman (izquierda) y curva de magnetización (derecha) de magnetita estabilizada con citrato (Fe3O4-citrato).
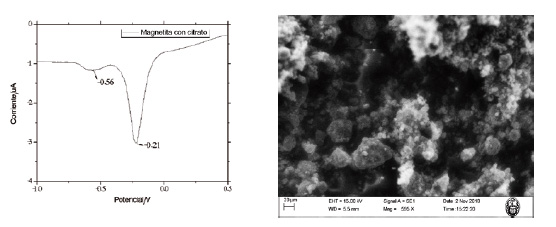
La magnetita-citrato también fue caracterizada mediante voltamperometría de separación anódica de onda cuadrada (figura 3), obteniéndose dos picos a -0,24 y 0,64 V, los cuales son característicos de la magnetita ya que representan la reducción de dos sitios cristalinos: uno tetraédrico (ocupado por Fe+3) y otro octaédrico (ocupado por Fe+2 y Fe+3 en cantidades iguales). Además, la muestra de magnetita sintetizada fue caracterizada mediante microscopía electrónica de barrido (figura 3), donde se observan cristales con poca aglomeración debido al uso de citrato como agente estabilizante.
Caracterización de hidroxiapatita
Los tres tipos de hidroxiapatita sintetizadas (método químico, sol-gel e hidrotermal) fueron caracterizadas mediante espectroscopía Raman determinándose la presencia de sus principales picos característicos20. La figura 4 muestra los espectros Raman de la hidroxiapatita obtenida mediante método químico (método 1) y de la obtenida mediante método sol-gel (método 2), en ambos, se puede apreciar un pico intenso a 965 cm-1 el cual está asociado al modo v1 del estiramiento totalmente simétrico del grupo PO4 (enlace P-O), también se aprecian dos picos de baja intensidad a 430 y 590 cm-1 asociados al modo de flexión v2,4 de PO4 (enlace O-P-O), finalmente se aprecia un pico a 1020 cm-1 asociado al modo de estiramiento asimétrico 3 de PO4 (enlace P-O).
El espectro Raman de la hidroxiapatita obtenida mediante el método hidrotermal también se muestra en la figura 4, donde se destaca la presencia del pico a 961 cm-1.
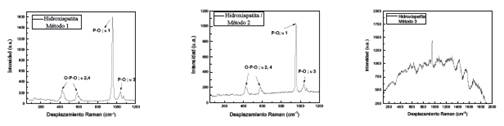
Figura 4 Espectros Raman de la hidroxiapatita (HAp) obtenida mediante el método 1, método 2 y método 3.
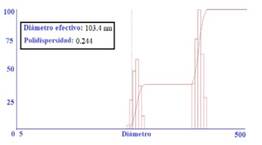
La figura 5 muestra los resultados obtenidos al utilizar la técnica de dispersión dinámica de luz, mediante la cual se obtuvieron partículas de hidroxiapatita (método hidrotermal) con un diámetro efectivo de 103,4 nm y una polidispersidad de 0,244, lo cual corresponde con lo reportado por la bibliografía16 de que se originan nanopartículas con un tamaño adecuado.
Caracterización del compósito Fe3O4/HAp
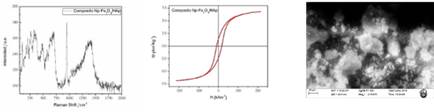
El compósito Fe3O4/HAp fue caracterizado mediante espectroscopía Raman (figura 6), en donde se observó que se mantiene el pico a 965 cm-1 asociado al enlace P-O (modo v1) y el pico asociado al magnón se desplaza (1393 cm-1) y pierde ligeramente su forma.
Por otra parte, este compósito fue caracterizado mediante magnetometría de muestra vibrante (VSM). La curva muestra que se mantiene el comportamiento ferromagnético del material y que los valores parámetros de Ms y Mr disminuyen (en comparación de Fe3O4-citrato) a 6,25 y 1,25 Am2kg-1, respectivamente, lo cual se puede atribuir a la interacción de la magnetita con la hidroxiapatita, que es un material que no presenta propiedades magnéticas.
Este compósito también fue caracterizado mediante microscopía electrónica de barrido (SEM), en la cual se observó rugosidad ligera sobre la superficie del material.
Caracterización del compósito Fe3O4/MWCNT
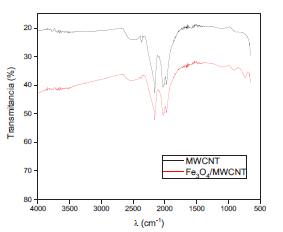
El compósito Fe3O4/MWCNT fue caracterizado mediante espectroscopía infrarroja (FTIR). La figura 7 muestra el espectro obtenido del compósito frente al espectro de los nanotubos, donde podemos observar que los picos asociados a los nanotubos se mantienen en el compósito y que destaca la presencia del pico a 690 cm-1, asociado al modo vibracional del Fe-O (uno de los picos característicos de la magnetita).
Por otra parte, el compósito fue caracterizado mediante microscopía SEM. La figura 8 muestra las micrografías de los nanotubos de carbono comerciales y del compósito Fe3O4/ MWCNT, en ellas podemos apreciar la aglomeración de los nanotubos (derecha) y una mayor dispersión de ellos en la formación del compósito (izquierda).
Caracterización del compósito Fe3O4/MWCNT/HAp
El compósito Fe3O4/MWCNT/HAp también fue caracterizado mediante microscopía SEM (figura 9). En las figuras, se pudo observar la superficie rugosa del material, algunas regiones cavernosas, que podrían asociarse a la aglomeración del agente porogénico en el proceso de coprecipitación de la muestra.
Pruebas de remoción de metales pesados
Efecto del pH
Se eligió un rango de pH a partir de 6, en base a que lo reportado por la literatura, a partir de este valor se manifiesta una mejor eficiencia en el proceso de adsorción.
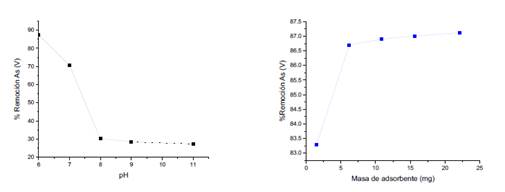
La figura 10 (izquierda) muestra una gráfica de porcentaje de remoción en función al pH. Se observó valores más altos porcentaje de remoción a un pH 6 frente al resto de valores de pH probados (7, 8, 10 y 11), lo cual coincide con lo reportado por trabajos anteriores21.
Efecto de masa de adsorbente
La figura 10 (derecha) muestra la gráfica de porcentaje de remoción en función a la masa de adsorbente, mediante la cual se obtuvo una relación directamente proporcional, donde el incremento de la masa de adsorbente, en nuestro caso, masa de compósito, generaba un aumento en los valores de la eficiencia de remoción. Además, se pudo notar que añadiendo desde 1,5 mg de adsorbente, los valores de porcentaje de remoción eran mayores al 80 %, indicando una alta remoción del metal. Por otra parte, fue posible observar que los valores de porcentajes de remoción obtenidos para 10,9; 15,6 y 22,1 mg fueron muy similares.
Efecto de tiempo de contacto
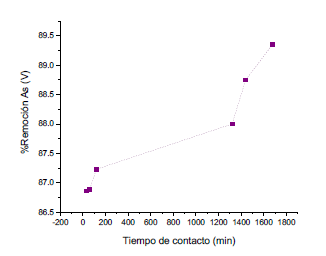
La figura 11 muestra la gráfica de porcentaje de remoción en función al tiempo de contacto. Podemos observar que a medida que aumenta el tiempo de contacto, hay un incremento en la eficiencia de remoción. Sin embargo, la diferencia entre los valores de remoción obtenidos (tabla 1) no es muy marcada, por lo cual podríamos elegir, en base a lo obtenido, un tiempo de 2 h y el material nos estaría dando resultados eficientes.
CONCLUSIONES
La magnetita (Fe3O4), hidroxiapatita (HAp) y los compósitos (Fe3O4/HAp, Fe3O4/MWCNT y Fe3O4/MWCNT/HAp) fueron sintetizados y caracterizados mediante las técnicas de: DLS, VSM, SEM, FTIR, Raman y técnicas voltamperométricas. Se realizaron pruebas preliminares en la remoción de As(V) variando los parámetros de pH, masa de adsorbente y tiempo de contacto. Se obtuvo los valores máximos de porcentaje de remoción de este metal (mayor a 85 %) a condiciones de pH 6, dosis de adsorbente de 0,5 g L-1 y un tiempo de contacto de 2 h, dándonos buenos indicios de hacer un estudio más amplio y con otros metales pesados.