INTRODUCCIÓN
El bonito (S. chiliensis chiliensis) es una especie pelágica que se distribuye desde Puerto Pizarro hasta Tacna, considerado como uno de los principales recursos ictiológicos del Perú, y que en el 2019 tuvo como límite de captura anual 64 mil toneladas1. La venta directa del bonito en los mercados de abasto genera subproductos como espinas, escamas, pieles entre otros que son desechados, produciendo de esta manera contaminación ambiental y desaprovechamiento de una importarte fuente de proteínas que pueden ser empleadas en la producción de hidrolizados, con un valor agregado para la industria alimentaria, farmacéutica y cosmética2.
La hidrólisis enzimática de los subproductos del pescado, es considerado un proceso ventajoso, controlado y selectivo, que genera péptidos de diferentes tamaños con propiedades funcionales o biológicas para el ser humano como antimicrobiano, antioxidante, antihipertensivo, entre otros3. Se han demostrado las actividades antioxidantes y antimicrobianas de péptidos obtenidos a partir de hidrolizados enzimáticos, empleando como materia prima la gelatina y colágeno de los residuos de diferentes especies marinas2,4,5.
Las propiedades funcionales de los hidrolizados dependen de la fuente de donde se obtenga, del grado de hidrólisis (GH), composición de los péptidos, enzima empleada y condiciones de reacción3, por lo que considerando estas propiedades y con la finalidad de proponer una aplicación alternativa al empleo de las pieles de bonito como sub productos de la actividad pesquera, se realizó la hidrólisis de la gelatina obtenida de dichas pieles empleando la enzima alcalasa y diferentes condiciones de temperatura, pH, tiempo y relación E/S, con el objetivo de obtener hidrolizados con actividad antioxidante y antimicrobiana así como demostrar el efecto del grado de hidrólisis (GH) sobre dichas actividades.
PARTE EXPERIMENTAL
Obtención de las muestras
Se recolectaron como residuos de la actividad pesquera las pieles de Sarda chiliensis chiliensis “bonito”, en el Terminal Pesquero de Ventanilla - Lima, durante el mes de diciembre del 2016. Se transportó en cooler y se almacenó a -20°C hasta su tratamiento.
Obtención de gelatina por hidrólisis parcial del colágeno
Se obtuvo colágeno por hidrólisis básica. Las pieles de pescado fueron tratadas con NaOH 0,5N, en la relación 1:10 (peso de piel: volumen) a 30 °C con agitación moderada por 10 horas. Para la obtención de gelatina, al colágeno se le agregó ácido acético (pH 5) y se llevó a baño termostatizado de 70°C por 6 h, se filtró y congeló a -20°C por 24 h, para luego descongelarse a temperatura ambiente y llevar a secado en circulación forzada de aire a 50°C por 12 h6.
Cuantificación de proteína total
La gelatina se cuantificó según el método de Bradford. Se realizó una curva de calibración con albúmina sérica bovina (BSA) en el rango de concentraciones 250 - 750 µg/mL. Las lecturas fueron hechas a 595 nm.
Factores que influyen en el proceso de hidrólisis
Se realizaron 15 experimentos siguiendo el diseño factorial tipo Plackett-Burman con punto central por triplicado, para ello se empleó la enzima alcalasa de Bacillus liqueniformis (Sigma Aldrich) y como sustrato gelatina obtenida en el paso anterior (70,32 % de proteína). Las condiciones de reacción ensayadas fueron: pH (7, 8 y 9), temperatura (50, 60 y 70 °C), tiempo (2, 3 y 4 h) y relación [enzima]:[sustrato] ([1]:[20], [1]:[35] y [1]:[50]). Las condiciones de pH a ensayar se lograron empleando buffer fosfato pH7.0 y 8.00; y Buffer Tris-HCl pH 9.0 todos a concentración 10 mM. Se inactivó la enzima al final de cada reacción a temperatura de 90 °C por 10 minutos y se centrifugó a 3800 rpm durante 15 minutos a 4 °C. El sobrenadante se almacenó a -20 °C hasta su análisis.
Determinación del Grado de Hidrólisis (GH)
Se realizó por cuantificación de proteína soluble por el método de Biuret, siguiendo el procedimiento descrito por Wangtueai et al7, se evaluó la proporción de proteína soluble en ácido tricloroacético (ATC) 20 % con respecto a la cantidad total de proteína en las muestras. La curva de calibración se realizó con BSA y se calculó el GH con la siguiente fórmula:
Actividad antioxidante mediante el método del radical (DPPH)
Se empleó el método modificado por Brand-Williams W. et al8. Para lo cual 980 μL del reactivo 2,2-difenil-1- picril-hidrazilo (DPPH® Sigma Aldrich) se mezcló con 20 μL de hidrolizado a diferentes concentraciones (25 a 2750 μg//mL) y se dejó reaccionar por 30 min a temperatura ambiente en oscuridad, la densidad óptica se leyó en un espectrofotómetro Agilent Cary 8454 a 517 ƞm. Se emplearon como estándares vitamina C y Trolox a concentraciones entre 0,8 - 2,8 μg/ mL y 1,2 - 6,0 μg/mL, respectivamente.
Actividad antioxidante mediante el método del radical catiónico (ABTS)
Se empleó la metodología propuesta por Re R. et al9. Para lo cual 50 μL del hidrolizado diluido se mezcló con 950 μL del reactivo ABTS y se incubaron a 30°C por 30 min. Las lecturas se midieron en espectrofotómetro a 734 nm. Los hidrolizados se diluyeron a concentraciones de 15 a 300 μg/ mL y se empleó como estándar el reactivo Trolox a las concentraciones de 2,5 - 25 μmol/L. los resultados se expresaron como micromoles de equivalentes Trolox por gramo de proteína (μmolET/g).
Actividad antimicrobiana
Se utilizó el método difusión en pozo en agar descrito por Rojas et al10. Para ello se prepararon suspensiones de turbidez 0,5 de la escala de McFarland de cultivos de 24 h de las cepas clínicas Stahylococcus aureus, Bacillus subtilis, Pseudomonas aeruginosa, Escherichia coli y Candida albicans, y se inocularon en Agar Muller Hinton para bacterias y Agar Dextrosa Saboraud para la levadura, a razón de 1 mL por cada 100 mL de medio. Se homogenizó y distribuyó 25 mL en cada placa petri estéril (90 mm) y se dejó solidificar. Luego se realizaron pozos de diámetro externo 9 mm y en cada pozo se incorporó 100 μL de hidrolizado (1,0 y 0,5 mg/mL). Se dejó difundir por 1 h y se llevó a 37 °C por 24h. Se midieron los halos de inhibición (mm.) indicativo de las propiedades antimicrobianas de las muestras analizadas.
Método de microdilución colorimétrica
Se trabajó según las metodologías del CLSI y Sarker et al11,12, para ello en una microplaca de 96 pocillos se agregaron cantidades iguales de concentraciones geométricamente ascendentes de la muestra, suspensión del microorganismo 1- 1,5x108 ufc/mL (0,5 escala de McFarland) en caldo Muller Hinton y resazurina (20 mg/mL) como indicador de crecimiento bacteriano. Se incubó a 37 °C por 16-20 h y el crecimiento microbiano se evidenció por cambio de coloración de azul púrpura a rosado rojizo en comparación con el control. La menor concentración de hidrolizado a la que no se observó viraje de color de púrpura a rosado se consideró como la concentración mínima inhibitoria (CMI).
RESULTADOS Y DISCUSIÓN
Evaluación de los factores que influyen en el proceso de hidrólisis
La hidrólisis enzimática a las diferentes condiciones de pH, temperatura, tiempo y relación [enzima/sustrato] expresada como porcentaje de grado de hidrólisis (GH) se muestra en la tabla 1. El menor GH (11,24 %), se observa para el tratamiento H505 bajo las condiciones de 50°C, pH 9, tiempo de 2 h y relación enzima/sustrato [1/20] y el máximo GH se reportó en el punto central en las 3 repeticiones para los experimentos H601, H602 y H603 con 33,21%; 32,67 % y 33,04 %, respectivamente, a las condiciones de 60°C, pH 8, tiempo de 3 horas y relación enzima/sustrato [1/35]. Estudios similares se han realizado empleando la enzima alcalasa, al respecto Blanco et al2, reportaron GH menores al 20 % para los hidrolizados del colágeno extraído de la piel de las especies de tiburón moteado, tiburón azul, pez espada y atún aleta amarilla a condiciones 50°C, pH 8, [enzima]: [sustrato] equivalente a [1]:[20] y tiempo de 3 h. Asimismo, Jridi et al13 sometieron a hidrólisis enzimática la gelatina de piel de sepia (Sepia officinalis), alcanzando un GH de 20,3 % empleando la enzima alcalasa a pH 8 y por un tiempo de 3 h.
Todos los hidrolizados de gelatina ensayados presentaron GH superiores a 10 %, por lo que son considerados en el grupo de alto grado de hidrólisis, y podrían mejorar las características de solubilidad y digestibilidad del mismo, si bien es cierto en la presente investigación no se realizaron pruebas funcionales a los hidrolizados, se conoce que hidrolizados de sub productos de pescado y pescado entero con GH mayores a 10 % incrementan la absorción de agua, solubilidad y capacidad espumante, además mejoran sus características sensoriales, importante para fines de la industria alimentaria14,15.
El GH es considerado un indicador importante en un proceso hidrolítico, como resultado de este, se obtienen cadenas peptídicas de diferente tamaño o aminoácidos libres que pueden relacionarse con las propiedades funcionales.
Tabla 1 Efecto de los factores pH, temperatura, tiempo y relación (enzima/ sustrato) en el grado de hidrólisis por tratamiento.
| ALCALASA | GRADO DE HIDRÓLISIS | ||||
| CONDICIONES | Temperatura (°C) | pH | Tiempo de hidrólisis (h) | Relación (enzima:sustrato) (w:w) | (%) |
| MUESTRA | |||||
| H601 | 60 | 8 | 3 | (1/35) | 33,21 |
| H602 | 60 | 8 | 3 | (1/35) | 32,67 |
| H603 | 60 | 8 | 3 | (1/35) | 33,04 |
| H504 | 50 | 7 | 2 | (1/50) | 16,42 |
| H505 | 50 | 9 | 2 | (1/20) | 11,24 |
| H506 | 50 | 9 | 4 | (1/50) | 15,31 |
| H507 | 50 | 9 | 4 | (1/20) | 11,99 |
| H508 | 50 | 7 | 2 | (1/20) | 13,24 |
| H509 | 50 | 7 | 4 | (1/50) | 25,80 |
| H7010 | 70 | 7 | 4 | (1/50) | 16,29 |
| H7011 | 70 | 9 | 2 | (1/50) | 16,96 |
| H7012 | 70 | 7 | 2 | (1/20) | 11,49 |
| H7013 | 70 | 9 | 4 | (1/20) | 17,17 |
| H7014 | 70 | 7 | 4 | (1/20) | 16,67 |
| H7015 | 70 | 9 | 2 | (1/50) | 20,99 |
Los resultados de la presente investigación bajo diferentes tratamientos demuestran que el GH depende de los diferentes factores estudiados, siendo la relación enzima/sustrato la variable que influencia significativamente en la hidrólisis enzimática de la gelatina de bonito (p valor < 0,05), como se presenta en la figura 1.
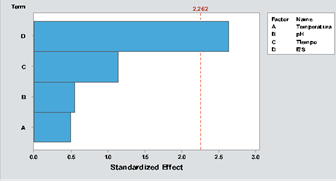
Figura 1 Diagrama de Pareto de los Factores Temperatura (valor-p: 0,635), pH (valor-p: 0,595), Tiempo (valor-p: 0,285) y relación Enzima / sustrato [E/S] (valor-p: 0,027*) en la hidrólisis enzimática de la gelatina de Sarda chiliensis chiliensis “bonito”.
Es importante notar que las variables tiempo y temperatura no influyen significativamente en el proceso de hidrólisis propuesto por lo que se puede aprovechar esta información, a fin de reducir a los mínimos valores de estos factores en un proceso de optimización, para reducir costos.
Relación entre la actividad antioxidante y el GH
En la tabla 2 se presenta la actividad antioxidante expresada como porcentaje de inhibición del radical DPPH, ABTS, así como también el IC50 y TEAC correspondiente a cada tratamiento.
Tabla 2 Grado de hidrólisis (% GH) y actividad antioxidante por los métodos DPPH● y ABTS ●+ para cada muestra.
| Muestra | Grado de hidrólisis (%) | Actividad Antioxidante | ||
|---|---|---|---|---|
| (DPPH●) | (ABTS●+) | |||
| IC50 mg/mL | IC50 mg/mL | TEAC (μmol Trolox/g hidrolizado proteico) | ||
| Vitamina C | _ | 0,00168 | _ | _ |
| Trolox | _ | 0,00353 | _ | _ |
| H601 | 33,21 | 1,240 | 0,139 | 89,28 |
| H602 | 32,67 | 1,237 | 0,136 | 91,21 |
| H603 | 33,04 | 1,247 | 0,137 | 90,67 |
| H504 | 16,22 | 0,539 | 0,097 | 128,32 |
| H505 | 11,24 | 1,827 | 0,161 | 79,45 |
| H506 | 15,31 | 1,611 | 0,160 | 77,48 |
| H507 | 11,99 | 1,702 | 0,162 | 76,22 |
| H508 | 13,24 | 0,533 | 0,086 | 143,79 |
| H509 | 25,80 | 0,959 | 0,114 | 109,08 |
| H7010 | 16,59 | 1,226 | 0,135 | 91,74 |
| H7011 | 16,96 | 1,830 | 0,200 | 61,76 |
| H7012 | 11,49 | 0,459 | 0,075 | 165,38 |
| H7013 | 17,17 | 1,706 | 0,172 | 72,12 |
| H7014 | 16,67 | 1006 | 0,122 | 101,33 |
| H7015 | 20,99 | 1393 | 0,114 | 108,92 |
Los valores de IC50 por el método DPPH se encontraron entre 0,459 (H7012) y 1,830 mg/ mL (H7011) y por el método ABTS variaron entre 0,075(H7012) y 0,200 mg/mL (H7011), siendo la mejor actividad antioxidante la que presenta valores de IC50 menores, en este caso corresponde al hidrolizado H7012 seguido de H504 y H508, además los valores de TEAC más altos se reportan también para estos 3 hidrolizados. Los resultados se asemejan a los reportados por otros autores. Wang et al16 encontraron buenas actividades antioxidantes de tres péptidos del hidrolizado del colágeno obtenido de escamas de Pseudosciaena crocea determinadas por el método DPPH (IC50 1,271; 0,675 y 0,283 mg/mL) y ABTS (IC50 0,421; 0,309 y 0,210 mg/mL), por otro lado Weng et al17 determinaron la actividad antioxidante de diferentes hidrolizados de piel de tiburón obteniendo para una de sus fracciones IC50 (DPPH) de 0,57 mg/mL similar a Nakchum et al18 que obtuvieron 0,417 mg/mL, para una fracción de hidrolizado de colágeno, aplicando el mismo método.
Se puede observar que las actividades antioxidantes del presente estudio no guardan relación directa con el GH, las mejores actividades antioxidantes para H7012, H504 y H508 se obtuvieron a GH de 11,49 %, 16,42 % y 13,24 %, observando que por encima de 16% la actividad antioxidante fue menor, lo cual concuerda con diversos estudios que han demostrado actividad antioxidante tanto de hidrolizados como de sus fracciones peptídicas empleando la enzima alcalasa con GH menores al 20 %4,5,13,16,17,18.
Los IC 50 obtenidos en el estudio, demuestran una buena actividad antioxidante, no se realizó el fraccionamiento, porque uno de los potenciales usos es el empleo de hidrolizados directamente en la industria de alimentos3 y los hidrolizados H7012, H504 y H508, podrían ser empleados para estos fines. Son pocos los estudios que comparan la actividad del hidrolizado sin fraccionar, como es el estudio de Jridi et al13, quienes compararon la actividad antioxidante de cuatro hidrolizados de gelatina de la piel de sepia obtenidos con tres enzimas crudas de diferentes microorganismos y una comercial (alcalasa), demostrando una mayor actividad antioxidante para el hidrolizado con alcalasa sugiriendo que los péptidos de los diferentes hidrolizados podrían ser diferentes en términos de longitud de cadena y secuencia de aminoácidos. Por otro lado Blanco et al2, al comparar la actividad antioxidante con los métodos de DPPH y ABTS de cuatro hidrolizados de colágeno obtenido de la piel de cuatro especies diferentes, demostraron que dicha actividad no solo está influenciada por el GH, sino también por la presencia de aminoácidos como la cisteína que interactúa con los radicales libres por sus grupos SH libres. La atribución de la buena actividad antioxidante de los hidrolizados de residuos de pescado y sus residuos podría estar asociada a la presencia de aminoácidos aromáticos y la capacidad de los grupos fenólicos como donadores de protones. Aunque, podría también relacionarse con la conformación y abundancia de los péptidos, así como a la posición de aminoácidos dentro de las secuencias peptídicas2,5,13
Relación entre la actividad antimicrobiana y el GH
La actividad antimicrobiana de los diferentes hidrolizados fue evidenciada por la presencia de halos sólo frente a S. aureus y B. subtilis, como se muestra en la tabla 3 y se complementó la evaluación con la determinación de la CMI
Tabla 3 Actividad antimicrobiana de los hidrolizados utilizando difusión en agar y microdilución.
| Muestra | Halos de inhibición (mm) para la concentración de 1 mg/mL de cada muestra | CMI (mg/mL) | ||
|---|---|---|---|---|
| S. aureus | B. subtilis | S. aureus | B. subtilis | |
| H601 | 15,5 | 14,5 | > 1000 | 1000 |
| H602 | 15,0 | 14,0 | > 1000 | 1000 |
| H603 | 15,5 | 14,0 | > 1000 | 1000 |
| H504 | 13,5 | 13,5 | 500 | 500 |
| H505 | - | - | - | - |
| H506 | - | - | - | - |
| H507 | - | - | - | - |
| H508 | 14,0 | - | 1000 | 1000 |
| H509 | 13,0 | 13,5 | 1000 | 1000 |
| H7010 | 14,0 | - | 1000 | 1000 |
| H7011 | - | - | - | - |
| H7012 | - | - | - | - |
| H7013 | - | - | - | - |
| H7014 | 14,5 | 13,5 | 1000 | >1000 |
| H7015 | - | - | - | - |
Los hidrolizados H601, H602, H603, H504, H508, H509, H7010 y H7014 mostraron actividad antimicrobiana baja frente a cepas clínicas de Staphylococcus aureus y Bacillus subtilis con halos entre 13 a 15,5 mm; sin embargo superan a lo obtenido por Gómez- Guillén et al 4 quienes reportan para el hidrolizado de piel de atún, halos de inhibición de aproximadamente 7,5 mm (con discos de 5 mm) frente a Staphylococcus aureus; así también Vinoth L19, demostró actividad antimicrobiana en hidrolizados de piel y músculo de quince pescados, destacando el del pez globo Arothron stellatus que presentó halo de 9 mm para S. aureus y 6 mm frente a Escherichia coli.
También a los hidrolizados se les determinó la CMI mediante el método de microdilución colorimétrica, hallando que la mayoría presentó CMI igual a 1000 µg/mL, que indicaría una actividad baja, o sin actividad en casos de CMI mayores a 1000 µg/mL; sin embargo, el hidrolizado H504 con GH de 16,22 % mostró CMI de 500 µg/mL frente a S. aureus y B. subtilis. Los valores entre 500 - 1000 µg/mL que indicarían baja actividad; estarían posiblemente asociadas a las características propias de los componentes (péptidos, aminoácidos, proteínas no hidrolizadas, entre otros) de los hidrolizados, como la solubilidad, peso molecular, polaridad, estructura y composición; y que a la vez podrían interaccionar no sólo con el microorganismo sino también con el medio de cultivo3. Sin embargo, considerando que estos hidrolizados derivan sólo de proteínas y no tienen otro tipo de componente; podríamos afirmar que lo obtenido no es despreciable por lo que se recomienda continuar con la purificación de los péptidos a fin de obtener mejores actividades.
CONCLUSIONES
Según los resultados las condiciones de reacción enzimática empleando la enzima alcalasa influyen en el grado de hidrolisis, llegando a obtener hidrolizados de 33,65 % a las condiciones de 60°C, pH 8, tiempo de 3 h y relación enzima/sustrato [1/35] siendo la relación E/S la variable que influye significativamente en el proceso de hidrólisis. Sin embargo, las mayores actividades antioxidantes y antimicrobianas se presentaron a GH entre 13 y 17 %. Tres hidrolizados H504, H508 y H7012 presentaron buena actividad antioxidante con valores de TEAC de 128,32; 143,79; 165,38 mol Trolox/g hidrolizado proteico. Ocho hidrolizados presentaron actividad antimicrobiana baja frente a Staphylococcus aureus (13 -15.5 mm) y Bacillus subtilis (13 - 14,5 mm), el hidrolizado H504 mostró CMI de 500 µg/mL frente a S. aureus y B. subtilis. En base a los resultados de la presente investigación la gelatina obtenida de la piel de Sarda chiliensis chiliensis puede ser empleada en un proceso controlado para obtener hidrolizados con propiedades funcionales y actividad antioxidante y antimicrobiana que pueden ser aprovechados por la industria de alimentos.















