INTRODUCCIÓN
Opuntia ficus-indica (L.) Miller “tuna” es una planta nativa de México distribuida en todo Sudamérica, que se ha adaptado en la costa y sierra del Perú1, cuyo potencial nutricional, medicinal, en la industria alimentaria y farmacéutica ha sido reconocido por la FAO para el desarrollo de las regiones áridas y semi áridas, especialmente en los países en desarrollo2.
El consumo de frutas con propiedades antioxidantes previenen diversas enfermedades crónicas y mejoran la salud del consumidor, es así que, Opuntia ficus-indica posee propiedades nutricionales, medicinales, antioxidantes y con una cantidad considerable de fibras con efectos en la salud como control de peso, colesterol en sangre y control de la diabetes1,3.
Las plantas con propiedades antioxidantes también presentan actividad antiinflamatoria como lo reportado en la cáscara de tuna que presenta actividad antioxidante y antiinflamatoria4, de la misma forma algunos polifenoles de las frutas tienen propiedades antioxidantes, antiinflamatorias, anticancerígenas y antibacterianas5.
Los radicales libres nocivos para la salud y los procesos inflamatorios como problemas de salud afectan principalmente a la población en general disminuyendo la calidad de vida de las personas, y para contrarrestar se utilizan diversos tratamientos siendo uno de ellos el uso empírico de plantas medicinales como la tuna que se usa para curar heridas y tratar diferentes patologías, como úlceras, disnea, glaucoma, enfermedades del hígado y fatiga. Además, el consumo de las frutas y sus jugos ha sido tradicionalmente recomendado por sus propiedades diuréticas, hipoglucemiantes, antialérgicas, analgésicas, y antiinflamatorias, así como el uso de los cladodios para la gastritis y tratamiento de úlceras6.
Los efectos adversos de los fármacos sintéticos es un problema vigente de la farmacología moderna, sin embargo, las plantas usadas en la medicina tradicional se constituyen en una alternativa para prevenir y curar diversas patologías sin causar efectos colaterales. No existen reportes del contenido de compuestos fenólicos, de su actividad antioxidante y antiinflamatoria in vitro de variedades de esta especie. Por lo tanto, en la presente investigación se determinó la actividad antiinflamatoria y antioxidante del extracto hidroalcohólico del fruto de tres variedades de Opuntia ficus-indica “tuna”.
PARTE EXPERIMENTAL
Población y muestra
Frutos de las variedades anaranjada, morada y blanca de Opuntia ficus-indica “tuna”, que crecen en el distrito de Tambillo de la región de Ayacucho.
La muestra estuvo constituida por 3 kg de frutos de cada variedad, cuyo muestreo fue por conveniencia teniendo en cuenta la integridad y calidad del fruto, colectadas entre enero y febrero de 2020.
Obtención del extracto hidroalcohólico
2 kg de pulpa del fruto fresco de cada variedad fue retirado en condiciones asépticas, trituradas en una licuadora y maceradas por 7 días con 5 L de etanol de 96° con agitación constante. Se filtró y el filtrado se concentró en un evaporador rotatorio BUCHI R3000 hasta sequedad. El extracto hidroalcohólico, fue conservado en refrigeración hasta su posterior uso.
Ensayo fitoquímico del extracto
Los metabolitos secundarios presentes en el extracto hidroalcohólico se identificaron según la técnica descrita por Lock7.
Determinación de fenoles totales
50 μL del extracto metanólico (10 mg/mL) se diluyó a 1 mL con agua destilada y se adicionó 0,5 mL del reactivo de Folin-Ciocalteu 0,2 N y 2,5 mL de carbonato de sodio al 5%, seguidamente se dejó reaccionar en la oscuridad por 40 minutos. La lectura de las absorbancias se realizó a 725 nm en espectrofotómetro UV-Vis Genesys 150 Thermoscientific. La curva patrón se preparó con solución de ácido gálico (50 μg/mL) a las concentraciones de 10, 20,30, 40 y 50 μg/mL. El contenido de fenoles totales se expresa en miligramos equivalente a ácido gálico por gramo de extracto (mg EAG/g )8.
Determinación del contenido de flavonoides
Se realizó según el método de cloruro de aluminio, en la cual a 0,50 mL del extracto (10 mg/mL) se llevó a 1 mL con agua destilada, luego se agregaron 0,15 mL de nitrito de sodio al 5%, 5 minutos después 0,15 mL de cloruro de aluminio al 10%, a los 6 minutos, 2 mL de hidróxido de sodio al 4% y se completó a 5 mL con agua destilada, se mezcló y se dejó reaccionar en la oscuridad por 15 minutos a temperatura ambiente. La lectura de las absorbancias se realizó a 510 nm contra un blanco utilizando el espectrofotómetro UV-Vis Genesys 150 Thermoscientific. Se preparó una curva patrón con quercetina (200 μg/mL) a las concentraciones de 40, 80, 120, 160 y 200 μg/mL. El contenido de flavonoides se presentan como miligramos equivalente a quercetina por gramo de extracto (mg EQ/g)8.
Determinación de la actividad antioxidante
Método de secuestramiento del radical libre 1,1 - difenil - picril - hidrazilo (DPPH)
150 μL de extracto (10 mg/mL) se mezcló con 2850 μL del radical libre DPPH (20 mg/L) en metanol con una absorbancia de 1,1 ± 0,02 nm. Después de mezclar fue incubada en la oscuridad por 30 minutos. La absorbancia se midió a 515 nm en espectrofotómetro UV-Vis Genesys 150 Thermoscientific. La curva patrón se preparó con Trolox a las concentraciones de 0 a 800 μmol/mL. La actividad antioxidante equivalente a trolox se expresa como micromol equivalente a trolox por gramo de extracto (µmol ET/g)9.
Método de secuestramiento del catión radical del ácido 2,2´- azinobis- (3- etilbenzotiazolina)-6-sulfónico (ABTS.+)
Se preparó una solución patrón (SP) mezclando 10 mL de ABTS 4,06 mg/mL con 10 mL de persulfato de potasio 0,7 mg/mL, al cual se dejó reaccionar por 12 horas. La solución de trabajo (ST) se preparó con 1 mL de SP y 60 mL de metanol, ajustándose la absorbancia a 1,1
± 0,02 con metanol a 734 nm en espectrofotómetro UV-Vis Genesys 150 Thermoscientific. 150 μL del extracto (5 mg/mL) fue mezclada con 2850 μL de ST e incubada en la oscuridad por 2 horas, midiéndose la absorbancia a 734 nm. La curva patrón se preparó con trolox de 0 - 400 μmol/mL. La actividad antioxidante se expresa como micromol equivale a trolox por gramo de extracto (µmol ET/g)9.
Método del potencial antioxidante reductor del hierro (FRAP)
Se mezcló 150 μL de muestra con 2850 μL del reactivo TPTZ previamente preparado al cual se dejó por 30 minutos a 37 °C. La absorbancia se midió a 593 nm en espectrofotómetro UV- Vis Genesys 150 Thermoscientific. La curva patrón se realizó con Trolox de 50 a 800 μmol/ mL. El resultado se expresa como micromol equivalente a Trolox por gramo de extracto (μmol ET/g)9.
Determinación de la actividad antiinflamatoria
La actividad antinflamatoria in vitro se realizó usando la técnica de estabilización de membrana de glóbulos rojos10. Se obtuvo 2 mL de sangre por punción venosa y se mezcló con 2 mL de solución de Alsever (Sigma-Aldrich), se mezcló en un vórtex, se centrifugó a 3000 rpm x 10 minutos y se eliminó el sobrenadante. Al sedimento se agregó solución salina fisiológica (SSF) para lavar los glóbulos rojos, se centrifugó a 3000 rpm x 5 minutos y se eliminó el sobrenadante. Se repitió el lavado de 2 a 3 veces hasta que el sobrenadante sea translucido. Luego se preparó una suspensión de glóbulos rojos al 10% con SSF.
Se prepararon las muestras a concentraciones de 25 mg/mL de los extractos de tuna anaranjada, morada y blanca, luego se procedió de la siguiente manera: en tubos de ensayo marcados se colocaron 1 mL de agua destilada, 1 mL de muestra 25 mg/mL, 1 mL de tampón salino, 1 mL de suero fisiológico y 0,5 mL de suspensión de glóbulos rojos (1 g/ mL). Seguidamente se llevaron a 37 °C por 30 minutos y después fueron centrifugados por 5 minutos a 3000 rpm. El sobrenadante se leyó a 560 nm en un espectrofotómetro UV-Vis Genesys 150 Thermoscientific. Como blanco se usó agua destilada y como estándares se utilizaron diclofenaco (0,5 mg/mL) y dexametasona (4 mg/mL). Se determinó el porcentaje de protección de la membrana de glóbulos rojos utilizando la siguiente fórmula:
% Protección=100-[(ABS_Muestra/ABS_Control)x 100]
Análisis estadístico
Los resultados fueron reportados como el promedio de tres determinaciones ± desviación estándar. Los datos del contenido de fenoles totales y flavonoides entre las variedades fueron sometidos al análisis de varianza de un factor (ANOVA) y las diferencias entre las muestras fueron determinadas por la prueba de comparaciones múltiples de Tukey. Valores de p < 0,05 fueron considerados como significativos.
RESULTADOS Y DISCUSIÓN
En la tabla 1, se observa los metabolitos secundarios presentes en el pulpa de la tuna de las variedades anaranjada, morada y blanca. Los metabolitos secundarios encontrados fueron lactonas y/o cumarinas, azúcares reductores, taninos y fenoles catequinas y flavonoides.
En la Tabla 2, se muestra que el contenido de fenoles totales es mayor en la variedad anaranjada (4,08 ± 0,13 EAG/g) y menor en la variedad morada (3,69 ± 0,42 EAG/g), sin embargo, estas diferencias no son significativas (p > 0,05). Asimismo, en el caso del contenido de flavonoides también la variedad anaranjada (2,36 ± 0,04 EQ/g) tuvo mayor contenido y la variedad blanca (2,00 ± 0,08 EQ/g) menor contenido, siendo las diferencias significativas (p < 0,05) y al realizar la prueba de comparaciones múltiples de Tukey, se observó respuestas similares para las variedades anaranjada y morada. Por otro lado, se determinó la relación entre el contenido de flavonoides y fenoles totales, resultando que la variedad morada tiene un mayor contenido de flavonoides y la variedad blanca un menor contenido en relación al contenido de fenoles totales.
Tabla 1 Metabolitos secundarios presentes en el extracto hidroalcohólico del fruto de tres variedades de Opuntia ficus-indica (L.) Miller “tuna”.
| Metabolito Secundario | Ensayos | Resultados | Observaciones | ||
| Tuna anaranjada | Tuna morada | Tuna Blanca | |||
| Lactonas y/o cumarinas | Baljet | c+ | + | + | Coloración roja |
| Azucares | Benedict | + | + | + | Precipitado rojo |
| Reductores | Feling | + | + | + | ladrillo |
| Aminoácidos | Ninhidrina | + | + | + | Coloración violeta |
| Catequinas | Catequinas | + | + | + | Coloración verde carmelita a la luz UV |
| Taninos y Fenoles | Cloruro férrico | + | + | + | Color azul negruzco |
| Flavonoides | Shinoda | + | + | + | Coloración roja |
En la Tabla 3, se observa que en el ensayo del DPPH la variedad anaranjada mostró mayor actividad antioxidante (6,20 ± 0,45 μmol ET/g), mientras que, la variedad blanca mostró menor actividad (3,39 ± 0,76 μmol ET/g) (p<0,05). En el caso del ensayo del ABTS la variedad morada tuvo mayor actividad antioxidante (25,35 ± 0,37 μmol ET/g) y la variedad blanca tuvo menor actividad (24,27 ± 0,15 μmol ET/g) (p<0,05). Finalmente, en el ensayo FRAP las tres variedades tuvieron actividad antioxidante similar (p>0,05).
Tabla 2 Contenido de fenoles totales y flavonoides presentes en el extracto hidroalcohólico del fruto de tres variedades de Opuntia ficus-indica (L.) Miller “tuna”.
| Variedad | Fenoles totales (mg EAG/g) | Flavonoides (mg EQ/g) | Relación entre flavonoides/fenoles totales |
| Anaranjada | 4,08 ± 0,13 | 2,36 ± 0,04 | 0,58 |
| Morada | 3,69 ± 0,42 | 2,29 ± 0,04 | 0,62 |
| Blanca | 3,87 ± 0,07 | 2,00 ± 0,08 | 0,52 |
| Valor p | > 0,05 | <0,05 |
Los resultados se expresan en promedio ± D.E.
Tabla 3 Actividad antioxidante del extracto hidroalcohólico del fruto de tres variedades de
| Variedad | DPPH (μmol ET/g) | ABTS (μmol ET/g ) | FRAP (μmol ET/g) |
| Anaranjada | 6,20 ± 0,45 | 24,71 ± 0,17 | 32,26 ± 4,55 a |
| Morada | 4,40 ± 0,81 | 25,35 ± 0,37 | 35,40 ± 3,54 a |
| Blanca | 3,39 ± 0,76 | 24,27 ± 0,15 | 32,80 ± 1,97 a |
| Valor p | < 0,05 | <0,05 | >0,05 |
Los resultados se expresan en promedio ± D.E.
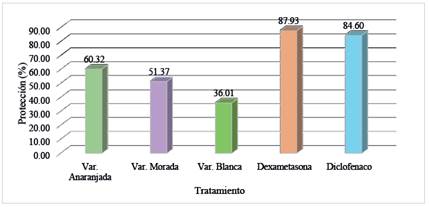
Figura 1 Actividad antiinflamatoria in vitro del fruto de tres variedades de Opuntia ficus-indica “tuna” (p<0,05)
En la figura 1, se presenta la actividad antiinflamatoria in vitro de los extractos del fruto de tres variedades expresada como porcentaje de protección de la membrana de glóbulos rojos, mostrando diferencias significativas. La protección para la variedad anaranjada fue de 60,32%, morada 51,37% y blanca de 36,01% siendo menor a la dexametasona (87,93%) y al diclofenaco (84,60%) que mostraron mejor protección (p < 0,05).
Se ha reportado el contenido de fenoles totales en extractos etanólicos de pulpa liofilizada (14,83 ± 0,10 mg EAG/g) y pulpa secada en estufa (17,59 ± 0,10 mg EAG/g) de frutos de Opuntia ficus-indicade Sudáfrica, sin precisar la variedad11. También, se ha reportado el contenido de fenoles totales en la pulpa del fruto de ocho variedades de Opuntia ficus-indica, en las cuales la variedad anaranjada (22,08 mg EAG/kg) obtuvo mayor contenido, seguida de la variedad morada (18,47 mg EAG/kg) y la variedad rosa (1,68 mg EAG/kg) menor contenido. Estos resultados coinciden con lo reportado. Estas diferencias en el contenido pueden deberse al tratamiento de la muestra, donde el extracto se obtuvo a partir de pulpa fresca. Otros factores podrían ser la madurez del fruto y el clima. Por otro lado, se ha determinado el contenido de fenoles totales en el jugo de la pulpa del fruto de Opuntia ficus- indica de cuatro cultivares provenientes de Tunez, Argelia, Maruecos e Italia, en las cuales el extracto metanólico de los cultivares Marruecos (2,53 ± 0,06 mg EAG/100 g) y Argelia (2,45 ± 0,06 mg EAG/100 g) tuvieron mayor contenido y el de menor contenido el cultivar Italia (0,80 ± 0,35 mg EAG/100 g), siendo las diferencias estadísticamente significativas (p<0,05)12.
Al determinar la actividad secuestradora del radical libre y antioxidante, hallaron que la variedad naranja tuvo la mayor actividad en los ensayos del DPPH (400,92 ± 8,376 μmol ET/100 g de extracto seco), ABTS (316,63 ± 12,468 μmol ET/100 g de extracto seco y FRAP (346,95 ± 7, 48 μmol ET/100 g de extracto seco), en relación con las variedades roja y amarilla13. Los resultados encontrados coinciden, debido a que la variedad anaranjada tuvo el mejor comportamiento frente a los ensayos del DPPH y ABTS. La actividad antioxidante según el método DPPH del fruto de tres variedades expresada como μmol ET/g de muestra, mostraron diferencias significativas entre las variedades. Las variedades blanca y morada mostraron menor capacidad secuestradora, mientras que, la variedad anaranjada mostró la mayor actividad.
En investigación realizada sobre las propiedades antioxidantes y antiinflamatorias de las cáscaras de Opuntia ficus-indica, se encontró la actividad antioxidante y antiinflamatoria en menor grado al mango (Mangifera indica)4. Al evaluar la composición fenólica, actividad antioxidante y antiinflamatoria de extractos de flores marroquíes de Opuntia ficus-indica se encontró un alto potencial antioxidante y antiinflamatorio de los extractos de flor de tuna14. En investigación efectuadas con dieta de Opuntia ficus-indica “tuna” encontraron disminución (p<0,05) de los marcadores proinflamatorios como el factor de necrosis tumoral-α (TNF-α), interleucina (IL) -1β, interferón-γ (INF) -γ, IL-8, proteína C reactiva (PCR) y velocidad de sedimentación globular (VSG), mientras que aumentó (p<0,05) el marcador antiinflamatorio IL-1015.














