Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.10 no.1 Trujillo ene./mar. 2019
http://dx.doi.org/10.17268/sci.agropecu.2019.01.10
ARTÍCULOS ORIGINALES
Compuestos fenólicos y capacidad antioxidante en tres ecotipos de maca (Lepidium meyenii Walp.) durante la pre-cosecha, cosecha y secado natural post-cosecha
Phenolic compounds and antioxidant capacity in three maca (Lepidium meyenii Walp.) ecotypes during pre-harvest, harvest and natural post-harvest drying
Emilio Yábar1,* ORCID iD https://orcid.org/0000-0001-6922-0771; Rosana Chirinos2 ORCID iD https://orcid.org/0000-0002-9045-7471; David Campos2 ORCID iD https://orcid.org/0000-0003-1722-1187
1 Facultad de Ingeniería en Industrias Alimentarias de la Universidad Nacional del Centro del Perú .
2 Instituto de Biotecnología (IBT), Universidad Nacional Agraria La Molina UNALM, Av. La Molina s/n, Lima, Perú.
Resumen
Este trabajo tuvo como objetivo evaluar el perfil HPLC-PDA de los compuestos fenólicos, su contenido y capacidad antioxidante en los extractos de los hipocótilos de maca amarilla, roja y negra durante las etapas de pre-cosecha, cosecha y secado natural post-cosecha. De la pre-cosecha al secado natural post-cosecha, en los tres ecotipos, se observó un incremento significativo de los compuestos fenólicos totales y su capacidad antioxidante. En la cosecha, la maca roja presentó la mayor concentración de compuestos fenólicos. Los análisis HPLC-PDA revelaron la prevalencia de 11 compuestos fenólicos, pero con diferentes concentraciones en cada ecotipo y en cada etapa de estudio, seis derivados del flavanol (flavan-3-ol), cuatro derivados del ácido benzoico y un derivado del ácido o-cumárico. El secado post-cosecha en condiciones naturales, generó una pérdida significat iva (maca amarilla 89,90%, maca roja 82,49% y maca negra 66,31%) de compuestos fenólicos, principalmente derivados del ácido benzoico y o-cumárico, llegando a límites no detectables, toleraron estas condiciones dos derivados del flavanol (flavan-3-ol). Los resultados del estudio sugieren mejorar el manejo post cosecha para preservar el contenido de compuestos fenólicos.
Palabras clave: Cultivos andinos; hipocótilos; Lepidium meyenii; alimento funcional.
Abstract
This research aimed to evaluate the HPLC-DAD profile of phenolic compounds, their content and antioxidant capacity in hypocotyls extracts of yellow, red and black maca during pre -harvest, harvest and natural post-harvest drying. A significant increase in total phenolic compounds and antioxidant capacity was observed from pre-harvest to natural post-harvest drying in all three ecotypes. During harvest, red maca had the highest concentration of phenolic compounds. HPLC-DAD analysis revealed the prevalence of 11 phenolic compounds, but with different concentrations in each ecotype and in each stage of study, such as six flavanol derivatives (flavan -3-ol), four derivatives of benzoic acid and an o-coumaric acid derivative. Post-harvest drying, under natural conditions, caused a significant loss (yellow maca 89.90%, red maca 82.49% and black maca 66.31%) of phenolic compounds, mainly derived from benzoic and o-coumaric acid, until non-detectable limits, only two flavanol derivatives (flavan-3-ol) tolerated these conditions. The results of the study sugg est improving cultivation techniques and post-harvest management to preserve the content of phenolic compounds.
Keywords: Andean crops; hypocotyls; Lepidium meyenii; funtional food.
1. Introducción
La Maca (Lepidium meyenii Walp, 2n = 8x = 64), es el único cultivo andino tradicional perteneciente a la familia Brassicaceae, crece en la sierra central del Perú (4000-5000 metros de altitud), se adapta bien a las condiciones de altitud extremadamente severas, debido al éxito de su poliploidización de los genomas en períodos de condiciones ecológicas drásticas (Zhang et al., 2016). Los compuestos fenólicos son metabolitos secundarios, producidos por las plantas como respuesta al estrés, poseen al menos un anillo aromático con uno o más sustituyentes hidroxilo y pueden dividirse según su estructura química en flavonoides (flavonas, flavonoles, flavanoles, flavanonas, isoflavonas y antocianinas), acidos fenólicos (derivados del ácido hidroxibenzoico y ácido hidroxicinámico), taninos, estilbenos, cumarinas y lignanos, en los alimentos contribuyen a su estabilidad oxidativa, color, olor y sabor astringente, proporcionan beneficios para la salud por sus propiedades antioxidantes, antialérgicos, anticancerosos, antiinflamatorios, antidiarreicos, antivíricos, antiulcerosos, molusquicidas, antihelmínticos, antihepatóxicos y antiproliferativos (Costa et al., 2015; Liu et al., 2019). Estudios epidemio-lógicos correlacionan la ingesta de flavonoides con una incidencia reducida de enfermedades crónicas, la actividad de las especies reactivas del oxígeno (ROS) en la etiología de estas enfermedades, ha sugerido que los polifenoles que muestran actividad antioxidante (captura del anión superóxido, radicales hidroxil y peroxil) pueden contribuir a la prevención de estas patologías, es importante considerar su cinética de absorción y biodisponibilidad (Lima et al., 2014).
El cuerpo humano tiene un sistema de defensa antioxidante para contrarrestar el estrés oxidativo, como el sistema redox enzimático constituido por catalasa (CAT), superóxido dismutasa (SOD), glutatión peroxidasa (GPx), glutatión reductasa (GR) y peroxiredoxinas (PRx), mecanismo de defensa celular que mantiene el equilibrio oxidativo, si este mecanismo es deficiente debido al estrés oxidativo por exceso de ROS, el consumo de una dieta rica en polifenoles refuerza y restaura la homeostasis redox incrementando la actividad de las enzimas antioxidantes (xenohormesis) (Zhang y Tsao, 2016). La biosíntesis y concentración de compuestos fenólicos en las plantas depende del genotipo, factores bióticos (plagas, infección por patógenos) y al estrés abiótico (luz, temperatura, fuente de nutrientes, disponibilidad de agua, condiciones de crecimiento y radiación UV), además de las condiciones de almacenamiento y tratamiento postcosecha, se producen por medio de la vía del ácido shikímico, donde la fenilalani-na amonio liasa (PAL), es la enzima clave que cataliza su biosíntesis (Cartea et al., 2011). Los factores más importantes durante la pre-cosecha están determinados por una interacción entre el genotipo, los factores climáticos, edáficos y el manejo del cultivo que influyen en el contenido, perfil de polifenoles y actividad de la polifenoloxidasa; en este contexto, los sistemas de cultivo eco-sostenibles generan rendimientos comerciales aceptables y buena calidad en bioactivos (Lombardo et al., 2018). Varios estudios mostraron un significativo incremento en el contenido de fenoles totales al momento de la cosecha debido al estrés inducido provocado por las acciones físicas realizadas durante este proceso por la activación de la PAL, durante el almacenamiento ocurre una disminución de los compuestos fenólicos y actividad antioxidante por la ruptura de las paredes celulares, al reordenamiento de la matriz vegetal y la oxidación causada por el oxígeno residual (Armesto et al., 2017; Pinela et al., 2018; Esua et al., 2019).
El contenido de fenoles totales varía según el ecotipo y el método de extracción, hay resultados donde la maca negra presentó más fenoles totales que la maca roja y amarilla, ese mismo comportamiento se observó con su capacidad antioxidante, en otros trabajos el ecotipo amarillo supera a la maca roja y negra, debe advertirse que la capacidad antioxidante está influenciado, además, por los glucosinolatos, alcamidas y polisacáridos (Korkmaz, 2018). El tratamiento doméstico (lavado, pelado, cortado, etc.) e industrial como el procesamiento convencional térmico y no térmico (altas presiones, campos eléctricos pulsantes, ultraso-nido/sonicación, ozono, ultravioleta) tienen efecto en la concentración final de polifenoles (Tiwari y Cummins, 2013).
A la fecha no hay trabajos que hayan evaluado la evolución de los compuestos fenólicos y su capacidad antioxidante en la cadena productiva de la maca como materia prima para la industria.
El objetivo del trabajo de investigación fue evaluar el efecto de las etapas de precosecha, cosecha y secado natural postcosecha en el perfil, contenido de compuestos fenólicos y capacidad antioxidante en los hipocótilos de tres ecotipos de maca.
2. Materiales y métodos
Material vegetal
Se trabajó con los hipocótilos de tres ecotipos de maca: amarilla, roja y negra, procedentes de un cultivo tradicional de la Comunidad campesina de San Pedro de Cajas, ubicado a 4200 msnm, latitud 11º15´01̎ y longitud 75º51ˈ53̎ (Junín, Perú). La siembra se realizó en noviembre del 2014 y la cosecha en julio del 2015. Se tomaron al azar muestras de 10 plantas (~2 kg) a los siguientes tiempos: (a) 90, 45, 30 y 15 días antes de la cosecha, (b) durante la cosecha, y (c) a los 15, 30, 45, 60, 75 y 90 días de secado natural post-cosecha. Durante la cosecha, los hipocótilos son apilados al medio ambiente durante 2 días, luego colocados en rafias de polipropileno de ~50 kg donde permanecieron por 2 a 3 días. Después de este período, los sacos de maca fueron trasladados al lugar de secado donde se esparcieron hasta una altura aproximada de 10 cm. Durante las noches, los hipocótilos se cubrieron con toldos de plástico para protegerlos de las condiciones extremas de temperatura (-10 °C). Las temperaturas durante el secado estuvieron comprendidas entre -10 a 15 °C y 70 a 95% de HR. Tomadas las muestras, estas fueron acondicionadas en un cooler y transportadas al laboratorio, se lavaron, secaron con papel toalla y envasaron en bolsas de polietileno negro y almacenado a -20 °C hasta el momento de su análisis. Una muestra fue utilizada para determinar su humedad.
Estándares y reactivos químicos
Estándares fenólicos: ácidos fenólicos (pcumárico, o-cumárico, protocatéquico, ferúlico, gálico, cafeico, clorogénico y ácido p-hidroxibenzoico), flavonoles (quercetina, rutina, miricetina y kaempferol), flavonas (luteolina y apigenina) y flavanonas (naringenina), grado HPLC o de valoración ≥ 95%, fueron adquiridos de Sigma Chemicals Co. (St. Louis, MO). Flavan-3oles (catequina y epicatequina grado HPLC ≥ 98%, fueron adquiridos de ChromaDexTM (Santa Clara, CA). Trolox (ácido 6-hidroxi-2,5,7,8-tetrametil croman-2-carboxilico, pureza 97%), Dimetilaminocinamaldehido (DMACA), pureza 98% y ácido 2,2ʹ-Azino-bis (3-etilbenzotiazolina-6-sulfonico) (ABTS●+), pureza ≥ 98% fueron adquiridos de Sigma Chemicals Co. (St. Louis, MO). Cloruro de aluminio, pureza 99,99%, acetonitrilo grado HPLC, 2N Folin-Ciocalteu, otros solventes y reactivos de grado analítico fueron adquiridos de MercK (Darmstadt, Germany).
Determinación de compuestos fenólicos totales
Los compuestos fenólicos totales fueron estimados según el método de Singleton y Rossi (1965). Se pesó un gramo de muestra (en base seca) y se homogenizó con 25 mL de metanol al 80% utilizando una licuadora de laboratorio (Thomas Scientific, Modelo TS3392, U.S.A.), se trasvasó a un erlenmeyer de 100 mL, se inyectó nitrógeno por 2 min, se mezcló por una hora a temperatura ambiente, seguidamente se centrifugó (centrífuga Hettich, Rotofix 32A, Alemania) a 4500 g por 20 min, el sobrenadante se recolectó y la torta se volvió a re-extraer, bajo las mismas condiciones con 25 mL de metanol al 80%. Ambos sobrenadantes se combinaron y mezclaron, se conservaron a -20 °C (congeladora, Electrolux, H300, Brasil), hasta el momento del análisis. Una alícuota de 500 µL del extracto, se mezcló (Agitador vortex, VELP Scientifica, Modelo F202A0175, Italia) con 250 µL del reactivo de Folin-Ciocalteu 1N y 1250 µL de una solución de carbonato de sodio, se dejó reaccionar por 30 min, al mismo tiempo una alícuota de 500 µL de agua destilada se trató de la misma forma que la muestra y se utilizó como control. La absorbancia se midió a 755 nm (espectrofotómetro, Thermo Spectronic, Modelo Genesys 20, U.S.A.) y los resultados se expresaron como mg equivalentes de ácido gálico (EAG) 100 g-1 de materia seca (MS). Se empleó una curva estándar construida con ácido gálico en el rango de 0,4624 a 3,2368 mg 100 mL-1.
Determinación de la capacidad antioxidante
La capacidad antioxidante se estimó por el método ABTS●+ propuesto por Arnao et al. (2003). Una alícuota de 150 µL del extracto se mezcló con 2,850 µL de solución de ABTS●+, preparada según Awika et al. (2003). Esta mezcla se dejó reaccionar a 20 °C por 30 min. En paralelo Al mismo tiempo, alícuotas de 150 µL de metanol fueron sometidas al mismo procedimiento y se utilizaron como control. Se utilizó como blanco metanol y la disminución de la absorbancia debido a la actividad antioxidante se registró a 734 nm. La capacidad antioxidante se calculó como µmol equivalentes de Trolox (ET) g-1 de materia seca (MS). Se empleó una curva estándar construida con Trolox en el rango de concentraciones de 0,0497 a 0,7978 µmol ET mL-1.
Determinación de antocianinas totales
La cuantificación de antocianinas se realizó por el método del pH diferencial propuesto por Giusti y Wrolstad (2001). Un gramo de muestra en base seca fue solubilizado en 20 mL del solvente de extracción (etanol al 95%: HCl 1,5 mol∙L−1, 85:15, v/v), se homogenizó por 2 min y se maceró a 4 °C durante 24 h. El extracto se centrifugó a 4500 g por 20 min, el sobrenadante se diluyó con un buffer (HCl 0,1 mol∙L-1, KCl 25 mmol∙L-1) pH 1,0 y buffer (CH3COONa 0,4 mol∙L-1) a pH 4,5 (Potenciómetro, ThermoOrion, Modelo Star A211, U.S.A.). La absorbancia de las mezclas se midió a 535 y 700 nm tomando como blanco agua destilada. La concentración de antocianinas fue calculada y expresada como mg equivalentes de cianidina-3-glucósido (EC3G) 100 g-1 de materia seca (MS), aplicando la siguiente ecuación:

Determinación de flavanoides totales
La determinación de flavanoides totales (flavan-3-oles, flavan-4-oles, flavan-3,4dioles, flavanonas y derivados) fue estimada por el método propuesto por Delcour y Devarebeke (1985). Un gramo de muestra (base seca) fue solubilizada en 20 mL de acetona al 70% en una licuadora de laboratorio, se trasvasó a un erlenmeyer de 100 mL, se inyectó nitrógeno por 2 min y se mantuvo en agitación (agitador orbital Heidolph, Polymax 2040, Alemania) por una hora, seguidamente se centrifugó a 4,500 g por 20 min, la torta residual fue sometido a una segunda extracción similar a la primera, los sobrenadantes fueron combinados y se concentraron a 40 °C en un rotavapor (Heidolph, modelo Laborotta 4000, Alemania), todo el experimento se realizó en oscuridad. Un mililitro del reactivo cromógeno DMACA (250 mg en 500 mL de HCl concentrado: MeOH, 30:70, v/v) se añadió a 200 µL del extracto, se mezcló y esperó a que ocurra la reacción por 10 min a temperatura ambiente. Se utilizó como blanco agua destilada bajo las mismas condiciones que la muestra. La absorbancia se midió a 640 nm. Los resultados se expresaron en mg equivalentes de catequina (EC) 100 g-1 de materia seca (MS). Se empleó una curva estándar construida con catequina de rango de concentraciones de 0,6 a 3,72 mg 100 mL-1.
Determinación de flavonoides totales
La determinación de flavonoides totales (flavonoles, flavonas e isoflavonas) fue estimada por el método colorimétrico propuesto por Chang et al. (2002). Un gramo de muestra (base seca), fue solubilizada con 20 mL de etanol al 80% en una licuadora de laboratorio, se trasvasó a un erlenmeyer de 100 mL, se inyectó nitrógeno por 2 min, se centrifugó a 4500 g por 20 min, se recolectó el sobrenadante y la torta residual fue utilizada para realizar una segunda extracción similar a la primera. Ambos sobrenadantes se mezclaron, el volumen final se concentró en un rotavapor a 40 °C hasta un 30%. Todo el trabajo se realizó en oscuridad. A 250 µL del extracto, se añadió 750 µL de etanol al 96%, 50 µL de cloruro de aluminio al 10%, 50 µL de acetato de potasio 1 M y 1400 µL de agua destilada, se mezcló y esperó 30 min a que ocurra la reacción a temperatura ambiente. Al mismo tiempo, se preparó un blanco con 50 µL de agua destilada en lugar de cloruro de aluminio al 10%. La absorbancia se midió a 415 nm. Los resultados fueron expresados en mg equivalentes de quercetina (EQ) 100 g-1 de materia seca (MS). La curva estándar fue preparada con quercetina en el rango de concentraciones de 4,08 a 14,28 mg 100 mL-1.
Análisis por HPLC-PDA de compuestos fenólicos
El perfil químico de los compuestos fenólicos fue determinado de acuerdo con el procedimiento propuesto por Chirinos et al. (2008). 5 gramos de muestra en base seca fue solubilizada en 50 mL de metanol al 80% utilizando una licuadora de laboratorio, se trasvasó a un frasco de 100 mL, se inyectó nitrógeno por 2 min, se agitó por una hora, se centrifugó a 4500 g por 20 min, a la torta residual se realizó una segunda re-extracción similar a la primera, se mezclaron ambos sobrenadantes y se concentró al vacío a 40 °C, todo el trabajo se realizó en oscuridad. El extracto se purificó en un cartucho Sep-Pak C18 siguiendo el procedimiento reportado por Zheng y Wang (2003). La fracción de compuestos fenólicos fue utilizada para su separación usando el cromatógrafo líquido de alta performance (HPLC) Waters 2695 (Milford, Massachusetts, U.S.A.) equipado con auto inyector, un detector PDA 2996, (detector de matriz de fotodiodos). Los datos espectrales fueron registrados entre 200 y 700 nm. La columna X-terra RP18 (5 µm, 250 x 4,6 mm) (Waters, Milford, Massachusetts, U.S.A.) y la pre-columna 4,6 x 2,0 mm fue utilizada para la separación de los compuestos fenólicos a 30 °C. La fase móvil consistió en el solvente (A) agua: ácido acético (94: 6, v/v, pH 2,27) y solvente (B) acetonitrilo. La elución se realizó con el gradiente siguiente: 0 15% de B en 40 minutos, 15 45 % de B en 40 minutos y 45 100 % de B en 10 minutos. El flujo fue de 0,5 ml∙min-1 y se inyectó 20 µL de muestra. Muestras y fases móviles fueron previamente filtradas con filtros Millipore de 0,22 µm, tipo GV (Millipore, Bedford, Massachusetts, U.S.A.). Las muestras fueron analizadas por triplicado. Los compuestos fenólicos se identificaron por comparación de sus tiempos de retención y espectros de absorción UV de los estándares fenólicos. Los resultados fueron expresados en mg 100 g-1 MS. Se tomó como base los criterios de identificación (características cromatográficas y espectrales) de los compuestos fenólicos.
Análisis estadístico
Los análisis se realizaron por triplicado. Los resultados se procesaron mediante un análisis de varianza de un factor. Se utilizó la prueba de Duncan para evaluar la diferencia de medias entre los diferentes tratamientos. Diferencias a una p < 0,05 fueron considerados como significativos. El software SPSS 14.0 para Windows (SPSS, Chicago, IL) fue utilizado para llevar a cabo todos los análisis estadísticos.
3. Resultados y discusión
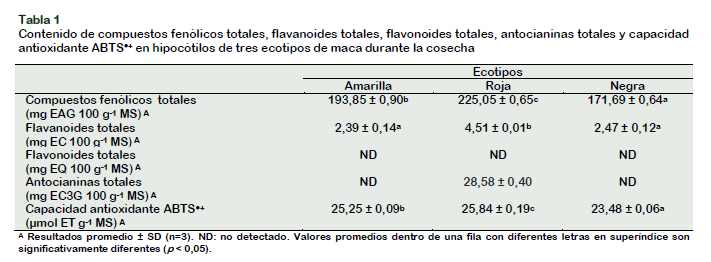
Contenido de bioactivos totales y capacidad antioxidante ABTS●+ en los hipocótilos de tres ecotipos de maca durante la cosecha
Con el fin de explicar la naturaleza de los compuestos fenólicos, fueron determinados por espectrofotometría, compuestos fenólicos totales, flavanoides totales, flavonoides totales, antocianinas totales y capacidad antioxidante ABTS●+. El contenido de compuestos fenólicos totales es significativamente mayor en los hipocótilos de maca roja, 225,05 ± 0,65 mg EAG 100 g-1 MS (71,14 ± 0,21 mg EAG 100 g-1 MF (materia fresca), respecto a la maca amarilla 193,85 ± 0,90 mg EAG 100 g-1 MS (58,39± 0.27 mg EAG 100 g-1 MF) y maca negra 171,60 ± 0,64 mg EAG 100 g-1 MS (57,84± 0,21 mg EAG 100 g-1 MF) (Tabla 1). Campos et al. (2006), encontraron que los genotipos de mashua (Tropaeolum tuberosum Ruiz & Pavón) púrpuras presentaron el mayor contenido de compuestos fenólicos. Los valores encontrados en este trabajo son similares a los determinados por Chirinos et al. (2009) para 6 genotipos de oca (Oxalis tuberosa Mol.), se confirma que los genotipos púrpuras presentan un mayor valor. Los genotipos de mashua púrpuras ARB 5241 y DP 0224, presentaron 1310 y 1290 mg EAG 100 g-1 MS, respectivamente (Chirinos et al., 2007b), superiores a los 225,05 ± 0,65 mg EAG 100 g-1 MS de la maca roja, mientras que el genotipo de oca púrpura COC-450 con 161,8 mg EAG 100 g-1 MF es mayor a los 71,14 ± 0,21 mg EAG 100 g-1 MF de la maca roja; por lo tanto, estos recursos andinos pueden ser considerados como fuente importante de compuestos fenólicos en la alimentación cotidiana del hombre andino.
Zevallos-Concha et al. (2016) reportaron que el extracto hidroalcohólico de maca negra (1,35 g de ácido gálico 100 g-1 de extracto) presentó mayor contenido de polifenoles que el extracto hidroalcohólico de maca roja (1,16 g de ácido gálico 100 g-1 de extracto), la diferencia podría deberse al tipo de extracción y forma de expresión de los resultados. No se observaron diferencias significativas en el contenido de flavanoides totales de los ecotipos amarilla, 2,39 ± 0,14 mg EC 100 g-1 MS (0,72 ± 0,05 mg EC 100 g-1 MF) y negra, 2,47 ± 0,12 mg EC 100 g-1 MS (0,83 ± 0,04 mg EC 100 g-1 MF), pero sí de ambos respecto a la maca roja que reportó el mayor valor, 4,51 ± 0,01 mg EC 100 g-1 MS (1,43 ± 0,003 mg EC 100 g-1 MF); similarmente, los cultivares de mashua y oca púrpuras, presentaron los valores mayores, 5,3 mg EC g-1 MS y 10,7 mg EC 100 g-1 MF, respectivamente (Chirinos et al., 2007a; Chirinos et al., 2009). No se detectaron flavonoides totales en ninguno de los hipocótilos de maca estudiados.
En lo que concierne a antocianinas totales, en la maca roja se determinó, 28,58 ± 0,40 mg EC3G 100 g-1 MS (9,03 ± 0,12 mg EC3G 100 g-1 MF), estos pigmentos se localizan principalmente en la cáscara, más no en la pulpa. Si comparamos el contenido de antocianinas totales en genotipos de mashua (50 a 205 mg EC3G 100 g-1 MF) y oca (0,53 a 47,4 mg EC3G100 g-1 MF) (Campos et al., 2006; Chirinos et al., 2009), resultan notablemente superiores a los de maca, debido a que el pigmento lo contienen tanto en la cáscara como en la pulpa.
Se observaron diferencias significativas en la capacidad antioxidante ABTS●+ entre los tres ecotipos de maca negra 23,48 ± 0,06 µmol ET g-1 MS (8,12 ± 0,02 µmol ET g-1 MF), amarilla 25,25 ± 0,09 µmol ET g-1 MS (7,32 ± 0,03 µmol ET g-1 MF) y roja 25,84 ± 0,19 µmol ET g-1 MS (8,14 ± 0,06 µmol ET g-1 MF).
En 11 genotipos de mashua, la capacidad antioxidante hidrofílica varió de 955 a 9800 μg TE g-1 MF (3,82 a 39,15 µmol ET g-1 MF), los genotipos púrpuras mostraron los valores más altos ~4,8 veces superior al ecotipo rojo (Campos et al., 2006). Los valores obtenidos en maca son similares a los reportados para genotipos de oca, la capacidad antioxidante ABTS●+ de estos varió de 1,1 a 8,9 µmol ET g-1 MF (Chirinos et al., 2009). Extractos acuosos de maca de diferentes concentraciones (0,03, 1,0 y 3,0 mg∙mL-1) tuvieron porcentajes de inhibición del radical libre DPPH (100 µM) de 21,64 ± 0,02, 55,40 ± 0,19 y 71,38 ± 0,31, respectivamente, evidenciando actividad antioxidante ascendente (Sandoval et al., 2002).
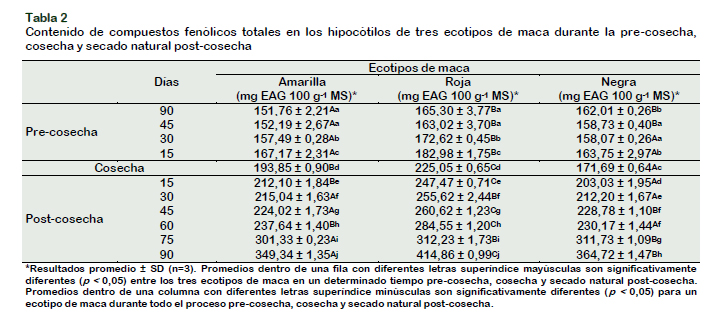
Contenido de compuestos fenólicos totales en los hipocótilos de tres ecotipos de maca durante la pre-cosecha y secado natural post-cosecha
Durante la etapa pre-cosecha entre ecotipos, a los 90 y 45 días, el contenido de compuestos fenólicos totales no difieren entre los hipocótilos de maca roja y negra, pero son significativamente (p < 0,05) mayo-res que los hipocótilos de maca amarilla; sin embargo, entre los 30 y 15 días, la maca amarilla y negra presentan resultados similares, pero significativamente menores que la maca roja (Tabla 2). Los hipocótilos amarillo y rojo aumentaron significativamente (p < 0,05) desde 90 días antes de la cosecha hasta la cosecha, la maca negra mostró una tendencia variable, disminuyeron en el margen de 90 a 45 días, entre los 45 a 30 días no mostraron diferencia significativa y de los 30 días precosecha a la cosecha este se incrementó. Los hipocótilos de maca amarilla, roja y negra, presentaron un incremento del 21,71, 26,55 y 5,64%, respectivamente. Chirinos et al. (2007a) desde 2,5 meses antes de la cosecha de 10 cultivares de mashua, encontraron valores promedioascendentes que oscilaron entre 9 a 21 mg equivalentes de ácido clorogénico (EACG) g-1 MS, los cultivares de mashua púrpuras presentaron los valores más altos, lo cual concuerda con los resultados obtenidos para la maca roja, respecto a los ecotipos amarillo y negro. Debido a que son muy escasos los estudios en la etapa de precosecha, sobre todo en brasicáceas, se reporta el caso de un proceso de germinación para evidenciarla como una etapa de biosíntesis. Xue et al. (2016) encontraron que, durante la germinación de tres tipos de frejoles, el contenido total de compuestos fenólicos se incrementó significativamente (p < 0,05), en el caso de la soya este incremento fue de 1,51 veces (6,67 mg GAE g-1 MF) que la soya no germinada. Durante el secado natural postcosecha, entre ecotipos, a los 15 días se observaron diferencias significativas a p < 0,05 entre los tres ecotipos, correspondiendo el mayor valor a la maca roja, seguido de la maca amarilla y maca negra. A los 30, 45, 60, 75 y 90 días de secado, el contenido de fenoles totales se incrementó gradualmente en los tres ecotipos, observándose a los 90 días una diferencia significativa (p < 0,05) entre los tres ecotipos, siendo el mayor valor para la maca roja, seguido de la maca negra y maca amarilla. La maca amarilla, roja y negra durante toda la etapa (15, 30, 45, 60, 75 y 90 días de secado), evidenciaron un incremento significativo (p < 0,05) de 44,51, 45,75 y 52,93%, respectivamente. Chirinos et al. (2007a), en los tubérculos de mashua púrpuras, DP 0224 y AGM 5109, durante el soleado post-cosecha, entre los 0 y 14 días, observaron un incremento del 12 y 64%, respectivamente; mientras que el cultivar ARB 5241 una disminución del 12%, todos los cultivares púrpuras mostraron una disminución después de los 14 días y en los cultivares amarillos se incrementaron al cabo de 35 días.
En la congelación rápida de brócoli sin escaldar seguido de un almacenamiento a 4 °C durante 7 días, el contenido de compuestos fenólicos se incrementó significativamente de 521,0 ± 5,06 mg EAG 100-1 MS a 679,10 ± 2,26 mg EAG 100-1 MS al quinto día, al sétimo día disminuyó a 636,00 ± 12,61 mg EAG 100-1 MS, este aumento estaría relacionado como respuesta al daño ocasionado por la congelación (Patras et al., 2011). Varios estudios evidenciaron un incremento en el contenido de polifenoles en vegetales almacenados a temperaturas de refrigeración, atmósferas modificadas, como respuesta al estrés por frio, tiempos más prolongados de almacenamiento resultan en una disminución del contenido de fenoles y una pérdida de su calidad sensorial, siendo el efecto mayor durante el almacenamiento a 20 ºC (Cartea et al., 2011).
El incremento de fenoles totales podría deberse a la liberación de grupos hidroxilo por la hidrólisis de flavonoides glicosilados y la liberación de compuestos fenólicos complejos presentes en las paredes celulares (Ordóñez-Santos et al., 2009). Se ha observado que el estrés provocado por el daño celular y la disminución de la temperatura promueven el aumento de la actividad de la PAL (EC 4.3.1.5) y su posterior oxidación de los compuestos fenólicos por la actividad de la tirosinasa (EC 1.14.18.1) o lacasa (EC 1.10.3.2) (Amodio et al., 2014). Se sabe que la calidad del ajo, composición química y contenido de compuestos bioactivos, es altamente dependiente de las condiciones previas y posteriores a la cosecha, como el genotipo, las prácticas de cultivo, las condiciones de crecimiento y el manejo post-cosecha (Martins et al., 2016). Los procesos y parámetros aplicados a los alimentos, sean estos naturales o tecnológicos, afectan a su contenido nutricional y de bioactivos, la col blanca fresca con 5,70 ± 0,13 mg EAG g-1 MS de compuestos fenólicos totales, por efecto del blanqueado por 30 s y secado a 60 °C disminuyó a 5,79 ± 0,10 y 4,13 ± 0,12 mg EAG g-1 respectivamente (Tao et al., 2019).
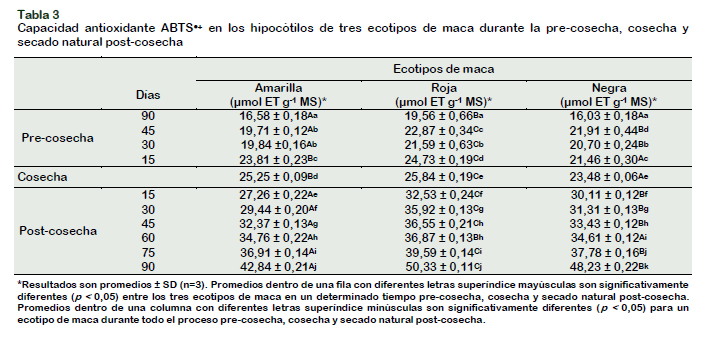
Capacidad antioxidante ABTS●+ en los hipocótilos de tres ecotipos de maca durante la pre-cosecha y secado natural post-cosecha
Durante la pre-cosecha entre ecotipos, se observaron diferencias significativas en la capacidad antioxidante, siendo mayor en la maca roja (Tabla 3). En los hipocótilos de maca amarilla, se observó una diferencia significativa entre los 90 y 15 días precosecha; siendo similares entre los 45 y 30 días, el incremento en esta etapa fue, de 16,58 ± 0,18 µmol ET g-1 MS (5,18 ± 0,06 µmol ET g-1 MF) a 25,25 ± 0,09 µmol ET g-1 MS (7,32 ± 0,03 µmol ET g-1 MF). En los hipocótilos de maca roja y negra se confirma un comportamiento variable, el incremento en la maca roja fue de 19,56 ± 0,66 µmol ET g-1 MS (6,05 ± 0,21 µmol ET g-1 MF) a 25,84 ± 0,19 µmol ET g-1 MS (8,14 ± 0,06 µmol ET g-1 MF) y en la maca negra el incremento fue de 16,03 ± 0,18 µmol ET g-1 MS (4,89 ± 0,05 µmol ET g-1 MF) a 23,48 ± 0,06 µmol ET g-1 MS (8,12 ± 0,02 µmol ET g-1 MF). Durante la pre-cosecha, los extractos de los hipocótilos de maca roja, negra y amarilla, incrementaron su capacidad antioxidante ABTS●+ en 24,30%, 31,73% y 34,34% respectivamente. En un estudio realizado por Chirinos et al. (2007a) con 10 cultivares de mashua entre 5 a 7,5 (cosecha) meses después de la siembra, reportaron resultados ascendentes de capacidad antioxidante ABTS●+ que oscilaron entre 80 a 378 µmol ET g-1 MS, los cultivares de mashua púrpuras, similar al caso de maca roja, presentaron los valores más altos. Son escasos los estudios precosecha en brasicáceas andinas. Se sabe que las semillas germinadas de frejoles, mostraron una mayor capacidad antioxidante que las semillas no germinadas cualquiera sea el método de estimación, a los 5 días de germinación, la capacidad antioxidante ABTS●+ de la soya se incrementó un 167,6% (Xue et al., 2016). Durante el secado natural post-cosecha, se observó una tendencia general ascendente entre ecotipos, siendo mayor la capacidad antioxidante ABTS●+ en la maca roja, seguido de la maca negra y por último la maca amarilla. En la maca amarilla el incremento de la capacidad antioxidante fue de 69,7%, en la maca roja 94,8% y en la maca negra 105,4%. Los resultados obtenidos en este trabajo no corroboran los estudios de evaluación de la actividad antioxidante ABTS●+ durante el soleado post-cosecha de mashua, pues se observó una tendencia de acumulación y elevación de la actividad antioxidante con el paso del tiempo en la maca, al contrario de los estudios de mashua que fue variable y disminuyendo gradualmente al paso del tiempo (Chirinos et al., 2007a). En otros recursos biológicos la capacidad antioxidante ABTS●+ de dos muestras de cáscara de papa liofilizadas, aumentaron significativamente a las 2, 4 y 8 semanas de almacenamiento a -20, 4 y 25 °C, debido probablemente a la producción de glicoalcaloides como respuesta al estrés, a la ruptura de los compuestos polifenólicos durante las primeras etapas de almacenamiento, así como a las interacciones sinérgicas entre los componentes individuales (Al-Weshahy et al., 2013), contradictoriamente la actividad antioxidante FRAP de inflorescencias de brócoli frescos, al momento de su cosecha reportó 3,96 µmol ET g-1 MF, empacados en platillos de plástico y almacenados a 15 °C ± 1 y 55 ± 2% de HR y a 4 ± 0,5 °C y 50 ± 2% de HR, después de 6 días, reportaron una disminución del 53,8% 49,5%, respectivamente (Nath et al., 2011). La aplicación de un proceso tecnológico, no siempre genera un incremento de la capacidad antioxidante, puede ocurrir un efecto inverso, lo cual depende de la naturaleza del material biológico y de las condiciones a la que es sometido.
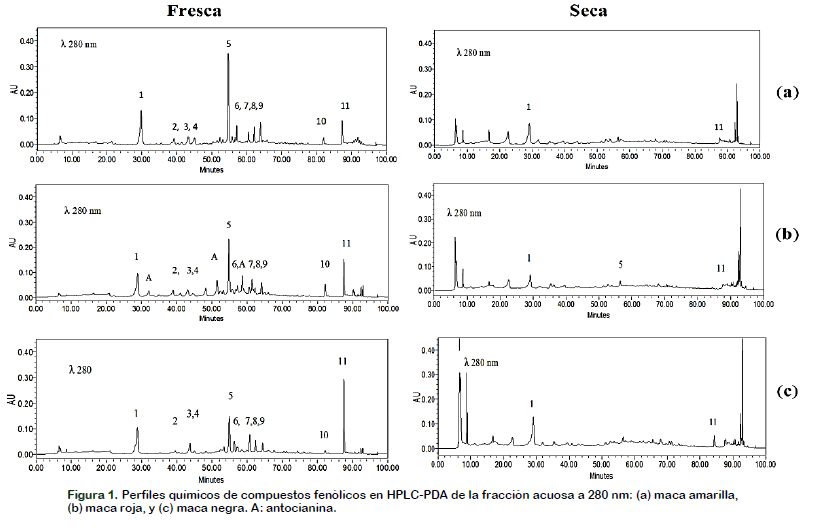
Análisis por HPLC-PDA de los compuestos fenólicos en los hipocótilos de tres ecotipos de maca durante la pre-cosecha, cosecha y secado natural post-cosecha
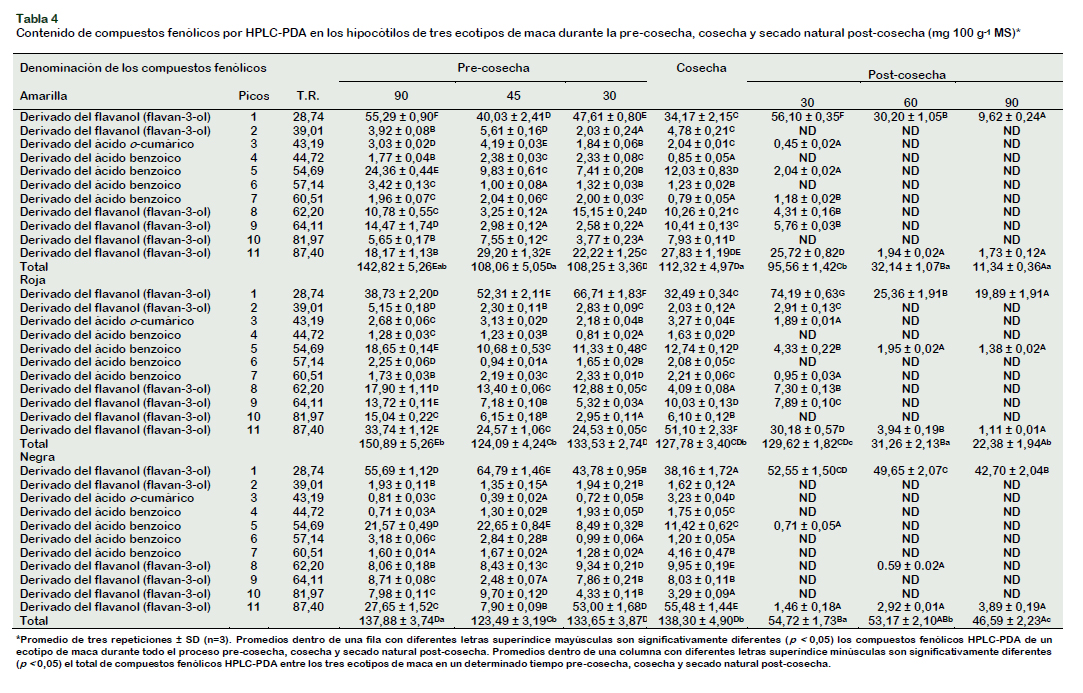
Se ha determinado las características cromatográficas y espectrales de los compuestos fenólicos (tiempo de retención, espectro de absorción, longitud de onda máxima y área relativa) para la identificación y cuantificación de los compuestos fenólicos durante la pre-cosecha, cosecha y secado natural post-cosecha (Chirinos et al., 2008). En los tres hipocótilos de maca, son significativos: seis derivados del flavanol (flavan-3-ol), cuatro derivados del ácido benzoico y uno derivado del ácido ocumárico (Figura 1). En los hipocótilos de maca amarilla, roja y negra, en el momento de la cosecha, el total de los seis derivados del flavanol (flavan-3-ol), representaron, 95,38 ± 4,00 (84,92%), 105,84 ± 3,12 (82,84%) y 116,53 ± 3,67 (84,26%) mg EC 100 g-1 MS, el total de los cuatro derivados del ácido benzoico, 14,90 ± 0,95 (13,27%), 18,53 ± 0,25 (14,60%) y 18,53 ± 1,19 (13,40%) mg EAG 100 g-1 MS y un derivado del ácido o-cumárico, 2,04 ± 0,01 (1,82%), 3,27 ± 0,04 (2,56%) y 3,23 ± 0,04 (2,34%) mg EAG 100 g-1 MS, respectivamente.
Chirinos et al. (2008) en los genotipos de mashua, ARB 5241 (piel púrpura/pulpa amarilla), DP 0224 (piel púrpura/pulpa púrpura) y ARB 5576 (piel amarilla/pulpa amarilla), determinaron cantidades importantes de epigalocatequina, derivados del ácido p-hidroxibenzoico, derivados del ácido cinámico, derivados de galocatequina y procianidina B2. La fracción acuosa de los genotipos de oca (Oxalis tuberosa Mol.), COC-450 (piel púrpura/pulpa amarillapúrpura) y M-2032 (piel amarilla/pulpa amarilla) registraron perfiles similares de compuestos fenólicos con diferencias en la concentración de cada compuesto individual, identificaron derivados del ácido cafeico, derivados de ácido vaníllico, derivados del ácido cinámico y otros picos que parecen corresponder a formas ligadas de catequina, luteolina y apigenina (Chirinos et al., 2009).
En los hipocótilos de maca amarilla, el pico 1 (TR = 28,74 min), derivado del flavanol (flavan-3-ol), disminuyó gradualmente desde 90 días antes de la cosecha hasta el momento de la cosecha, de 55,29 ± 0,90 mg 100 g-1 MS a 34,17 ± 2,15 mg 100 g-1 MS. Durante el secado natural post-cosecha, se observó un incremento importante de este compuesto a los 30 días (56,10 ± 0,35 mg 100 g-1 MS) y desde este momento hacia adelante ocurren pérdidas significativas hasta 9,62 ± 0,24 mg 100 g-1 MS a los 90 días. El pico 3 (TR = 43,19 min), derivado del ácido o-cumárico, desde 90 días antes de la cosecha hasta el momento de la cosecha tuvieron un comportamiento variable, de 3,03 ± 0,02 mg 100 g-1 MS aumentó de 4,19 ± 0,03 mg 100 g-1 MS, luego disminuyó a 1,84 ± 0,06 mg 100 g-1 MS y seguidamente aumentó a 2,04 ± 0,01 mg 100 g-1 MS. A 30 días del secado natural post-cosecha disminuyó significativamente a 0,45 ± 0,02 mg 100 g-1 MS, no es detectado a los 60 y 90 días de dicho periodo. El pico 5 (TR = 54,69 min), derivado del ácido benzoico, 90 días antes de la cosecha tuvo una concentración de 24,36 ± 0,44 mg 100 g-1 MS, disminuyendo a 12,03 ± 0,83 mg 100 g-1 MS en el momento de la cosecha. A 30 días del secado natural post-cosecha, este compuesto disminuyó significativamente hasta 2,04 ± 0,02 mg 100 g-1 MS y no es detectado a los 60 y 90 días de secado natural post-cosecha. El pico 11 (TR = 87,40 min), derivado del flavanol (flavan-3-ol), 90 días antes de la cosecha su contenido fue 18,17 ± 1,13 mg 100 g-1 MS incrementándose a 27,83 ± 1,19 mg 100 g-1 MS al momento de la cosecha. A los 90 días del secado natural post-cosecha este disminuyó significativamente hasta 1,73 ± 0,12 mg 100 g-1 MS (Tabla 4).
Los picos, 2 (TR = 39,01 min), derivado del flavanol (flavan-3-ol), 4 (TR = 44,72 min), derivado del ácido benzoico, 6 (TR = 57,14 min), derivado del ácido benzoico y 10 (TR = 81,97 min), derivado del flavanol (flavan-3-ol) a 30 días de secado natural postcosecha no fueron detectados, sumándose a estos los picos, 3 (TR = 43,19 min), derivado del ácido o-cumárico, 5 (TR = 64,59 min), derivado del ácido benzoico, 7 (TR = 60,51 min), derivado del ácido benzoico, 8 (TR = 62,20 min), derivado del flavanol (flavan-3-ol) y 9 (TR = 64,11 min), derivado del flavanol (flavan-3-ol), que tampoco fueron detectados a partir de los 60 días para adelante, la cuantificación final en esta etapa correspondió solamente a los picos 1 y 11.
En los hipocótilos de maca roja y negra el análisis y patrón de comportamiento variable fue similar con ligeras modificaciones. Camargo et al. (2015) para explicar el comportamiento variable de los compuestos fenólicos HPLC-PDA, ácido ascórbico y actividad antioxidante durante la maduración/senescencia, ocurre un desequilibrio de la homeostasis redox que desencadenan dichas respuestas. En los resultados obtenidos en este trabajo se observó tendencias de incremento y disminución de los diferentes compuestos fenólicos durante la pre-cosecha, esto podría estar relacionado con la complejidad de las rutas metabólicas de biosíntesis y degradación. En el secado natural post-cosecha, los hipocótilos de maca amarilla, roja y negra disminuyeron los compuestos fenólicos HPLC-PDA en 89,90%, 82,49% y 66,31% respectivamente.
Considerando la germinación como un proceso pre-cosecha, los compuestos fenólicos HPLC-PDA en brotes de Brassica oleracea se incrementaron en forma significativa (p < 0,05) a 1138 mg kg-1 MS, expresados como derivados del ácido hidroxicinámico, después de su cosecha, almacenadas a 4 °C durante 7 días continuó incrementándose, un almacenamiento prolongado origina un descenso a los 12 días de ~750 mg∙kg-1 MS, como resultado de la degradación de los tejidos (Valea et al., 2015). En el momento de la cosecha, se observó diferencias significativas a p < 0,05 entre los hipocótilos de maca amarilla y roja, amarilla y negra, pero no entre los hipocótilos de maca roja y negra, el mayor valor se observó en la maca negra, 138,30 ± 4,90 mg 100 g-1 MS. Durante el secado natural post-cosecha, los tres ecotipos de maca sufren una disminución de su contenido de compuestos fenólicos totales; sin embargo, a los 30 días, el ecotipo rojo todavía mantiene un contenido similar al que presentó en la etapa pre-cosecha y cosecha (129,62 ± 1,82 mg 100 g-1 MS). A los 90 días del secado natural post-cosecha se evidenció diferencia significativa a p < 0,05, entre los tres ecotipos, el mayor contenido se observó en la maca negra, 46,59 ± 2,23 mg 100 g-1 MS. Con estos resultados, la serie de eventos que ocurren durante el secado natural post-cosecha afectan significativamente al contenido de compuestos fenólicos individuales identificados como derivados del flavanol (flavan3-ol), ácido benzoico y ácido o-cumárico, los mismos que tienen efecto sobre el contenido total, haciéndose crítico a partir de los 30 días para adelante. Son muy escasos los estudios que evalúen el comportamiento de los compuestos fenólicos individuales en brasicáceas, particularmente en la etapa de precosecha. Odeh et al. (2014) estudiaron los compuestos fenólicos determinados por HPLC durante la maduración de frutos de siete cultivares de plantas datileras, encontraron ácido gálico, ácido p-hidroxi benzoico, ácido vaníllico, ácido cafeico, ácido siringico y ácido ferúlico, registrando incremento en algunos de ellos e incremento y descenso en otros. Similar variación ocurrió en el contenido de siete compuestos fenólicos durante el desarrollo de hojas, tallos y raíces de frijol de palo (Cajanus cajan (L.) Millsp.) evaluados en forma simultánea, los autores del trabajo plantean que su variación responde a una correlación entre el equilibrio metabólico de las plantas y las perturbaciones ambientales externas (Liu et al., 2010). Wang et al. (2016) en el proceso de maduración de azufaifa (Ziziphus jujuba Miller), reportó que individualmente cada compuesto fenólico varió de distinta manera, el ácido clorogénico varió de 47,55 µg-1 MS a 8,01 µg-1 MS y 366,53 µg-1 MS y el ácido p-hidroxi benzoico libre varió de 71,35 a 12,54 y 0,14 µg-1 MS. Estos resultados podrían explicar que, durante la etapa de pre-cosecha de los hipocótilos de maca, individualmente cada compuesto fenólico responde fisiológicamente de manera distinta a las condiciones climáticas extremas que se dan en la Meseta de Bombón, debido sobre todo a la extrema variación de la temperatura (-10 a 15 °C), esta respuesta fisiológica podríamos denominarla como "incertidumbre metabólica". La disminución de los compuestos fenólicos observada en la etapa de secado natural post-cosecha, podrían ser a consecuencia de la ruptura de la estructura celular y al daño por frio ocasionado a temperaturas por debajo de los 4 °C, tal como lo propone Liu et al. (2010).
4. Conclusiones
Los estudios de este trabajo revelaron que la maca fresca representa una fuente importante de compuestos fenólicos y capacidad antioxidante. El perfil químico evidencia que el ecotipo rojo presenta las mayores concentraciones de compuestos fenólicos en comparación al amarillo y al negro. Los análisis por HPLC-PDA revelaron la prevalencia de 11 compuestos fenólicos, con diferentes concentraciones en cada ecotipo y en cada etapa de maduración, tales como, seis derivados del flavanol (flavan-3-ol) (82,84 a 84,92%), cuatro derivados delácido benzoico (13,27 a 14,69%) y un derivado del ácido ocumárico (1,82 a 2,56%). El secado postcosecha en condiciones tradicionales generó una pérdida significativa principalmente de los derivados del ácido benzoico y o-cumárico hasta límites no detectables, toleraron mejor estas condiciones los derivados del flavanol (flavan-3-ol), esta pérdida en la maca amarilla representa el 89,90%, en la maca roja 82,49% y en la maca negra 66,31%. De los resultados se desprende la posibilidad de un secado post-cosecha en condiciones ambientales entre 15 a 30 días, seguido de un escaldado para inactivar enzimas y secado por aire caliente.
Agradecimientos
A la Ing. Katiusca Luna Mayta y a la empresa ECOANDINO S.A.C. por la provisión oportuna de las muestras de maca.
Referencias bibliográficas
Al-Weshahy, A.; El-Nokety, M.; Bakhete, M.; Rao, V. 2013. Effect of storage on antioxidant activity of freeze-dried potato peels. Food Research International 50(2): 507-512. [ Links ]
Amodio, M.L.; Derossi, A.; Colelli, G. 2014. Modeling phenolic content during storage of cut fruit and vegetables: A consecutive reaction mechanism. Journal of Food Engineering 140: 1-8. [ Links ]
Armesto, J.; Gómez-Limia, L.G.; Carballo, J.; Martínez, S. 2017. Impact of vacuum cooking and boiling, and refrigerated storage on the quality of galega kale (Brassica oleracea var. acephala cv. Galega). LWT Food Science and Technology 79: 267-277. [ Links ]
Arnao, M.; Cano, A.; Acosta, M. 2003. The hydrophilic and lipophilic contribution to total antioxidant activity. Food Chemistry 73(2): 239-244. [ Links ]
Awika, J.M.; Rooney, L.W.; Wu, X.; Prior, R.L.; CisnerosZevallos, L. 2003. Screening methods to measure antioxidant activity of sorghum (Sorghum bicolor) and Sorghum products. Journal of Agriculture and Food Chemistry 51(23): 6657-6662. [ Links ]
Camargo, L.; Milanez, J.; Moreno, R.; Cisneros-Zevallos, L. 2015. Post-harvest nutraceutical behaviour during ripening and senescence of 8 highly perishable fruit species from the Northern Brazilian Amazon region. Food Chemistry 174: 188-196. [ Links ]
Campos, D.; Noratto, G.; Chirinos, R.; Arbizu, C.; Roca, W.; Cisneros-Zevallos, L. 2006. Antioxidant capacity and secondary metabolites in four species of Andean tuber crops: Native potato (Solanum sp.), mashua (Tropaeolum tuberosum Ruiz and Pavón), oca (Oxalis tuberosa Molina) and ullucu (Ullucus tuberosum). Journal of the Science of Food and Agricultural 86(10): 1481-1488. [ Links ]
Cartea, M.E.; Francisco, M.; Soengas, P.; Velasco, P. 2011. Review Phenolic Compounds in Brassica Vegetables. Molecules 16(1): 251-280. [ Links ]
Costa, D.C.; Costa, H.S.; Gonçalves Albuquerque, T.; Ramos, F.; Castilho, M. C.; Sanches-Silva, A. 2015. Advances in phenolic compounds analysis of aromatic plants and their potential applications. Trends in Food Science & Technology 45(2): 336-354. [ Links ]
Chang, C.C.; Yang, M.H.; Wen, H.M.; Chern, J.C. 2002. Estimation of total flavonoid content in propolis by two complementary colorimetric methods. Journal of Food and Drug Analysis 10(3): 178-182. [ Links ]
Chirinos, R.; Betalleluz-Pallardel, I.; Huamán, A.; Arbizu, C.; Pedreschi, R.; Campos, D. 2009. HPLC-DAD characterisation of phenolic compounds from Andean oca (Oxalis tuberosa Mol.) tubers and their contribution to the antioxidant capacity. Food Chemistry 113(4): 1243-1251. [ Links ]
Chirinos, R.; Campos, D.; Arbizu, C.; Rogez, H.; Rees, JF.; Larondelle, Y.; Noratto, G.; Cisneros-Zevallos, L. 2007a. Effect of genotype, maturity stage and post-harvest storage on phenolic compounds, carotenoid content and antioxidant capacity, of Andean mashua tubers (Tropaeolum tuberosum Ruiz & Pavón). Journal of the Science of Food and Agriculture 87(3): 437-446. [ Links ]
Chirinos, R.; Campos, D.; Costa, N.; Arbizu, C.; Pedreschi, R.; Larondelle, Y. 2008. Phenolic profiles of Andean mashua (Tropaeolum tuberosum Ruíz & Pavón) tubers: Identification by HPLC-DAD and evaluation of their antioxidant activity. Food Chemistry 106(3): 1285-1298. [ Links ]
Chirinos, R.; Rogez, H.; Campos, D.; Pedreschi, R.; Larondelle, Y. 2007b. Optimization of extraction conditions of antioxidant phenolic compounds from mashua (Tropaeolum tuberosum Ruíz & Pavón) tubers. Separation and Purification Technology 55(2): 217-225. [ Links ]
Delcour, J.A.; Devarebeke, D. 1985. A new colorimetric assay for flavonoids in pilsner beers. Journal of the Institute of Brewing 91(1): 37-40. [ Links ]
Esua, O.J.; China, N.L.; Yusof, Y.A.; Sukor, R. 2019. Effects of simultaneous UV-C radiation and ultrasonic energy postharvest treatment on bioactive compounds and antioxidant activity of tomatoes during storage. Food Chemistry 270: 113-122. [ Links ]
Giusti, M.M.; Wrolstad, R.E. 2001. Anthocyanins. Characterization and measurement with UV–Visible spectroscopy. In R. E. Wrolstad (Ed.), Current protocols in food analytical chemistry, Unit F 1.2 (pp. 1–13). New York: John Wiley & Sons. [ Links ]
Korkmaz, S. 2018. Antioxidants in maca (Lepidium meyenii) as a supplement in nutrition. In E. Shalaby (Ed.), Antioxidants in Foods and Its Applications (pp.138-154). IntechOpen Limited. [ Links ]
Lima, G.P.P.; Vianello, F.; Corrêa, C.R.; da Silva Campos, R.A.; Borguini, M.G. 2014. Polyphenols in fruits and vegetables and its effect on human health. Food and Nutrition Sciences 5(11): 1065-1082. [ Links ]
Liu, H.K.; Kang, Y.F., Zhao, X.Y.; Liu, Y.P.; Zhang, X.W.; Zhang, S.J. 2019. Effects of elicitation on bioactive compounds and biological activities of sprouts. Journal of Functional Foods 53: 136–145. [ Links ]
Liu, W.; Zu, Y.G.; Fu, Y.J.; Kong, Y.; Ma, W.; Yang, M.; Li, J.; Wu, N. 2010. Variation in contents of phenolic compounds during growth and post-harvest storage of pigeon pea seedlings. Food Chemistry 121(3): 732-739. [ Links ]
Lombardo, S.; Pandino, G.; Mauromicale, G. 2018. The influence of pre-harvest factors on the quality of globe artichoke. Scientia Horticulturae 233: 479-490. [ Links ]
Martins, N.; Petropoulos, S.; Ferreira, I.C. 2016. Chemical composition and bioactive compounds of garlic (Allium sativum L.) as affected by preand post-harvest conditions: A review. Food Chemistry 211: 41-50. [ Links ]
Nath, A.; Bagchi, B.; Misra, L.K.; Deka, B.C. 2011. Changes in post-harvest phytochemical qualities of broccoli florets during ambient and refrigerated storage. Food Chemistry 127(4): 1510-1514. [ Links ]
Odeh, I.; Al-Rimawi, F.; Abbadi, J.; Obeyat; L.; Qabbajeh, M.; Hroub, A. 2014. Effect of Harvesting Date and Variety of Date Palm on Antioxidant Capacity, Phenolic and Flavonoid Content of Date Palm (Phoenix Dactylifera). Journal of Food and Nutrition Research 2(8): 499-505. [ Links ]
Ordóñez-Santos, L.E.; Vázquez-Odériz, L.; Arbones-Maciñeira, E.; Romero-Rodríguez, A. 2009. The influence of storage time on micronutrients in bottled tomato pulp. Food Chemistry 112(1): 146-149. [ Links ]
Patras, A.; Tiwari, B.K.; Brunton, N.P. 2011. Influence of blanching and low temperature preservation strategies on antioxidant activity and phytochemical content of carrots, green beans and broccoli. LWT-Food Science and Technology 4(1): 299-306. [ Links ]
Pinela, J.; Barros, L.; Barreira, J.C.M.; Carvalho, A.M.; Oliveira, B.P.; Santos-Buelga, C.; Ferreira, I.C.F.R. 2018. Postharvest changes in the phenolic profile of watercress induced by post-packaging irradiation and modified atmosphere packaging. Food Chemistry 254: 70-77. [ Links ]
Sandoval, M.; Okuhama, N.N.; Angeles, F.M.; Melchor, V.V.; Condezo, L.A.; Lao, J.; Miller, M.J.S. 2002. Antioxidant activity of the cruciferous vegetable Maca (Lepidium meyenii). Food Chemistry 79(2): 207-213. [ Links ]
Singleton, V.L.; Rossi, J.A. 1965. Colorimetry of total phenolics with phosphomolybedic-phosphotungstic acid reagents. American Journal of Enology and Viticulture 16(3): 144-158. [ Links ]
Tao, Y.; Han, M.; Gao, X.; Han, Y.; Show, P.L.; Liu, Ch.; Ye, X.; Xie, G. 2019. Applications of water blanching, surface contacting ultrasound-assisted air drying, and their combination for dehydration of white cabbage: Drying mechanism, bioactive profile, color and rehydration property. Ultrasonics Sonochemistry (In Press). [ Links ]
Tiwari, U.; Cummins, E. 2013. Factors influencing levels of phytochemicals in selected fruit and vegetables during pre-and post-harvest food processing operations. Food Research International 50(2): 497-506. [ Links ]
Valea, A.P.; Santos, J.; Brito, N.V.; Marinho, C.; Amorim, V.; E.; Oliveira, B.P. 2015. Effect of refrigerated storage on the bioactive compounds and microbial quality of Brassica oleraceae sprouts. Postharvest Biology and Technology 109: 120-129. [ Links ]
Wang, B.; Huang, Q.; Venkitasamy, C.; Chai, H.; Gao, H.; Cheng, N.; Cao, W.; Lv, X.; Pan, Z. 2016. Changes in phenolic compounds and their antioxidant capacities in jujube (Ziziphus jujuba Miller) during three edible maturity stages. LWT Food Science and Technology 66: 56-62. [ Links ]
Xue, Z.; Wang, C.; Zhai, L.; Yu, W.; Chang, H.; Kou, X.; et al. 2016. Bioactive compounds and antioxidant activity of mung bean (Vigna radiata L.), soybean (Glycine max L.) and black bean (Phaseolus vulgaris L.) during the germination process. Czech Journal of Food Sciences 34(1): 68-78. [ Links ]
Zevallos-Concha, A.; Nuñez, D.; Gasco, M.; Vasquez, C.; Quispe, M.; Gonzales, G. F. 2016. Effect of gamma irradiation on phenol content, antioxidant activity and biological activity of black maca and red maca extracts (Lepidium meyenii Walp). Toxicology Mechanisms and Methods 26: 67-73. [ Links ]
Zhang, H.; Tsao, R. 2016. Dietary polyphenols, oxidative stress and antioxidant and anti-inflammatory effects. Current Opinion in Food Science 8: 33-42. [ Links ]
Zhang, J.; Tian, Y.; Yan, L.; Zhang, G.; Wang, X.; Zeng, Y.; et al. 2016. Genome of plant maca (Lepidium meyenii) illuminates genomic basis for high–altitude adaptation in the central Andes. Molecular Plant 9: 1066-1077. [ Links ]
Zheng, W.; Wang, S.Y. 2003. Oxygen radical absorbing capacity of phenolics in blueberries, cranberries, chokeberries, and lingonberries. Journal of Agriculture and Food Chemistry 51(2): 502-509. [ Links ]
Received June 18, 2018.
Accepted March 17, 2019.
* Corresponding author
E-mail: eyabar@uncp.edu.pe (E. Yábar).