INTRODUCCIÓN
La anemia gestacional continúa siendo un problema de salud pública a nivel mundial. A pesar de numerosas intervenciones, en todas las poblaciones de la mayoría de los países, la prevalencia de la anemia leve ha cambiado poco, mientras que la anemia moderada y grave disminuyó significativamente 1,2). Sin embargo, las cifras globales de anemia se han mantenido estancadas en las dos últimas décadas.
La Organización Mundial de la Salud (OMS) reconoce que los resultados de la intervención con hierro durante los últimos 20 años han sido insatisfactorios y que las estrategias para reducir estas altas tasas deben ser integrales y no solo enfocadas a suplementar a las poblaciones con hierro 3). El diagnóstico de la anemia se basa en la sola medición de la hemoglobina (Hb)(4), lo cual imposibilita determinar su causa o etiología.
La OMS recomienda desde 2016 que en el segundo trimestre se considere como umbral de Hb para diagnosticar anemia un valor de 10,5 g/dL y para el primer y tercer trimestre un valor de 11 g/dL 5). Como el embarazo es una condición nueva y donde se desarrolla una nueva vida, se requiere 1,040 mg adicionales de hierro para la eritropoyesis, la placenta, el feto y para el parto 6). Para ello, desde el segundo trimestre los niveles de la hormona hepcidina bajan y con ello aumenta la absorción del hierro, lo que permite incrementar la producción de glóbulos rojos que aumenta la masa roja en 20%, y para evitar una hemoconcentración el volumen vascular se expande al 50%, proceso que permite generar una hemodilución, por lo que la concentración de hemoglobina y de ferritina se reducen.
La OMS prioriza al diagnóstico de la anemia mediante el uso del hemograma automatizado en sangre venosa, debido a que la medición en sangre capilar es inexacta (7). Por lo general, la medición de la Hb en los diferentes países se hace usando el hemoglobinómetro denominado HemoCue. Un estudio de metaanálisis muestra que las mediciones de Hb con HemoCue® Hb 301 resultan en concentraciones más altas que las mediciones con HemoCue® Hb 201+ en mujeres no embarazadas 8). Estas diferencias deben ser tomadas en cuenta cuando se requiere comparar prevalencia de anemia entre diferentes regiones o entre diferentes tiempos en una misma región.
En diversos estudios se ha demostrado que la anemia por deficiencia de hierro (ADH) no sería la principal causa de anemia en países de ingresos medios y bajos, y han establecido que donde las infecciones y el parasitismo son endémicos predomina la anemia inflamatoria. Por ello, los programas de control de la anemia deben ser específicos de cada región 9).
El embarazo se caracteriza por una respuesta inmune reducida, lo que genera una mayor susceptibilidad a las infecciones 10). Otro aspecto para tener en cuenta es que según la etnia hay diferencias en las tasas de anemia y los resultados adversos 11).
En gestantes que inician el embarazo con valores normales de Hb y de ferritina sérica (FS) cuando son evaluadas prospectivamente reducen sus concentraciones en el segundo y tercer trimestre y luego se recuperan al término del embarazo, lo que sugiere no requerir de suplemento de hierro (SH) 12). En la actualidad hay gran preocupación sobre el exceso de hierro en la dieta, debido al riesgo de sobrecarga en los tejidos, ya que en gestantes no anémicas con SH se observan efectos adversos con una dosis de 45 mg/día.
La eritrocitosis o Hb > 13 g/dL durante la gestación causa alta viscosidad sanguínea, lo que resulta en una menor disponibilidad de oxígeno a los tejidos y complicaciones en la salud 13). La asociación entre los niveles de Hb y los resultados de la gestación tiene forma de U 14). La anemia grave y en algunos casos también la moderada son las únicas asociadas a daño en la salud de la madre y/o del recién nacido 15,16).
La presente revisión discutirá el rol y resultados asociados a la hemodilución, ADH, y eritrocitosis en la gestación, la corrección de la Hb por la altura y el impacto de la contaminación ambiental del aire sobre la concentración de Hb durante la gestación.
EVALUACIÓN DE LOS CRITERIOS HEMATOLÓGICOS PARA DEFINIR ANÉMIA: USO DEL HEMOGRAMA AUTOMATIZADO
En el 2016, la OMS notificó que las gestantes deberían ser evaluadas trimestralmente mediante el uso del hemograma automatizado 5). La alteración de tres a cuatro de los valores normales para el volumen corpuscular medio (VCM), la hemoglobina corpuscular media (HCM), la concentración media de hemoglobina corpuscular (CHCM) y el coeficiente de variación de la amplitud de distribución eritrocitaria (RDW-CV) y una Hb< 11 g/dL son calificadas como ADH, en tanto con Hb<11 g/dL y los cuatro marcadores normales se califica como anemia por hemodilución 17).
La concentración del receptor soluble de transferrina (RsTf) en hemodilución es similar a lo observado en gestantes normales o con eritrocitosis, indicando que no son DH ni requieren una mayor eritropoyesis. A través de la curva ROC se analizaron tres modelos para diagnosticar ADH grave, ADH total y anemia por hemodilución. Los resultados muestran que los criterios empleados permiten diferenciar ADH (total y grave) y anemia por hemodilución (tabla 1). Similares resultados se han observado en otra investigación realizada en 2,100 gestantes 18).
Tabla 1 Áreas bajo la curva ROC con respecto a cada biomarcador del estado de hierro o inflamación.
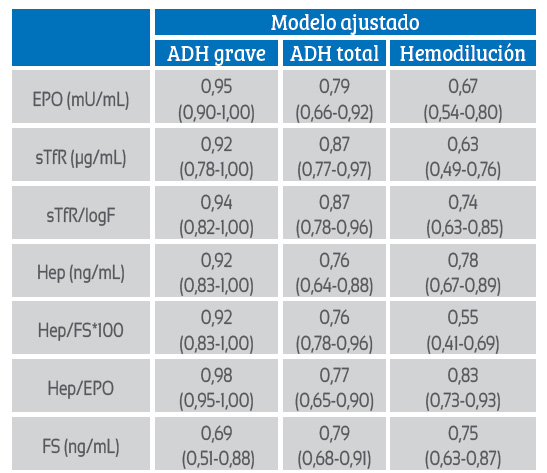
EPO: Eritropoyetina; sTfR: Receptor soluble de transferrina; Log F: Logaritmo de ferritina, Hep: Hepcidina, FS: Ferritina sérica. Modelo ajustado: controlado por paridad, edad gestacional e inflamación. Fuente:(45).
Los valores del hemograma automatizado pueden servir para valorar la DH, inflamación y la anemia macrocítica que puede orientar a la existencia de una deficiencia de ácido fólico y de vitamina B12. Incluso hay marcadores del hemograma automatizado para diferenciar anemia por talasemia de la ADH. El análisis automatizado es mucho más costo efectivo que solo la medición de hemoglobina 19,20).
UMBRALES DE LA CONCENTRACIÓN DE LA HEMOGLOBINA PARA EL DIAGNOSTICO DE ANEMIA
Luego de la definición en 1967 del umbral de Hb para el diagnóstico de anemia durante la gestación (Hb: 11 g/dL), en el 2016, la OMS realizó ajustes para gestantes en el segundo trimestre (Hb: 10,5 g/dL) 5).
El punto de corte de Hb en mujeres en edad reproductiva también ha sido motivo de discrepancia, debido a la baja respuesta de la intervención con hierro. Así, en la India se ha demostrado que el punto de corte de Hb para una mujer no gestante sería 10,8 g/dL y no 12 g/dL como propone OMS y este mayor punto de corte explicaría la persistentemente alta prevalencia de anemia (21). Si bien la OMS ha definido valores referenciales para los niveles bajos de Hb, no ha hecho lo mismo para los valores altos 14).
CORRECCIÓN DE LA HEMOGLOBINA POR LA ALTURA DE RESIDENCIA
Debido a que la concentración de Hb se incrementa conforme aumenta la altitud de residencia, la OMS propone corregir la Hb a partir de los 1,000 m. Este ajuste es proporcional a la altura, y cuando se corrige la Hb por la altura, las tasas de anemia se incrementan notablemente 22).
Una reciente revisión sugiere que la seguridad diagnóstica de la hemoglobina es mayor cuando no se utiliza corrección por la altura 23). En gestantes peruanas, la corrección de la Hb por la altura aumenta 3,75 veces los casos de anemia en las mujeres en edad reproductiva y en 4,7 veces la prevalencia de anemia en gestantes (Figura 1).
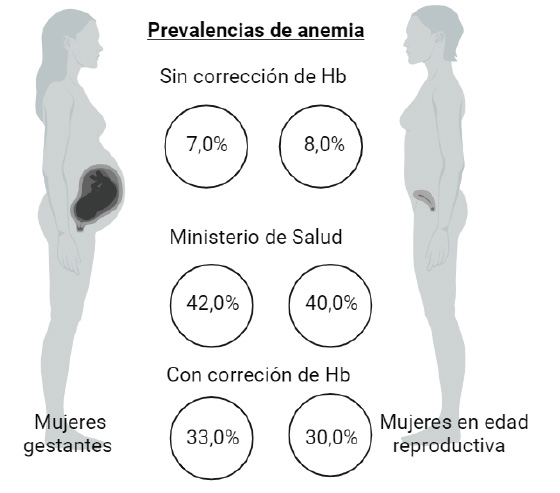
Figura 1 Prevalencia de anemia con y sin corrección de la hemoglobina por la altura en mujeres gestantes y mujeres en edad reproductiva.
Este criterio de corrección consiste en que en la altura hay una menor saturación arterial de oxígeno, lo que para nivelarlo al valor de nivel del mar debe reducirse de manera proporcional el valor de Hb. Esta suposición, sin embargo, no toma en cuenta que cada grupo hemo de la molécula de Hb tiene un átomo de hierro en su interior y que, por lo tanto, de ser cierta la premisa de menor disponibilidad de oxígeno en la altura, esta no se va a corregir con la administración de más hierro. Por el contrario, al aumentar la ingesta de hierro hay mayor posibilidad de eritrocitosis. Los diferentes estudios demuestran que el CCH en gestantes de altura es similar o más alto que a nivel del mar 24).
La eritrocitosis se asocia a mayor viscosidad de la sangre y matemáticamente se puede reducir el valor de Hb por la corrección por la altura, pero ello no va a cambiar el grado de viscosidad, aunque por la corrección de la Hb las gestantes pasen a la categoría de Hb normal.
ANEMIA POR DEFICIENCIA DE HIERRO, ANEMIA POR HEMODILUCIÓN Y ANEMIA POR OTRAS CAUSAS DE LA GESTANTE
La anemia tiene un origen multifactorial. Sin embargo, tanto en la práctica clínica como en la salud pública el hierro es la primera y a menudo la única intervención para tratar la anemia 3).
De acuerdo con la OMS y durante largo tiempo se estableció que la DH era la causa del 50% de la anemia, en tanto 42% era debido a factores inflamatorios y 8% a otras causas. Esto ha cambiado en la actualidad pues en entornos con alta carga de infección predomina la anemia inflamatoria (9, 10).
ANEMIA POR DEFICIENCIA DE HIERRO
Para diagnosticar ADH se utilizan las pruebas de FS, la Hb, el VCM, la HCM, la CHCM y la RDW-CV, los cuales se encuentran reducidos excepto el RDW-CV, que más bien se incrementa 25). La ADH particularmente de grado moderado y grave requieren de tratamiento con SH.
La SH debe orientarse al segundo y tercer trimestre, mientras que en gestantes no anémicas no debería administrarse. En el primer trimestre (organogénesis), la absorción intestinal del hierro es bastante baja debido a que el hierro es teratogénico, y por ello no debe suplementarse con hierro.
Conforme avanzan los trimestres, el volumen plasmático incrementa; en el primer trimestre aumenta un 6%, en el segundo entre 18 y 29% y en el tercer trimestre entre 42 y 48%(26). Esta expansión vascular es dependiente del eje renina-angiotensina-aldosterona. Un menor incremento del volumen plasmático (hemoconcentración) se relaciona con alteraciones hipertensivas del embarazo.
Se ha sugerido realizar sistemáticamente un hemograma en el primer trimestre del embarazo pues la medición de Hb en ese periodo es el mejor biomarcador predictivo de la anemia en el tercer trimestre, con un valor de corte de 12 g/dL 27). La ADH se diagnostica cuando los niveles de FS están por debajo de lo normal y los valores del RsTf se encuentran elevados. También se ha descrito la valoración del contenido corporal de hierro (CCH) que utiliza los valores del logaritmo de la proporción RsTf y ferritina [Log. (R/F)]. Se considera ADH cuando los valores de CCH son menores de - 4 mg/kg 24).
La OMS da valores referenciales para ferropenia solo en el primer trimestre con valores de FS<15 ng/mL. Luego indica que este umbral se modifica, aunque no establece cifras, tanto por efecto de un aumento fisiológico de las proteínas de fase aguda secundario al embarazo, aumento del volumen plasmático en el segundo trimestre y cambios en las medidas de inflamación en el tercer trimestre de gestación 28). El índex RsTf/ LogFS según unos autores predice mejor la DH en sujetos que presentan inflamación 29).
En Perú, los programas de reducción de anemia mediante SH, han sido ineficaces, particularmente para las poblaciones de gran altitud, donde los niveles séricos de hepcidina son similares o mayores, como se ha demostrado en gestantes de Ayacucho y Cusco 30), que en las de nivel del mar. Ello indica que la DH no ocurre poblacionalmente en las zonas a grandes altitudes. Un problema adicional es que la frecuencia de eritrocitosis disminuye. A nivel del mar, la eritrocitosis se asocia con efectos adversos como preeclampsia, diabetes gestacional, pequeño para edad gestacional (PEG) y partos pretérminos (PP). Al corregir la Hb por la altura, la tasa de eritrocitosis disminuye, pero los problemas de salud van a subsistir.
ANEMIA GESTACIONAL POR HEMODILUCIÓN
En las gestantes, la expansión del volumen plasmático puede llegar al 50%, valor superior al 20% en que aumenta la masa roja, por lo que ocurre una hemodilución que determina que la concentración de Hb disminuya a pesar de la mayor eritropoyesis 26). Para diferenciar la ADH de la anemia por hemodilución en 183 gestantes atendidas en el Instituto Nacional Materno Perinatal, se realizó el diagnóstico de ADH grave y total con VCM (15%) y Hb (11g/dL) para el primer y tercer trimestre y 10,5 g/dL para el segundo trimestre. La anemia por hemodilución se diagnostica cuando hay Hb<11 g/dL asociado a los 4 valores corpusculares dentro de la normalidad. Las gestantes con hemodilución representaron el 17,3%, y aquellas con ADH el 13,96%.
En el diagnóstico de ADH grave, ADH total y anemia por hemodilución hay menores valores estadísticamente significativos versus el grupo de Hb normal de los marcadores de FS y hepcidina. El RsTf, Index RsTf/Log ferritina y la eritropoyetina se encuentran en mayor concentración en las gestantes con ADH grave y ADH total que en las gestantes con anemia por hemodilución y que el grupo referencial (tabla 2). El área bajo la curva (ABC) ROC para ADH (total y grave) y para anemia por hemodilución se encuentran en la tabla 1. El modelo de regresión ajustado por diferentes variables muestra una mejor ABC ROC para ADH (total o grave), pero no para anemia por hemodilución. Asimismo, la relación hepcidina/FS muestra buena ABC ROC para ADH (total o grave) pero no para la anemia por hemodilución. Esta metodología permite diferenciar ADH de anemia por hemodilución.
Tabla 2 Biomarcadores serológicos según categorías definidas por parámetro hematológicos.
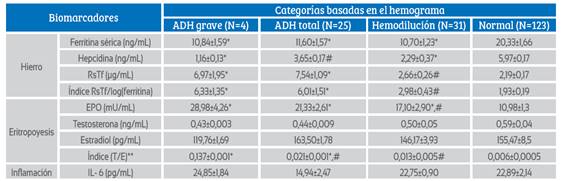
Los datos son medias ± EE.**Valores reportados por 10. ANOVA *p<0,05 con respecto a las gestantes normales. # p<0,05 con respecto a las gestantes deficiencia de hierro grave. EPO: Eritropoyetina; IL-6: Interleucina 6. Fuente:(45).
Diversos estudios muestran que la anemia leve se relaciona con resultados maternos perinatales favorables, lo cual estaría asociado con la hemodilución al tener valores normales del VCM. En China, en 18’948,443 gestantes entre 15 y 49 años la anemia moderada/grave se asoció con resultados adversos, mientras que la leve se asoció con mejor salud materna y fetal 31). Esto permitiría a nuestro país no considerar la anemia como un problema grave de salud pública, pues entre anemia grave y moderada no superan el 10% (Figura 2). Esto indicaría que no todos los casos de anemia leve van a requerir tratamiento, sobre todo si en estos casos no se diagnostica una deficiencia de hierro.
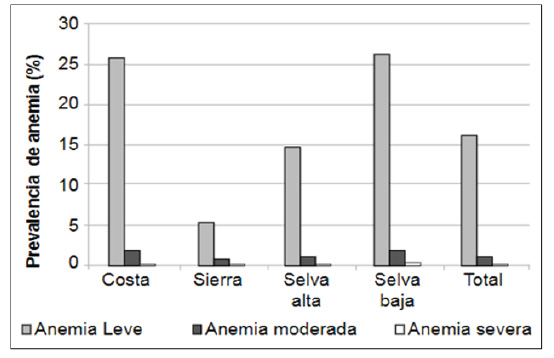
Figura 2 Prevalencia de anemia gestacional en diferentes regiones del Perú según grado de anemia (leve, moderada y grave) y anemia total. La concentración de Hb para definir anemia no ha sido corregida por la altura (Elaboración propia. Publicado en la Revista Peruana de Medicina Experimental y Salud Pública) (44).
OTRAS CAUSAS DE ANEMIA
Otras causas de anemia incluyen a otras deficiencias nutricionales (vitaminas, proteínas), afecciones infecciosas e inflamatorias, pérdida de sangre y trastornos genéticos de la Hb, que pueden superponerse y variar según la geografía 10).
ERITROCITOSIS EN LA GESTACIÓN
Tanto las concentraciones bajas como altas de Hb materna son fuertes predictores de resultados adversos para la salud materna e infantil 14).
En un reciente estudio, la obesidad se asoció a eritrocitosis 32). Esto se puede deber a la hemoconcentración en la gestante obesa. La eritrocitosis (Hb > 13 g/dL) se asocia a una reducción del peso del recién nacido mayor de 100 g que cuando la Hb materna es de 10 g/dL 33), y también a un mayor riesgo de diabetes gestacional 34). Hay varios mecanismos potenciales de cómo se genera la eritrocitosis, entre ellos, una menor expansión del volumen plasmático; un mayor estado de hierro y la vida en las grandes alturas. Estudios nacionales han demostrado que en gestantes de Cusco (3400 m), el CCH fue mayor que en Lima 24). Los sherpas tienen un mayor volumen plasmático como resultado de mejor adaptación que los nativos andinos 35).
ANEMIA GESTACIONAL Y SU ASOCIACIÓN CON CONTAMINANTES AÉREOS
Los contaminantes del aire causan cambios en la homeostasis del hierro, culminando en inflamación y fibrosis 36). El hierro en exceso en los tejidos puede afectar su función e incluso producir ferroptosis, muerte celular programada dependiente de hierro y por lipoperoxidación lipídica.
El hierro puede también ser parte del material particulado (PM2,5 y PM10) y así ocasionar un exceso a nivel respiratorio y un ingreso mayor desde la vía olfativa hacia el cerebro. En casos de inflamación puede haber ADH con carga alta de hierro en los tejidos que son secuestrados por el aumento en los niveles de hepcidina generado por la inflamación. Existe evidencia de la asociación entre la exposición a la contaminación atmosférica y los efectos adversos en el embarazo como peso bajo al nacer, pequeño para edad gestacional, parto pretérmino (PP) e incluso muerte fetal 37). El feto es más vulnerable durante la etapa temprana del desarrollo a la muerte asociada con la exposición a PM2,5 38.
La exposición prenatal a la contaminación del aire, especialmente en las semanas 21 a 24 del embarazo, se asocia con el riesgo de rotura prematura de membranas (RPM), que está parcialmente mediado por los niveles bajos de Hb materna. La SH en gestantes anémicas puede evitar el riesgo de RPM asociado con la exposición a la contaminación del aire 39).
Un estudio entre 2015 y 2021 con 6824 gestantes de tres hospitales de China encontró que por cada 10 μg/m3 en PM2,5 y PM10, y por cada 5 μg/ m3 en SO2 y por cada 0,1 mg/m3 en CO de incremento durante el segundo y tercer trimestre se asocian a menores niveles de Hb materna 40).
Igualmente, por cada incremento del rango Inter cuartil (RIQ) de PM2.5, carbón negro, nitrato (NO3-) y materia orgánica (MO) hay una disminución de Hb 40). Y en Etiopía, en 1088 gestantes se demostró que el uso del querosene y carbón vegetal para cocinar se asoció con anemia (OR: 4,6; IC 95%: 1,41 a 18,35); siendo más alto en aquellas que se encontraban en el tercer trimestre (tabla 3), mientras otros estudios encuentran que la exposición a PM2,5 se asocia con reducción en el crecimiento fetal debido a eritrocitosis 41).
Tabla 3 Revisión literaria relacionados a contaminación ambiental y anemia
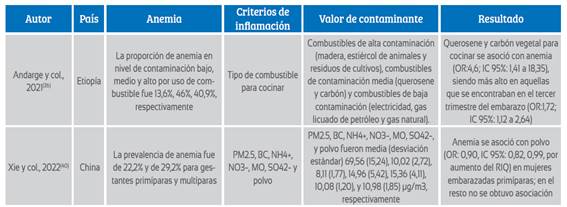
RIQ: rango intercuartílico. PM2,5: material particulado <2,5 μg, BC: carbón negro, NH4+: amonio, NO3−: nitrato, SO42−: sulfato; MO: materia orgánica. IC95%: intervalo de confianza al 95%
Estos resultados contradictorios muestran la necesidad de mayor investigación sobre el impacto de los contaminantes del aire en las diferentes fases del embarazo sobre la concentración de Hb, incluyendo el PM y sus constituyentes.
SUPLEMENTACIÓN DE HIERRO: NORMA TÉCNICA O CRITERIO FISIOLÓGICO
Durante el embarazo, los requerimientos de hierro cambian de 1 mg/día en mujeres no embarazadas a 0,8 mg/día en el primer trimestre y 7 mg/ día en el segundo y tercer trimestre. Como la DH se ha relacionado con resultados adversos del embarazo, la SH es una práctica común antes y durante el embarazo, y ello ocurre en Perú por normativa del Ministerio de Salud en 2017, que obliga suplementar con hierro desde la semana 14 de gestación, sea o no anémica la gestante.
Los resultados de nuestras investigaciones en Lima y en Ayacucho han demostrado que cuando una mujer es diagnosticada como anemia por hemodilución, el peso del recién nacido es óptimo. En cambio, en los casos de diagnóstico de ADH leve, moderada o grave, el peso del recién nacido es menor que en el grupo de anemia por hemodilución (datos en vías de publicación).
En mujeres jóvenes se ha demostrado que dosis orales de hierro ≥60 mg en DH y ≥100 mg en ADH aumentan los niveles de hepcidina sérica que persiste 24 h después de la administración de la dosis de hierro, pero disminuye a las 48 h de esta. Para maximizar la absorción de hierro se deben administrar dosis orales ≥ 60 mg en días alternos. El aumento circadiano de los niveles de hepcidina sérica es mayor cuando se administra hierro en la mañana 42). En resumen, se sugiere para las mujeres con DH y ADH leve, dosis en las mañanas de 60 a 120 mg de hierro en forma de sal ferrosa administrada juntamente con ácido ascórbico (AA), lejos de comidas o de café, en días alternos.
En un ensayo clínico se ha demostrado que las mujeres con FS < 30 ng/mL al principio del embarazo tienen un riesgo alto de DH/ADH y se les debe recomendar SH. Con el aumento de las reservas de hierro, la necesidad de SH disminuye y las mujeres que tienen FS ≥ 40 ng/mL rara vez desarrollan ADH. Las mujeres con niveles de FS ≥ 50 ng/mL tienen reservas adecuadas de hierro y no necesitan SH 43).
CONCLUSIONES
Para su adecuado control, la anemia gestacional debe ser diagnosticada de forma diferencial entre las principales causas que se presentan, como la anemia por hemodilución, anemia por DH, anemia inflamatoria, entre otras. El hemograma automatizado debe ser utilizado y aplicado como prioridad para la evaluación a nivel nacional, pues apoya al diagnóstico diferencial de la anemia en gestantes. La hemodilución es un proceso natural que ocurre en la gestación y que puede ser identificado mediante la aplicación de cinco parámetros: VCM, HCM, CHCM, RDW-CV y hemoglobina.
La inflamación de grado bajo por la contaminación ambiental puede afectar la disponibilidad de hierro, pudiendo producir anemia con aumento de la reserva de hierro. La obesidad pregestacional puede ocasionar hemoconcentración en la gestación aumentando los niveles de Hb.
La suplementación de hierro es efectiva en casos de ADH y debe ser monitorizada adecuadamente y evitada en casos en que la reserva de hierro es suficiente, como ocurre en las poblaciones residentes en la altura.
Mediante la evidencia científica presentada y que se recopila a nivel mundial se deben de evaluar y rectificar las políticas públicas para el abordaje de la anemia como problema de salud pública. Con ello principalmente hay que considerar que la SH no debe ser la medida principal u obligatoria para el manejo de esta condición.
Las evidencias científicas actuales revelan que tanto la anemia moderada/grave como la eritrocitosis generan problemas en la salud de la gestante y del recién nacido, por lo que se deben establecer los puntos de corte referenciales de Hb para definir anemia y eritrocitosis.











 texto en
texto en 



