Introducción
La hemorragia posparto (HPP) es una emergencia obstétrica que puede seguir al parto vaginal o cesárea. Es una de las principales causas de mortalidad materna con incidencia aproximada entre 5% y 20% de los partos. La definición actual, basada en la cuantificación de la pérdida hemática, tiene limitaciones, por lo que existe gran variabilidad en la frecuencia de diagnóstico1. Puede clasificarse en primaria o secundaria. Los casos considerados como primarios ocurren en las 24 horas siguientes al parto, mientras que las hemorragias posparto secundarias ocurren entre el puerperio mediato y 6 semanas posteriores al parto. Su incidencia es del 1% al 2% en las embarazadas y generalmente está asociada a mayor morbilidad que a mortalidad materna2.
La subinvolución del lecho placentario (SILP) es una causa de HPP secundaria, debida a la regresión inadecuada del trofoblasto endovascular después del parto. Las arterias uteroplacentarias que sufrieron cambios fisiológicos para adaptarse a las necesidades fetoplacentarias no involucionan ni regresan a su estado pregestacional. El cuadro clínico característico es la hemorragia de inicio abrupto, que puede producir colapso hemodinámico fulminante, acompañada del útero aumentado de tamaño y cuya incidencia máxima es durante la segunda semana de puerperio3. El diagnóstico está basado en hallazgos clínicos y evidencia de vasos subinvolucionados en el lecho placentario ante ausencia de restos placentarios4. Se presenta un caso de hemorragia posparto secundaria causada por subinvolución del lecho placentario.
Comunicación Del Caso
Una paciente de 29 años, gesta III, para II, cesárea I, acudió a la emergencia obstétrica por presentar sangrado de moderada intensidad con coágulos, acompañado de mareos, cefalea y náuseas. Refería antecedentes de cesárea por sufrimiento fetal agudo 26 días antes de la aparición de la sintomatología, con evolución postoperatoria satisfactoria. Fue dada de alta al tercer día posparto con hemoglobina de 9,1 g/ dL, parámetros de coagulación dentro de valores normales y suplementación con hierro oral. Negaba antecedentes personales de traumatismos, trombofilias o neoplasias malignas.
Al momento del ingreso estaba afebril, sudorosa y con marcada palidez cutáneo-mucosa. Los parámetros hemodinámicos eran: presión arterial 90/50 mmHg, frecuencia cardiaca 125 latidos por minuto y frecuencia respiratoria 18 respiraciones por minuto. El abdomen estaba blando, depresible y no doloroso. Se apreciaba una incisión abdominal tipo Pfannenstiel con cicatrización correcta, sin evidencia de eritema o secreción purulenta. El útero estaba en el punto medio entre la sínfisis del pubis y la cicatriz umbilical. El examen ginecológico mostró sangrado genital en moderada cantidad, acompañado de coágulos. La especuloscopia mostró que el cuello uterino estaba cerrado sin evidencia de desgarros o laceraciones. No se observaron evidencias de lesiones o desgarros en la región vulvovaginal.
Los resultados de las pruebas de laboratorio fueron hemoglobina de 6,5 g/dL con hematocrito de 21%. Las pruebas de contaje y fórmula leucocitaria, funcionalismo renal y hepático, electrolitos, coagulación, trombofilias, proteína C reactiva, velocidad de sedimentación globular y examen de orina estaban dentro de los límites normales. La prueba de gonadotropina coriónica humana fue negativa. La ecografía transvaginal mostró un útero aumentado de tamaño, con concavidad ocupada en el tercio medio por una imagen ecogénica heterogénea de 4 x 2 centímetros en la cara posterior del istmo uterino, sin signos de retención de tejido placentario o una anomalía visible de la cicatriz uterina. La evaluación Doppler color mostró incremento de la velocidad sistólica pico con onda de baja resistencia en la zona de la concavidad (figura 1).
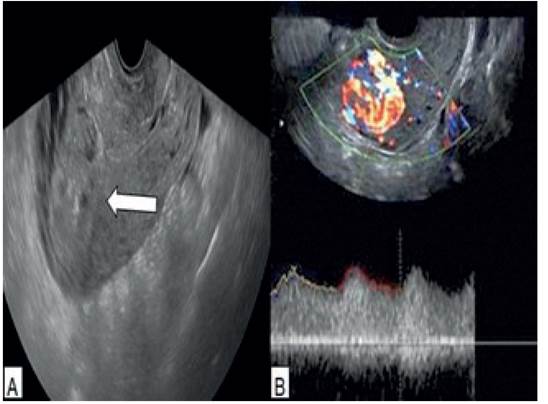
Figura 1 imágenes de ecografía transvaginal. a) tumor a lo largo del tercio interior del miometrio de la cara posterior del útero. b) ecografía doppler que muestra vasos tortuosos hipoecoicos con aumento de la velocidad del pico sistólico y ondas de baja resistencia.
En vista de los hallazgos clínicos y de imágenes, se realizó legrado uterino fraccionado bajo anestesia general, obteniéndose escaso material durante el procedimiento, decidiéndose colocar una sonda intrauterina, uterotónicos (oxitocina endovenosa, metilergometrina intramuscular y misoprostol rectal) y hemoderivados (3 unidades de concentrado globular). Como las condiciones de la paciente no mejoraban, se decidió realizar laparotomía ginecológica.
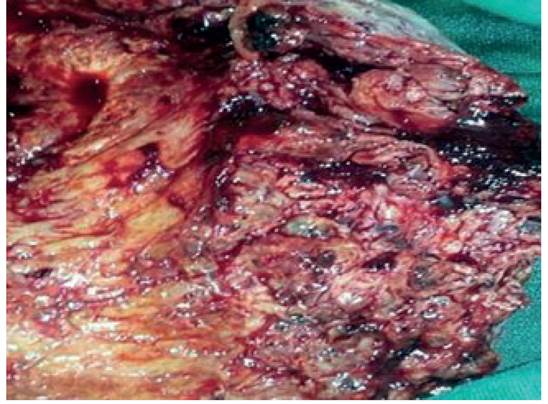
Durante la cirugía, el útero estaba aumentado de tamaño con color pálido. El segmento inferior no mostraba signos de dehiscencia de histerorrafia ni sangrado activo. No se encontró evidencia de colecciones hemáticas ni secreciones intraabdominales. En vista de lo anterior, se decidió realizar histerectomía subtotal con conservación del anexo izquierdo. La recuperación postoperatoria transcurrió sin complicaciones y la paciente fue dada de alta a los 5 días.
El examen anatomopatológico mostró útero de gran tamaño con incisión quirúrgica suturada en la pared anterior baja del útero con coágulo adherido (figura 2). La evaluación microscópica hizo notar áreas endometriales con múltiples vasos dilatados y permeables de paredes gruesas y distorsionadas con depósito de material fibrinoide que reemplazaba la media. Estos vasos mostraban ausencia parcial del revestimiento endotelial con trombos de tamaño variable, parcialmente oclusivos y recanalizados en las regiones subendometrial y miometrial, pero no estaban en el espesor del miometrio. También se encontraron células trofoblásticas dentro y alrededor de las arterias espirales, de aspecto degenerativo, grandes, pálidas y a menudo vacuoladas. Las secciones microscópicas del coágulo adherido contenían decidua necrotizante inflamada. El miometrio circundante tenía vasos normalmente involucionados adyacentes a los vasos subinvolucionados, los cuales presentaban adventicia laxa, capa media eosinofílica brillante, íntima engrosada y revestimiento endotelial identificable, con pequeñas luces vasculares en forma de hendiduras (figura 3). No se observó tejido placentario retenido, signos de acretismo placentario o evidencia de lesiones malignas. Estos hallazgos eran compatibles con el diagnóstico de HPP tardía asociada a SILP.
Discusión
La HPP es una emergencia obstétrica que ocurre independientemente del tipo de parto. Esta puede ocurrir dentro de las 24 horas siguientes al parto (primaria) o en las 24 horas posteriores al parto hasta las 6 semanas del puerperio (secundaria)5). La HPP primaria y secundaria comparten causas, las cuales pueden incluir atonía uterina, retención de restos placentarios, acretismo placentario, infecciones endometriales, trombofilias hereditarias, coagulopatías de consumo y lesiones perineales. Sin embargo, la HPP secundaria ha llamado menos la atención, probablemente debido a su baja frecuencia y que está asociada más a morbilidad que a mortalidad materna1.
El mecanismo de involución del sitio placentario después del parto aún no está claramente definido. Las arterias uteroplacentarias sufren trombosis y reorganización posterior a la contracción del sitio placentario y regeneración endometrial6. En la SILP, las arterias uterinas y la musculatura del lecho placentario no logran involucionar y regresar a su estado pregestacional. Los vasos están dilatados, tortuosos y parcialmente hialinizados, con pérdida del revestimiento endotelial y de la lámina elástica interna. El trofoblasto endovascular no involuciona, dando lugar a dilatación persistente de los vasos, llevando a la aparición del sangrado posparto. Este proceso es de origen idiopático, más que iatrogénico1.
La fisiopatología exacta de la SILP es desconocida. Algunos autores han propuesto la participación de componentes inmunológicos que llevan a la interacción anormal entre los tejidos maternos y el trofoblasto fetal7. No obstante, existe evidencia que muestra que los depósitos de componentes del complemento e inmunoglobulinas son similares entre las embarazadas con SILP y las embarazadas sanas8. Otros estudios han propuesto que la actividad anormal de componentes del complemento o la expresión duradera de genes apoptóticos (como la oncoproteína Bcl-2 que inhibe la apoptosis y aumenta la supervivencia celular) llevan a oclusión luminal parcial y temporal de los vasos uterinos en el miometrio superficial en el sitio de implantación placentaria9.
La mayoría de los casos de SILP son diagnosticados dentro de la segunda semana posterior al parto, pero existen informes de casos hasta dos meses después del parto. Generalmente, el inicio del sangrado genital suele ser abrupto, lo que lleva a las pacientes a buscar atención médica inmediata1. Los principales diagnósticos diferenciales incluyen: enfermedad trofoblástica gestacional, retención de restos placentarios, acretismo placentario y endometritis. Los hallazgos de laboratorio, como concentraciones elevadas de gonadotropina coriónica, marcadores inflamatorios y cultivos sanguíneos/vaginales positivos, junto a la exploración del canal del parto, son esenciales para identificar la causa de la HPP3.
La severidad de la HPP puede estar exacerbada por factores proinflamatorios tisulares locales10. Además, puede verse aumentada por la presencia de infección activa, la cual puede llevar a la aparición de coagulación intravascular diseminada11. Algunos autores han propuesto que esta condición es más frecuente en pacientes sometidas a cesárea, probablemente asociada a cambios mecánicos (alteración de la contracción e involución del miometrio, proliferación fibrótica en la cicatriz), inmunológicos (procesos autoinmunes, reacción al material de sutura, inflamación local, actividad linfomonocítica y de citoquinas) o moleculares (sobreo subexpresión de genes de factores de crecimiento implicados en la cicatrización uterina). Estos genes modifican el reemplazo de decidua por endometrio, disminuyendo los depósitos de colágeno vascular, la agregación plaquetaria y la actividad del factor XIII en la interfaz materno-fetal12.
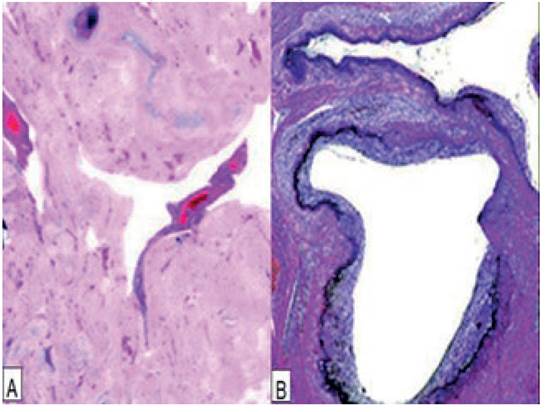
Figura 3 imágenes de examen anatomopatológica. a) arterias dilatadas, tortuosas y parcialmente trombosadas en el sitio de implantación placentaria junto a arterias involucionadas (coloración hematoxilina-eosina, 20x). b) arteria miometrial permeable cuyas paredes presentan degeneración fibrinoide de sus paredes (coloración hematoxilina-eosina, 100x).
El diagnóstico ecográfico de la SILP puede realizarse mediante ecografía Doppler de onda pulsada que muestran vasos tortuosos hipoecoicos con ondas vasculares de baja resistencia a lo largo del tercio interno del miometrio. Sin embargo, estas alteraciones pueden ser difíciles de diferenciar de malformaciones arteriovenosas congénitas o adquiridas. Por otra parte, la retención de restos ovulares puede presentar hallazgos ecográficos similares, por lo que es importante documentar la presencia de tejido placentario ecogénico en la cavidad endometrial3.
La evaluación del lecho placentario mediante el examen del útero completo es la única forma de realizar el diagnóstico de SILP. En esta condición pueden observarse fragmentos hialinizados de arterias uterinas distendidas y permeables con oclusión parcial por trombosis2. A diferencia de los tumores trofoblásticos, en el sitio placentario subinvolucionado la presencia de trofoblasto endovascular es un hallazgo aislado y no muestra una proliferación de células trofoblásticas. Los cambios fibrinoides de la pared vascular y la presencia de células inflamatorias pueden sugerir vasculitis ginecológica o sistémica; pero existen células trofoblásticas que reemplazan al endotelio vascular13.
La incidencia de HPP secundaria causada por SILP es muy baja, por lo que su manejo terapéutico es similar a la HPP primaria4. El principal objetivo es la estabilización hemodinámica inmediata y evitar la aparición de coagulopatías. No obstante, el uso de medidas distintas a la histerectomía sigue siendo controversial, en especial en aquellos casos con sangrado severo14. Entre las opciones de tratamiento conservador están la evacuación quirúrgica de la cavidad uterina, tratamiento con uterotónicos y embolización arterial percutánea selectiva de las arterias uterinas, pero la utilidad de estas medidas no está respaldada por datos suficientes15.
En conclusión, la SILP es una forma rara de HPP secundaria. Su causa es la ausencia de cambios en las arterias uterinas en su estado pregestacional. Su fisiopatología es desconocida y debe ser considerada como diagnóstico diferencial de otras causas de HPP secundaria. Es fundamental identificar rápidamente la severidad del sangrado para evitar el choque hemodinámico y la aparición de coagulopatías. La SILP es un proceso importante de conocer, ya que implica una causa idiopática, y no iatrogénica, de HPP.











 texto en
texto en