INTRODUCCIÓN
Desde el punto de vista agrícola, el ñame (Dioscorea sp.) es el tercer tubérculo de mayor importancia a nivel mundial debido a es un producto clave para la alimentación de las comunidades rurales, además generando fuentes de empleo e ingresos para los pequeños productores. Se cultiva en regiones tropicales y subtropicales de todo el mundo, con una producción mundial estimada de 7 258 millones de toneladas y un rendimiento promedio de 8 351.5 kg ha-1 registrados para el año 2018 (FAOSTAT, 2020). Para Colombia es considerado un producto de alta importancia agrícola, ya que ocupó el segundo lugar en producción en el continente americano con 419 267 toneladas en el año 2018; mientras tanto, en rendimiento ocupó el noveno lugar con 10 459 kg ha-1 (FAOSTAT, 2020). En Colombia este tubérculo se siembra preferencialmente en la región Caribe, en donde se concentra el 95% de producción nacional, principalmente en los departamentos de Córdoba (43%), Sucre (14%) y Bolívar (30%) (MADR, 2015). En la región Caribe, a este cultivo se vinculan alrededor de 20 mil familias, constituyéndose en la fuente principal de ingresos y empleo rural para pequeños y medianos productores, estableciéndose en un producto importante de la agricultura familiar y de la cadena alimentaria (González, 2012; Doncel et al., 2017).
En años recientes, la pudrición seca de los tubérculos se ha registrado como un problema de creciente importancia para los productores y comercializadores del tubérculo en la región Caribe de Colombia. Aunque aún no se han evaluado las pérdidas, algunos agricultores y comercializadores del tubérculo indican que la enfermedad puede ocasionar pérdidas de hasta el 50% de la producción en almacenamiento (Amadioha et al., 2001; Nwankiti y Gwa, 2018). Las principales pérdidas ocurren debido a que los tubérculos, una vez cosechados, se almacenan durante un período de tiempo antes de su comercialización y en este estado se produce la infestación de hongos. Algunos autores sostienen que esta enfermedad puede iniciar en campo, antes de la cosecha, como hongos que atacan las plantas ocasionando ligeras manchas que las debilitan y deterioran (Folgueras et al., 2011). Se ha reportado que los agentes causales pueden penetrar los tubérculos a través de heridas o daños mecánicos que ocurren en campo durante el manejo del cultivo y durante la cosecha (Adeniji et al., 2020).
Los síntomas se manifiestan en los tubérculos en almacenamiento con daños aparentes en el exterior en algunos casos, pero que en la parte interna muestran una pudrición de los tejidos, los cuales se desintegran y vuelven duros y secos, lo que ocasiona la pérdida de su valor comercial (Dania et al., 2019). En algunos trabajos previos se han observado micelios fúngicos con tejidos de color marrón y bordes circulares o irregulares que muestran una tendencia a dañar el tejido sano (Nahunnaro, 2008). Varios complejos fúngicos han sido reportados, entre los que se mencionan Aspergillus, Fusarium, Rhizopus y Penicillium, entre otros, los cuales en la literatura se reportan como agentes asociados a perdidas de productos agrícolas en post-cosecha o almacenamiento (Gwa et al., 2015; Gwa y Ekefan, 2017; Ijato, 2019).
En Colombia no se han realizado estudios relacionados con esta enfermedad y los agentes causales aún son desconocidos. Por lo anterior, el objetivo de esta investigación fue colectar, aislar y caracterizar los hongos asociados a la pudrición seca de los tubérculos de ñame en almacenamiento en la región Caribe colombiana.
MATERIALES Y MÉTODOS
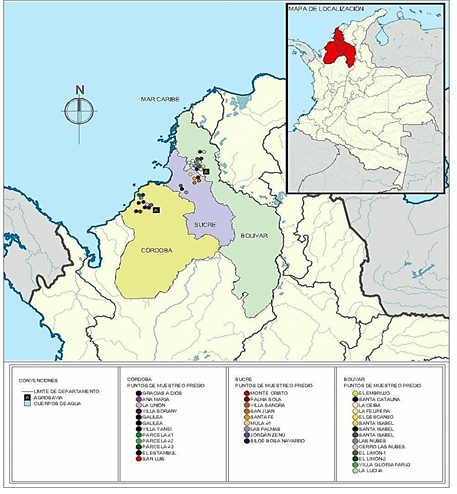
Colecta de tubérculos. A través de fuentes secundarias, se identificaron las principales zonas productoras de ñame en los departamentos de Córdoba, Sucre y Bolívar en la región Caribe de Colombia (Figura 1) y se realizaron visitas a 34 predios de productores en donde se efectuaron colectas de tubérculos del ñame cv. "Espino", que se encontraban en almacenamiento para ser usados como semilla en la siguiente temporada de siembras. Los tubérculos colectados se seleccionaron por presentar síntomas de la afectación, fueron empacados en bolsas de papel kraft y transportados en neveras a una temperatura entre -4 y -8 °C al Laboratorio de Microbiología Agrícola del Centro de Investigación Turipaná de la Corporación Colombiana de Investigación Agropecuaria-Agrosavia, ubicado en el municipio de Cereté, departamento de Córdoba, con coordenadas geográficas: 8º50’79” de latitud Norte y 75º47’58” de longitud Oeste.
Las colectas se realizaron siguiendo los lineamientos de la Resolución No. 1466 del 03 de diciembre de 2014 de la Autoridad Nacional de Licencias Ambientales (ANLA), que regula en Colombia la colecta de especímenes de la diversidad biológica con fines de investigación.
Aislamientos. En laboratorio se realizó una desinfección superficial del tubérculo con hipoclorito de sodio al 2% y enjuague con agua destilada. Luego se tomaron rodajas de 10-12 mm de grosor del tejido afectado de las regiones basal, media y apical del tubérculo, las cuales se enjuagaron con agua y detergente durante cinco minutos, y se dejaron en hipoclorito de sodio al 5% durante dos minutos. Posteriormente, se lavaron durante 30 minutos en agua corriente. De las rodajas se tomaron secciones de 1.0 cm2, las cuales se sumergieron en alcohol al 70% durante un minuto y se enjuagaron con agua destilada estéril. Seguidamente, estas secciones fueron sembradas en medio de cultivo Papa Dextrosa Agar (PDA)® suplementado con amikacina 1.0 mL L-1 para evitar la contaminación por bacterias e incubadas a una temperatura 30 ± 2 °C durante 7 días (Montiel et al., 2016). Para obtener cultivos puros, se realizaron resiembras continuas hasta asegurar la pureza de los aislamientos.
Características macroscópica y microscópica. Los micelios y conidios obtenidos fueron ensamblados en laminas, usando Azul de Lactofenol® para su descripción bajo microscopio binocular (DM500 Leica®, USA). Las descripciones macroscópicas se realizaron teniendo en cuenta la metodología propuesta por Pacasa-Quisbert (2017), en la cual se describieron la coloración, textura, superficie, presencia de exudados y tipo de borde desarrollado por los crecimientos fúngicos (Stchigel, 2000). La caracterización macro y microscópica sirvió de base para la agrupación de los hongos en morfotipos, basado en la similitud de sus características.
Frecuencia de morfotipos. La frecuencia de la distribución de los morfotipos en la zona de estudio se calculó utilizando la siguiente ecuación:
Donde:
ni= número de veces que se presenta un morfotipo.
N=Tamaño total de la muestra.
Caracterización molecular. Para la identificación molecular de los morfotipos se procedió a sembrar los aislados en caldo de papa y dextrosa para obtener micelios, los cuales fueron macerados con nitrógeno líquido para la extracción DNA, siguiendo las instrucciones del fabricante de DNeasy Plant Mini Kit® (QIAGEN Inc., Valencia, CA, USA).
La PCR se realizó amplificando fragmentos de algunos genes como: región ITS1-ITS4, Calmodulina y β-Tubulina-2. La reacción de PCR se efectuó usando el Kit PCR Master Mix (Thermo Scientific®, Lucigen, USA) siguiendo las instrucciones del fabricante y usando los siguientes juegos de primers: ITS-1F (ITS-1F 5′ CTT GGT CAT TTA GAG GAA GTA A 3´), ITS-4 (ITS-4R 5′ TCC TCC GCT TAT TGA TAT GC 3´) (Gardes y Bruns, 1993). El programa de PCR que se utilizó fue el siguiente: desnaturalización inicial 95°C por 3 minutos, 35 ciclos a 95°C por 30 segundos de desnaturalización, 55°C por 30 segundos de alineación, 72°C por 45 minutos de extensión y una extensión final de 72°C por 7 minutos. Para el gen de la Calmodulina se utilizaron los primers (CL1-F5´ GAR TWC AAG GAG GCC TTC TC 3´) y (CL2A-R5´ TTT TTG CAT CAT GAG TTG GAC O 3’) (O’Donnell et al. 2000). El programa de PCR fue el mismo de los ITS, pero la temperatura de alineación se ajustó a 57°C.
Para la β-Tubulina-2 se utilizaron los primers T1 (T1-F 5´ AAC ATG CGT GAG ATT GTA AGT 3´) y T2 (T2-R 5´ TAG TGA CCC TTG GCC CAGT TG 3´) (O’Donnell Cigelnik, 1997) con el siguiente programa de PCR: desnaturalización inicial 94°C por 3 minutos, 10 ciclos a 94°C por 30 segundos de desnaturalización, 46°C por 30 segundos de alineación, 72°C por 1 minuto de extensión; 25 ciclos a 94°C por 30 segundos de desnaturalización, 57°C por 30 segundos de alineación, 72°C por 1 minuto de extensión y una extensión final de 72°C por 10 minutos, utilizado el equipo termociclador MiniAmp Plus (Applied Biosystems™, Singapur, Asia).
La verificación de la calidad de la extracción se realizó corriendo una electroforesis en gel de agarosa al 2% en buffer TAE1X en una cámara de electroforesis horizontal Enduro VE20 (Labnet interntional Inc Taiwán, China). Como revelador se usó EZ-vision® (Amresco Inc., USA) y como marcador molecular Gene ruler de 1kb de (Thermo Fisher Scientific Inc., USA). El gel fue observado en un equipo para análisis y documentación de geles Gel Doc XR (BioRad, USA).
A los productos de la PCR se les realizó un análisis de secuenciación de Sanger en doble sentido en el equipo de electroforesis capilar ABI 3500 (Applied Biosystems®, USA). Las secuencias obtenidas se alinearon con secuencias de referencia de la base de datos GenBank® del National Center for Biotechnology Information (NCBI), mediante la herramienta Basic Local Alignment Search Tool (BLAST).
Con las secuencias obtenidas se realizó un análisis filogenético en el software Mega 10 (Versión 10.0.5., State College, USA). Las secuencias se alinearon mediante el programa MUSCLE (Comparación de secuencias múltiples por Log-Expectation). La construcción del árbol filogenético se infirió al usar el método de máxima verosimilitud (Felsenstein, 1981). Las distancias evolutivas se calcularon utilizando el modelo Kimura de 2 parámetros (Kimura, 1980) para la región ITS.
RESUTADOS
Número de colectas. Se realizaron un total de 48 colectas de tubérculos de ñame cv. "Espino" en un total de 34 predios en los municipios de San Juan Nepomuceno, Carmen de Bolívar, San Jacinto, Ovejas, Los Palmitos, Sincelejo, San Pelayo y Cereté. Los tubérculos colectados se encontraban en almacenamiento de 3 a 4 meses para ser usados como semilla y presentaban algunos síntomas externos de deterioro a causa de la enfermedad (Figura 2). El deterioro fúngico post cosecha de ñame, a diferencia de la mayoría de las infecciones de plantas individuales, está influenciado por la presencia simultánea de varios hongos patógenos. En la parte externa de los tubérculos se presentaron grietas de diferente tamaño, observándose parches con podredumbre y con rompimiento y desprendimiento de la corteza externa o cáscara. En varios casos, las lesiones externas de los tubérculos mostraban desintegración o rompimiento del tejido en pequeñas partículas secas. Internamente, los tubérculos presentaban podredumbre seca en diferentes regiones de los tejidos internos con decoloración negra, café oscuro o rosado con bordes amarillos.
Morfotipos. La similitud en las características macro y microscópica de los aislamientos permitió la conformación de 10 morfotipos de hongos obtenidos de los tubérculos o semillas de ñame afectados por la enfermedad de la pudrición seca. Las características de los 10 morfotipos se muestran en la (Tabla 1). Es de señalar que el morfotipo DH3, presenta dos colonias con características macroscópicas diferentes (referenciadas como DH3 y DH13), pero que microscópicamente son muy similares.
Tabla 1 Descripción macro y microscópica de 10 morfotipos de hongos aislados de tubérculos de ñame afectados por la enfermedad de la pudrición seca en la región Caribe colombiana.
| Morfotipo | Características macroscópicas | Características microscópicas |
|---|---|---|
| DH2 | Colonia de color gris oscuro, textura lanosa, con micelio aéreo y borde regular. | El micelio es septado, las clamidosporas son intercalares y terminales. |
| DH3 | Macroscópicamente este morfotipo presenta dos (2) características: DH3) Colonias de color blanco con centro de color rosa y borde irregular; DH13) Colonia de coloración rosa en el centro con circunferencias de color violeta y blanca, textura lanosa aterciopelada con una superficie elevada en el centro y borde regular. | Hifas septadas, macroconidias de forma curvada con 2 a 3 septos, las cuales se forman sobre conidióforos que pueden o no ser ramificados. Los microconidios presentan forma de media luna, abundantes y unicelulares. |
| DH6 | Colonia de color blanco, textura lanosa. Borde irregular y crecimiento rápido. | Macroconidias con forma de media luna, presentan aseptados o 1 a 2 septos, ligeramente curvados. |
| DH9 | Colonia de color café, textura lanosa y seca. | Hifas septadas de color café con células fragmentadas que van desde un par hasta varias células de color café. |
| DH11 | Colonia de color grisáceo con esclerocios en el centro de la colonia, textura lanosa con una superficie plana y un borde irregular. | Hifas septadas de color café. Conidióforos con dos a cuatro conidios periformes de color pardo con tres septos transversales. |
| DH16 | Colonia de color negro con anillos de color blanco, textura aterciopelada en el centro y granulosa en el borde, el cual es regular. | Conidióforos simples con cabeza conidial cilíndrica, que sostiene conidios hialinos sub- esféricos y suspendidos en hileras. |
| DH17 | Colonia de color blanco, centro rosa, textura lanosa aterciopelada, superficie elevada en el centro y borde regular. | Hifas con clamidosporas terminales. |
| DH18 | Colonia de color gris, con superficie elevada aterciopelada y borde regular. | Hifas septadas agrupadas. No se observan estructuras reproductivas. |
| DH20 | Colonia de color verde oscuro, textura granulosa, superficie plana y borde regular. | Conidióforo hialino cilíndrico con conidios ovalados, agrupados y de color café. |
| DH22 | Colonia de color verde oliva en el centro con borde blanco y forma irregular. | Conidióforos simples que poseen métulas y fiálides que sostienen conidios hialinos, sub- cilíndricos, agrupados en hileras. |
Fuente: elaboración propia.
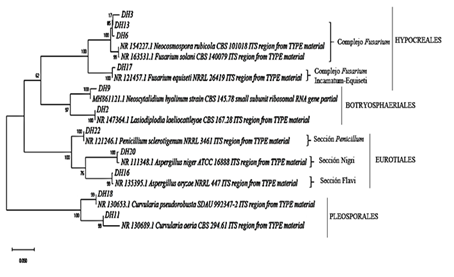
Caracterización molecular. Se realizó la amplificación del ADN de los 10 morfotipos de hongos para la región ITS y, como resultado de la secuenciación de Sanger, se obtuvieron secuencias en sentido Forward y Reverse de los productos PCR de la región ITS. Las secuencias fueron editadas y se obtuvo la secuencia consenso, la cual fue alineada con secuencias del Genbank® para determinar su identidad. Se identificaron 10 especies de hongos que presentaron la mayor similaridad y cobertura con las secuencias de la región ITS, de los morfotipos asociados a la pudrición seca de los tubérculos de ñame (Tabla 2).
Tabla 2 Similaridad y cobertura de los morfotipos asociados a la pudrición seca de los tubérculos de ñame espino con especies de hongos. Fuente: elaboración propia.
| Identificación | Género y Especies | Cobertura | Similaridad | Refseq |
|---|---|---|---|---|
| DH2 | Lasiodiplodia theobromae | 92% | 99,81% | NR_147364.1 |
| DH3 | Fusarium solani DH3 Fusarium solani DH13 | 96% 97% | 97,77% 97,78% | NR_163531.1 NR_163531.1 |
| DH6 | Neocosmospora rubicola | 96% | 97,57% | NR_154227.1 |
| DH9 | Neoscytalidium hyalinum | 100% | 98,50% | MH861121.1 |
| DH11 | Curvularia aeria | 89% | 100,00% | NR_130689.1 |
| DH16 | Aspergillus oryzae | 90% | 99,47% | NR_135395.1 |
| DH17 | Fusarium equiseti | 95% | 99,45% | NR_121457.1 |
| DH18 | Curvularia pseudorobusta | 91% | 100,00% | NR_130653.1 |
| DH20 | Aspergillus niger | 91% | 99,65% | NR_111348.1 |
| DH22 | Penicillium sclerotigenum | 90% | 100,00% | NR_121246.1 |
Fuente: elaboración propia.
A partir de lo anterior se obtuvo un árbol filogenético en donde se pudo observar la conformación de cuatro grupos definidos, así: Hypocreales, Botryosphaeriales, Eurotiales y Pleosporales (Figura 3). El grupo de los Hypocreales está conformado por los morfotipos DH3, DH6 y DH17, el cual se encuentra con una representación del 50,0% de las muestras colectadas. Este grupo se le conoce comúnmente como complejo Fusarium al cual se asocian las especies Fusarium solani, Neocosmospora rubicola y Fusarium equiseti. Las especies Fusarium incamatum-equiseti (FIESC), ha sido previamente descrita por Santos et al. (2019), mientras que le especie Fusarium Solani (FSSC) aparece descrita por Sandoval-Denis et al. (2019).
La representación del grupo de Botryosphaeriales se encuentra con un 5,36% de las muestras colectadas, en donde se asocian los morfotipos DH2 (Lasiodiplodia theobromae) y DH9 (Neoscytalidium hyalinum). Estas especies fueron descritas por Cardoso et al. (2018) y Girona et al. (2019).
En el grupo de los Eurotiales se presentó una representación del 10,71% de los individuos aislados, en donde los morfotipos asociados al género Aspergillus se encuentran distribuidos en tres secciones: el morfotipo DH20 se relaciona con especies pertenecientes a la Sección Nigri (Samson et al., 2014). El morfotipo DH16 se relaciona dentro de la sección Flavi (Frisvad et al., 2019). El morfotipo DH22 se ubicó en la sección Penicillum (Houbraken et al., 2016). Finalmente, dentro de los Pleosporales se ubican los los morfotipos DH11 (Curvularia aeria) y DH18 (Curvularia pseudorobusta) (Li, et al., 2017) y se encuentran con una representatividad del 33,93% de las muestras colectadas.
Complementario a la región ITS, los genes que codifican proteínas se utilizan como marcadores moleculares por la presencia de regiones intrónicas que, generalmente, evolucionan más rápido en comparación con ITS (Raja et al., 2017). Los marcadores de codificación de proteínas β-tubulina 2 (Hibbett et al., 2007) y Calmodulina (Ca) (Samson et al., 2014) se han usado más comúnmente para inferir relaciones filogenéticas entre los hongos (Raja et al., 2017). En esta investigación se utilizaron los marcadores Calmodulina y β-tubulina 2 para complementar la caracterización molecular de los hongos asociados a la pudrición seca de tubérculos de ñame.
Para el gen de la Calmodulina se obtuvo la amplificación en dos morfotipos de hongos que presentaron bandas superiores a los 750 pb. Para el gen β-tubulina-2 se amplificaron seis morfotipos que presentaron bandas entre los 500 y 700 pb. Para cada morfotipo se obtuvieron secuencias en sentido Forward y Reverse de los productos PCR del gen Calmodulina y β-tubulina 2. Las secuencias fueron editadas y se obtuvo la secuencia consenso la cual fue alineada con secuencias del Genbank® para determinar su identidad. En las Tablas 3 se describen las secuencias con mayor similaridad y cobertura del Genbank® relacionadas con las cepas de hongos asociados a pudrición seca de tubérculos de ñame. Como se observa, de todas las cepas caracterizadas con la región ITS, fue posible amplificar el gen de la Calmodulina para dos de los morfotipos de hongos; mientras que para el gen β-tubulina 2, un total de seis morfotipos de hongos fueron posibles. No fue posible amplificar con estos marcadores los morfotipos DH2, DH11 y DH18.
Tabla 3 Porcentaje de Similaridad y cobertura de las secuencias de los morfotipos de hongos asociados a la pudrición seca de tubérculos de ñame en la región Caribe de Colombia. Similaridad y cobertura con los disponibles en la base de datos NCBI a partir del gen Calmodulina y β-tubulina 2.
| Gen Calmodulina | ||||
|---|---|---|---|---|
| Identificación | Género Especies | Cobertura | Similaridad | Refseq |
| DH16 | Aspergillus oryzae | 100% | 97,94% | MG826016.1 |
| DH20 | Aspergillus niger | 98% | 99,18% | LC425338.1 |
| Gen β-tubulina 2 | ||||
| Identificación | Especies | Cobertura | Similaridad | Refseq |
| DH3 | Fusarium solani | 98% | 98,32% | MF662660.1 |
| DH6 | Neocosmospora rubicola | 98% | 99,25% | KM232061.1 |
| DH9 | Neoscytalidium dimidiatum | 98% | 98,91% | KF720786.1 |
| DH13 | Fusarium solani | 97% | 98,70% | MF662660.1 |
| DH17 | Fusarium equiseti | 92% | 99,47% | KU938967.1 |
| DH22 | Penicillium sclerotigenum | 69% | 98,93% | AY674393.1 |
Fuente: elaboración propia.
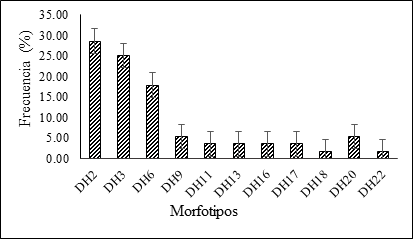
Frecuencia. La frecuencia permitió determinar los morfotipos con mayor representatividad en las muestras colectadas con afectaciones de pudrición seca en las zonas productoras de ñame en la región Caribe de Colombia. Se evidencia en la Figura 4 que los morfotipos DH2, correspondiente a la especie Lasiodiplodia theobromae y DH3, a Fusarium solani, presentaron los mayores valores de frecuencia, indicando que son los hongos que con mayor frecuencia se presentan asociados a la pudrición seca de los tubérculos de ñame espino en la región Caribe en Colombia. Estos resultados indican que probablemente estos dos hongos son los principales agentes causales de la enfermedad en esta región. En menor proporción se presenta el morfotipo DH6, correspondiente a la especie Neocosmospora rubicola, tambien considerado como posible agente causal primario de esta enfermedad. Los restantes morfotipos de hongos se encuentran en frecuencias mucho menores que los anteriores, por lo cual no se consideran aquí como principales agentes causales.
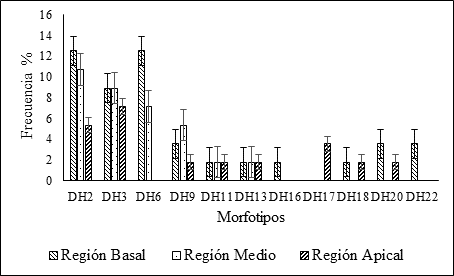
Se presenta alguna controversia en cuanto al sitio del tubérculo con la mayor probabilidad de infección por los patógenos, por lo que se realizó una determinación de la frecuencia de la presencia de los morfotipos en las secciones basal, media y apical de los tubérculos. Los resultados se muestran en la Figura 5, donde se observa que la región basal del tubérculo de ñame, correspondiente al sitio de union con la planta madre, es la sección donde se presentó la mayor incidencia de los patógenos aislados. En esta sección se presentan con mayor frecuencia los morfotipos DH2 (Lasiodiplodia theobromae), DH6 (Neocosmospora rubicola), con 12,50%, en ambos casos y DH3 (Fusarium solani) con un 8,93%. En la sección media y apical por su parte, los morfotipos DH2 (Lasiodiplodia theobromae) y DH3 (Fusarium solani), presentaron las mayores frecuencias con un comportamiento similar en ambas secciones. Los anteriores resultados parecen indicar que el probable sitio de infección de los hongos patógenos asociados a la pudrición seca es la seccion basal de los tuberculos de ñame lo cual corresponde al sitio de union con la planta madre. Lo anterior parece corroborar lo indicado por algunos autores que sostienen que esta enfermedad podría iniciarse en campo, antes de la cosecha, como hongos que atacan las plantas (Folgueras et al., 2011).
DISCUSIÓN
De las colectas de tubérculos en almacenamiento, realizadas en los departamentos de Córdoba, Sucre y Bolívar se obtuvieron un total 56 crecimientos fungicos, de los cuales se pudieron identificar un total de 10 morfotipos. A través de la amplificación de la región ITS del DNA ribosomal, complementado con los genes Calmodulina y β-tubulina 2 se pudieron identificar un total de 10 especies de hongos asociadas a la pudrición seca de los tuberculos. Estas especies fueron Lasiodiplodia theobromae, Fusarium solani, Neocosmospora rubicola, Neoscytalidium hyalinum, Curvularia aeria, Aspergillus oryzae, Fusarium equiseti, Curvularia pseudorobusta, Aspergillus niger y Penicillium sclerotigenum. De las anteriores especies, las que se presentaron con mayor frecuencia en las colectas realizadas fueron L. theobromae, F. solani y N. rubicola, constituyendose como los principales agentes causales de la pudrición seca del tubérculo del ñame en la región Caribe de Colombia.
Lasiodiplodia theobromae se presentó con una frecuencia 28,57%, encontrándose en los municipios de Sincelejo, San Juan Nepomuceno, San Jacinto, Los Palmitos y Carmen de Bolívar. Según se ha reportado en la literatura, este es un hongo de alta importancia patogénica debido a que tiene la capacidad para secretar la enzima poligalacturonasa que digiere o descompone los componentes de la pared celular de los tejidos infectados (Turner y Ogundana, 1983). Esta especie se encuentra reportada como un patógeno de alta importancia, pues causa enfermedades en una gran diversidad de plantas y presenta una amplia distribución mundial, especialmente prevalente en las regiones tropicales y subtropicales, con una alta capacidad de virulencia (Dania et al., 2019; Chukunda y Onyeizu, 2019). Se indica que este hongo sobrevive de una temporada de cultivo a la siguiente en el suelo y los tejidos de plantas hospederas, lo cual ocasiona la reinfección de cultivos sembrados en terrenos con registros previos de la enfermedad. Lo anterior es corroborado por estudios de Markson et al. (2017), quienes indican que este hongo puede sobrevivir en el tejido infectado hasta por más de ocho meses. En Colombia, se reportó en tubérculos de ñame por Arrieta et al. (2020) quienes clasifican a L. theobromae dentro de las seis especies asociadas con la enfermedad seca de los tubérculos del ñame en la zona costanera del departamento de Córdoba. Por otro lado, nuestros resultados indican que, aunque el hongo L. theobromae se encuentra en todas las secciones del tubérculo, su presencia es más frecuente en la parte basal, lo cual corrobora lo expuesto por Folgueras et al. (2011), quienes sostienen que esta enfermedad puede iniciar en campo, antes de la cosecha, como hongos que atacan las plantas madre, con posterior infección de los tubérculos. Asimismo, Otusanya (2018) informa que la porción basal comúnmente denominada como “cabeza” de los tubérculos de ñame, especialmente en el ñame guinea blanco (D. rotundata), son más "resistentes" a enfermedades que las regiones media o apical y se prefieren naturalmente como material de siembra, ya que brotan fácilmente en un corto tiempo en almacenamiento y tienen menos probabilidades de pudrirse después de plantar en el campo.
El hongo Fusarium solani presentó en estos estudios dos morfologías macroscópicas con porcentajes de aparición de un 25,0% en el morfotipo DH3 y del 3,57% en el morfotipo DH13, presentándose, principalmente, en los municipios de San Juan Nepomuceno, San Jacinto, Ovejas, Los Palmitos y Cereté. Este hongo se encuentra reportado con alta frecuencia de diseminación en campo, presentándose en los cultivos de ñame y por ende en los tubérculos (Montiel et al., 2016). Asimismo, en estudios realizados por Gwa y Richard (2018), se indica que F. solani se encuentra incluido entre uno de los hongos que causa con más prevalencia en la pudrición de la región basal y apical del tubérculo de ñame. Por otra parte, al realizar las pruebas de patogenicidad en tubérculos de ñame, este hongo ha demostrado ser extremadamente virulento, causando pudrición tanto en la región basal como apical del tubérculo. De igual forma, Adeniji et al. (2020) informa que F. solani se encuentra dentro del grupo de hongos que causan podredumbre a los tubérculos, dificultando la posibilidad de exportación y amenazando la seguridad alimentaria. En otras especies de ñame comestible como Dioscorea esculenta, Prasannath y Karunakaran (2018) reportan a F. solani como agente causal de la pudrición seca de tubérculos de ñame, con características macroscópicas y microscópicas similares a los aislados DH3 y DH13 del presente estudio.
El tercer hongo en importancia en estos estudios fue Neocosmospora rubicola, el cual presentó un porcentaje de frecuencia del 17,86%, presente en los tubértulos colectados en los municipios de Ovejas, San jacinto, Los Palmitos, San Pelayo y Cereté. Dicho hongo se encuentra reportado por Riaz et al. (2018) causando pudrición del tallo de la papa, siendo una amenaza emergente en las regiones productoras Pakistán. De la misma manera, Sepehrnoos et al. (2018) informan que, con base en los caracteres morfológicos y los datos de la secuencia de DNA, se pudo confirmar a N. rubicola como agente causal de la pudrición o chancro en plantas de papa. Este hongo se ha encontrado ampliamente distribuido ocasionando daños de diversos grupos de plantas en regiones tropicales y subtropicales del mundo (Sandoval-Denis et al., 2018).
Otros hongos, encontrados con menor frecuencia en las colectas realizadas en la región Caribe fueron Neoscytalidium hyalinum, Curvularia aeria, Aspergillus oryzae, Fusarium equiseti, Curvularia pseudorobusta, Aspergillus niger y Penicillium sclerotigenum, los cuales se consideran agentes causales de orden secundarios en estos estudios.
El hongo N. hyalinum posee características morfologícas que, según estos estudios, coinciden con las descritas por Nouri et al. (2018) para Neoscytalidium dimidiatum, obtenido de diversos chancros, frutas infectadas y brotes. Asimismo, Al Raish et al. (2020) informan que en estudios realizados en árboles de Delonix regia afectados con la enfermedad de chancro del tallo, se aislaron N. dimidiatum DSM 109897 de tejidos enfermos. En nuestro estudio, el porcentaje frecuencia de este hongo fue del 5,36%, presente en los municipios de Cereté, Los palmitos y San Juan Nepomuceno. Por otra parte, Lin et al. (2017) reportan la presencia del hongo N. dimidiatum en cultivos de D. esculenta Lour. afectando también hojas y tallos, con manchas marrones oscuras que ocasionan la marchitez de las partes superiores de la planta.
El hongo Aspergillus niger en nuestro estudio presentó un porcentaje de frecuencia del 5,36%, registrándose en los municipios de Carmen de Bolívar, Los palmitos y Sincelejo. Con respecto a este hongo, Gwa y Richard (2018) han reportado aislamientos en tubérculos de ñame afectados por pudrición del tubérculo; Por su parte, Patrice et al. (2017) reportan a A. niger como uno de los hongos más severos, causante de la pudrición en almacenamiento, ocasionando pérdidas entre 25-60%. Samuel et al. (2018) también coinciden que los hongos de este género causan pérdidas económicas y reducción de la vida útil en almacenamiento, en raíces y tubérculos.
Investigaciones realizadas por Otusanya et al. (2016) asocian la alta incidencia y severidad de los hongos A. niger y L. theobromae con la nutrición del cultivo, en especial con las deficiencias de calcio. Al respecto indican que las aplicaciones de carbonato de calcio mejoraron la resistencia contra estas enfermedades y redujeron la pérdida de peso en los tubérculos.
Los hongos Curvularia aeria, Aspergillus oryzae y Fusarium equiseti presentaron un porcentaje de frecuencia de un 3,57% en las muestras colectadas. Nayab y Akhtar (2016) reportan a C. aeria como causante de enfermedades de manchas foliares en tomate. Mientras tanto, Aspergillus oryzae es reportado por Frank y Kingsley (2014) quienes en sus investigaciones reportan pérdidas de tubérculos en almacenamiento por pudredunbre fúngica, e indican que este hongo produce metabolitos secundarios como ácido kójico y ácido ciclopiazónico, que causa deterioro en los tubérculos (Abarca et al., 2000). Por otra parte, Ezrari et al. (2020) informan la presencia del hongo F. equiseti en muestras de calabacín (Cucurbita pepo L.), mostrando podredumbre típica de este hongo e identificadolo con la amplificación de la región ITS del ribosoma del DNA ribosomal y usando cebadores ITS1 / ITS4.
Por su parte, los hongos Curvularia pseudorobusta y Penicillium sclerotigenum presentaron una frecuencia baja (1,79%) en la región basal del tubérculo, su incidencia se registró en los municipios de Carmen de Bolívar y Sincelejo, respectivamente. En estudios adelantados por Sowley et al. (2019) se describe el aislamiento de P. sclerotigenum en tubérculos de D. rotundata con signos de pudrición. En revisiones de literatura por Frisvad et al. (2018) reporta que P. sclerotigenum se encuentra relacionado como una de las especies productoras de patulina, la cual es una micotoxina que afecta diversos productos alimenticios como a las frutas, legumbres y cereales (Zhu et al., 2016; Coton et al., 2020; Sajid et al., 2020). Este hongo presenta metabolitos secundarios no volátil, la patulina que produce toxicidad aguda y crónica, principalmente genotoxicidad e inmunotoxicidad, así como citotoxicidad en humanos (Zhou et al., 2018).
CONCLUSIONES
La enfermedad conocida en Colombia como pudrición seca de los tubérculos de ñame está asociada a una variedad de hongos, los cuales pueden ser agrupados en 10 morfotipos con identidad de los estudios morfológicos y filogenéticos a las siguientes especies: Lasiodiplodia theobromae, Fusarium solani, Neocosmospora rubicola, Neoscytalidium hyalinum, Curvularia aeria, Aspergillus oryzae, Fusarium equiseti, Curvularia pseudorobusta, Aspergillus niger y Penicillium sclerotigenum. De acuerdo con la caracterización realizada se puede definir que las especies L. theobromae, F. solani y N. rubicola, asociadas a los morfotipos DH2, DH3 y DH6, se constituyen como los principales agentes causales de la enfermedad de la pudrición seca de tubérculos de ñame espino en almacenamiento en la región Caribe de Colombia, dado que se presentan con mayor frecuencia en las muestras colectadas.
Los anteriores resultados de investigación dan una base para continuar con las pruebas de patogenicidad para, posteriormente, estudiar recomendaciones de manejo que constribuyan a disminuir su incidencia en los tubérculos en almacenamiento.












 uBio
uBio