Introducción
En la actualidad, según datos proporcionados por el Instituto de Conservación Forestal (ICF), la región de Puno, junto con otras como Apurímac, Ayacucho, Cusco y Huancavelica, cuenta con extensas áreas de plantaciones de eucalipto, queñuas y otros tipos de árboles que cubren aproximadamente 4,030 hectáreas. Sin embargo, es importante destacar que, a pesar de esta abundancia de recursos forestales, el eucalipto suele ser transformado principalmente en madera o leña, mientras que sus hojas se desaprovechan y a menudo son incineradas. Paralelamente, la región de Puno es rica en plantas medicinales, como la muña, que, lamentablemente, también se desaprovechan, a pesar de su potencial para satisfacer necesidades alimentarias y contribuir a la seguridad alimentaria (Vira et al., 2015).
En cuanto a la cadena alimentaria, enfrentamos una problemática significativa relacionada con el almacenamiento, manejo inadecuado y transporte de alimentos, lo que resulta en pérdidas considerables que afectan tanto la cantidad como la calidad de los alimentos. Esta situación puede tener consecuencias graves para la salud pública, ya que los alimentos contaminados pueden dar lugar a enfermedades transmitidas por alimentos (ETAs), como intoxicaciones alimentarias e incluso casos fatales. De acuerdo con la Organización de Naciones Unidas (ONU), a nivel nacional se registran pérdidas de alimentos contaminados que equivalen a toneladas por año. Esta problemática se debe en gran medida a la presencia de cepas microbianas como Staphylococcus aureus, coliformes fecales, Escherichia coli, salmonella, shigella, yersinia y otros patógenos que se encuentran de manera natural en el entorno y que se identifican como los principales agentes etiológicos responsables de las ETAs (Vega et al., 2017; Alzamora et al., 2001; Pitarch, 2000).
Para abordar esta situación y garantizar la seguridad alimentaria, es necesario implementar medidas efectivas de control microbiológico. Entre las posibles soluciones se encuentran los aceites esenciales, que son sustancias volátiles con propiedades antimicrobianas. Estos aceites esenciales contienen una variedad de componentes bioactivos, como terpenos oxigenados, alcoholes, fenoles, sesquiterpenos, óxidos terpénicos, flavonoides, resinas y compuestos como la pulegona, mentona, linalol, cariofileno, limoneno e isopoligón, que les confieren su capacidad para proteger, inactivar y conservar los alimentos (Luna et al., 2009).
En un contexto más amplio, se puede hacer referencia al relato bíblico en el libro de Génesis (Génesis 1:29-30), donde se menciona que al principio de la creación, en los jardines habitados por Adán y Eva, se encontraba un aroma amargo y místico que estaba relacionado con la presencia de aceites esenciales.
El objetivo central de este estudio de investigación es evaluar el efecto antimicrobiano de dos especies de aceites esenciales obtenidos mediante el método de arrastre de vapor. Además, se busca establecer el efecto inhibitorio de estos aceites esenciales en diferentes diluciones, que van desde el 25% hasta el 75%, sobre dos tipos de microorganismos específicos: Staphylococcus aureus y coliformes fecales.
Materiales y métodos
Lugar de ejecución
Se realizó en el Centro de Investigación de Tecnología de Alimentos (CITAL) de la Universidad Peruana Unión, por otro lado, la extracción del aceite esencial de Muña, Eucalipto se llevó en las instalaciones de Ingeniería Química (UNAP).
Materia prima
Las materias primas que se utilizaron para la extracción del aceite fueron: Muña variedad Satureja montana ajedrea, a inicios de florecimiento de color blanco y Eucalipto variedad Gunni estas muestras fueron recolectadas a las 14 horas en la Comunidad Huaquina a 2 km de la Provincia de Chucuito Juli, departamento de Puno.
Cepas microbianas
Las cepas microbianas como: coliformes fecales y Staphylococcus aureus son ampliamente difundidos en la naturaleza para tal efecto, estas cepas como: coliformes fecales se obtuvieron en el laboratorio de microbiología de la Carrera Profesional de Ingeniería Ambiental y Staphylococcus aureus fue obtenido en el Hospital “Carlos Monje Medrano” en el laboratorio clínico del Área de microbiología, luego se realizó el aislamiento para las pruebas bioquímicas para posterior ser aplicadas en la inhibición de los aceites esenciales.
Materiales e instrumentos de laboratorio
Materiales de laboratorio en uso fue: Tubos de ensayo, Vasos precipitado 100, 250 ml (Pyrex), Matraz de 250 y 500 ml (Pyrex), Placas Petri (Pyrex), Probetas de 100, 250ml (Pyrex), Pipetas 1,5 y 10 ml (Pyrex), Micropipeteador, Micro pipetas (12 Unidades), Espátula, canaletas, Papel filtro, Algodón, gasa y pabilo, Asas de siembra y asa de drigalski, Mechero bunsen, Pinzas metálicas, Gradillas, Discos de papel filtro, Papel craft. Equipos usados: Extractor arrastre de vapor (Inducontrol), Balanza analítica de 0.001 (PIONEER), Autoclave (Jisico-JNA45:13.6), Estufa eléctrica (Samsung-9030B), Incubadora (Binder-Serie 03-43903), Cocina eléctrica. Reactivos: Etanol 96°, Agua destilada finalmente los medios utilizados es: Agar Mueller Hinton: Difco, Agar baird Parker: Difco, Peptona, Agar hierro triple azúcar, Agar hierro lisina, Caldo urea, Agar citrato de Simmons.
Flujograma de extracción de aceite esencial por arrastre de vapor
En la figura 1 se presenta el flujograma para extracción de aceite esencial de eucalipto (Eucalyptus globulus labill) y muña (Minthostachys mollis), en donde se utilizó el extractor por arrastre de vapor de capacidad de 5kg.
Descripción del flujograma
Selección: Se eligieron hojas verdes y tiernas de eucalipto de variedades Gunni y también se seleccionó hojas y tallos triturados aprox. 3 a 5cm de largo de muña variedad satureja montana ajedrea. Pesado: Se realizó el peso de las hojas de eucalipto y muña en hojas y tallos verde en una cantidad de 5 kg cada muestra, en una balanza de precisión. Extracción: Se procedió a introducir en el extractor una cantidad de 5 kg de cada muestra (muña, eucalipto) durante 3 horas a una temperatura inicial de 17°C y la temperatura final de 187°C. Separación: Se utilizó la pera de decantación de 500 ml, en donde se envaso en unos recipientes oscuros de 10 ml, por tanto, gracias a la presencia de la densidad del aceite que se logra la separación inmediata.
Determinación del rendimiento del aceite esencial
Para la determinación del rendimiento del aceite esencial de Eucalipto y Muña se procedió a utilizar la siguiente formula:
Dónde: M2 = masa del aceite en kg, M1 = masa de la muestra kg, 100 = Factor matemático
Análisis fisicoquímico del aceite esencial
En análisis fisicoquímico del aceite de Muña y Eucalipto se realizó mediante la metodología presentada en la tabla 1.
Tabla 1 Métodos aplicados para la determinación del análisis fisicoquímico del aceite extraído
| ANÁLISIS | MÉTODO |
|---|---|
| Determinación índice de Peróxido | Método Volumétrico |
| Determinación índice de Acidez | Método Convencional |
| Determinación índice de Iodo | Método de Wijs |
| Determinación índice de Refracción | Método Pfund |
| Determinación de Densidad | Método Picnómetro (Norma: INV E-222 e INV E-223) |
Determinación de la capacidad mínima inhibitoria
Para la determinación de la capacidad Mínima Inhibitoria de los microorganismos en estudio se aplicó el procedimiento que consiste en:
Procedimiento
Se obtuvieron las cepas de coliformes fecales en el laboratorio de microbiología de la carrera profesional de Ingeniería Ambiental de la Universidad Peruana Unión. Estas cepas se cultivaron en Caldo de Bilis Verde Brillante y se incubaron a 37°C durante 24 horas. Asimismo, las cepas de Staphylococcus aureus se obtuvieron en el hospital "Carlos Monje Medrano", específicamente en el área de Laboratorio Clínico de Microbiología.
Para la preparación del caldo Peptonado con cloruro de sodio, se tomaron 20 ml en un matraz de 50 ml, los cuales se esterilizaron a 120°C durante 15 minutos. Luego, utilizando una asa bacteriológica, se transfirió una porción de las cepas obtenidas en placas de agar Mueller Hinton y se incubaron a 37°C durante 24 horas. Además, se calentó el medio de agar Mueller Hinton en una cocinilla durante 1 minuto y se sometió a autoclave junto con los materiales necesarios, como placas Petri, tubos de ensayo, pinzas, hisopos y discos de sensibilidad, a 120°C durante 30 minutos. El agar Mueller Hinton se vertió en placas Petri estériles en cantidades aproximadas de 25 ml por placa, permitiendo que el medio se solidificara durante 5 minutos en un entorno estéril.
Tras este periodo, se aplicaron las muestras de coliformes, previamente preparadas en caldo de Bilis Verde Brillante, en 18 placas utilizando hisopos. Para Staphylococcus aureus, se realizó una estría en 18 placas Petri utilizando caldo Peptonado. Luego, se colocaron discos de sensibilidad en las placas Petri en cuatro ubicaciones, asegurando que estuvieran a una distancia no menor de 15 mm y a 1.5 cm del borde de la placa, utilizando una pinza estéril. Se llevaron a cabo diversas diluciones de aceite esencial de muña y eucalipto con alcohol al 25%, 50% y 75%. Estas diluciones se distribuyeron en placas Petri para su aplicación con diferentes concentraciones en los discos, utilizando un micropipeteador con 1 micro litro de la dilución correspondiente. Todos los detalles de las muestras se registraron en las placas Petri que contenían los coliformes fecales y Staphylococcus aureus, así como las diferentes concentraciones de aceite esencial (25%, 50%, 75%). Las 36 placas Petri se colocaron en una incubadora a 37°C durante 24 horas. Finalmente, se midieron los halos de crecimiento utilizando un pie de rey, que proporciona resultados en milímetros. Estos datos se registraron para su posterior comparación entre las diferentes concentraciones en los resultados obtenidos.
Análisis estadístico de diseño de bloques completamente al azar (DBCA)
En el siguiente trabajo se aplicó el diseño de bloques completamente al azar, en donde se presenta, 2 bloques como: coliformes fecales, Staphylococcus aureus y los tratamientos son: aceites esenciales de eucalipto y muña en diluciones 25, 50 y 75%, en un nivel de confianza de 95% y 0.05% de significancia.
Resultados
Rendimiento en la extracción de aceite
La tabla 3, muestra el rendimiento de los aceites de muña y eucalipto en donde se utilizó 5kg de Muña y se obtuvo 50 ml de aceite, 5kg de eucalipto y se obtuvo 52 ml de aceite, por tanto, las hojas de eucalipto presencio mayor rendimiento.
Determinación de análisis fisicoquímico de aceite esencial
Se realizó la caracterización fisicoquímica de los aceites esenciales de Muña y Eucalipto como se aprecia en la tabla 4.
Tabla 4 Resultados de la caracterización Fisicoquímica del aceite esencial de muña y eucalipto
| Muestra de aceite | Índice de peróxido Meq/Kg | Índice de Iodo (IV) | Índice de Acidez | Índice de Refracción | Densidad Kg/L |
| Muña | 0.75 | 6.87 | 1.78 | 1.486 | 0.898 |
| Eucalipto | 0.68 | 8.08 | 1.82 | 1.495 | 0.845 |
| Valores referenciales | |||||
| Muña | 0.69 - 0.78 | 6.5-7.02( | 1.35-1.79 | 1.485-1.55 | 0.85-0.98* |
| Eucalipto | 0.65 - 0.70 | 8-9 | 1.52-1.90 | ||
*NTP 319087
Identificación bioquímica
En la Tabla 5 se presenta las pruebas bioquímicas, para coliformes fecales y Staphylococcus aureus; en donde cada cepa bacteriana dio positivo para los análisis realizados mostrando así que ambos pueden degradar el azúcar (TSI), (LIA).
Determinación de la capacidad mínima inhibidora del aceite esencial extraído
Coliformes Fecales
La Figura 2, muestra el diámetro de los halos de inhibición del crecimiento en coliformes fecales, el crecimiento de los halos generados en diámetro que se reportó con aceite de muña en 25% un valor de 9.7950 mm; en 50%, 10.7467 mm; y 75% con 13.2700 mm; respecto al aceite de eucalipto en 25% un valor de 12.0983 mm; en 50% con 13.2900mm; y 75% con 14.5875mm, asimismo en ambos casos con tendencia a subir.
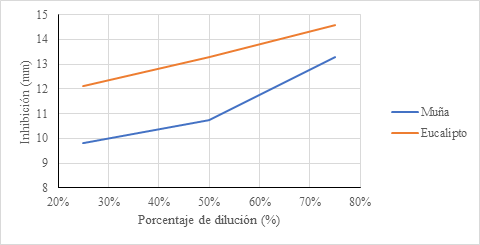
Figura 2 Halos de Inhibición en aceite de Muña y eucalipto en diluciones de 25, 50 y 75% frente a Coliformes fecales
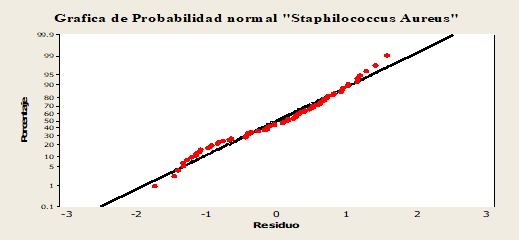
En la figura 3 se aprecia la gráfica de la probabilidad normal para coliformes fecales, en donde R-Cuadrado presento 74.81% por tanto los puntos presentaron muy cercanas a la línea central.
Staphylococcus aureus
La figura 4, presenta los halos de crecimiento frente a Staphylococcus aureus en el aceite de muña presentó al 25% 9.9600mm; 50% 10.7408mm; 75% 13.1533mm; en aceite de eucalipto 25% 11.7200mm; 50% 13.5608mm; 75% 14.3767mm.
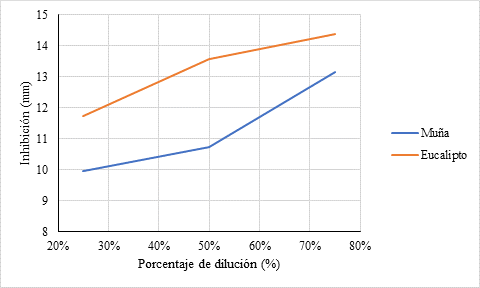
Figura 4 Halos de Inhibición en aceite de Muña y eucalipto en diluciones de 25, 50 y 75% frente a Coliformes fecales
En la figura 5 se presenta la gráfica de probabilidad normal para Staphylococcus aureus, en donde el R- cuadrado presento 77.01% por tanto se afirma que los puntos presentaron.
El efecto inhibitorio en diluciones 25, 50 y 75% de aceite esencial
Análisis de varianza en Coliformes Fecales
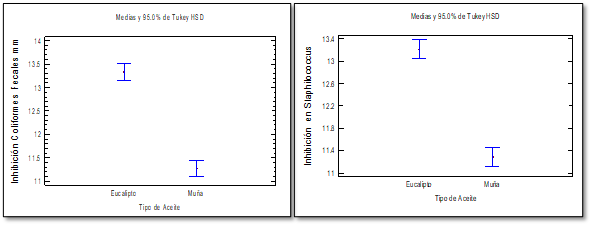
En la figura 6 y 7 se aprecia el análisis de varianza de los halos de crecimiento frente a coliformes fecales y Staphylococcus aureus, en donde se trabajó a un nivel de significancia de 95% con un error de 0.05%, las diluciones de aceites 25, 50, 75% el valor P = 0.000 es significativo; en tipos de aceite el valor P = 0.100 presento no significativo y en Staphylococcus aureus en diluciones de aceites el valor P = 0.000 es significativo, en los tipos de aceites presento el valor P = 0.783 no significativo, por otro lado se presenta la prueba de medias en se compara los tipos de aceites.
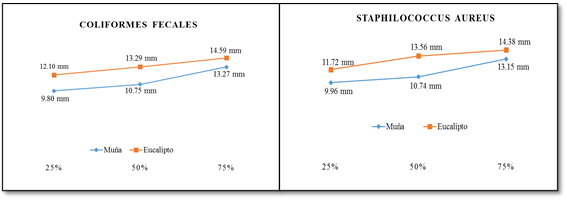
Figura 6 Halos de Inhibición en diluciones de 25, 50, 75% frente a coliformes Fecales y Staphylococcus aureus
Discusión
En la tabla 3 se muestra el rendimiento del aceite esencial de muña en donde presento: 50 ml de 5 kg de masa. Comparados con otras investigaciones el rendimiento obtenido en 2 fue de 20 ml, otros estudios reportan un rendimiento de: 0.9083ml en 100g de masa. Por otro lado, se presenta el rendimiento de aceite esencial de hojas de eucalipto en donde presento 52 ml en 5 kg masa. Comparados con otros trabajos el rendimiento presento de: 1.02ml en 100g de masa. como también otros investigadores reportaron un rendimiento de 27.33 ml en 5 kg de masa de hojas de eucalipto. Cabe resaltar que el rendimiento depende de las condiciones geobotánicas como: el clima, altitud, tipo de suelo, luminosidad, pluviosidad, temperatura, época de recolección y edad de las plantas por ello la materia prima para este trabajo se recolectó a inicios de florecimiento por tanto se obtuvo mayor rendimiento.
Se aprecia el índice de peróxido en donde se encuentra en una media de 0.75 Meq/kg en muña y 0.68 Meq/kg en eucalipto, confirmando de manera genérica por investigadores quienes afirman que el promedio en muña es de: 0.69 a 0.79 y eucalipto de:0.65 a 0.70 Meq/kg. Por tanto, si los datos sobrepasan el promedio de Meq/kg (estado de oxidación) esto generaría problemas mínimos en el experimento. Con respecto a la caracterización del índice de Iodo los valores presentan de; muña: 6.87, eucalipto: 0.6. Asimismo, se reporta que el índice de Iodo varia en muña de: 6.5 a 7.02; eucalipto: 8 a 9, dicha variación es debido a que son especies diferentes. Respecto a la caracterización del Índice de acidez como se aprecia en la tabla 4, el promedio en muña es: 1.78; eucalipto: 1.82; asimismo, se presenta el promedio del índice de acidez en los aceites en donde: el aceite de muña: 1.35 a 1.79; eucalipto:1.52 a 1.90. Afirmando que los datos obtenidos están dentro del rango mencionado, finalmente cabe recalcar, los ácidos libres indican la calidad del aceite Los resultados de índice de refracción presento en la tabla 4 un promedio de; muña: 0.898; eucalipto: 0.845, por otro lado, se reporta el índice de refracción varia de: 1.485 a 1.55 en los aceites, comprobándose la variación, debido a su especie y la velocidad de propagación de cada masa. Según la NTP: 319087 establecida para aceites esenciales la densidad varia de: 0.85 a 0.98, es preciso mencionar en la tabla 4 se aprecia la densidad en muña; 0.898; eucalipto: 0.845 kg/l, por ello esto debe a la diferencia de especie de cada masa que existe un determinado volumen.
Las pruebas bioquímicas realizadas para coliformes fecales y Staphylococcus aureus en donde las pruebas se identificaron positivos. Estos resultados también coinciden con otros trabajos en donde el medio LIA, TSI, tienen del contenido de carbohidratos como: glucosa, lactosa y sacarosa, estos azucares ayudan el incremento de microorganismos por ello los medios tienden a virar de color violeta (TSI) y amarillo (LIA). Con respecto al medio Urea se identificó positivo, las enzimas vienen de ureasa esto libera amoniaco y dióxido de carbono entonces detectan la extensión de microorganismos hasta lograr que el medio vire a color amarillo. Por otro lado el medio citrato de Simmons (C) tiende del cofactor enzimático y fosfato mono-amónico que es fuente de nitrógeno así mismo este medio tiende a virar a color azul. Se describe el medio sim médium (SIM) para coliformes fecales y Staphylococcus aureus, que se identificó positivo, ya que el medio tiene el contenido de la caseína rico en triptófano y la presencia de tres actividades de tiosulfato sódico, sulfato ferroso de amonio que existe la producción de ácidos y gases que son indicadores de presencia de microorganismo, por tanto, el medio tiende a virar de color negro oscuro.
Además, se reportó que estas bacterias Gram negativas tienen menos resistencia a la acción de los aceites, como resultados de las cadenas alifáticas como los anillos fenólicos de los componentes del aceite. Igualmente se ha reportado que los coliformes son menos sensible entre todas las bacterias evaluadas. La variabilidad de la actividad de estos aceites hacia diferentes cepas microbianas se atribuye a las diferencias cualitativas y cuantitativas en componente de los aceites. Por otro lado, algunos aceites esenciales son capaces de inhibir el crecimiento de varios grupos bacterianos. Esto se debe a los compuestos químicos encontrados en los aceites tales como fenoles isoméricos como el Carvacrol y el timol, el bajo pH de estas moléculas es más disociado e hidrofóbico de las proteínas. Corroborando con que el R-cuadrado es una medida estadística que representa el porcentaje de los movimientos de seguridad, que estos movimientos explican el índice de referencia, por ello el R-cuadrado trabaja de 0 al 100%, en lo cual más cercanos al 0% los puntos están muy lejanos del punto central, entonces cercanos al 100% los puntos tienden estar más cercanos a la línea central. Asimismo, cuando el R-cuadrado tienden a sobrepasar el 65% por ello las pruebas tienden a aceptarse.
Generalmente se ha encontrado que Staphylococcus aureus está presente en la piel dañada y alimentos salados, también se reconoce que los aceites esenciales dependen de sus propiedades lipofilicas o hidrofilicas también los tepenoides que sirven como ejemplo agente liposolubles, las cuales afectan la actividad de las enzimas catalizadora a nivel de membrana, ciertos componentes de los aceites actúan como desacopladores, las cuales interfieren en la translocación de protones sobre la membrana. Es por esto que las alternativas al uso de compuestos químicos como los aceites esenciales esto representa una parte importante de la farmacopea tradicional, ya que se registró con mayor actividad antibacteriana, anti fúngica e insecticida que reporta los Staphylococcus aureus son de Gram positivos que tienen más resistencia que Gram negativo es por esto que existen diferencias significativas con respecto al tamaño de los halos de inhibición. Adicionalmente existe la afirmación que el uso de los aceites en el sector alimenticio es menudo y limitado debido que las dosis antimicrobianas son eficaces que pueden exceder niveles aceptables, coincidiendo con y el uso de esos aceites esenciales son para líneas farmacéuticas.
Por otro lado, también se evaluó la inhibición y afirmando que el eucalipto tiene el contenido de 95% de cineol, 25% monoterpéno, al igual que quien reporta el contenido de sus principios activos como: 95% de eucaliptol, alfa-pineno, p-cimeno, limoneno, filandreno, aldehídos, butiraldehido, capronaldehido, azuleno, taninos, resina, flavona, eucaliptina, triterpeno y 4% de ácido ursólico, Asimismo, el eucalipto tiene el contenido de cineol, flavonoides, taninos y ácidos que presenta la acción expectorante antimicrobiana, analgésica, antibacteriana, febrífuga, diurética, cicatrizante, anti reumatismo, vermífuga, antiviral, depurativa, antiséptica.
Conclusiones
El presente estudio, demostró primero que ambas especies de hojas presentan un buen rendimiento en el método aplicado, asimismo, para el caso de la capacidad mínima inhibitoria para ambas cepas el aceite esencial de eucalipto presento mayor capacidad que el aceite de muña, es por eso que los aceites esenciales son fuente importante para la inhibición de bacterias patógenas.
Conflicto de intereses
Los autores declaran que no existe conflicto de intereses para la publicación del presente artículo científico.












 uBio
uBio