INTRODUCCIÓN
Una de las principales actividades económicas en Perú es la actividad agrícola, la cual en los últimos años ha tomado gran importancia debido a la exportación de frutas frescas. Las exportaciones agrícolas en el 2022 ascendieron a US$ 9807 millones (ComexPeru, 2023), representando 1/6 de las exportaciones totales peruanas. Sin embargo, las pérdidas durante la cosecha y postcosecha pueden ser elevadas. Muchos de los factores que aumentan las pérdidas durante la cosecha, postcosecha y transporte a mercado de destino son los daños mecánicos por golpes, el ataque de plagas, fallos en la cadena de frío, fallos en el envase y embalaje, entre otros.
Con el afán de combatir el ataque de plagas y el deterioro de las frutas se utilizan una serie de pesticidas sintéticos que tienen un alto poder residual. Por ejemplo, uno de los funguicidas post cosecha de mayor utilización por su amplio espectro es el Tiabendazol, el cual está calificado como Ligeramente Peligroso (Categoría III de la OMS). Sin embargo, este tipo de productos enfren-tan cada vez con mayor frecuencia restricciones de uso a nivel de mercados de alto poder adquisitivo, generando una necesidad en la búsqueda de productos de bajo impacto ambiental y legalmente permitidos. Producto de estas restricciones los pequeños productores por su vulnerabilidad podrían verse afectados negativamente, derivando en pérdidas económicas significativas y generando un importante problema social.
Por otro lado, otras de las actividades productivas importantes en Perú son la actividad hidrobiológica y acuícola. Uno de los productos que ha tomado mucha importancia debido a su abundancia es la Pota (Dosidicus gigas). En el año 2022 se desem-barcó un total de 52619 t de este recurso (Produce, 2023), siendo el 10% un residuo denominado “pluma”. Este residuo está constituido principal-mente por quitina, la cual tiene la ventaja de ser convertida fácilmente en quitosano sin necesidad de pasar por el proceso de blanqueo que utiliza gran cantidad de insumos químicos (Moreno et al., 2017).
El quitosano es un material derivado de la quitina obtenida por deacetilación que exhibe una impor-tante actividad antibacteriana sobre diferentes bacterias Gram positiva y negativa y hongos (Confederat et al., 2021; Ke et al., 2021), la mayoría de los cuales involucrados en la descomposición de alimentos. Las materias primas para producir quitosano a escala comercial incluyen desechos como exoesqueleto de langostino mediante una serie de métodos de naturaleza química, enzimática y microbiológica (Kou et al., 2021).
Las aplicaciones del quitosano como antibacte-riano incluyen recubrimientos o películas solo y combinado para combatir bacterias y hongos durante la post cosecha de diversas frutas como manzanas (Camatari et al., 2017; Cosme Silva et al., 2017; Khalifa, Barakat, El-Mansy, & Soliman, 2017; D. Kumar, Kumar, & Pandey, 2018), fresas (Badawy et al., 2016), mango (Camatari et al., 2017; Cosme Silva et al., 2017), banana et al., 2018), uva (Barka et al., 2018). El quitosano se ha impregnado o funcionalizado con diversas nanopartículas con miras a no solo ampliar su espectro antimicro-biano, sino también mejorar sus propiedades físicas, mecánicas y térmicas. Algunas de estas nanopartículas utilizadas han sido ZnO, Zn, Cu, Ag (Du et al., 2009; Gonzaga, 2016; Kumar et al., 2018; Sámano-Valencia et al., 2013). También se ha estudiado el uso de quitosano en forma de nano-partículas, dado que son mucho más efectivas contra bacterias y hongos que atacan a las frutas y a los alimentos en general (Castelo et al., 2018; Kumar et al., 2018; Llanos & Tadini, 2018; Lustriane et al., 2018).
Es evidente que existe aún mucho campo de estudio en la temática, sobre todo relacionado con la combinación de dos o más agentes antimicrobianos en forma de nanopartículas que permitan ampliar el espectro antimicrobiano y antifúngico. Es así como en el presente trabajo de investigación se evaluaron recubrimientos líquidos basados en quitosano de alto peso molecular derivado de pluma de pota, nanopartículas de quitosano y ZnO para inhibir los microorganismos que atacan a las frutas de exportación en el norte del Perú.
METODOLOGÍA
Recolección de Frutas
Las muestras de frutas fueron recolectadas de diferentes áreas de producción y comercialización en la zona norte del Perú (Tumbes, Piura). Estas frutas incluyeron arándanos, uvas, limón y aguaymanto.
Aislamiento e identificación de hongos
Se utilizaron dos métodos, considerando si el fruto presentó o no lesiones visibles. Para el primer caso, se utilizó 100 g de cada fruta seleccionada y se diluyó 1:10 con agua peptonada estéril al 1%. Se mezcló vigorosamente por 30 min en un agitador orbital para luego realizar diluciones seriadas en agua peptonada al 1%. Luego se sembró por superficie en agar patata dextrosa (PDA, Merck) suplementada con 100 mg/L de cloranfenicol. Por otro lado, si las frutas presentaron lesiones se realizarán cortes de 0,5 cm de tejidos entre las zonas lesionadas y no lesionadas del fruto. Posteriormente los cortes de tejidos se trataron en batería de desinfección que comprendió lavados con hipoclorito de sodio al 1% por 1 min, etanol 70% por 1 min y tres lavados sucesivos con solución salina fisiológica estéril 0,85% (SSFE). Los tejidos desinfectados se secaron en papel filtro estéril y se sembraron por superficie en PDA suplementada con 100 mg/L de cloranfenicol.
Para el aislamiento de hongos, las placas inoculadas se incubaron a temperatura ambiente por 5 días. Transcurrido el tiempo de incubación, se realiza-ron recuentos de unidades formadoras de colonias (UFC) y se purificaron los hongos de interés en nuevos agares de cultivo. Posteriormente, las cepas aisladas se conservaron en tubos con agar PDA (hongos) inclinados.
La extracción de ADN se realizó utilizando el método estándar CTAB-DTAB. Se procedió a pesar entre 30 mg de micelio fúngico en microtubos de 1,5 mL. Se agregaron 600 μL de la solución de extracción DTAB (dodeciltrimetilamonio bromuro 8%, NaCl 1,5%, Tris HCl 100 mM a pH 8,8 y EDTA 50 mM)), se agitaron en el vortex por 20 s y se procedió a incubar a 75 °C por 10 min. Luego se agitó en vortex por 20 s y se adicionaron 600 μL de cloroformo grado HPLC y se agitó nuevamente en vortex por 20 s. A continuación, se centrifugó a 13000 g durante 5 min. Se transfirió el sobrena-dante 250 μL a otro microtubo de 1,5 mL que contenía previamente 100 μL de solución CTAB (5% cetiltrimetilamonio bromuro, 0,4 M NaCl) y 900 μL de agua destilada estéril. Se agitó en vortex e incubó a 75 °C durante 5 min. Se enfrió a temperatura ambiente y centrifugó a 13000 g por 10 min. Se eliminó el sobrenadante, se re-suspendió el pellet (ADN) con 150 μL de solución disolvente (NaCl 1,2 M), incubándose a 75 °C durante 5 min y se enfrió a temperatura ambiente. A continuación, se centrifugó a 13000 g por 5 min y después se transfirió el sobrenadante de 150 μL a un nuevo microtubo con 300 μL de etanol absoluto. Se agitó en vortex por 20 s y centrifuga a 13000 g por 5 min, luego se lavó el pellet con 500 μL de solución de lavado (etanol al 75%), se volteó el tubo varias veces, se centrifugó a 7500 g por 5 min y se procede a secar el pellet de ADN por 15 min, y se re-suspendió con 200 μL de tampón TE (Tris 10 mM- EDTA 1 mM) y se conservó a -20 °C.
Los hongos se identificaron utilizando los cebadores universales para hongos ITS1F e ITS4. Las reacciones fueron realizadas con 2X Taq Mastermix GeneOn (0,1 U/µL Taq DNA polimerasa, 0,4 mM dATP, 0,4 mM dGTP, 0,4 mM dCTP, 0,4 mM dTTP, 4 mM MgSO4, 20 mM KCl, 16 mM (NH4)2SO4, 20 mM tris-HCL, pH 8,8) De cada producto de amplificación de la reacción en cadena polimerasa (PCR), 10 μL se migraron en gel de agarosa al 1 % con tampón de migración TAE 1X. La migración se realizó a 120 V durante 20 min; conjuntamente se migró un marcador de peso molecular de 50 pares de bases (pb). Los geles se visualizaron utilizando un transiluminador UV.
Para la secuenciación bidireccional se utilizó 10 μL de los productos obtenidos por amplificación de la PCR, y se colocaron en microtubos de 0,2 mL. La secuenciación de las muestras fue realizada por la empresa Macrogen Inc de Korea.
Preparación y caracterización de los recubrimientos
Se prepararon por separado soluciones de quito-sano derivado de pota (Dosidicus gigas) (Moreno et al., 2017), alcohol polivinílico (PVA), NPs de quitosano y NPs de ZnO. La solución de quitosano se preparó disolviendo el quitosano con una solución de ácido acético al 1% (p/v) en agitación constante. Una vez el quitosano estuvo totalmente disuelto se filtró para eliminar algunas impurezas. La solución de PVA se preparó disolviendo el PVA con agua ultrapura en agitación constante a 80 °C.
Para la preparación de nanopartículas de quito-sano, se preparó una solución de quitosano 0,2% (p/v) en ácido acético al 1% (p/v). Se disolvió tripolifosfato de sodio (TPP) en agua ultrapura a una concentración de 0,3% (p/v). Luego, la solución de TPP se vertió gota a gota en la solución de quitosano con agitación a 1000 rpm. La mezcla se agitó durante 20 min más y luego se centrifugó a 10000 rpm por 15 min. Finalmente se recolectó la fase liquida y se almacenó a 4 °C.
Las nanopartículas de ZnO se sintetizaron utili-zando el método de precipitación y como agente precursor nitrato de zinc hexahidratado (Cruz et al., 2020).
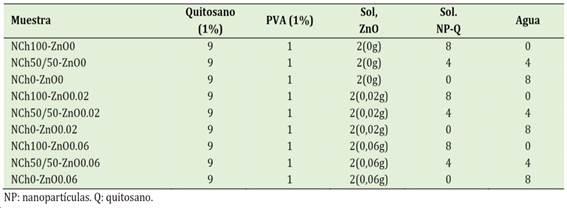
Una vez preparados los insumos se procedió a la formulación de los recubrimientos líquidos. Para ello, la solución de quitosano se mantuvo en agitación constante y se adicionó la solución de PVA y se mantuvo agitación por 20 min. Luego se agregó las NPs de ZnO disueltas en agua ultrapura, manteniéndose agitación por 20 min. Finalmente se agregó las NPs de quitosano y el agua ultrapura y se homogenizó por 10 min. Se elaboraron diferentes formulaciones, tal como se describe en la Tabla 1. El volumen total de la solución del recubrimiento fue de 20 ml.
Se obtuvieron los espectros de espectroscopia infrarroja con reflectancia atenuada (FTIR-ATR) (Shimadzu Tracer-100).
Pruebas de inhibición antimicrobiana-selección de recubrimientos
Para el estudio de inhibición de hongos por los diversos tratamientos se utilizó el ensayo de halos de inhibición. De los hongos identificados se seleccionaron 5 en base a la mayor incidencia en el deterioro de las frutas. Los hongos seleccionados fueron inoculados en medio de cultivo PDA (patata dextrosa agar, Merck) por 5 a 7 días para la obtención de esporas.
Para el ensayo se siguió la metodología de Nehra et al. (2018), con algunas modificaciones. Se utilizó PDA, y se sembró mediante placa vertida una concentración de 1-3x106 esporas/mL de cada hongo. Una vez solidificado el medio, se cortaron cuatro pocillos, y fueron llenados con 100 µL de los recubrimientos líquidos formulados.
Las placas de agar se incubaron a 28 °C. Para expresar los resultados se midió el diámetro de las zonas de inhibición de los recubrimientos a los 5 d.
RESULTADOS Y DISCUSIÓN
Identificación molecular de hongos aislados de las frutas de exportación
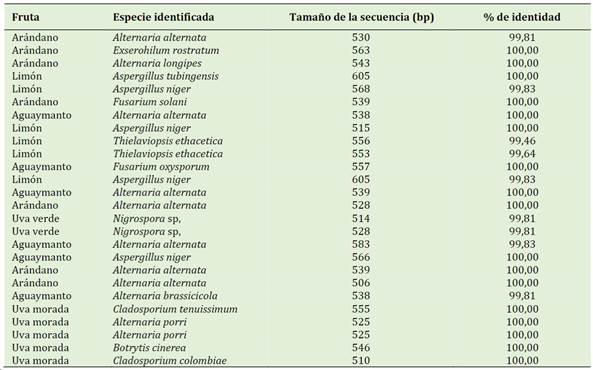
En la Tabla 2 se muestra los resultados del aislamiento e identificación de los hongos de las frutas analizadas. Aquí, se muestra el tamaño de la secuencia nucleotídica en pares de bases (bp) y el % de identidad comparada con las secuencias de la base de datos GenBank. En el caso de arándano se han identificado especies de los géneros Alternaria, Fusarium y Exserohilum. En el caso de limón las especies encontradas fueron del género Aspergillus y Thielaviopsis, mientras que en el caso de aguaymanto las especies encontradas están dentro de los géneros Alternaria, Fusarium y Aspergillus.
En el caso de las uvas, tanto verdes como moradas, las especies de hongos aisladas están dentro de los géneros Nigrospora, Cladosporium, Botrytis y Alternaria.
Caracterización de recubrimientos
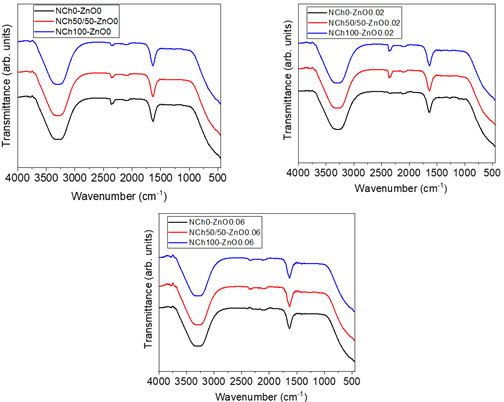
En la Figura 1 se aprecian los resultados de FTIR-ATR de los recubrimientos desarrollados. Estos son similares para todas las muestras con un pico ancho entre 3000 - 3500 cm-1 que correspondería al grupo funcional -OH o N-H. Se observa otro pico en 1640 cm-1, el cual correspondería al estrecha-miento C=O (amida I) (Rahman et al., 2019) típico del quitosano. Aparentemente las concentraciones de NPs de quitosano y ZnO en el recubrimiento liquido es muy bajo para poder ser detectado por esta técnica de análisis.
Resultados de las pruebas antimicrobianas contra hongos aislados de las frutas
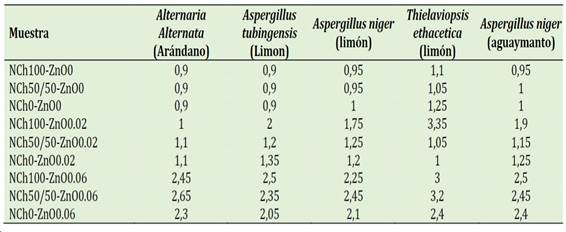
En la Tabla 3 se muestran los resultados del tamaño de halos de inhibición de los diferentes recubri-mientos aplicados sobre los hongos aislados. Se aplicó un modelo bifactorial para evaluar la concentración de NPs de quitosano y la de ZnO en el recubrimiento. En todos los casos para un valor de α = 0,01 se observó que no existe diferencia significativa en cuanto a la concentración de NPs de quitosano, sin embargo, si se evidencia la diferencia significativa en función del factor concentración de NPs de ZnO en el recubrimiento. Se puede apreciar que, en general, a mayor concentración de NPs de ZnO en el recubrimiento mayor capacidad de inhibición de los hongos evaluados.
Tabla 3 Resultadosde capacidad antifúngica (halos de inhibición en cm) de los recubrimientos líquidos basados en NPs de ZnO y quitosano contra hongos aislados de frutas
En el caso de ZnO su capacidad antifúngica ha sido corroborada en diversos trabajos donde incluso se ha logrado aumentar la vida útil de productos frescos (Decelis et al., 2017; Luksiene et al., 2020; Ruffo et al., 2019). El mecanismo antibacteriano de las NPs de ZnO es consecuencia de su contacto directo de la pared celular o membrana de los microrganismos resultando en la destrucción de la integridad de la misma. El ZnO en medio acuoso libera iones Zn+2 y generan especies oxigeno reactivas (Kim et al., 2022).
En otros estudios se ha demostrado la capacidad antifúngica de NPs de quitosano (Abdel-Rahman et al., 2021; Ruffo et al., 2019), a diferencia del presente. Es posible que las concentraciones utilizadas en el presente trabajo no hayan sido las suficientemente altas para provocar la inhibición de los hongos evaluados.
CONCLUSIONES
Se prepararon diferentes formulaciones de recu-brimientos líquidos de quitosano y nanopartículas de quitosano y ZnO, utilizando varias concentra-ciones de cada componente utilizando dos técnicas de producción. Estos recubrimientos fueron evaluados “in vitro” sobre hongos aislados e identificados mediante halos de inhibición.
Los principales géneros de hongos aislados e identificados molecularmente de las frutas incluyeron Alternaria, Exserohilum, Aspergillus, Fusarium, Thielaviopsis, Nigrospora, Cladosporium y Botrytis.
Los recubrimientos presentaron efecto antifúngico contra Alternaria Alternata (arándano), Aspergillus tubingensis (limón), Aspergillus niger (limón), Thielaviopsis ethacetica (limón) y Aspergillus niger (aguaymanto). La concentración de NPs de quito-sano no tuvo efecto sobre la capacidad antifúngica de los recubrimientos, mientras que las NPs de ZnO si tuvieron un efecto directamente proporcional.
Los recubrimientos líquidos en base a quitosano y NPs de quitosano y ZnO tienen un potencial de uso como agente antifúngico en frutas con potencial de exportación.












 uBio
uBio