Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Neuro-Psiquiatría
Print version ISSN 0034-8597
Rev Neuropsiquiatr vol.77 no.4 Lima Oct. 2014
Depresión en la tercera edad como factor de riesgo y su posible rol como pródromo de demencia
Depression and dementia in the mental health of old age
Nilton Custodio1,2,3, Eder Herrera-Pérez1,4, David Lira1,2,3, Rosa Montesinos1,2,5, Marcela Mar2,6,7, Erik Guevara-Silva8, Sheila Castro-Suárez1,3,9, Patricia Cortijo1,2,10, José Cuenca-Alfaro1,2,8,10, Liza Nuñez del Prado1,2,3,8.
1 Unidad de Investigación, Instituto Peruano de Neurociencias. Lima, Perú.
2 Unidad de Diagnóstico de Deterioro Cognitivo y Prevención de Demencia, Instituto Peruano de Neurociencias. Lima, Perú.
3 Servicio de Neurología, Instituto Peruano de Neurociencias. Lima, Perú.
4 Unidad de Proyectos de Investigación, Instituto de Salud del Niño. Lima, Perú.
5 Unidad de Medicina de Rehabilitación, Instituto Peruano de Neurociencias. Lima, Perú.
6 Unidad de Geriatría. Instituto Peruano de Neurociencias. Lima, Perú.
7 Servicio de Geriatría, Hospital Central de la Fuerza Aérea del Perú. Lima, Perú.
8 Instituto Nacional de Ciencias Neurológicas. Lima, Perú.
9 Servicio de Neurología de la Conducta, Instituto Nacional de Ciencias Neurológicas. Lima, Perú.
10 Unidad de Neuropsicología, Instituto Peruano de Neurociencias. Lima, Perú.
RESUMEN
Depresión y demencia, sobre todo enfermedad de Alzheimer (EA) son entidades críticas en la salud mental de la tercera edad. Ambas condiciones disminuyen la calidad de vida e incrementan el deterioro de actividades de vida diaria de individuos de la tercera edad. EA tiene pobre pronóstico al ser una enfermedad neurodegenerativa; mientras que la depresión es básicamente reversible. Los estudios de seguimiento longitudinal y de caso-control reportan una estrecha asociación entre depresión de inicio tardío y deterioro cognitivo progresivo, pues se ha demostrado riesgo de incremento en 2 a 5 veces para desarrollar demencia en pacientes con depresión de inicio tardío. Por otro lado, la depresión de inicio precoz ha demostrado en forma consistente ser también un factor de riesgo para demencia, y escasas probabilidades de ser pródromo de demencia.La naturaleza de la asociación (si depresión es un pródromo o consecuencia de demencia, o un factor de riesgo para desarrollar demencia) permanece aún sin ser esclarecida. Independiente de ello, las estrategias para tratar depresión podrían alterar el riesgo de desarrollar demencia.
PALABRAS CLAVE: Demencia, depresión, enfermedad de Alzheimer, factor de riesgo.
SUMMARY
Depression and dementia, in particular Alzheimer´s disease (AD) are critically important issues in the mental health of old age. Both conditions apparently reduce quality of life and increase the impairment of activities of daily living for elderly persons. AD usually shows poor prognosis owing to progressive neuronal degeneration, while depression is basically reversible. Longitudinal follow-up and case-control studies reported a strong association between late-onset depression and dementia, and therefore increased risk was observed in 2-5 times to develop dementia in patients with late-onset depression. Furthermore, early-onset depression have also consistenly demonstrated to be a risk factor for dementia and unlikely to be prodromal to dementia. The nature of this association (if depression is a prodrome or consequence of, or risk factor for dementia) remains unclear. Regardless of this, treatment strategies for depression could alter the risk of dementia
KEYWORDS:Dementia, depression, Alzheimer´s disease, risk factor.
INTRODUCCIÓN
Con el incremento de la expectativa de vida de la población a nivel mundial, y con el consiguiente progresivo envejecimiento de la población, algunas enfermedades están adquiriendo cada vez mayor interés en el ámbito clínico de la neurología, la psiquiatría y la neuropsicología. La declinación cognitiva y demencia tienen un elevado impacto individual y está estrechamente asociado a la edad, por lo que la prevalencia y el impacto social se encuentran en incremento a nivel mundial. Este incremento va a ser particularmente marcado en países en vías de desarrollo (1,2). La prevalencia de demencia en América Latina según estudios basados en comunidad de adultos mayores de 65 años de edad es 7,1%, muy similar a la de los países desarrollados (3). La prevalencia de demencia en Perú es 6.85%, siendo enfermedad de Alzheimer (EA), la demencia más frecuente (4). No obstante debe ser de particular interés identificar otras causas alternativas a las demencias de origen neuro-degenerativo y/o vascular (vale decir EA y/o demencia vascular); la utilidad de extensas evaluaciones de laboratorio e imágenes cerebrales deben ser manejadas con mucho criterio, dado sus elevados costos en nuestra región. La importancia de investigar la etiología de la demencia radica en la posibilidad de tratar demencias potencialmente reversibles (5,6), entre las cuales, se incluyen demencia inducida por alcohol y drogas, estados confusionales agudos, condiciones metabólicas (como deficiencia de vitamina B12 e hipotiroidismo), y el término cada vez menos usado, pseudodemencia debido a depresión. Raramente, lesiones cerebrales estructurales, como hematoma subdural, hidrocefalia de presión normal, y algunos tumores cerebrales son otras causas potencialmente reversibles de demencia. En la mayoría de los casos, el diagnóstico de demencia y particularmente el de EA se realiza por exclusión, efectuando una historia cuidadosa y descartando otros problemas que pueden producir deterioro cognitivo, pero que son potencialmente reversibles, como es el caso de la depresión. No obstante, el problema sobreviene cuando los síntomas depresivos son clínicamente significativos y aparecen a la vez que los primeros síntomas cognitivos de deterioro (quejas de memoria). Entonces, es difícil distinguir sí los síntomas depresivos son secundarios a un posible problema de demencia, si los síntomas depresivos coexisten con los síntomas cognitivos, o bien, si los síntomas depresivos constituyen por sí mismos un síndrome, y son síntomas primarios acompañados de quejas de memoria. Así pues, la depresión constituye, en la práctica diaria, uno de los principales y más frecuentes problemas de diagnóstico diferencial con el síndrome de demencia, en especial en sus fases iniciales. Algunos de los estudios retrospectivos que se realizaron en el siglo pasado mostraron una proporción de error de hasta el 30% en la decisión clínica de sí un paciente tenía o no demencia; la mayoría de los pacientes que fueron mal diagnosticados tenían una depresión (7). Y en estudios sobre demencia, en los que se incluye seguimiento, también se han demostrado tasas de error de hasta el 50% de casos (7,8).
Lamentablemente hasta la fecha no existe un marcador diagnóstico de la EA para distinguirla de la depresión. No existen marcadores biológicos o anatómicos que permitan un correcto diagnóstico diferencial entre la demencia y la depresión. Y éste se basa fundamentalmente en los antecedentes previos de trastorno afectivo, en el análisis del curso clínico de los síntomas y de las características de las alteraciones neuropsicológicas. Tanto desde el punto de vista de la evaluación neuropsicológica como de la investigación experimental, la pérdida de memoria ha sido la disfunción cognitiva que más atención ha recibido, dado que es el rasgo clínico más sobresaliente de la EA. Pero, el problema está en que la memoria y el aprendizaje son también procesos susceptibles a la depresión, llegando en algunos casos a presentar un deterioro tan marcado que puede clínicamente sugerir lo que se ha venido en llamar cada vez con menos frecuencia una pseudodemencia depresiva. Algunos investigadores, sugieren entonces, que se podría facilitar la diferenciación entre demencia y depresión; pero más precisamente un criterio que podría servirnos para facilitar el diagnóstico entre los pacientes con EA y con pseudodemencia depresiva podría ser la evaluación de las capacidades básicas del lenguaje. Existe un conjunto de investigaciones que demuestran que el lenguaje es una de las funciones cognitivas menos afectadas por el envejecimiento normal; y que, por el contrario, el trastorno lingüístico constituye una de las primeras manifestaciones de demencia en la EA (9,10). Este hecho implicaría que el examen de las habilidades lingüísticas podría tener un alto interés clínico, ya que permitiría el diagnóstico diferencial entre la pérdida de funciones cognitivas asociadas a la edad y el inicio de un proceso patológico como la demencia. De tal manera, que no sólo la evaluación de la memoria, sí no también el estado del lenguaje nos permitiría diferenciar entre EA y la pseudodemencia depresiva.Con la finalidad de entender el factor depresión y su relación con demencia, planteamos el presente artículo de revisión en cual realizaremos un análisis de los síntomas cognitivos de depresión de la tercera edad, definiremos con precisión depresión de inicio precoz y depresión de inicio tardío, y su relación como factor de riesgo en demencia, estableceremos la fisiopatología común entre depresión y demencia a través de la hipótesis vascular, y el rol de depresión en la progresión de deterioro cognitivo hacia EA.
Los sintomas cognitivos de depresión de la tercera edad
Los pacientes deprimidos se quejan con frecuencia de la dificultad para concentrarse, de estar distraídos, de la incapacidad para llevar a cabo sus tareas habituales, y de olvidos. Aquellos pacientes con un trabajo que intelectualmente es más demandante son a menudo incapaces de funcionar de forma adecuada. Por todo ello, los déficits cognitivos pueden ser la razón para buscar tratamiento, especialmente en casos donde haya una clara interferencia con su rendimiento laboral. Se ha demostrado que el compromiso de las áreas cognitivas de los pacientes deprimidos se explican por reducción en la velocidad de los procesos de información; aunque se supone que la disfunción ejecutiva fue un fuerte mediador de los otros déficits, no obstante, los factores de riesgo vascular podrían mediar una gran parte de las deficiencias de los procesos de la información (11). Bhalla y colaboradores evaluaron prospectivamente 56 pacientes con depresión sin demencia, y luego al año, después del tratamiento cuando estuvieron en remisión. Ellos demostraron, que después de un año las áreas que permanecieron más frecuente y severamente afectadas fueron velocidad en el proceso de la informacion, función visuo-espacial y memoria retrasada (12). Sin embargo los estudios de comunidad no comparten los mismos hallazgos. Así, Baune y colaboradores analizaron los efectos de la depresión sobre la cognición en pacientes de cuidados primarios y también encontraron una relación entre humor deprimido con la velocidad del procesamiento de la información, pero no con la función ejecutiva (13). El compromiso cognitivo puede observarse tanto en depresión como en EA, pero el patrón típico del compromiso difiere en ambas condiciones. Los pacientes con depresión típicamente exhiben deficiencias en la memoria cuando se usan pruebas cognitivas que emplean tareas de recuerdo libre de la información previamente aprendida (sin claves), mientras que las tareas que requieren el reconocimiento o con claves de ítems recientemente aprendidos son generalmente normales. Por el contrario, durante estadios tempranos de EA, los pacientes con EA exhiben compromiso tanto del recuerdo así como del reconocimiento de ítems previamente aprendidos (14,15). En un estudio español (16), en donde el objetivo fue comparar el rendimiento neuropsicológico de pacientes diagnosticados de EA, con y sin depresión asociada, pacientes con depresión mayor unipolar y un grupo de sujetos control en diferentes tareas de memoria (verbal y no verbal), los resultados demostraron que los grupos EA sin depresión y EA con depresión no difieren en ninguna de las tareas de memoria utilizadas. Estos hallazgos son consistentes con los obtenidos por el grupo de Bäckman y colaboradores (17), cuando refieren que la depresión no incrementa el deterioro de la memoria episódica (verbal y no verbal) en pacientes con EA. Por lo contrario, otros estudios han encontrado que la depresión puede incrementar el deterioro cognitivo de los pacientes sobre el MMSE (18). No obstante, utilizar esta medida como única variable dependiente impide conocer si las diferencias entre los grupos de EA, con y sin depresión, se deben a la evolución de la enfermedad o al efecto de la depresión. Los resultados encontrados por Contador-Castillo (16) y colaboradores, son consistentes con los de Berger y colaboradores (19), y permiten afirmar que, cuando los grupos EA sin depresión y EA con depresión están equiparados cognitiva y funcionalmente, la depresión no ejerce ningún efecto sobre la memoria, verbal y no verbal, en estos pacientes. El déficit del grupo con depresión unipolar en la sub-escala Iniciación-Perseveración, que acredita una adecuada validez concurrente para la evaluación de la función ejecutiva (20), parece relevante si tenemos en cuenta que la disfunción prefrontal es la principal responsable del deterioro de la memoria en los pacientes con depresión (21). De la misma manera, Zakzanis y colaboradores (22), indican que los pacientes deprimidos muestran más deterioro en la memoria a medida que aumentan las demandas de la tarea (por ejemplo, recuerdo libre de palabras y de posición). Mientras tanto, las medidas de reconocimiento suelen estar preservadas, tal y como han confirmado otras investigaciones (23). La medida reconocimiento de dibujos fue la única que no confirmó estos resultados, pues, según el meta-análisis de Burt y colaboradores (24), la probabilidad de que los pacientes con depresión presenten un déficit en el reconocimiento aumenta con el intervalo de demora. Al comparar los grupos de EA (con y sin depresión) con el grupo de depresión unipolar, se encuentra que las medidas de aprendizaje de palabras diferenciaron entre los pacientes con EA y los pacientes del grupo con depresión unipolar. Estos resultados sustentan que la memoria episódica verbal (recuerdo y reconocimiento de palabras) no sólo es una medida sensible a la EA, sino también específica para diferenciar pacientes con EA y depresión (25). Por el contrario, ni la tarea de dígitos inversos ni las medidas del Test de Aprendizaje Visuo-Espacial (TAVE) discriminaron entre los grupos de EA sin depresión y EA con depresión, ya que el deterioro neuropsicológico de los pacientes con depresión resulta más acentuado ante dos condiciones particulares: el grado de depresión es moderado o grave (26) y las tareas empleadas (por ejemplo, dígitos inversos y TAVE) demandan un elevado control atencional y/o la intervención de las funciones ejecutivas (21). A pesar de que los grupos EA sin depresión y EA con depresión no mostraron diferencias significativas en el rendimiento mnésico, es interesante señalar que las medidas no verbales tienden a estar más afectadas que las medidas verbales en el grupo EA con depresión. Más aún, el test de Corsi sustentó un efecto de interacción de la depresión en la EA. Esto sucede porque, a diferencia de la memoria episódica, donde más del 90% de los EA presenta un efecto suelo en las fases incipientes de la EA, el deterioro cognitivo de otras medidas neuropsicológicas es más heterogéneo (27,28) o, incluso, como ocurre con la memoria a corto plazo, inexistente. Esto nos permite conjeturar que ciertas medidas neuropsicológicas (p. ej., el test de Corsi), más conservadas en las fases incipientes, podrían ser sensibles al efecto de la depresión en la EA.
Depresión de inicio precoz (DIP) y depresión de inicio tardío (DIT) y su influencia como factor de riesgo de demencia
Un factor importante en la etiología y el curso de la depresión y su relación con el deterioro cognitivo, es la edad en la cual un individuo experimenta su primer episodio de depresión, clínicamente significativo. La cuestión es, ¿cuál es la edad límite para considerar la edad de inicio de la depresión?; y los estudios muestran diversos puntos de corte, por lo que para esta revisión definiremos depresión de inicio tardío (DIT), a aquellos que inician su primer episodio depresivo después de los 50; mientras que la depresión de inicio precoz (DIP), incluirá a los individuos que presentan su primer episodio depresivo antes de los 50 (29). Estudios basados en población sugieren que el 30% de individuos experimentan DIT, 40% como DIP y en un 30% no se logra determinar la edad de inicio debido a errores metodológicos (30). La DIT frecuentemente se caracteriza por comorbilidad médica, mientras que la DIP es más frecuentemente asociada con otra comorbilidad psiquiátrica y una historia familiar de desorden del humor (31). Sin embargo, apatía ocurre más frecuentemente en DIT que en DIP (32). Respecto a la etiología de la DIT, se ha demostrado que se asocia con patología de sustancia blanca profunda y subcortical (33) y más frecuentemente ocurre con trastorno cognitivo, típicamente con características prominentes de disfunción ejecutiva que refleja la disrrupción de los circuitos fronto-estriatales (34,35), mientras que la etiología de la DIP no está bien definida, pero algunas investigaciones sugieren que se asocian a pérdida de volumen en el hipocampo (36,37), lo cual posiblemente contribuye a disfunción del eje hipotálamo-pituitario-adrenal (38). En general, individuos que se presentan con primer episodio de depresión en la vida tardía tienen alto riesgo de desarrollar alguna forma de demencia (39), pero en estudios de meta-análisis más actualizados no se puede excluir la posibilidad que tanto DIT, como DIP están relacionados con un riesgo incrementado de demencia (29).
Fisiopatología común entre depresión y demencia: la hipótesis vascular
Estudios clínicos y de la comunidad han identificado una asociación consistente entre depresión y enfermedad cerebrovascular (ECV), lo cual ha conducido a plantear la hipótesis de depresión vascular (40,41). La depresión vascular clínicamente definida se caracteriza por la presencia de condiciones médicas que se presumen son asociados con ECV y las pruebas neuropsicológicas realizadas son compatibles con disfunción subcortical, específicamente en los dominios de funciones de atención y funciones ejecutivas (42,43). Esta definición es apoyada por los estudios clínicos basados en imagen por resonancia magnética (IRM) en donde se demuestran que la lesiones isquémicas subcorticales son más frecuentes entre ancianos deprimidos que en los controles sin depresión (44,45). Otros estudios de IRM han demostrado una asociación entre hiperintensidad de sustancia blanca profunda (HSBP) y deficiencias en memoria y funciones ejecutivas en sujetos ancianos deprimidos, las cuales no se encuentran en individuos deprimidos sin HSBP y controles normales con o sin HSBP (46). Por otro lado, esta asociación entre ECV y depresión en muestras de la comunidad (41) y en estudios prospectivos sugieren que la patología vascular parece estar asociado con un persistente y peor curso de depresión (47). Sin embargo, Naarding y colaboradores (48) reportaron un análisis de dos cohortes de pacientes en Holanda, en el cual no se pudo identificar un fenotipo de depresión vascular como previamente lo describe Alexopoulos (42). De la misma manera, en un estudio de cuidados primarios que examinó específicamente factores vasculares y depresión (49), los investigadores encontraron que los factores de riesgo cerebro-vascular están asociados con depresión mayor; pero no, después de ser corregidos para la carga de enfermedades médicas, y con algunas mediciones de disfunción ejecutiva. Sorpresivamente, disfunción ejecutiva no fue asociada con el diagnostico de depresión, pero las mediciones fueron asociadas con severidad de depresión. Otros investigadores, sin embargo, refuerzan la evidencia para una relación entre depresión y enfermedad vascular. Así Kim y colaboradores (50) quienes examinaron depresión, cognición y factores de riesgo vascular en la evaluación basal y luego en un promedio de 2 años en 631 pacientes coreanos, encontraron que la incidencia de ictus, cardiopatía isquémica basal, y bajos niveles de HDL estuvieron asociados con el desarrollo de depresión, el cual fue independiente de cambios en la cognición. En ese sentido Purandare (51) encontró una asociación significativa entre síntomas depresivos y embolia cerebral espontanea en demencia, sugiriendo que estos mecanismos vasculares pueden ser relevantes para el desarrollo de depresión, quizás especialmente en aquellos con compromiso cognitivo previo. En una muestra muy diferente, que incluyó 143 pacientes post-ictus evaluados dentro de las 3 semanas de su ictus, Nys y colaboradores (52) reportaron una asociación de compromiso cognitivo basal, diabetes y ataque isquémico transitorio con síntomas depresivos desarrollados 6-10 meses más tarde.
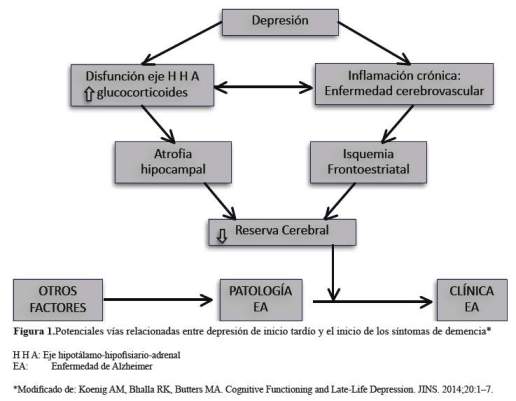
Si bien es cierto, la literatura actual sugiere que existen evidencias en las cuales DIT se encuentra más frecuentemente asociado con riesgo incrementado para EA; cada vez se demuestra también que cambios neuropatológicos no-Alzheimer (como cuerpos de Lewy, enfermedad vascular y atrofia hipocampal relacionada a hipercortisolemia) ocurren con mayor frecuencia en individuos con DIT, comparado con individuos no deprimidos. Entre todos los modelos sugeridos para explicar esta asociación, el que goza de mayor aceptación es el sugerido por Butters y colaboradores (53), en el cual depresión puede contribuir a la patología de la EA, tanto directamente, como indirectamente al reducir la reserva cerebral, y originar la temprana aparición de los síntomas clínicos de demencia. Sin embargo, este modelo, no representa un modelo integrador de todos los mecanismos neurobiológicos comprometidos; de tal manera que en este escenario DIT puede ser sólo un factor de riesgo ante la presencia de otros factores de riesgo establecidos. En este modelo, la DIT está asociada con disfunción del eje hipotálamo-pituitario-adrenal (HPA), lo cual conduce a una producción elevada de glucocorticoide adrenal, así como a inflamación crónica. Existen dos vías potencialmente independientes, a través de la cual depresión puede conducir a un riesgo incrementado para EA, o para incidencia de EA. En la primera vía, la disfunción del eje HPA puede contribuir directamente a la patología EA. En la segunda vía, la disfunción del eje HPA con la consecutiva hipercortisolemia puede producir episodios repetidos que conduce a apoptosis de los receptores hipocampales de cortisol, originando atrofia del hipocampo. Además, una tercera vía de este modelo compromete inflamación crónica, que conduce a isquemia, especialmente en las vías fronto-estriatales. De esta manera, la combinación de atrofia hipocampal, isquemia generalizada y disfunción frontoestriatal disminuyen la reserva cerebral, la cual en un contexto de neuropatología subyacente de EA, acelera la presentación clínica de demencia (Figura 1).
Revisión de meta-análisis de los estudios de depresión como factor de riesgo de enfermedad de Alzheimer
Depresión de inicio tardío y riesgo de demencia
A la fecha de revisión de publicaciones en Pub-med para la realización de este artículo (30 Julio del 2014), se han desarrollado 17 estudios de investigación que evalúan la relación entre DIT y demencia, de los cuales 12 fueron prospectivos, 2 fueron de corte transversal y 3 estudios de meta-análisis. De los 12 estudios prospectivos, 6 de ellos encontraron sólida evidencia de riesgo de incremento (2 a 5 veces) para desarrollar demencia en pacientes con DIT (54) y dos de ellos, no encontraron efecto de la depresión sobre el riesgo de demencia (55,56), sin embargo el estudio de Becker (55) presentó un pequeño tamaño de muestra y el de Lindsay (56), midió depresión con un cuestionario auto-administrado. El estudio longitudinal más largo que evalúa la relación depresión y demencia es de 17 años, y los investigadores reportaron un riesgo de 70% de incremento en el riesgo para desarrollar demencia en individuos con depresión (57). Sin embargo, los periodos de seguimiento y significancia estadística son muy variables. Por ejemplo, un estudio reportó que una historia de depresión incrementó el riesgo de desarrollar EA (en 2 veces) a los 2 años de la evaluación basal, pero la asociación no fue observada a los 5 años del seguimiento (58). Por el contrario, otro estudio encontró asociación significativa a los 5 años de seguimiento (59), y otro estudio no encontró asociación significativa entre depresión y demencia a los 9 años de seguimiento (55). Respecto al supuesto de que depresión es un factor de riesgo para demencia, un estudio encontró que el riesgo de demencia en un registro de pacientes con EA fue aproximadamente el doble cuando la depresión precedió al inicio de EA por más de 10 años; no obstante, cuando la depresión se desarrolló antes de los 10 años del inicio de EA, no fue un factor de riesgo significativo (60). Por otro lado, un estudio realizado en una muestra de gemelos encontró resultados contrarios, en el cual la tasa de riesgo para EA declinó en tanto el intervalo entre el inicio de la depresión y el inicio de la EA se incrementó (61). Peor aún, en otro estudio, la historia de depresión no fue un factor de riesgo para EA en una gran muestra basada en población, respecto del momento del inicio (56). En el meta-análisis de Silva y colaboradores (62), la mayor severidad de los síntomas depresivos en la evaluación basal estuvo asociado con elevado riesgo de desarrollar demencia y EA. Además, en un estudio de cohortes en Dinamarca, se demostró que existe una relación directa entre el número de episodios depresivos y el riesgo de desarrollar demencia, siendo significativo, cuando se compara individuos con un episodio depresivo y comparado con aquellos que tienen más de 4 episodios (HR=6,16 CI 95% 1.39–27,22) (63). Por otro lado, un estudio reportó que el tiempo de duración de los síntomas depresivos no fue predictivo de EA (OR = 1,01, 95% CI 0,88–1,15) o demencia (OR = 1,04, 95% CI 0,97–1,11) (64).
Se ha notado que ciertos grupos de individuos con depresión pueden tener un riesgo incrementado para desarrollar demencia. Los hombres, y no las mujeres con síntomas depresivos tuvieron 4 veces riesgo de desarrollar demencia en un periodo de seguimiento longitudinal de 8 años (65). Otro estudio, demostró que individuos con DIT con más de 8 años de educación, tuvieron 4 veces riesgo de desarrollar EA durante un periodo de seguimiento de 4 años, comparado con aquellos sin depresión (66). Estos estudios sugieren que DIT puede ser un síntoma precoz o subclínico de demencia, y que es más evidente en ciertos grupos que en el futuro desarrollarán EA.
Los resultados de los estudios transversales son conflictivos; pues uno de los estudios reportó que individuos con depresión tienen 20% y 40% de probabilidades de ser diagnosticados en el futuro con DV y EA respectivamente. Mientras que el otro estudio, mostró una asociación marginal entre depresión y todas las causas de demencia (54). Si bien es cierto, dos estudios de meta-análisis concluyeron que la depresión incrementa en 2 veces el riesgo de desarrollar demencia, la mayoría de los estudios fueron realizados antes del año 2000 y los efectos no son sólidos en los estudios individuales (54,64). Es lógico suponer que las inconsistencias podrían ser atribuibles a diferencias metodológicas (por ejemplo tamaño de muestra, definición y operacionalización de depresión), razones culturales (estudios realizados en USA, Canadá, Israel, Holanda, Francia, Dinamarca, Turquia, China y Reino Unido) o diferentes subpoblaciones (veteranos, clérigos, japoneses-americanos). Además, en los estudios transversales, no podemos precisar si depresión o síntomas depresivos representan la fase prodrómica de la demencia, una consecuencia del inicio de EA, o es un factor de riesgo para demencia.
Depresión de inicio precoz y riesgo de demencia
Se ha publicado a la fecha 5 estudios que evalúan la relación entre de DIP y demencia, de los cuales 4 fueron longitudinales, los cuales sugieren que DIP, así como larga duración y alta frecuencia de episodios están asociados a incremento en 2 a 4 veces el riesgo para desarrollar demencia. El estudio que encontró que DIP incrementa en 4 el riesgo de desarrollar EA, fue un estudio con pocos pacientes (486 pacientes) y corto tiempo de seguimiento (6 años) y además no encontró relación entre DIT y demencia (67). Dal Forno y colaboradores evaluaron longitudinalmente depresión con intervalos de 2, 4 y 6 años antes del inicio de la demencia, con la finalidad de evaluar temporalidad y dirección de la asociación depresión-demencia (68); mientras que Dotson y colaboradores midieron depresión recurrente luego de 5 décadas (69). Los resultados del primer estudio sugieren que la demencia prodrómica no fue la causa de la asociación, debido a que el aumento del doble en el riesgo de la demencia asociada con la depresión permaneció intacta cuando el retardo entre la detección de los síntomas y el diagnóstico de demencia fue ≥ 4años; sin embargo este resultado fue encontrado solo entre hombres (68). El segundo estudio demostró una sólida asociación entre el número de episodios depresivos y el riesgo de demencia tras un seguimiento promedio de 24 años, sugiriendo una relación dosis-dependiente entre episodios depresivos acumulados y riesgo de demencia. Por otro lado, Barnes y colaboradores evaluaron la asociación de DIP con diferentes subtipos de demencia, incluyendo EA y DV, y comparó el riesgo de demencia en individuos con síntomas depresivos en la edad media (40-50 años de edad) y en la edad tardía (≥ 60 años de edad). Ellos concluyeron que los síntomas depresivos en la edad media estuvieron asociados con el riesgo de desarrollar EA y DV. El riesgo de EA fue aproximadamente el doble en individuos deprimidos durante la edad tardía, tanto en forma aislada, como en combinación con los síntomas depresivos de la edad media. Estos hallazgos sugieren que depresión en algún momento de la vida está asociado con mayor riesgo para desarrollar DV, mientras que el riesgo para desarrollar EA es dependiente de DIT (70).
El estudio de corte transversal (caso-control) sugirió que la historia de depresión 25 años antes del inicio de EA se asocia con un aumento de casi el doble de la probabilidad de desarrollar EA; mientras que los síntomas depresivos dentro del primer año antes del inicio de EA fue asociado con un incremento de cinco veces el riesgo de desarrollar EA (71). Pero, en estos hallazgos es inevitable una superposición de sintomatología cuando los síntomas depresivos son evaluados en épocas muy cercanas al diagnóstico de demencia. Además, a pesar de una muestra grande (1935 individuos con EA y 2093 controles) y la capacidad para evaluar múltiples años de depresión antes del inicio de la EA, la exactitud de los resultados puede ser cuestionable, por ejemplo los informantes de pacientes con EA pueden tener cierta tendencia a recordar con cierta claridad los eventos relacionados al inicio de la enfermedad. En resumen, DIP ha demostrado en forma consistente ser un factor de riesgo para demencia, y escasas probabilidades de ser pródromo de demencia. Una fortaleza de estos estudios, a diferencia de los estudios de DIT, es su relativa homogeneidad, 4 de los 5 estudios son de pacientes estadounidenses, todos midieron síntomas depresivos con similares cuestionarios y puntos de corte, y todos tuvieron un tiempo de seguimiento sustancial.
Revisión de los estudios de depresión como pródromo de enfermedad de Alzheimer
Hoy en día, aún existe la controversia respecto a, si depresión es un factor de riesgo para demencia, si es un síntoma temprano de neurodegeneración, o si es una reacción a las deficiencias cognitivas tempranas. Ciertas evidencias sugieren con frecuencia que DIT podría ser pródromo de declinación cognitiva. Algunas observaciones sugieren que algunos tipos de DIT podrían ser manifestaciones tempranas de demencia, como el hecho que algunos episodios depresivos recientes están asociados con una incidencia incrementada de EA (60), o el hecho de que algunos individuos con DIT y compromiso cognitivo transitorio desarrollan EA a los pocos años del inicio de la depression (72,73).
Además, depresión es común en pacientes con EA, sobre todo en estadios leve y moderado de la enfermedad; pero es menos común en EA severa. De hecho, se ha demostrado cambios estructurales cerebrales, como la reducción del flujo sanguíneo cerebral en SPECT (Single-Photon Emission Computed Tomography) y PET (Positron Emission Tomography) a nivel frontal y sistema límbico en pacientes con depresión y demencia (74). En tal sentido, en pacientes con DIT se ha demostrado mayor cantidad de cambios de sustancia blanca y otras anormalidades subcorticales en la IRM cerebral (75). Estas lesiones, denominadas también leucoaraiosis, o enfermedad cerebral de pequeños vasos que reflejan cambios vasculares, se han observado de manera similar en individuos deprimidos y dementes, tanto en EA como en DV (76). Un estudio que realizó seguimiento longitudinal con IRM, reveló que los cambios en el volumen de hiperintensidad de sustancia blanca estuvo significativamente asociado con demencia, especialmente entre el grupo de demencias no Alzheimer (77). Así, este estudio podría sugerir que ciertas lesiones cerebrovasculares en DIT se encuentra asociado con lesiones no Alzheimer. Por otro lado, estudios de neuroimagenes estructurales han demostrado francas diferencias entre DIP y DIT. Los pacientes con DIT tienen significativamente mayor atrofia del lóbulo temporal medial izquierdo y del núcleo caudado izquierdo que los pacientes con DIP de la misma edad (78). Pacientes con EA y depresión tienen más degeneración neuronal en áreas implicadas en depresión (locus coereleus y núcleo del rafe) comparadas con EA sin depression (79). Los procesos neurodegenerativos como EA, degeneración lobar frontotemporal, enfermedad de Parkinson, o los procesos vasculares como DV pueden iniciar cambios en regiones frontales y límbicas o comprometer las vías serotoninérgicas y nor-adrenérgicas; por lo que estos pacientes con cualquiera de estos desórdenes puede presentar síntomas depresivos en etapas tempranas de la enfermedad. En depresión se ha demostrado niveles reducidos de serotonina y nor-epinefrina y se han convertido en la base para la terapia neurofarmacológica; pero de manera similar, estos cambios en los neurotransmisores también ocurren en demencia, particularmente en EA (80). Así, los síntomas depresivos pueden ser pródromos o síntomas tempranos de ciertas enfermedades neurodegenerativas. Otro indicio a favor de que depresión podría ser pródromo de demencia, son los estudios de seguimiento longitudinal de DCL, en donde depresión incrementa la probabilidad de conversión de DCL a demencia (81), y se refuerza con los estudios de biomarcadores periféricos, en donde los pacientes con DIT sin desorden cardiovascular exhiben un perfil similar que los reportados en pacientes con EA (82): disminución de la concentración plasmática de beta-amiloide 42 (βA42), con el consiguiente incremento de la proporción βA40/βA42. Sin embargo, varios de los estudios muestran que el riesgo de desarrollar demencia no está limitado a DIT. Un meta-análisis encontró que el intervalo entre el diagnóstico de depresión y EA fue positivamente correlacionado con un incremento en el riesgo de desarrollar EA (64). Además, muchos de los estudios prospectivos presentados en la revisión sistemática de Da Silva y colaboradores (62) donde se realizó el análisis de los estudios que incluían puntuaciones basales de depresión, el diagnóstico de depresión estuvo significativamente asociado con riesgo elevado de desarrollar demencia.
Respecto a la hipótesis en la que depresión tiene un alto riesgo para desarrollar demencia debido a la reacción emocional ante la pérdida de las habilidades cognitivas, Wilson y colaboradores (83) re-analizaron los datos de una cohorte usada para estudiar síntomas depresivos y el riesgo de desarrollar DCL o EA y no encontraron un incremento en síntomas depresivos durante la fase pre-clínica de EA. Esto sugiere que la asociación entre síntomas depresivos y el posterior desarrollo de EA no se debe a respuestas reactivas.
Lamentablemente, no existen evidencias inequívocas que relacionen DIT con la patología de la EA. Pues, los primeros cambios patológicos de la EA se inician en etapas muy tempranas de la vida, probablemente alrededor de los 45 años de edad, pero no se ha logrado demostrar que DIP represente esos cambios neuropatológicos. Además, aún ante la evidencia de incremento de cambios patológicos de EA en pacientes con DIT, es más lógico que otras explicaciones tengan más validez que la hipótesis del pródromo. No obstante Rapp y colaboradores (84) encontraron que individuos con EA y una historia de depresión mostraron mayor carga de placas de amiloide y formación de ovillos neurofibrilares a nivel del hipocampo, comparados con individuos con EA sin historia de depresión. Con esto, se podría plantear que depresión puede influir en la patología de la EA, induciendo mayor depósito de carga patológica. Dados estos resultados contradictorios, parece ser que el riesgo de desarrollar demencia asociada a desórdenes depresivos no es exclusivamente explicado por la hipótesis del pródromo.
Por otro lado, la asociación entre DIP y riesgo de desarrollar demencia es más difícil de estudiar, debido a problemas metodológicos, definición retrospectiva de los casos de depresión y la necesidad de un largo periodo de seguimiento. En la revisión de Byers and Yaffe (54) se concluye que la DIP es un consistente factor de riesgo para demencia, pero los resultados para DIT son conflictivos. Mientras que la revisión de Da Silva y colaboradores (62), no soporta completamente dicha perspectiva. Pues, si bien es cierto, los resultados de estudios que evalúan tanto DIP y DIT como factor de riesgo para demencia no son consistentes, esto podría ser explicado por diferencias metodológicas, especialmente con divergencias con respecto a la definición de edad de inicio de la DIT; por lo que no se puede excluir la posibilidad que tanto DIP y DIT están relacionados con un riesgo incrementado para desarrollar demencia.
En conclusión, los investigadores no han logrado resolver la interrogante respecto a sí depresión está más exactamente caracterizado como riesgo o como pródromos de demencia; aunque las evidencias de depresión como factor de riesgo para demencia son más sólidas; sin embargo, el riesgo de desarrollar demencia asociada a desórdenes depresivos no es exclusivamente explicado por la hipótesis del pródromo; pero, la importancia clínica es que ambas condiciones están frecuentemente relacionadas; así la presencia de depresión, particularmente la de inicio tardío deben llamar la atención para realizar una correcta y detallada evaluación del compromiso cognitivo como parte de una medida de cuidados preventivos de largo plazo.
REFERENCIAS BIBLIOGRAFICAS
1. Ferri CP, Prince M, Brayne C, Brodaty H, Fratiglioni L, Ganguli M, et al. Global prevalence of dementia: a Delphi consensus study. Lancet. 2005;366(9503):2112- 2117. [ Links ]
2. Kalaria RN, Maestre GE, Arizaga R, Friedland RP, Galasko D, Hall K, et al. Alzheimers disease and vascular dementia in developing countries: prevalence, management and risk factors. Lancet Neurol. 2008;7(9):812-826. [ Links ]
3. Nitrini R, Bottino C, Albala C, Custodio N, Ketzoian C, Llibre JJ, et al. Prevalence of dementia in Latin American: a collaborative study of population-based cohorts. International Psycogeriatrics. 2009; 21:622- 630. [ Links ]
4. Custodio N, García A, Montesinos R, Escobar J, Bendezú L. Prevalencia de demencia en una población urbana de Lima-Perú: Un estudio puerta a puerta. An Fac med. 2008; 69(4): 233-238. [ Links ]
5. Clarfield AM. The decreasing prevalence of reversible dementias. Arch Intern Med. 2003;163:2219-2229. [ Links ]
6. Barry PP, Moskowitz, MA. The diagnosis of reversible dementia in the elderly: a critical review. Arch Intern Med. 1988;148:1914-1918. [ Links ]
7. Ron MA, Toone BK, Garralda ME, Lishman WA. Diagnostic accuracy in presenile dementia. B J Psych. 1979;134:161-168. [ Links ]
8. García D, Reding MJ, Blass JP. Over-diagnosis of dementia. J Am Geriatr Soc 1981;29(9):407-410. [ Links ]
9. Ardila A, Ostrosky-Solís F, Rosselli M, Gómez C. Age-related cognitive decline during normal ageing: The complex effects of education. Arch Clin Neuropsychol. 2000;15(6):495-513. [ Links ]
10. Jones S, Livner A, Backman L. Patterns of prospective andretrospective memory impairment in preclinical Alzheimers disease.Neuropsychology. 2006;20(2): 144-152. [ Links ]223
11. Sheline YI, Barch DM, Garcia K, Gersing K, Pieper C, Welsh-Bohmer K, et al. Cognitive function in late life depression: relationships to depression severity, cerebrovascular risk factors and processing speed. Biol Psychiatry. 2006; 60:58–65. [ Links ]
12. Bhalla RK, Butters MA, Mulsant BH, Begley AE, Zmuda MD, Schoderbek B, et al. Persistence of neuropsychologic deficits in the remitted state of late- life depression. Am J Geriatr Psychiatry. 2006; 14:419–427. [ Links ]
13. Baune BT, Suslow T, Engelien A, Arolt V, Berger K. The association between depressive mood and cognitive performance in an elderly general population: the MEMO Study. Dement Geriatr Cogn Disord. 2006; 22:142-149. [ Links ]
14. Reding M, Haycox J, Blass J. Depression in patients referred to a dementia clinic: a three-year prospective study. Arch Neurol. 1985; 42: 894-896. [ Links ]
15. Visser PJ, Verhey FR, Ponds RW, Kester A, Jolles J. Distinction between preclinical Alzheimers disease and depression. J Am Geriatr Soc. 2000; 48: 479-484. [ Links ]
16. Contador-Castillo I, Fernandez-Calvo B, Cacho- Gutierrez LJ, Ramos-Campos F, Hernández-Martín L. Depresión en la demencia tipo Alzheimer: Existe algún efecto sobre la memoria?. Rev Neurol. 2009;49:505-10. [ Links ]
17. Bäckman L, Hassing L, Forsell Y, Viitanen M. Episodic remembering in a population-based sample of nonagenarians: does major depression exacerbate the memory deficits seen in Alzheimer disease? Psychol Aging. 1996; 11: 649-57. [ Links ]
18. Rovner B, Broadhead J, Spencer M, Carson K, Folstein M. Depression and Alzheimer disease. Am J Psychiatry. 1989; 146: 350-3. [ Links ]
19. Berger AK, Fahlander K, Wahlin A, Bäckman L. Negligible effects of depression on verbal and spatial performance in Alzheimers disease. Dement Geriatr Cogn Disord. 2002; 13: 1-7. [ Links ]
20. Dubois B, Slachevsky A, Litvan I, Pillon B. The FAB: a Frontal Assessment Battery at bedside. Neurology. 2000; 55: 1621-6. [ Links ]
21. Elliott R. The neuropsychological profile in unipolar depression. Trends Cogn Sci. 1998; 2: 447-54. [ Links ]
22. Zakzanis KK, Leach L, Kaplan E. On the nature and pattern of neurocognitive function in major depressive disorder. Neuropsychiatry Neuropsychol Behav Neurol. 1998; 11: 111-9. [ Links ]
23. Fields JA, Norman S, Straits-Tröster KA, Tröster AI. The impact of depression on memory in neurodegenerative disease. En: Troester AI. (Editor). Memory in neurodegenerative disease: biological, cognitive, andclinical perspectives. New York: Cambridge University Press; 1998.p. 314-37. [ Links ]
24. Burt DB, Zembar MJ, Niederehe G. Depression and memory impairment:a meta-analysis of the association, its pattern, and specificity.Psychol Bull. 1995; 117: 285-305. [ Links ]
25. Strang JM, Donnelly KZ, Grohman K, Kleiner J. Verbal learning and visuomotor attention in Alzheimers disease and geriatric depression.Brain Cogn. 2002; 49: 216-20. [ Links ]
26. OCarroll RE, Conway S, Ryman A, Prentice N. Performance on the delayed word recall test (DWR) fails to differentiate clearly between depression and Alzheimers disease in the elderly. Psychol Med. 1997;27: 967-71. [ Links ]
27. Stokholm J, Vogel A, Gade A, Waldemar G. Heterogeneity in executive impairment in patients with very mild Alzheimer's disease. Dement Geriatr Cogn Disord. 2006; 22: 54-9. [ Links ]
28. Moreno-Martínez FJ, Tallón-Barranco A, Frank- García A. Enfermedad de Alzheimer, deterioro categorial y variables relevantes en la denominación de objetos. Rev Neurol. 2007; 44; 129-33. [ Links ]
29. Diniz BS, Butters MA, Albert SM, Amanda M, Reynolds CR 3rd. Late-life depression and risk of vascular dementia and Alzheimer´s disease: systematic review and meta-analysis of community- based cohort studies. BJP. 2013;202:329-335. [ Links ]
30. Blazer DG. Depression in late life: review and commentary. J Gerontol A Biol Sci Med Sci 2003;58:249. [ Links ]
31. Lyness SA, Eaton EM, Schneider LS. Cognitive performance in older and middle-aged depressed outpatients and controls. J Gerontol. 1994; 49:129 –136. [ Links ]
32. Krishnan KR, Hays JC, Tupler LA, George LK, Blazer DG. Clinical and phenomenological comparisons of late-onset and early-onset depression. Am J Psychiatry. 1995;152:785–788. [ Links ]
33. Krishnan KR, Hays JC, Blazer DG. MRI-defined vascular depression. Am J Psychiatry. 1997;154:497– 501. [ Links ]
34. Alexopoulos GS, Kiosses DN, Klimstra S, Kalayam B, Bruce ML. Clinical presentation of the depression- executive dysfunction syndrome of late life. Am J Geriatr Psychiatry. 2002;10:98 –106. [ Links ]
35. Butters MA, Whyte EM, Nebes RD, Begley AE, Dew MA, Muksant BH, et al. The nature and determinants of neuropsychological functioning in late-life depression. Arch Gen Psychiatry. 2004;61:587–598. [ Links ]
36. Sheline YI, Gado MH, Kraemer HC. Untreated depression and hippocampal volume loss. Am J Psychiatry. 2003;160:1516 –1518. [ Links ]
37. Bell-McGinty S, Butters MA, Meltzer CC, Greer PJ, Reynolds CF 3rd, Becker JT. Brain morphometric abnormalities in geriatric depression: long-term neurobiological effects of illness duration. Am J Psychiatry. 2002;159:1424 –1427. [ Links ]
38. Sapolsky RM. Depression, antidepressants, and the shrinking hippocampus. Proc Natl Acad Sci U S A. 2001;98:12320 –12322. [ Links ]
39. Schweitzer I, Tuckwell V, OBrien J, Ames D. Is late onset depression a prodrome to dementia? Int J Geriatr Psychiatry. 2002;17:997–1005. [ Links ]
40. Krishnan KR, Hays JC, Blazer DG. MRI-defined vascular depression. Am J Psychiatry. 1997;154:497-501. [ Links ]
41. Steffens DC, Helms MJ, Krishnan KR, Burke GL. Cerebrovascular disease and depression symptoms in the Cardiovascular Health Study. Stroke. 1999;30:2159-2166. [ Links ]
42. Alexopoulos GS, Meyers BS, Young RC, Campbell S, Silbersweig D, Charlson M. Vascular depression hypothesis. Arch Gen Psychiatry. 1997;54:915–922. [ Links ]
43. Baldwin RC, OBrien J. Vascular basis of late-onset depressive disorder. Br J Psychiatry. 2002; 180:157– 160. [ Links ]
44. Krishnan KR, McDonald WM, Doraiswamy PM, Tupier LA, Husain M, Boyko OB, et al. Neuroanatomical substrates of depression in the elderly. Eur Arch Psychiatry Clin Neurosci. 1993;243:41-46. [ Links ]
45. Dahabra S, Ashton CH, Bahrainian M, Britton PG, Ferrier IN, McAllister VA, et al. Structural and functional abnormalities in elderly patients clinically recovered from early- and late-onset depression. Biol Psychiatry. 1998;44:34–46. [ Links ]
46. Kramer-Ginsberg E, Greenwald BS, Krishnan KR, Christiansen B, Hu J, Ashtari M, et al. Neuropsychological functioning and MRI signal hyperintensities in geriatric depression. Am J Psychiatry. 1999;156:438–444. [ Links ]
47. Steffens DC, Bosworth HB, Provenzale JM, Mc Fall JR. Subcortical white matter lesions and functional impairment in geriatric depression. Depress Anxiety. 2002;15:23–28. [ Links ]
48. Naarding P, Tiemeier H, Breteler MM, Schoevers RA, Jonker C, Koudstaal PJ, et al. Clinically defined vascular depression in the general population. Psychol Med. 2007; 37:383–392. [ Links ]
49. Sanders ML, Lyness JM, Eberly S, King DA, Caine ED. Cerebrovascular risk factors, executive dysfunction, and depression in older primary care patientsAm J Geriatr Psychiatry. 2006; 14:145-152. [ Links ]
50. Kim J-M, Stewart R, Kim S-W, Yang SJ, Shin IS, Yoon JS. Vascular risk factors and incident late-life depression in a Korean population. Br J Psychiatry. 2006; 189:26–30. [ Links ]
51. Purandare N, Voshaar RCO, Hardicre J, Byrne J, McCollum C, Burns A. Cerebral emboli and depressive symptoms in dementia. Br J Psychiatry. 2006; 189:260–263. [ Links ]
52. Nys GMS, van Zandvoort MJE, van der Worp HB, de Haan EHF, de Kort PLM, Jansen BPW, et al. Early cognitive impairment predicts long-term depressive symptoms and quality of life after stroke. J Neurol Sci. 2006; 247:149–156. [ Links ]
53. Butters MA, Young JB, Lopez O, Aizenstein HJ, Mulsant BH, Reynolds CF 3rd, et al. Pathways linking late-life depression to persistent cognitive impairment and dementia. Dialogues in Clinical Neuroscience. 2008;10(3):345–357. [ Links ]
54. Byers AL, Yaffe K. Depression and risk of developing dementia. Nat Rev Neurol. 2011;7:323-331. [ Links ]
55. Becker JT, Chang YF, Lopez OL,Dew MA, Sweet RA, Barnes D, et al. Depressed mood is not a risk factor for incident dementia in a community-based cohort. Am. J. Geriatr. Psychiatry. 2009:17:653–663. [ Links ]
56. Lindsay J, Laurin D, Verreault R, Hébert R, Helliwell B, Hill GB, et al. Risk factors for Alzheimers disease: a prospective analysis from the Canadian study of health and aging. Am J Epidemiol. 2002;156:445- 453. [ Links ]
57. Saczynski JS, Beiser A, Seshadri S, Auerbach S, Wolf PA, Au R. Depressive symptoms and risk of dementia: the Framingham Heart Study. Neurology. 2010;75:35– 41. [ Links ]
58. Andersen K, Lolk A, Kragh-Sørensen P, Petersen N E, Green A. Depression and the risk of Alzheimer disease. Epidemiology 2005;16:233-238. [ Links ]
59. Gatz JL, Tyas SL, St John P, Montgomery P. Do depressive symptoms predict Alzheimers disease and dementia? J Gerontol A Biol Sci Med Sci. 2005; 60: 744–747. [ Links ]
60. Speck CE, Kukull WA, Brenner DE, Bowen JD, McCormick WC, Teri L, et al. History of depression as a risk factor for Alzheimers disease. Epidemiology. 1995;6:366-369. [ Links ]
61. Steffens DC, Plassman BL, Helms MJ, Welsh- Bohmer KA, Saunders AM, Breitner JC. A twin study of late-onset depression and apolipoprotein E e4 as risk factors for Alzheimers disease. Biol Psychiatry. 1997; 41:851-856. [ Links ]
62. Da Silva J, Goncalves-Pereyra M, Xavier M, Mukaetova-Ladinska EB. Affective disorders and risk of developing dementia: systematic review. BJP. 2013;202:177-186. [ Links ]
63. Kessing L, Andersen PK. Does the risk of developing dementia increase with the number of episodes in patients with depressive disorder and in patients with bipolar disorder? J Neurol Neurosurg Psychiatry. 2004; 75: 1662-6. [ Links ]
64. Ownby RL, Crocco E, Acevedo A, John V, Loewenstein D. Depression and risk for Alzheimer disease: Systematic review, meta-analysis, and metaregression analysis. Archives of General Psychiatry. 2006; 63(5):530–538. [ Links ]
65. Fuhrer R, Dufouil C, Dartigues JF. Exploring sex differences in the relationship between depressive symptoms and dementia incidence: prospective results from the PAQUID Study. J Am Geriatr Soc. 2003;51:1055–1063. [ Links ]
66. Geerlings MI, Schmand B, Braam W, Jonker J, Bouter LM, van Tiburg W. Depressive symptoms and risk of Alzheimers disease in more highly educated older people. J Am Geriatr Soc. 2000:48:1092–1097. [ Links ]
67. Geerlings MI, den Heijer T, Koudstaal PJ, Hofman A, Breteler MM. History of depression, depressive symptoms, and medial temporal lobe atrophy and the risk of Alzheimer disease. Neurology. 2008;70:1258- 1264. [ Links ]
68. Dal Forno G, Palomo MT, Donohue JE, Karagiosis H, Zonderman AB, Kawas CH. Depressive symptoms, sex, and risk for Alzheimers disease. Ann Neurol 2005;57:381-387. [ Links ]
69. Dotson VM, Beydoun MA, Zonderman AB. Recurrent depressive symptoms and the incidence of dementia and mild cognitive impairment. Neurology. 2010;75:27–34. [ Links ]
70. Barnes DE, Yaffe K, Byers AL, McCormick M, Schaefer C, Whitmer RA. Mid-life versus late-life depression and risk of dementia: differential effects for vascular dementia and Alzheimers disease. Arch Gen Psychiatry. 2012;69(5): 493-498. [ Links ]
71. Green RC, Cupples LA, Kurz A, Auerbach S, Go R, Sadovnick R, et al. Depression as a risk factor for Alzheimer disease: the MIRAGE Study. Arch. Neurol. 2003;60:753–759. [ Links ]
72. Alexopoulos G, Young R, Meyers B. Geriatric depression: age of onset and dementia. Biol Psychiatry. 1993;34:141–145. [ Links ]
73. Alexopoulos GS, Meyers BS, Young RC, Mattis S, Kakuma T. The course of geriatric depression with reversible dementia: a controlled study. Am J Psychiatry. 1993;150(11):1693-1999. [ Links ]
74. Mayberg HS. Frontal lobe dysfunction in secondary depression. J Neuropsychiatry Clin Neurosci. 1994;6(4):428-442. [ Links ]
75. Alexopoulos GS, Murphy CF, Gunning-Dixon FM, Latoussakis V, Kanellopoulos D, Klimstra S, et al. Microstructural white matter abnormalities and remission of geriatric depression. Am J Psychiatry 2008;165(2):238-244. [ Links ]
76. Hirono N, Kitagaki H, Kazui H, Hashimoto M, Mori E. Impact of white matter changes on clinical manifestation of Alzeimer´s disease: a quantitative study. Stroke. 2000;31(9):2182-2188. [ Links ]
77. Steffens DC, Potter GG, McQuoid DR, McFall JR, Payne ME, Burke JE, et al. Longitudinal magnetic resonance imaging vascular changes, apolipoprotein E genotipe, and development of dementia in the neurocognitive outcomes of depression in the elderly study. Am J Geriatr Psychiatry. 2007;15(10):839-849. [ Links ]
78. Greenwald BS, Kramer-Ginsberg E, Bogerts B, Ashtari M, Aupperle P, Wu H, et al. Qualitative magnetic resonance imaging findings in geriatric depression. Possible link between later-onset depression and Alzheimer´s disease? Psychol Med. 1997;27(2):421-431. [ Links ]
79. Zubenko GS, Moossy J, Kopp U. Neurochemical correlates of major depression in primary dementia. Arch Neurol 1990;47(2): 209-214. [ Links ]
80. Reinikainen KJ, Soininen H, Riekkinen PJ. Neurotransmitter changes in Alzheimer´s disease: implications to diagnostics and therapy. J Neurosci Res. 1990;27(4):576-586. [ Links ]
81. Panza F, Frisardi V, Capurso C, DIntrono A, Colacicco AM, Imbimbo BP, et al. Late-life depression, mild cognitive impairment, and dementia: possible continuum? Am J Geriatr Psychiatry. 2010; 18: 98-116. [ Links ]
82. Yaffe K, Weston A, Graff-Radford NR, Satterfield S, Simonsick EM, Younkin SG, et al. Association of plasma beta-amyloid level and cognitive reserve with subsequent cognitive decline. JAMA 2011; 305: 261-266. [ Links ]
83. Wilson RS, Arnold SE, Beck TL, Bienias JL, Bennett DA. Change in depressive symptoms during the prodromal phase of Alzheimer disease. Arch Gen Psychiatry. 2008; 65: 439–445. [ Links ]
84. Rapp MA, Schnaider-Beeri M, Grossman HT, Sano M, Perl DP, Purohit DP, et al. Increased hippocampal plaques and tangles in patients with Alzheimer disease with a lifetime history of major depression. Arch Gen Psychiatry. 2006; 63: 161-167. [ Links ]
Conflictos de intereses:
Ninguno.
Correspondencia:
Nilton Custodio.
Unidad de Investigación. Instituto Peruano de Neurociencias.
Bartolomé Herrera 161. Lince.
Teléfono: 51-1-2653834.
Correo electrónico: ncustodio@ipn.pe
Recibido: 05/10/2014
Aceptado: 15/12/2014