Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Neuro-Psiquiatría
versión impresa ISSN 0034-8597
Rev Neuropsiquiatr vol.78 no.1 Lima ene. 2015
Meningoencefalitis tuberculosa en niños. Experiencia en el Instituto Nacional de Salud del Niño de Lima, 2009 – 2013
Meningial Tuberculosis in children. Experience in the Instituto Nacional de Salud del Niño from Lima, 2009-2013
Johnny D. Montiel-Blanco1,2,b,Edgar J. Lázaro-Ignacio2,b, Viviana C. Granados-Alzamora2,a, Pamela R. Muñoz-Huerta2,b, Inés Caro-Kahn2,a, Julio C. Flores-Bravo2,a, Hernán Del Castillo-Barrientos3,c, Nicolás Ramos Timaná2,b, Daniel G. Koc-Gonzales2,a,e.
1 Facultad de Medicina Alberto Hutado, Universidad Peruana Cayetano Heredia. Lima, Perú
2 Servicio de Neuropediatría, Instituto Nacional de Salud del Niño. Lima, Perú
3 Servicio de Neumología, Instituto Nacional de Salud del Niño. Lima, Perú
a Neurólogo pediatra; b médico pediatra, c neumólogo pediatra; d profesor invitado;
e Jefe del servicio.
RESUMEN
Objetivos: Describir las características epidemiológicas, clínicas, de laboratorio y neuroimagen en los niños diagnosticados de meningoencefalitis tuberculosa (MEC TBC) en el Instituto Nacional de Salud del Niño de Lima – Perú. Material y métodos: Estudio retrospectivo y descriptivo de una serie de casos entre enero del 2009 a setiembre del 2013. Resultados: Se seleccionaron 31 casos con diagnóstico de MEC TBC, con una frecuencia de 7,4 casos por año, edad promedio de 7,3 años, la relación varón/ mujer fue 1,2. Los características más frecuentes fueron la desnutrición, el contacto TBC y la TBC pulmonar. Los síntomas más frecuentes fueron la fiebre, vómitos, y somnolencia. El trastorno de la conciencia y el síndrome meníngeo fueron los síndromes neurológicos más comunes. La mayoría ingresaron en estadio II (83,9 %) y egresaron con secuelas mayores (51,6%). Los hallazgos en el líquido cefalorraquídeo (LCR) fueron pleocitosis promedio de 275,6 células /mm3 y mediana de 184 células/mm3 (rango entre 15-1364 células/mm3), el Bacilo de Koch fue aislado por cultivo en el 19,5% de los casos. Los hallazgos más frecuentes de neuroimagen fueron la hidrocefalia (58%), infarto ygranuloma. Seis pacientes con hidrocefaliarequirieron derivación ventricular. Cinco de los pacientes desarrollaron reacción paradójica. La letalidad fue 12,9%.Conclusiones: La incidencia hospitalaria de MEC TBC fue 7,4 casos por año, la mayoría ingresó en estadio IIy egresó con secuelas mayores, en la neuro imagen la hidrocefalia fue el hallazgo más observado, la letalidad fue 12,9%.
PALABRAS CLAVE: Meningoencefalitis, meningitis, tuberculosis, niños, TBC.
SUMMARY
Objectives: To describe clinical, epidemiological, laboratory and neuro imaging characteristics of children with Meningeal Tuberculosis (MEC TBC) at the Instituto Nacional de Salud del Niño, in Lima, Peru. Methods: Retrospective, descriptive case series from January 2009 to September 2013. Results: 31 cases with MEC TBC were included, with a frequency of 7.4 cases per year. The average age was7.3 years and boy/girl rate was 1.2. The more frequent characteristics were the malnutrition, a positive TBC contact and pulmonary TBC. The most common clinical findings were fever, vomits, altered consciousness and meningeal signs. Most cases were in the II clinical state of the disease (83.9%) and the majority evolved with severe complications (51.6%). The cerebrospinal fluid (CSF) findings showed an average 275.6 cells/mm3 cells and median of 184 cells/mm3 (15-1364 cells/mm3). The Koch bacillus was identified in 19.5 % of the CSF culture. The more frequent imaging findings were hydrocephalus (58%), cerebral infarct and granuloma. Six children with hydrocephalus needed a cerebral peritoneal shunt and five children evolved with a paradoxical reaction. The mortality was 12.9%. Conclusions: The hospital incidence was 7.4 cases per year, most of them came in stage II of the disease and left with major sequela, the hydrocephalus was the most frequent imaging finding and the mortality was 12.9%.
KEY WORDS: Meningoencephalitis, meningitis, tuberculous, children, TBC.
INTRODUCCIÓN
La MEC TBC es la forma extra pulmonar más frecuente de la tuberculosis, presente entre 7,1 y 14,3% de los niños afectados (1-5) y la forma clínica de tuberculosis con peor pronóstico (6). El diagnóstico precoz permite un tratamiento oportuno y evita la progresión clínica o la muerte (7,8).
En el Perú, se han publicado dos trabajos descriptivos de MEC TBC en niños, en 1993 y 1999 (9,10). El primero, fue realizado en el Hospital Nacional Cayetano Heredia donde seleccionaron 70 niños en el periodo de 1982 a 1991, demostrando la ocurrencia de 7 casos por año con una letalidad de 14,3%, siendo los escolares el grupo etario más afectado. El tiempo de compromiso de conciencia fue el factor que determinó el estadio clínico de ingreso y la condición de alta (9).
En 1999, se presentó una serie de casos seleccionados entre el 1984 y 1997, los autores describieron las características clínicas de 685 niños del Instituto Nacional de Salud del Niño y del Hospital Nacional 2 de Mayo, con un promedio de 48,9 casos por año, observándose mayor frecuencia en los últimos años. Se registró una letalidad de 30% (10).
La situación epidemiológica ha cambiado desde entonces, lo cual motiva la realización del presente estudio para describirlas características epidemiológicas, clínicas, de laboratorio y además los hallazgos en la neuroimagen actuales de los niños diagnosticados de MEC TBC.
MATERIAL Y MÉTODOS
El Instituto Nacional de Salud del Niño (INSN), es el centro hospitalario de mayor complejidad de atención pediátrica del Perú, ubicado en la ciudad de Lima, donde se realizó el presente estudio de tipo descriptivo, retrospectivo de una serie de casos hospitalizados con el diagnóstico de meningoencefalitis tuberculosa entre enero del 2009 y setiembre del 2013.
Se incluyeron pacientes menores de 18 años de edad, con clínica de meningoencefalitis subaguda mayor de 7 días y líquido cefalorraquídeo (LCR) inflamatorio, con pleocitosis mayor o igual a 10 células/dl. Se excluyeron los pacientes diagnosticados en otros centros de salud o referidos por alguna complicación.
Los pacientes fueron clasificados por estadios clínicos (3,4,7,11). Estadio I: sintomatología infecciosa inespecífica con fiebre, anorexia, irritabilidad o cefalea, sin signos de compromiso neurológico. Estadio II: signos neurológicos como somnolencia, alteración de nervios craneales (III, VI y VIII principalmente), anisocoria o convulsiones, con o sin signos de hipertensión endocraneana. Estadio III: afectación neurológica grave con estupor o coma.
La condición de alta fue clasificada de acuerdo a los criterios de Kennedy (9). Categoría 1: sin secuelas neurológicas. Categoría 2: nivel mental normal, con secuelas menores. Categoría 3: compromiso del nivel mental, con secuelas mayores (plejías, crisis epilépticas). Categoría 4: fallecido.
La información fue recopilada de las historias clínicas seleccionadas en una ficha de recolección de datos y luego analizada a través de estadística de frecuencias.
RESULTADOS
Se revisaron los registros de los pacientes hospitalizados del INSN, se identificaron 48 casos, no se ubicaron cuatro historias clínicas, y dos casos fueron sólo de granulomas. De los 42 restantes, cuatro se eliminaron por ser casos posibles y siete porque habían sido atendidos en centros que fueron referidos por reacciones adversas farmacológicas al tratamiento anti tuberculoso, o complicaciones como recambio de drenaje ventricular; finalmente se seleccionaron 31 casos.
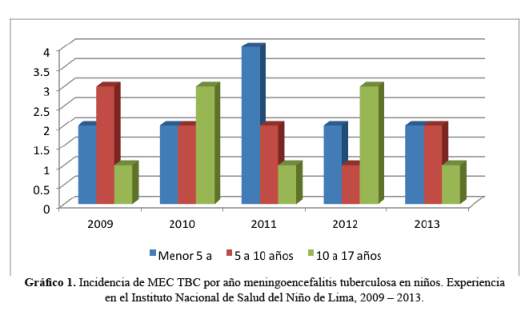
La frecuencia fue 7,4 casos por año (rango de 5 a 9). De los 31 casos seleccionados 9 fueron catalogados como diagnóstico de certeza (cultivo y/o PCR) y 22 con diagnostico probable de MEC TBC según los criterios del consenso diagnóstico de meningitis tuberculosa del 2010 (12); la edad promedio fue de 7,.3 años de edad (rango de 3 meses a 16 años), la relación varón/ mujer fue 1,2. Durante los 5 años estudiados ha variado anualmente el grupo etario prevalente, en el 2009 predominó el grupo de escolares entre 5 y 10 años de edad, y en el 2011 predomino el grupo entre 3 meses y 5 años. En los dos últimos la distribución por edad fue homogénea (Gràfico 1).
La desnutrición (48,4%), el contacto TBC (32,3%) y la TBC pulmonar (32,3%), fueron las características epidemiológicas más frecuentes (tabla 1). Catorce pacientes (45,2%) tuvieron por lo menos dos consultas médicas antes de su hospitalización y recibieron la vacuna de la BCG 21 niños (67,7%).
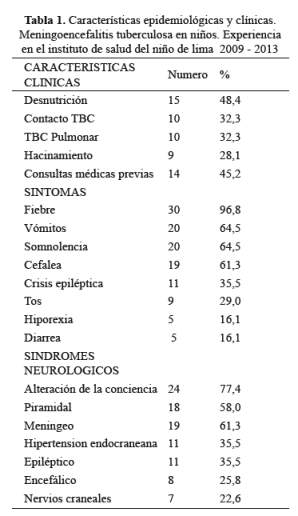
Solo ocurrieron cuatro casos de MEC TBC en lactantes menores de un año, tres de ellos recibieron la vacuna de la BCG y 2 tuvieron antecedente de contacto TBC. Los síntomas más frecuentes al ingreso fueron, fiebre (96,8%), vómitos (64,5%) y somnolencia (64,5%), este último fue el motivo más frecuente de consulta a la emergencia. Solo 11 pacientes presentaron crisis epilépticas a su ingreso (35,5 %). Los síndromes neurológicos más comunes fueron, el trastorno de conciencia (77,4%) y el síndrome meníngeo (61,3%), solo 7 niños presentaron compromiso de nervios craneales (23,1%), siendo el III, VI y el VII los nervios craneales afectados (tabla 1).
Ingresaron 26 pacientes en el estadio II (83,9%), y 4 en el estadio III (12,9%), 2 casos del último grupo fallecieron (50%), El único caso que ingreso en estadio I egresó sin complicaciones neurológicas. La mayoría egresaron con secuelas mayores 51,6% (16/31). La letalidad fue de 12,9% (Tabla 2).

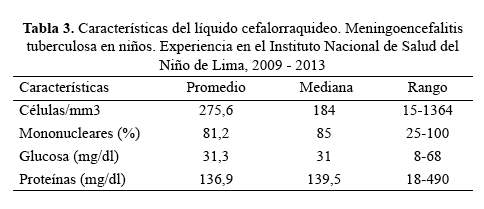
El 67,7% de casos habían recibido PPD, de los cuales 33,3% fueron positivos (más de 10 mm). En el LCR, La pleocitosis promedio fue 275,6 leucocitos/mm3 (15 y 1368 células/dl), la mayoría a predominio mononuclear (Tabla 3).
El Mycobacterum tuberculosis fue aislado en 6 (19,4 %) pacientes, ningún caso fue identificado por la tinción de Ziehl-Neelsen. En 9 casos de cultivos negativos se realizó la prueba de reacción en cadena a la polimerasa (PCR), de ellos 3 fueron positivos.
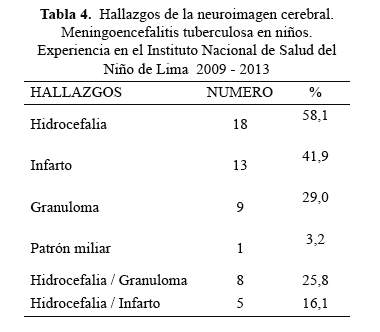
Se realizaron neuroimágenes a todos los casos, tomografía cerebral (TC) en el 100% y la resonancia magnética cerebral en cuatro niños. Los hallazgos más frecuentes fueron: hidrocefalia, infarto y granuloma. Además se observaron en 41,9 % de las imágenes presentación concomitante de hidrocefalia e infarto, e hidrocefalia y granuloma (Tabla 4).
Se describe el caso de un adolescente de 16 años con la forma miliar, que se caracterizó por contacto TBC con 6 semanas de enfermedad progresiva con fiebre, cefalea, diaforesis nocturna, vómitos, irritabilidad, disartria, marcha atáxica y deteriorodel sensorio; el LCR presentó 150 células/mm3, hipoglucorraquia y hiperproteinorraquia; PCR positivo para bacilo TBC, y la RM cerebral mostró lesiones micro nodulares en los hemisferios cerebelosos, protuberancia, y regiones fronto temporales, asociado a isquemia del globo pálido derecho, y captación de contraste de meninges a nivel basal (Figura 1y figura 2). Además cursó con TBC renal. Su condición de alta fue de categoría 3 con hemiparesia derecha y pobre lenguaje expresivo.
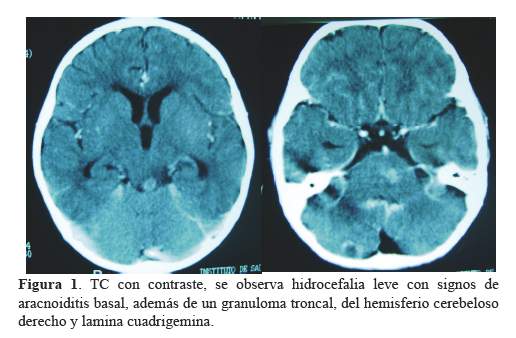
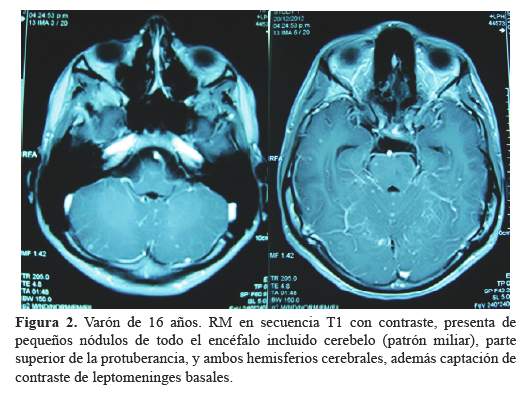
De los 18 pacientes con hidrocefalia (58%), seis requirieron derivación ventricular. Además cinco de los pacientes desarrollaron reacción paradójica entre el mes y los 4 meses del inicio del tratamiento antituberculoso.
DISCUSIÓN
La TBC estuvo presente en el Perú desde la época pre inca (13) y en la actualidad sigue siendo un problema de salud pública, a pesar de la mejora en el programa de control de TBC (14). La MEC TBC, es la forma severa y primera causa de muerte por TBC (7,11,15,16). En el estudio de Castillo del 2005 realizado en el Hospital Nacional Guillermo Almenara, el 8,1% de 161 niños con TBC desarrollaron MEC TBC (17) dentro del rango habitualmente reportado en la literatura entre 7,1 y 14,3% (5,11).
A pesar de una incidencia similar al estudio de 1993, la letalidad descrita en el presente trabajo (12,9%) fue menor, y más aún con el estudio de 1999 (30%), posiblemente por dos razones, posibles casos falsos, MEC subagudas de otras etiologías como viral u otros agentes que pudieran responder al tratamiento antiTBC; o la posibilidad de mejor atención de la etapa aguda en la unidad cuidados intensivos.
Durante los 5 años estudiados a pesar que la edad promedio fue 7,3 años, se observó gran variabilidad, en el 2009 predominó el grupo de los escolares, como los años 80 (9), y en el 2011, predominaronlos menores de 5 años similar a los estudios publicados en Iberoamérica y en la literatura clásica (3,7,18-21); sería importante vigilar esta variable en los próximos años.
La desnutrición y el contacto TBC fueron las 2 características epidemiológicas presentes con menor frecuencia que en el estudio del 1993donde el contacto TBC estuvo presente en 67% diferente al 32,3% actual, siendo más frecuente en los niños menores de 1 año (50%). La desnutrición es uno de los factores que predispone al desarrollo de MEC TBC (7,21).
Ha sido reportado que la vacuna de la BCG podría reducir el riesgo de MEC TBC hasta un 75 a 86% (3), pero no por completo (22). En esta serie la recibieron el 67,7% de los niños comparado con el 60% en 1993, incluso 3 de los 4 lactantes menores de 1 año recibieron la vacuna de la BCG, lo contrario a lo descrito en el estudio de 1993, donde la mayoría de lactantes no lo recibieron, observación débil por el pequeño número de casos de nuestro estudio, otros factores son importantes, como la edad que recibió la vacuna BCG, la desnutrición o inmunodeficiencias asociadas. Contrariamente, Khemir M y col. (5) y Wasay (23) y col. señalaron que la severidad clínica y pronóstico de la MEC TBC es similar entre niños que recibieron la vacuna BCG y los que no lo recibieron.
La mayoría de los casos ingresaron en el estadio II de la enfermedad, similar a otros estudios (3,9,20) incluso recibiendo por lo menos 2 consultas médicas previas a su hospitalización, lo que caracteriza la dificultad diagnóstica de la enfermedad (15), a pesar que la historia natural habitualmente es constante. Solo la tercera parte de casos presentó crisis epilépticas, similar a otro autores (9,15), siendo una característica clínica poco frecuente. Llama la atención que la mayoría (51,6%) egresaron con secuelas mayores, probablemente se trate de una limitante del estudio retrospectivo que no permite valorar el grado de discapacidad.
Sobre los hallazgos en el LCR, se ha observado la triada clásica de pleocitosis, a predominio mononuclear, hipoglucorraquia y proteinorraquia en 24 casos, característica referida en otros estudios (3,8). Además se observó el bajo aislamiento del Bacilo de Koch y ningún caso positivo a la tinción de Ziehl-Neelsen (ZN) en el LCR, estudios previos describen entre 14,4 % y 35,1% de cultivos positivos y 3,5% a 10% positivos a la tinción de ZN (3,7,10,24,25). Es posible incrementar la identificación del bacilo de Koch con mayor volumen y concentrando la muestra de LCR (7,15). En algunos casos del estudio el diagnostico se reforzó con resultados positivos del cultivo o tinción ZN de muestras de esputo, aspirado gástrico, lavado bronquio alveolar o ganglionar.
Se realizó la PCR para Mycobacterium tuberculosis en el LCR de 9 pacientes y tres resultaron positivos cuyo cultivo fue negativo, lo cual ayudó a confirmar MEC TBC, no se puede señalar otras afirmaciones porque fueron pocas pruebas de PCR. Según la literatura utilizando el cultivo positivo como estándar de oro, el PCR en LCR tiene una sensibilidad de 82,4%, especificidad de 75,9%, con un valor predictivo positivo (VPP) de 85,7% y un valor predictivo negativo (VPN) de 71%. Necesitamos pruebas que confirmen la MEC TBC en estadio temprano para asegurar el tratamiento precoz y mejor pronóstico (9,15); recientemente se utilizan cultivos en medios líquidos (BACT, MODS) con resultados en 1 a 3 semanas, con mayor rendimiento que el clásico cultivo de Lowenstein Jenssen (15,26).
Los hallazgos de neuroimagen más frecuentes fueron la hidrocefalia, el infarto cerebral yel granuloma; y cerca del 40% mostraron en forma concomitante por lo menos 2 de los hallazgos descritos, información similar pero en menor frecuencia que otros estudios, (4,7,27). Es infrecuente el hallazgo de granulomas como sucedió en nuestro estudio (29%), siendo descrito en 16,8 % de 202 niños con MEC TBC en un hospital de Sudafrica entre los años 1985 y 1994 por Ravesnscroft (28). La neuroimagen resulta una herramienta para el diagnóstico de MEC TBC, considerado en los actuales criterios diagnósticos (12).
Siendo la resonancia magnética la técnica que muestra mayores hallazgos en forma precoz e incluso patrones como la TBC miliar (29) que no identificamos con la TC, constituye el método de elección para el estudio de MEC TBC (15,30).
Se describe el término de TBC miliar del sistema nervioso central al hallazgo por neuroimagen de micronódulos (menores de 2 mm) hiperintensos en T2, descrito por Docampo et al (29) forma atribuible a la difusión hematógena encefálica a tener en cuenta entre los hallazgos de resonancia magnética.
De los pacientes con hidrocefalia, que es la complicación más común de la MEC TBC (31), menos del 40% necesitaron drenaje ventricular, menor porcentaje que otras publicaciones (3,27,22,24,32).
Se define la reacción paradójica al deterioro clínico y/o radiológico, de grado variable, de lesiones tuberculosas preexistentes, o el desarrollo de nuevas lesiones, en un paciente que mejora inicialmente con la terapéutica antituberculosa (6,33,34), casos observados en nuestro estudio.
Las limitaciones de este estudio fueron el tamaño reducido de la población, el menor número de casos confirmados, la falta de PCR para Mycobacterium tuberculosis a todos los pacientes, y casos con datos insuficientes en las historias clínicas, variables que deberían considerarse en la realización de futuros estudios prospectivos. Tampoco se registraron el número de pacientes que requirieron hospitalización en la unidad de cuidados intensivos.
La incidencia hospitalaria de la MEC TBC fue 7,4 casos por año, la desnutrición, el contacto TBC y la TBC pulmonar, fueron las características más frecuentes; los hallazgos del LCR fueron pleocitosis moderada (276,3), hipoglucorraquia e hiperproteinorraquia, la mayoría ingreso en estadio II y con secuelas mayores, la hidrocefalia se observó en el 58% y la letalidad fue 12,9%.
REFERENCIAS BIBLIOGRAFICAS
1. Van Toorn R, Solomons R. Update on the diagnosis and management of tuberculous meningitis in children. Semin Pediatr Neurol. 2014; 21(1):12-18. [ Links ]
2. Bejarano N, Zarallo L, Cardesa J. Meningitis tuberculosa: Revisión epidemiológica y clínica de los pacientes ingresados en el Hospital M-Infantil de Badajoz, durante los últimos 15 años. Vox paediatrica. 2008; 16 (1): 14-17. [ Links ]
3. Jordán A, Tagarro A, Baquero F. Meningitis tuberculosa: revisión de 27 años. An Pediatr (Barc). 2005; 62(3):215-220. [ Links ]
4. Farinha NJ, Razali KA, Holzel H, Morgan G, Novelli VM. Tuberculosis of the central nervous system in children: A 20 years survey. J Infect. 2000; 41:61-8. [ Links ]
5. Khemiri M, Bagais A, Ben S, et al. Tuberculous meningitis in bacille Calmette-Guerin-vaccinated Children: Clinical Spectrum and Outcome. J Child Neurol. 2012; 27: 741-746 [ Links ]
6. González N, Alvarez S. Reacción paradojal en meningitis tuberculosa: Presentación de un caso. Arch Argent Pediatr. 2014; 112(6): e252-e256. [ Links ]
7. Solarte RA, Cabrera D, Cornejo W. Meningoencefalitis tuberculosa en niños: Revisión de 35 casos en el Hospital Universitario San Vicente de Paúl en Medellín, Colombia 1997-2004. Iatreia. 2005; 18 (4):385-395. [ Links ]
8. Moghtaderi A, Alavi-Naini R, Izadi S, Cuevas L. Diagnostic risk factors to differentiate tuberculous and acute bacterial meningitis. Scand J Infect Dis. 2009; 41: 188-194. [ Links ]
9. Guillén D, Campos P, Hernández H, Chaparro E. Meningoencefalitis tuberculosa en niños: Diez años de experiencia en el Hospital Nacional Cayetano Heredia. Rev Med Hered. 1993; 4(4): 182-187. [ Links ]
10. Jeri RF, Castañeda MA, Yalan F, Heinicke H. Tuberculosis del sistema nervioso observaciones sobre 1360 pacientes estudiados en tres centros asistenciales en Lima. Rev Neuropsiquiatr. 1999; 62: 28-50. [ Links ]
11. Fernandes AR, Favoreto A, Machado AM, Cruz A, Aloe M, Penna C. Tuberculosis del sistema nervioso central: aspectos clínicos y tomográficos. Rev Neurol. 2006; 43 (5):314-316. [ Links ]
12. Marais S, Thwaites G, Schoeman JF, et al. Tuberculous meningitis: a uniform case definition for use in clinical research. Lancet Infect Dis. 2010; 10 (11): 803-812. [ Links ]
13. Gómez J, Mendonça SMF. Prehistoric Tuberculosis in America: Adding comments to a literature review. Mem Inst Oswaldo Cruz (Rio de Janeiro). 2003; 98(S1): 151-159. [ Links ]
14. Bonilla CA, Jave O, Cortez Y, Aylas R, Quispe E, Chavez AM. Estrategia sanitaria nacional de prevención y control de la tuberculosis. Lima: Ministerio de Salud; 2006. p.16-44. [ Links ]
15. Lasso M. Meningitis tuberculosa: claves para su diagnóstico y propuestas terapéuticas. Rev Chil Infect. 2011; 28 (3): 238-247. [ Links ]
16. Shah I. Steroid therapy in children with tuberculous meningitis. Scand J Infect Dis. 2009; 41 (6): 532-534. [ Links ]
17. Castillo VA. Valor diagnóstico de los criterios de Stegen modificado por Toledo en la tuberculosis infantil en el Hospital Nacional Guillermo Almenara Irigoyen. Rev peru Pediatr. 2005; 30:39. [ Links ]
18. Bell W, McCornick W. Neurologic infections in children. Second Edition. Philadelphia: Sounders; 1981. p.188-209. [ Links ]
19. Schoeman J, Le Roux, Bezuidenhout PB, Donald P. Intracranial pressure monitoring in tuberculous meningitis: Clinical and computerized tomographic correlation. Developmental Medicine & Child Neurology. 1985;27: 644-654. [ Links ]
20. Darnaud R, Prieto V, Sequeira MD. Meningitis tuberculosa en menores de 5 años en la Argentina. Medicina (Buenos Aires). 2006; 66:119-124. [ Links ]
21. Orozco I, Nesbitt C, Gonzáles S. Tuberculosis en pediatría: epidemiología. Rev Enfermed Infec Pediatr. 2009; 22 (87): 83-90. [ Links ]
22. Kelekc S, Karabel M, Karabel D, et al. Bacillus Calmette-Guerin is a preventive factor in mortality of childhood tuberculous meningitis. Int J Infect Dis. 2014; 21:1-4. [ Links ]
23. Wasay M, Ajmal S, Taqui AM, et al. Impact of bacilli Calmette-Guérin vaccination on neuroradiological manifestations of pediatric tuberculous meningitis. J Child Neurol. 2010; 25(5):581-586. [ Links ]
24. Chiang SS, Khan FA, Milstein MB, Tolman AW, Benedetti A, Starke JR, et al. Treatment outcomes of childhood tuberculous meningitis: a systematic review and meta-analysis. Lancet Infect Dis. 2014; 14(10):947-957. [ Links ]
25. Wu XR, Yin QQ, Jiao AX, Xu BP, Sun L, Jiao WW, et al. Pediatric tuberculosis at Beijing Childrens Hospital: 2002-2010. Pediatrics. 2012; 130(6):1433- 1440. [ Links ]
26. Cornejo JW, Perez JC. Meningitis tuberculosa en niños: una revisión de aspectos clínicos, de laboratorio, epidemiológicos y terapéuticos y de la utilidad de la vacunación con BCG. Iatreia. 2010; 23 (3): 250-258. [ Links ]
27. Raut T, Garg RK, Jain A, et al. Hydrocephalus in tuberculous meningitis: Incidence, its predictive factors and impact on the prognosis. J Infec. 2013; 66(4):330-337. [ Links ]
28. Ravenscroft A, Schoeman JF, Donald PR. Tuberculous granulomas in childhood tuberculous meningitis: radiological features and course. J Trop Pediatr. 2001;47(1):5-12. [ Links ]
29. Docampo J, Mariluis C, Gonzáles N, Morales C, Bruno C. Neurotuberculosis: Hallagos intracraneanos en RM. RAR. 2012; 76 (2):151-159. [ Links ]
30. Lammie GA, Hewlett RH, Schoeman JF, Donald PR. Tuberculous cerebrovascular disease: a review. J Infec. 2009;59(3):156-166. [ Links ]
31. Srikantha U, Mora J B, Sastry S, et al.Outcome of ventriculo peritoneals hunt placement in grade IV tubercular meningitis with hydrocephalus: a retrospective eanalysis in 95 patients. J Neurosurg Pediatrics. 2009; 4: 176-183. [ Links ]
32. Ramzan A, Nayil K, Asimi R, Wani A, Makhdoomi R, Jain A. Childhood tubercular meningitis: An institutional experience and analysis of predictors of outcome. Pediatr Neurol. 2013; 48(1):30-35. [ Links ]
33. Prakash G, Rajendra B, Hemaratnan A, et al. Paradoxical progression of tuberculous lesions during chemotherapy of central nervous system tuberculosis. J Neurosurg. 1995; 83:359-362. [ Links ]
34. Das A, Das SK, Mandal A, Halder AK. Cerebral tuberculoma as a manifestation of paradoxical reaction in patients with pulmonary and extrapulmonary tuberculosis. J Neurosci Rural Pract. 2012;3(3):350-354. [ Links ]
Correspondencia:
Johnny Montiel Blanco
Correo electrónico: johmontielblanco@gmail.com
Agradecimiento: Al Dr. Daniel Guillén por sus recomendaciones en la realización del presente estudio.
Recibido: 01/12/2014
Aceptado: 24/03/2015














