Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Neuro-Psiquiatría
versão impressa ISSN 0034-8597
Rev Neuropsiquiatr vol.79 no.3 Lima jul. 2016
ARTÍCULO DE REVISIÓN
Nuevos términos clínicos, prevención y tratamiento del trastorno cognitivo vascular:revisión de literatura basada en la evidencia.
New clinical terms, prevention and treatment of vascular cognitive impairment: A review of evidence-based literature.
Nilton Custodio1,2, Rosa Montesinos1,3, Carlos Alva-Diaz4,5, Koni Mejía-Rojas4, Yahaira Becerra-Becerra5,6, David Lira1,2.
1 Unidad de Diagnóstico de Deterioro Cognitivo y Prevención de Demencia, Instituto Peruano de Neurociencias. Lima, Perú.
2 Servicio de Neurología, Instituto Peruano de Neurociencias. Lima, Perú.
3 Servicio de Medicina de Rehabilitación, Instituto Peruano de Neurociencias. Lima, Perú.
4 Servicio de Neurología, Hospital Nacional Daniel Alcides Carrión. Callao, Perú.
5 Red de Eficacia Clinica y Sanitaria (REDECS). Lima, Perú.
6 Servicio de Geriatría, Instituto Peruano de Neurociencias. Lima, Perú.
RESUMEN
El trastorno cognitivo vascular agrupa todas las instancias donde el compromiso cognitivo puede ser atribuido a enfermedad vascular cerebral, es mayor que el esperado para el envejecimiento normal y que, cuando llega a afectar las actividades de la vida diaria, se denomina demencia vascular. En esta revisión, se actualizan los términos relacionados a trastorno cognitivo vascular y se plantean estrategias de prevención y tratamiento basadas en revisiones sistemáticas y meta-análisis. En la primera parte se definen diversos términos relacionados a trastorno cognitivo vascular; en la segunda, se plantea el tratamiento del trastorno cognitivo vascular/demencia vascular, que incluye un manejo orientado a prevención primaria, controlando los factores de riesgo; un tratamiento secundario para prevenir la exacerbación o la extensión de las lesiones producidas por la injuria vascular cerebral y, finalmente, un tratamiento terciario o sintomático de los problemas cognitivos y/o conductuales. Damos especial énfasis y se fundamenta la conveniencia y beneficios de los tratamientos primario y secundario.
PALABRAS CLAVE: Demencia, demencia vascular, prevención primaria, prevención secundaria, prevención terciaria, tratamiento. (Fuente: DeCS BIREME).
SUMMARY
Vascular cognitive impairment is a label ascribed to cases in which the cognitive impairment can be attributed to cerebral vascular disease, is greater than the expected for normal aging and, when affecting the activities of daily life, is called vascular dementia. In this review, the terms related to vascular cognitive impairment, are updated, and strategies for prevention and treatment, based on systematic reviews and meta-analyses are outlined. In the first part,various vascular cognitive impairment-related terms are defined; in the second part, the treatment of vascular cognitive impairment / vascular dementia is described: it includes, management steps oriented towards primary prevention,controlling risk factors; a secondary treatment aimed at the prevention of exacerbation or extension of lesions produced by the vascular brain injuries and, finally, the tertiary or symptomatic treatment of cognitive and/or behavioral manifestations. Special emphasis is placed on, and the convenience and benefits of the primary and secondary treatments are substantiated.
KEYWORDS: Dementia, vascular dementia, primary prevention, secondary prevention, tertiary prevention, treatment.(Source: MeSH NLM).
INTRODUCCIÓN
El diagnostico de demencia vascular (DV) en un paciente con antecedentes de hipertensión, diabetes y tabaquismo que presenta síntomas cognitivos y conductuales luego de un infarto cerebral suele ser de fácil diagnóstico; pero, existen otras condiciones, menos evidentes como los infartos lacunares y lesión de sustancia blanca (LSB) que pueden generar inicialmente deterioro cognitivo sin demencia. En la actualidad, se tiene clara la secuencia de pasos hasta la aparición de síntomas de demencia: Se inicia con la aparición de los factores de riesgo vascular (FRV), los cuales generan enfermedad vascular cerebral (EVC), como arterioloesclerosis, ateroesclerosis y angiopatía amiloide; que a su vez, origina injuria vascular cerebral (IVC), resumidas en enfermedad de grandes arterias y de pequeñas arterias, las cuales, según su localización generaran diversos tipos de compromiso cognitivo, pasando por el trastorno cognitivo vascular (TCV) hasta llegar a DV (Figura 1) (1-3).
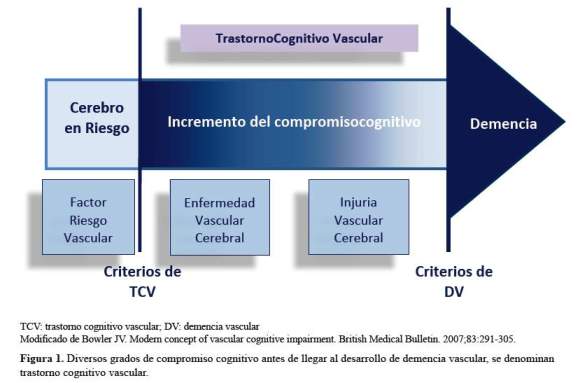
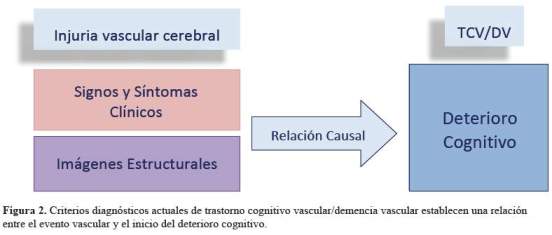
El TCV agrupa todas las instancias donde el compromiso cognitivo puede ser atribuido a EVC y éste es mayor a lo esperado para el envejecimiento normal; pero, que aún no afecta las actividades de la vida diaria. Mientras, que DV vendría a estar localizada al final del TCV, donde el compromiso cognitivo es lo suficientemente severo para interferir con el funcionamiento social y ocupacional (4). Por otro lado, DV puede iniciar con deficiencia del control ejecutivo (y no, con el trastorno de la memoria, como sucede habitualmente en la enfermedad de Alzheimer-EA) que luego, afecta otras áreas cognitivas, para finalmente originar pérdida de las actividades de vida diaria instrumentales, sin necesidad de evidencia clínica de lesión neurológica focal y que en imágenes por resonancia magnética (IRM) de cerebro, se evidencia por lo menos algunas lesiones de sustancia blanca (LSB), pudiendo ésta ser focal o difusa, con o sin infarto evidente (5,6). En el nuevo enfoque, DV estaría al final de una serie de sucesos originados por los FRV, de tal manera, que un adecuado control de ellos, disminuirá la carga tanto de TCV, como de DV. Tradicionalmente EA y DV han sido reconocidas como las dos formas más prevalentes de demencia de inicio tardío. La combinación de patología tipo EA y vascular se denomina demencia mixta (DM) y habitualmente se considera la tercera causa de demencia; aunque en algunos reportes con estudios basados en comunidad puede alcanzar el segundo lugar (3). El diagnóstico actual de EA para propósitos de investigación requiere evidencia de 1) depósito de amiloide según la autopsia, bajas concentraciones de ß-amiloideen líquido cefalo raquídeo (LCR), o depósito de ß-amiloide en tomografía por emisión de positrones (TEP) y 2) neuro-degeneración por autopsia, altas concentraciones de Tau fosforilado (taup) en LCR, y patrón de atrofia tipo EA en las imágenes estructurales (7-9). Sin embargo, en la práctica clínica habitual los bio-marcadores amiloide y tau no son requeridos para el diagnóstico. Mientras que en los criterios actuales de TCV/DV (2), se busca establecer una clara relación causal entre el evento vascular (pudiendo ser clínico o por imágenes cerebrales) o entre la severidad y patrón del deterioro cognitivo con la presencia de EVC subcortical o difusa (Figura 2). En esta revisión, vamos a actualizar los diversos términos relacionados a trastorno cognitivo vascular, y plantear sus principales estrategias de prevención y tratamiento basados en revisiones sistemáticas y meta-análisis.
Definición de términos relacionados
Demencia: El Manual diagnóstico y estadístico de las enfermedades mentales (DSM) de la Asociación Americana de Psiquiatría (APA) en su quinta versión (DSM-V) introduce el concepto de ‘trastorno neurocognitivo’, que ocupa el lugar de los ‘trastornos mentales orgánicos’ de ediciones anteriores. Así, los trastornos neurocognitivos se dividirán en tres categorías: delirium, trastorno neurocognitivo menor (para referirse a deterioro cognitivo leve) y trastorno neurocognitivo mayor, el cual conocemos como demencia. El trastorno neurocognitivo mayor y el menor se diferencian en función de la intensidad de los síntomas y su repercusión en la funcionalidad del paciente. Los criterios diagnósticos de trastorno neurocognitivo mayor requieren la evidencia de un declive cognitivo sustancial desde un nivel previo de mayor desempeño en uno o másde los dominios cognitivos referidos como preocupación del individuo, de un tercero informado o del facultativo con respecto a un declive sustancial en las funciones cognitivas; declive en el desempeño neuropsicológico, implicando un desempeño en las pruebas cognitivas del rango de dos o más desviaciones estándares por debajo de lo esperado en la evaluación neuropsicológica reglada o ante una evaluación clínica equivalente; que interfieran con la independencia y que no ocurran exclusivamente en el contexto de delirium (10).
Demencia pre-senil y demencia senil: Definen el deterioro cognitivo según la edad de presentación de los síntomas; así demencia presenil o demencia de inicio temprano, se manifiesta antes de los 65 años de edad; mientras que demencia senil o demencia de inicio tardío, se presenta en individuos = 65 años de edad. Llamamos la atención para evitar el uso de estos términos (pre-senil y senil), pues presupone erróneamente que las personas de la tercera edad tienen un deterioro cognitivo asociado a edad, el cual puede ser parte de la evolución cognitiva de la edad; pero excluye la posibilidad de realizar una exhaustiva evaluación para definir la etiología de la demencia (11).
Demencia tipo Alzheimer: El profesor McKhan en 2011 planteó una puesta al día de los criterios del National Institute of Neurological and Communicative Disorders and Stroke and the Alzheimer’s Disease and Related Disorders Association (NINCDS-ARDRA) de1984 de su misma autoría. Esta propuesta surge del trabajo conjunto de grupos pertenecientes al National Institute of Aging estadounidense (NIA) y la Alzheimer’s Association (AA) (9). Los criterios de demencia debido a EA probable exigen el cumplimiento estricto de los criterios nucleares (el cuadro clínico presenta un inicio insidioso, historia clara de un empeoramiento cognitivo progresivo referido u observado y el déficit inicial y más prominente puede seguir un patrón de presentación amnésico-acompañado de afectación en al menos otro dominio cognitivo, o no amnésico-trastorno del lenguaje, trastorno visuo-perceptivo o disfunción ejecutiva) y, además, la ausencia de evidencia de enfermedad cerebrovascular, demencia por cuerpos de Lewy, demencia frontotemporal en todas sus variables o de otras enfermedades, o consumo de sustancias que puedan afectar a la cognición de forma sustancial. Estos criterios del NIA-AA permiten agregar el término “con evidencia de procesos fisiopatológicos de EA” en caso de que sea posible realizar un estudio de bio-marcadores. Este es el caso cuando, a una demencia debida a EA posible o probable, se le puede añadir la presencia de bio-marcadores, tales como: evidencia de depósito de ß-amiloide (puesto de manifiesto a través de datos como niveles bajos de proteína Aß42 en líquido cefalo-raquídeo o amiloide positivo en tomografía por emisión de positrones-PET), evidencia de lesión o degeneración neuronal descendente (como la presencia de niveles incrementados de proteínas tau total y tau fosforilada en liquido cefalorraquideo), captación disminuida de fluorodeoxiglucosa en la corteza parieto-temporal en estudios de PET, o atrofia desproporcionada en los lóbulos temporal medio, basal y lateral y en el lóbulo parietal medio en imágenes por resonancia magnética (IRM). Por último, se empleará el término “demencia debida a EA fisiopatológicamente probada” cuando se cumplen criterios clínicos y anatomo-patológicos de EA. El término “demencia improbablemente debida a EA” se aplicará cuando el proceso no cumple criterios de EA, cuando existe suficiente evidencia de otro diagnostico neurodegenerativo, de origen médico o por sustancias, o ante un estudio de bio-marcadores negativo para la EA.
Demencia Vascular: Basados en los conservadores criterios del National Institute of Neurological Disorders and Stroke-Association Internationale pour la Recherche et l’Enseignement en Neurosciences (NINDS-AIREN)(12), era necesario demostrar evidencia de compromiso de la memoria y al menos dos otras áreas cognitivas, además de evidencia de lesión vascular cerebral (signos neurológicos focales e infartos/lesión de sustancia blanca en las imágenes cerebrales) y que el inicio de la demencia se presente dentro de los 3 meses de producido el ictus cerebral; sin embargo la gran limitación de dicha clasificación era la disfunción de memoria como principal característica, la cual sólo se presenta en estadios avanzados. En el contexto actual, DV puede ser definida como deficiencia del control ejecutivo que origina pérdida de la función de las actividades de vida diaria instrumentales, sin necesidad de evidencia clínica de lesión neurológica focal y con por lo menos alguna evidencia de lesión de sustancia blanca, pudiendo esta ser focal o difusa, con o sin infarto (2). Los criterios diagnósticos de DV incluyen: declinación de las funciones cognitivas con evidencia de un deterioro previo o una variación en las evaluaciones basales previas en más de 2 dominios cognitivos lo suficientemente severos para afectar las actividades de la vida diaria (AVD); que esté basado en pruebas cognitivas y al menos cuatro dominios evaluados: funciones ejecutivas/atención, lenguaje, memoria y funciones visuo-espaciales; y que los déficits de las AVDs sean independientes de las secuelas motoras/sensoriales del evento vascular. Para el diagnóstico de DV probable se busca establecer una clara relación entre el evento vascular y el inicio del deterioro cognitivo, o una clara relación entre la severidad y el patrón del deterioro cognitivo con la presencia de EVC subcortical o difusa, con ausencia de deterioro cognitivo gradual y progresivo antes o después de la EVC. En el nuevo enfoque, DV es un término arbitrario y tardío en la evolución de la EVC, que estaría al final del continuum de una serie de sucesos originados por los factores de riesgo vascular cerebral.
Trastorno cognitivo vascular: Agrupa todas las instancias donde el compromiso cognitivo puede ser atribuido a EVC y éste es mayor a lo esperado para el envejecimiento normal; mientras que DV vendría a ser el estadio final del TCV,donde el compromiso cognitivo es lo suficientemente severo para interferir con el funcionamiento social y ocupacional(2-4). El énfasis en definir TCV es llamar la atención en la prevención y tratamiento oportuno. El TCV es un síndrome o fenotipo causado por EVC. A diferencia de EA, TCV no es por sí mismo una enfermedad, es un conjunto de síndromes que representan una IVC, y además la EVC en la mayoría de casos progresa a DV, mientras que EA invariablemente progresa hacia demencia de la EA. TCV se origina con la aparición de los factores de riesgo vascular, los cuales generan EVC y luego IVC, el cual según su localización genera diversos tipos de compromiso cognitivo (Figura 3).
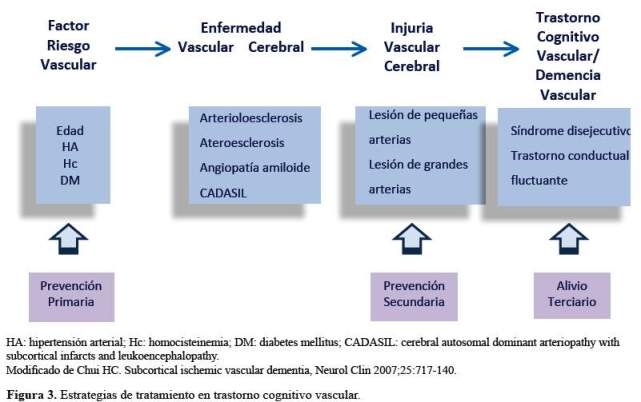
Factores de riesgo vascular: Son todos los factores de riesgo que han demostrado influir en el deterioro cognitivo de los individuos expuestos a un determinado factor. El grueso de las evidencias confirma las correlaciones entre edad (13), hipertensión arterial (14,15), hiperhomocisteinemia (16,17), e hiperseñales de sustancia blanca, conocidas también como hiperintensidades de sustancia blanca o LSB en IRM (18,19). El control efectivo de la presión arterial (PA) entre sujetos hipertensos parece disminuir la tasa de progresión de lesiones de sustancia blanca(15). De la misma manera diabetes parece ser un factor de riesgo para EA y atrofia progresiva de sustancia gris, pero no hay datos claros sobre su rol en TCV (20,21).
Enfermedad vascular cerebral: Son las lesiones vasculares que generan IVC e incluyen arterioloesclerosis, ateroesclerosis, angiopatiaamiloide y CADASIL (Cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy) (1,3,22). La arterioloesclerosis es un término patológico referido a degeneración hialina del musculo liso de arteriolas pequeñas (600 a 900 µ de diámetro). La ateroesclerosis está referida a una lesión inflamatoria iniciada por el depósito de colesterol que compromete la capa íntima de arterias que contienen lámina elástica interna. La angiopatíaamiloide cerebralcomprende un grupo de desórdenes, caracterizada por depósito de proteínas amiloidogénicas en la pared de los vasos sanguíneos cerebrales. Las proteínas depositadas pueden diferir ampliamente en la secuencia de aminoácidos, pero su conformación estructural es similar al Beta-amiloide.CADASIL es un desorden genético que afecta al gen Notch 3 y afecta las arterias pequeñas del cerebro. En la IRM se observa LSB con predilección del polo temporal, capsula externa, y cuerpo calloso, el cual es un patrón distintivo de la LSB de origen hipertensivo (1,3,13,14).
Injuria vascular cerebral: Hace referencia a la lesión cerebral ocasionada por la EVC, la cual va a depender del tamaño de la arteria comprometida, por lo tanto tendremos lesión de grandes arterias y lesiones de pequeñas arterias. En el primer caso, puede ocasionar oclusión total y tendremos un infarto, con un cuadro clínico deficitario, generalmente motor; que en el curso de los meses, puede evolucionar hacia un cuadro clínico de deterioro cognitivo, que se conoce como demencia pos-ictus (o demencia post-ictus). En el caso de la IVC ocasionada por lesión de pequeñas arterias tenemos dos probables escenarios, que terminan en los clásicos síndromes de estado lacunar y síndrome de Binswanger, dependiendo de la oclusión completa o incompleta de la arteria (1,3,13,14).
Tratamiento del trastorno cognitivo vascular/demencia vascular
El tratamiento puede ser dividido en prevención primaria (es decir, prevenir la presentación de EVC, a través del control de los factores de riesgo), tratamiento secundario (es decir, prevenir la exacerbación o la extensión de las lesiones producidas por IVC) y tratamiento terciario (referido al tratamiento sintomático de los problemas cognitivos y/o conductuales, y que algunos autores, la mencionan como el “alivio terciario”, en clara alusión al hecho de que no se produce ninguna mejoría del cuadro clínico de fondo) (1,11,22). En el enfoque actual, se pone especial énfasis al tratamiento primario y secundario, debido a la incorporación y reconocimiento del término TCV; a diferencia de lo que sucedía mucho tiempo atrás, cuando solo nos enfocábamos al tratamiento sintomático conductual de la DV (realmente, se trata de una intervención tardía), es decir el control de los síntomas psicológicos y conductuales, principalmente los psicóticos que se presentan en etapas muy avanzadas de la enfermedad, sin afectar la evolución progresiva de la enfermedad.
Prevención primaria en TCV
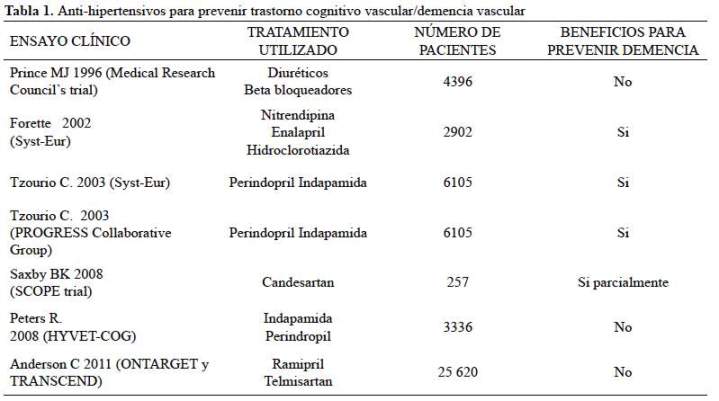
Anti-hipertensivos y el trastorno cognitivo vascular En prevención primaria, los estudios longitudinales sugieren una asociación entre el tratamiento antihipertensivo y la reducción en el riesgo de deterioro cognitivo y EA. No obstante,las discrepancias surgen por la población heterogénea, la duración del tratamiento, o las propiedades neuro-específicas de los agentes anti-hipertensivos (23), estas dudas pueden ser resueltas en parte por los ensayos clínicos controlados (Randomized Controlled Trial: RCT). En ese sentido, varios estudios de meta-análisis de RCTs han sido publicados, también con resultados diversos (24-28). Cuando los resultados del HYVET (Hypertension in the Very Elderly Trial; 3336 hipertensos [PAS: 160-200, PAD<110 mmHg] mayores de 80 años de edad, recibieron un diurético-indapamida con posible adición de un Inhibidor de la Enzima Convertidora de Angiotensina-IECA [perindopril vs placebo]) son combinados en un meta-análisis con otros tres ensayos clínicos controlados con placebo de tratamiento antihipertensivo que evalúa demencia incidente: Syst-Eur (Systolic Hypertension in Europe; 2418 hipertensos sistólicos recibieron un antagonista de los canales de calcio-ACC, nitrendipino con la posible adición de un IECA-enalapril, diurético- hidroclorotiazida, o ambos vs placebo); PROGRESS (Perindopril Protection Agains Recurrent Stroke Study; 6105 sujetos con Ataque Isquémico Transitorio-AIT o ictus previo recibieron un IECA- perindopril, con posible adición de un diurético-indapamida vs placebo); y el SHEP (Systolic Hypertension in the Elderly Program; 4736 hipertensos sistólicos de edad promedio 72 años recibieron un diurético-clortalidona con posible adición de un beta-bloqueador-atenolol, o bloqueador del sistema nervioso simpático -reserpina vs placebo) el riesgo de demencia incidente fue menor levemente significativo, alcanzando un riesgo relativo de 0,87 (95% CI 0.76–1.00; p=0.045)(24); mientras que los meta-análisis previos habían sido inconclusos(25,26). Posteriormente una revisión Cochrane encontró resultados no significativos en términos de prevención de demencia (HR (95%CI)=0,89 (0,74-1,07)). Los estudios evaluados incluyeron el HYVET, SCOPE (Study on Cognition and Prognosis in the Elderly; 4964 hipertensos mayores de 70 años de edad, sin demencia,recibieron un antagonista de los receptores de angiotensina (ARA)-candesartan con posible adición de un diurético-hidroclorotiazida), SHEP y el SYST-EUR. A pesar de los resultados, una mejoría significativa en el MMSE fue encontrada en el grupo bajo tratamiento, comparado con el grupo bajo placebo (diferencia media (95%CI)=0,42 (0,30-0,53))(27). Los mecanismos que pueden explicar el beneficio del tratamiento anti-hipertensivo involucran tanto a la disminución de la presión arterial como a los efectos neuroprotectores específicos de los ACC, IECA y ARA. Con estos resultados se proponen RCTs diseñados especialmente para evaluar una relación entre el tratamiento anti-hipertensivo y la declinación cognitiva o demencia, teniendo a la evaluación cognitiva como medida de evaluación primaria. También se plantea que es importante evaluar el umbral de presión arterial baja que podría ser deletérea para la función cognitiva (28).
En otro RCT se probó si el uso de diuréticos o beta bloqueador se asocia a cambios en la función cognitiva durante más de 54 meses de tratamiento en un subconjunto de 2584 personas de 65-74 años de edad de los 4396 participantes que recibieron tratamiento de la hipertensión. No encontraron diferencias en la velocidad de cambio de la puntuación en el tiempo en las pruebas de aprendizaje(PALT) entre los tres tratamientos: -0,33 para diurético (IC95% -0,23 a -0,39), -0.31 para bloqueador beta (-0,25 a -0,41), y -0,30 para placebo (-0,24 a -0,36). Tampoco hubo diferencia en los coeficientes promedios del rendimiento en el TrailMaking Test (29).Tanto en el ensayo clínico ONTARGET y TRANSCEND que probaron los efectos del bloqueo del sistema reninaangiotensina sobre la función cognitiva en pacientes mayores de 55 años con enfermedad cardiovascular aterosclerótica establecida o diabetes, se llegó a la conclusión que no hay efectos claros sobre los resultados cognitivos aunque los pacientes con la presión arterial sistólica más bajo tuvieron mayor preservación de la función cognitiva (30) (tabla 1).
En la revisión sistematica y metanálisis realizado por McGuinness para evaluar si los efectos del tratamiento que disminuyen la presión arterial previenen demencia y deterioro cognitivo en pacientes con hipertensión, pero sin antecedentes de enfermedad cerebrovascular, el resultado combinado de cuatro ensayos mostró que no hubo diferencias significativas entre el tratamiento y el placebo en la incidencia de demencia (OR = 0,89; IC95%: 0,74 - 1,07)(27).
Hipotension y trastorno cognitivo vascular.
Existe preocupación en la magnitud de la disminución de la presión arterial y el potencial compromiso de la perfusión cerebral de áreas sensibles como hipocampo y tálamo, sobre todo en pacientes con enfermedad cerebrovascular. En el estudio de Kähönen-Väre y col., se reportó que tener menores cifras de presión arterial y disfunción ventricular izquierda fueron factores de riesgo para deterioro cognitivo en adultos mayores de 75 años (31). Así mismo, en el estudio de cohorte de Qiu y col. (n = 1270, edades = 75 a 101) se concluyó que tanto los pacientes con PAD muy baja (≤ 65 vs 66-90 mm Hg) como la PAS muy alta(>180 vs 141-180 mm Hg) presentan mayor riesgo de deterioro cognitivo (RR 1,5, IC95%, 1,0-2,1; RR 1,6, IC95%, 1,1-2,2) y EA (RR 1,7; IC95%, 1,1-2,4; RR 1,5, IC95%, 1,0-2,3) (32). Por otro lado, el estudio de Verghese y col. concluyeron que la PAD baja (≤70 mmHg) se asociaba a mayor riesgo de deterioro cognitivo en adultos mayores de 75 años (HR=1,91, IC95%, 1,05-3,48) y este riesgo se incrementaba cuando persistía la PAD baja por más de 2 años (HR 2,19, IC95% 1,27-3,77). Sin embargo en este estudio la PAD baja no se asoció a demencia vascular (33). Otro estudio realizado en individuos de tercera edad (79 ± 5 años) realizado en Italia, sugiere que el control estricto de la PAS afecta negativamente la cognición (medido según variaciones del MMSE) y propone que futuros RCTs deben evaluar los riesgos y beneficios del tratamiento anti-hipertensivo con diferentes objetivos en esta población (34).
Control de diabetes y trastorno cognitivo vascular
Los estudios que evalúan el tratamiento de la diabetes mellitus en relación con la función cognitiva o demencia son limitados. Las guías de la American Heart Association/American Stroke Association (AHA/ASA)para demencia no establecen una clara recomendación en relación al tratamiento de la hiperglucemia y diabetes para prevención de demencia y tan sólo recomiendan un control más estricto de la glicemia para la prevención de complicaciones asociadas (2).En un ensayo aleatorio que comparó dos agentes antidiabéticos orales en 156 pacientes adultos mayores con diabetes se encontró que las glicemias postprandial más altas se asociaron con mayores descensos en las medidas de desempeño cognitivo durante un año de seguimiento (35). Sin embargo, en otro ensayo clínico, se encontró que un valor de HbA1C de uno por ciento más alto se asoció significativamente con un peor rendimiento cognitivo (36).
Hipolipemiantes y trastorno cognitivo vascular
Respecto al rol de las estatinas y los agentes hipolipemiantes para reducir la incidencia o progresión de demencia, sobre todo de EA sólo existen datos a favor en los estudios observacionales y solo un RCT, con resultados rebatibles. Así, un estudio observacional longitudinal realizado en una clínica de memoria en 342 pacientes con EA, mostró que sujetos tratados con estatinas y fibratos tenían una declinación en el puntaje del MMSE más lento (1,5 puntos/año), comparado con los pacientes no tratados (2,4 puntos/año) o con pacientes normo-lipémicos (2,6 puntos/año) (37). Un menor riesgo para EA se encontró en pacientes tratados con estatinas en el estudio MIRAGE, un estudio de casos y controles, basado en familia, realizado en 895 pacientes con EA y 1483 sujetos normales (38). Un estudio aleatorizado, doble ciego, controlado con placebo examinó el efecto de la exposición a un año de la atorvastatina 80 mg/día en individuos con EA leve-moderada. El estudio demostró que atorvastatina produjo una significativa mejoría en la cognición (medido por una escala cognitiva para demencia: ADAScog) y memoria después de 6 meses de tratamiento. Este efecto persistió después de 1 año (39). Por el contrario, estudios basados en comunidad de corte cruzado, como el Cache County Study(40) y el Cardiovascular Health Study(41) no encontraron asociación entre el uso de estatinas y el inicio subsecuente de demencia o EA. Dos estudios aleatorizados, el PROSPER (PROspective Study of Pravastatin in the Elderly at Risk Pravastatin in elderly individuals at risk of vascular disease)(42) y el HPS (Heart protection Study) (43) analizaron pravastatina y simvastatina respectivamente, y ambos fallaron para demostrar algún efecto significativo sobre la performance cognitiva. También en otro estudio con 4316 pacientes mayores de 65 años, Reitz y colaboradores reportaron que existe una débil relación entre los niveles de colesterol no HDL-C, LDL-C y HDL-C y el riesgo de demencia vascular. Sin embargo concluyeron que no habría asociación entre el riesgo de AD y los niveles de lípidos y el uso de agentes para disminuirlos (44).Finalmente una revisión sistematizada, no encontró alguna evidencia para recomendar el uso de las estatinas para la prevención de EA(45).
Disminución de homocisteína
Los niveles elevados de homocisteína son un factor de riesgo para la enfermedad vascular y podría asociarse con el riesgo de demencia, siendo el mecanismo potencial, la alteración de la función endotelial. En ese sentido, el tratamiento con ácido fólico y vitamina B-12 disminuyó las concentraciones de homocisteína en pacientes de tercera edad con enfermedad vascular, sin embargo estos resultados no se asociaron con beneficios estadísticamente significativos sobre la función cognitiva en el corto o medio plazo (46).
Hábitos de vida saludable
Los resultados del estudio Whitehall II (Reino Unido) realizado en 5123 hombres y mujeres donde se examinó la asociación de los comportamientos de salud y la cognición durante un período de 17 años se encontró que quienes presentaron un mayor número de conductas poco saludables (de 1 a 4, de tabaquismo, abstinencia de alcohol, escasa actividad física, y bajo consumo de frutas y verduras) eran más propensos a tener un menor desempeño en la función ejecutiva y la memoria. Estos resultados presentaron un incremento desde la fase 1 (OR = 1,84, IC95%: 1.27 – 2.65), la fase 5 (OR = 2,38, IC95%: 1,76 – 3,22) y la fase 7 (OR = 2,76, IC95%: 2,04 – 3,73). Se concluye que el número de conductas no saludables y su duración se asocian con el deterioro de la función cognitiva (47).
Prevención secundaria en TCV/DV
Anti-agregación plaquetaria y trastorno cognitivo vascular
El tratamiento secundario de TCV está orientado a la prevención de recurrencia de un ictus o de ataque isquémico transitorio (AIT), es decir en individuos que ya tienen IVC y por lo tanto, tienen mayor riesgo de deterioro cognitivo. En este sentido, en el tratamiento farmacológico para reducir el número de recaídas después del primer ictus, no hay mucho que discutir y, está bien establecido e incluye adecuado manejo de la presión arterial, anti-tromboticos, warfarina y otros para la fibrilación auricular y endarterectomia carotidea. En el Perindopril Protection Against Recurrent Stroke Study (PROGRESS), 6105 sujetos quienes tenían un ictus o AIT previo fueron randomizados para recibir perindopril con o sin indapamida vs placebo y seguidos longitudinalmente por 3.9 años. El grupo bajo tratamiento mostró una reducción de 19% en el RR vs placebo en la medición cognitiva, evaluada según el MMSE, y un 43% de reducción en nuevas LSB, no obstante la diferencia no alcanzo significancia estadística(8/89 [9,0%] versus 16/103 [15,5%], respectivamente; P=0,17)(48). Sin embargo, hasta el momento, la probabilidad que la prevención de ictus recurrente sea capaz de prevenir declinación cognitiva permanece en un abierto debate; no hay lugar a dudas que la reducción de ictus juega un rol clave en la disminución del riesgo de demencia (tanto DV y DM), por lo que se puede inferir que las drogas anti-plaquetarias probablemente reducen el riesgo de declinación cognitiva. No existe otro antiagregante plaquetario superior en eficacia a aspirina, el cual reduce el riesgo de un nuevo ictus en 20 a 30%, no obstante los eventos adversos son mayores en el grupo que recibe aspirina comparado con ticlopidina y clopidogrel (49). A pesar que la eficacia del tratamiento anti-trombótico en prevención de ictus ha sido bien documentada, su rol en prevención de declinación cognitiva aún no ha sido probada (50). Un estudio prospectivo de 3809 individuos mayores de 65 años de edad seguidos longitudinalmente a 3 y 6 años falló para demostrar algún efecto estadístico significativo de la aspirina en prevenir algún tipo de demencia(51). Pero, otros dos estudios mostraron que aspirina, warfarina o la combinación de ambos pueden prevenir declinación cognitiva(52,53).De la misma manera, otro ensayo clínico con 3350 pacientes mayores de 50 años no se encontró diferencias en los puntajes medios de las pruebas cognitivas (32,7% y 34,8%, OR: 0,91, IC95%,0,79 a 1,05, P = 0.20). Se concluyó que dosis bajas de aspirina (100 mg por día) no afecta la función cognitiva de personas de edad avanzada con mayor riesgo cardiovascular (54). También en el análisis secundario del ensayo SPS3 donde se valoró si la reducción de la presión arterial y el tratamiento anti-plaquetario dual afectaban la función cognitiva en pacientes con enfermedad de pequeño vaso cerebral mediante el instrumento CASI (del inglés, Cognitive Abilities Screening Instrument) tampoco se encontraron diferencias entre los grupos asignados a tratamientos anti-plaquetarios (p = 0,858). Dicho estudio concluye que la función cognitiva no se ve afectada por el tratamiento anti-plaquetario doble en pacientes relativamente jóvenes con infarto lacunar de reciente presentación (55). Se recomienda que los futuros estudios de función cognitiva después de un evento cerebrovascular isquémicotengan una duración más larga o centrarse en pacientes con mayores índices de deterioro cognitivo (55).
Tratamiento terciario en demencia vascular
Las revisiones sistemáticas (RS) de RCTs para evaluar eficacia y/o seguridad de otros medicamentos distintos a inhibidores de acetil-colinesterasa (IChE) o memantina para el tratamiento de los síntomas cognitivos de DV, incluyendo citicolina (56), vitamina E, vitamina B12, ácido fólico, ginkgo biloba, nicergolina, nimodipino, hidergina e indometacina (57), no han demostrado eficacia en la mejoría o estabilidad de las escalas de medición propuestas, por el contario los riesgos de su uso en muchos casos es superior. En ese sentido, los RCTs sugieren que vitamina E (dosis total de 2000 UI dividida en dos dosis por 24 meses), nimodipino (90/180 mg/día por 12 a 26 semanas), ácido fólico (2 a 15 mg/día por 1 a 3 meses) e indometacina (100 a 150 mg/día por 6 meses) incrementan el riesgo de eventos adversos y no ofrecen ningún beneficio. Por otro lado, existe evidencia insuficiente de los RCTs para determinar si vitamina B12 (10/50/1000 mcg/día por 1 a 5 meses), nicergolina (40 a 60 mg/día por 4 a 104 semanas) e hidergina (1,5 a 7,5 mg/día por 9 a 60 semanas) ofrecen beneficios que superen cualquier riesgo de eventos adversos. Una RS de 33 RCTs de ginkgo biloba (80 a 600 mg/día por 3 a 52 semanas) comparado con placebo en 3278 pacientes con demencia (58), y otro ECC con 123 participantes aleatorizados para ginkgo biloba(160 a 240 mg/día) o placebo (59) sugieren que el beneficio es superado por los riesgos de eventos adversos, principalmente la posibilidad de hemorragia. Sin embargo, debido a la falta de uniformidad en la medición de evaluación de cognición es difícil determinar la importancia de su beneficio clínico.
Suponiendo que existe una superposición entre las anormalidades neuropatológicas y neuroquímicas de EA y DV sobre todo en la afectación del sistema colinérgico y partiendo del supuesto que se produce una interrupción de los circuitos pre-frontales subcorticales (cabeza del núcleo caudado, globus pallidus, tálamo anterior/dorso medial, rodilla de cápsula interna, centro semi-oval anterior, brazo anterior de cápsula interna y corteza pre-frontal),particularmente en la DV del tipo isquémico subcortical (60); es lógico suponer que restableciendo la transmisión colinérgica a través de los IChEs se podría ofrecer una mejoría en los síntomas cognitivos y conductuales. Sin embargo,este supuesto no ha logrado ser demostrado en los casos puros de DV, aunque sí se ha observado en los casos de EA y casos de DM (61). Uno de los primeros estudios de galantamina en un grupo de pacientes con DV pura y DM mostró un pequeño beneficio cognitivo (62). Sin embargo, estudios con mejor diseño y de mayor tiempo de seguimiento (6 meses) en pacientes con DV según criterios de NINDS-AIREN para probar eficacia de galantamina, donepezilo y rivastigmina mostraron resultados mixtos (63-67) (Tabla 2). Muchos estudios han mostrado pequeños pero significativos de los IChEs sobre cognición, la magnitud de este efecto ha sido leve (cerca de 2 puntos en la escala VADAScog,aproximadamente la mitad del beneficio de lo observado en los estudios de pacientes con EA), mientras que los beneficios en el funcionamiento global, actividades de vida diaria y síntomas conductuales no han sido demostrados consistentemente. Al igual que con IChEs, dos RCTs de tratamiento por 6 meses con memantina (68,69) reportan un pequeño pero significativo beneficio sobre la cognición, sin afectar las mediciones de funcionamiento global. De la misma manera, un metaanálisis de ambos estudios soportan estas conclusiones (70). Debido a esto, las agencias regulatorias y las guías de asociaciones especializadas concluyen que los IChEs y memantina no deben ser usados en pacientes con DV (1).
CONCLUSIONES
El TCV es un conjunto de síndromes que se inician con la aparición de los factores de riesgo vascular, los cuales indefectiblemente generan enfermedad vascular cerebral, que con el paso de los años,originarán injuria vascular cerebral, resumidas en enfermedad de grandes arterias y de pequeñas arterias; las cuales, según su localización generarán diversos tipos de compromiso cognitivo, principalmente de tipo ejecutivo; y cuando afecta las actividades de diaria se denomina demencia vascular. Se ha planteado que un adecuado control de los factores de riesgo vascular se podría disminuir la carga de TCV y DV. En prevención primaria, debido a problemas metodológicos y falta de precisión en la medición de los resultados, los meta-análisis y revisiones sistemáticas de anti-hipertensivos han sido inconsistentes; pero han demostradouna leve disminución del riesgo de incidencia de demencia. A la fecha, aún existen datos insuficientes para demostrar que controles adecuados de la hiperglicemia y diabetes disminuyen el riesgo de demencia incidente. No existe evidencia alguna para recomendar estatinas en la prevención de demencia. Mientras que en prevención secundaria, a pesar que la eficacia del tratamiento anti-trombótico en prevención de ictus ha sido bien documentada, su rol en prevención de declinación cognitiva aún no ha sido probada. Para el manejo sintomático de demencia vascular establecida, los inhibidores de colinesterasa y memantina sólo han demostrado beneficios leves en el funcionamiento cognitivo.
REFERENCIAS BIBLIOGRÁFICAS
1. OBrien JT, Thomas A. Vascular dementia. Lancet Neurol. 2015;386:1698-1706. [ Links ]
2. Gorelick PB, Scuteri A, Black SE, De-Carli C,Greenberg SM, Iadecola C, et al. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the American heart association/American strokeassociation. Stroke. 2011; 42:2672-2713. [ Links ]
3. Chui HC, Ramirez-Gomez L. Clinical and imaging features of mixed Alzheimer and vascular pathologies. Alzheimers Res Ther 2015;1:21. DOI:10.1186/s13195-015-0104-7. [ Links ]
4. Gorelick PB, Counts SE, Nyenhuis D. Vascular cognitive impairment and dementia. Biochim Biophys Acta. 2016;1862(5):860-868. DOI:10.1016/j.bbadis.2015.12.015. [ Links ]
5. Iadecola C. Pathobiology of vascular dementia.Neuron. 2013; 80:844-866. [ Links ]
6. Sudo FK, Alves GS, Tiel C, Ericeira-Valente L,Moreira DM, Laks J, et al. Neuroimaging criteria and cognitive performance in vascular mild cognitive impairment. Dement Neuropsychol. 2015;9(4):394-404. [ Links ]
7. Sperling RA, Aisen PS, Beckett LA, Bennett DA,Craft S, Fagan AM, et al. Toward defining the preclinical stages of Alzheimer-s disease: recommendations from the National Institute on Aging-Alzheimers Association workgroups on diagnostic guidelines for Alzheimers disease. Alzheimers Dement. 2011;7: 280-292. [ Links ]
8. Albert MS, DeKosky ST, Dickson D, Dubois B, Feldman HH, Fox NC, et al. The diagnosis of mild cognitive impairment due to Alzheimer-s disease: recommendations from the National Institute on Aging-Alzheimers Association workgroups on diagnostic guidelines for Alzheimer-s disease. Alzheimers Dement. 2011;7:270-279. [ Links ]
9. McKhann GM, Knopman DS, Chertkow H, Hyman BT, Jack CR, Kawas CH, et al. The diagnosis of dementia due to Alzheimer-s disease: recommendations from the National Institute on Aging-Alzheimers Association workgroups on diagnostic guidelines for Alzheimer-s disease. Alzheimers Dement. 2011;7:263–269. [ Links ]
10. Asociacion Americana de Psiquiatria. Manual diagnóstico y estadístico de los trastornos mentales. Madrid: Panamericana; 2014.
11. Custodio N, Lira D, Montesinos R, Bendezú L, Escobar J, Cortijo P. La importancia de reconocer el trastorno cognitivo vascular y su rol en la prevención de demencia vascular. Interciencia. 2011;2(1):11-23. [ Links ]
12. Roman GC, Tatemichi TK, Erkinjuntti T,Cummings JL, Masdeu JC, Garcia JH, et al. Vascular dementia: diagnostic criteria for research studies: Report of the NINDS-AIREN International Workshop. Neurology. 1993; 43:250–260. [ Links ]
13. Breteler MM, van den Ouweland FA, Grobbee DE, Hofman A. A community-based study of dementia:the Rotterdam Elderly Study. Neuroepidemiology. 1992; 11(S1):23–8. [ Links ]
14. Launer LJ, Ross GW, Petrovitch H, Masaki K, Foley D, White LR, et al. Midlife blood pressure and dementia: the Honolulu-Asia aging study. Neurobiol Aging. 2000;21:49-55. [ Links ]
15. Skoog I, Lernfelt B, Landahl S, Palmertz B, Andreasson LA, Nilsson L, et al. 15-year longitudinal study of blood pressure and dementia. Lancet. 1996;347:1141-5. [ Links ]
16. Morris MS, Jacques PF, Rosenberg IH, Selhub J. Hyperhomocysteinemia associated with poor recall in the third National Health and Nutrition Examination Survey. Am J Clin Nutr. 2001;73: 927-33. [ Links ]
17. Duron E, Hanon O. Vascular risk factors, cognitive decline, and dementia. Vasc Health Risk Manag. 2008; 4:363-81. [ Links ]
18. Doddy RS, Massman PJ, Mawad M, Nance M. Cognitive consequences of subcortical magnetic resonance imaging changes in Alzheimers disease: comparison to small vessel ischemic vascular dementia. Neuropsychiatry Neuropsychol Behav Neurol. 1998; 11(4): 191-199. [ Links ]
19. Modrego PJ, Rios C, Perez Trullen JM, Errea JM, García-Gómara MJ, Sanchez S. The cerebrovascular pathology in Alzheimers disease and its influence on clinical variables. Am J Alzheimers Dis Other Demen. 2008; 23(1):91-96. [ Links ]
20. Leibson CL, Rocca WA, Hanson VA, Cha R, Kokmen E, OBrien PC, et al. Risk of dementia among persons with diabetes mellitus: a population- based cohort study. Am J Epidemiol. 1997; 145:301-308. [ Links ]
21. MacKnight C, Rockwood K, Awalt E, McDowell I. Diabetes mellitus and the risk of dementia,Alzheimer-s disease and vascular cognitive impairment in the Canadian Study of Health and Aging. Dement Geriatr Cogn Disord. 2002;14:77-83. [ Links ]
22. Chui HC, Nielsen-Brown N. Vascular cognitive impairment. Continuum Lifelong Learning Neurol. 2007; 13(2):109-143. [ Links ]
23. Savva GM, Stephan BCM. Epidemiological studies of the effect of stroke on incident dementia: A systematic review. Stroke. 2010; 41: e41-e46. [ Links ]
24. Peters R, Beckett N, Forette F, et al. Incident dementia and blood pressure lowering in the hypertension in the very elderly trial cognitive function assessment (HYVETCOG): a double-blind, placebo controlled trial. Lancet Neurol.2008; 7:683-689. [ Links ]
25. Bellew KM, Pigeon JG, Stang PE, Fleischman W, Gardner RM, Baker WW. Hypertension and the rate of cognitive decline in patients with dementia of the Alzheimer type. Alzheimer Dis Assoc Disord. 2004;18:208-213. [ Links ]
26. Mielke MM, Rosenberg PB, Tschanz J, Cook L, Corcoran C, Hayden KM, et al. Vascular factors predict rate of progression in Alzheimer disease. Neurology. 2007; 69: 1850-1858. [ Links ]
27. McGuinness B, Todd S, Passmore P, Bullock R. Blood pressure lowering in patients without prior cerebrovascular disease for prevention of cognitive impairment and dementia. Cochrane Database Syst Rev. 2009; 2: CD004034. [ Links ]
28. Nagai M, Hoshide S, Kario K. Hypertension and dementia. Am J Hypertens. 2010;23: 116-124. [ Links ]
29. Prince MJ, Bird AS, Blizard RA, Mann AH. Is the cognitive function of older patients affected by antihypertensive treatment? Results from 54 months of the Medical Research Councils trial of hypertension in older adults. BMJ.1996;312(7034):801-805. [ Links ]
30. Anderson C, Teo K, Gao P, Arima H, Dans A, Unger T, et al. Renin-angiotensin system blockade and cognitive function in patients at high risk of cardiovascular disease: analysis of data from the ONTARGET and TRANSCEND studies.The Lancet Neurology. 2011; 10(1): 43-53. [ Links ]
31. Kahonen-Vare M, Brunni-Hakala S, Lindroos M, Pitkala K, Strandberg T, Tilvis R. Left ventricular hypertrophy and blood pressure as predictors of cognitive decline in old age. Aging clinical and experimental research. 2004;16(2):147-152. [ Links ]
32. Qiu C, von Strauss E, Fastbom J, Winblad B, Fratiglioni L. Low blood pressure and risk of dementia in the Kungsholmen project: a 6-year follow-up study. Archives of Neurology. 2003;60(2):223-228. [ Links ]
33. Verghese J, Lipton RB, Hall CB, Kuslansky G, Katz MJ. Low blood pressure and the risk of dementia in very old individuals. Neurology. 2003; 61(12):1667-1672. [ Links ]
34. Mossello E, Pieraccioli M, Nesti N, Bulgaresi M, Lorenzi C, Caleri V, et al. Effects of low blood pressure in cognitively impaired elderly patients treated with antihypertensive drugs. JAMA Intern Med. 2015;175(4):578-585. [ Links ]
35. Abbatecola AM, Rizzo MR, Barbieri M, Grella R, Arciello A, Laieta MT, et al. Postprandial plasma glucose excursions and cognitive functioning in aged type 2 diabetics. Neurology. 2006; 67(2):235-240. [ Links ]
36. Cukierman-Yaffe T, Gerstein HC, Williamson JD, Lazar RM, Lovato L, Miller ME, et al. Relationship between baseline glycemic control and cognitive function in individuals with type 2 diabetes and other cardiovascular risk factors: the action to control cardiovascular risk in diabetes-memory in diabetes (ACCORD-MIND) trial. Diabetes care. 2009;32(2):221-226. [ Links ]
37. Masse I, Bordet R, Deplanque D, Al Khedr A, Richard F, Libersa C, et al. Lipid lowering agents are associated with a slower cognitive decline in Alzheimers disease. J Neurol Neurosurg Psychiatry. 2005; 76: 1624-1629. [ Links ]
38. Green RC, McNagny SE, Jayakumar P, Cupples LA, Benke K, Farrer LA, et al. MIRAGE Study Group Statin use and the risk of Alzheimers disease: The MIRAGE Study. Alzheimers Dement. 2006; 2: 96-103. [ Links ]
39. Sparks DL, Sabbagh M, Connor D, Soares H, Lopez J, Stankovic G, et al. Statintherapy in Alzheimers disease. Acta Neurol Scand. 2006; S185: 78-86. [ Links ]
40. Zandi PP, Sparks DL, Khachaturian AS, et al. Do statins reduce risk of incident dementia and Alzheimer disease? The Cache County Study. Arch Gen Psychiatry. 2005; 62: 217-224. [ Links ]
41. Rea TD, Breitner JC, Psaty BM, Fitzpatrick AL, Lopez OL,Newman AB, et al. Statin use and the risk of incident dementia: the Cardiovascular Health Study. Arch Neurol. 2005; 62:1047-1051. [ Links ]
42. Shepherd J, Blauw GJ, Murphy MB, et al. PROspective Study of Pravastatin in the Elderly at Risk Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomized controlled trial. Lancet. 2002; 360: 1623-1630. [ Links ]
43. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomized placebo-controlled trial. Lancet. 2002;360: 7-22. [ Links ]
44. Reitz C, Tang MX, Luchsinger J, Mayeux R. Relation of plasma lipids to Alzheimer disease and vascular dementia. Arch Neurol. 2004;61(5):705-714. [ Links ]
45. McGuinness B, Craig D, Bullock R, Passmore P. Statins for the prevention of dementia. Cochrane Database Syst Rev. 2009; 2: CD003160. [ Links ]
46. Stott DJ, MacIntosh G, Lowe GD, Rumley A, McMahon AD, Langhorne P, et al. Randomized controlled trial of homocysteine-lowering vitamin treatment in elderly patients with vascular disease. Am J Clin Nutr. 2005;82(6):1320-1326. [ Links ]
47. Sabia S, Nabi H, Kivimaki M, Shipley MJ, Marmot MG, Singh-Manoux A. Health behaviors from early to late midlife as predictors of cognitive function: The Whitehall II study. Am J Epidemiol. 2009;170(4):428-437. [ Links ]
48. Tzourio C, Anderson C, Chapman N, Woodward M, Neal B, MacMahon S, et al. Effectsof blood pressure lowering with perindopril and indapamide therapy on dementia and cognitivedecline in patients with cerebrovascular disease.Arch Intern Med. 2003; 163:1069-1075. [ Links ]
49. Easton JD, Saber JL, Albers GW, Alberts MJ, Chaturvedi S, Feldmann E, et al. Definition and evaluation of transient ischemic attack. Stroke.2009;40:2276-2293. [ Links ]
50. Sorrentino G, Migliaccio R, Bonavita V. Treatment of vascular dementia: The route of prevention. Eur Neurol. 2008;60:217-223. [ Links ]
51. Sturmer T, Glynn RJ, Field TS, Taylor JO, Hennekens CH. Aspirin use and cognitive function in the elderly. Am J Epidemiol. 1996; 143: 683-691. [ Links ]
52. Richards M, Meade TW, Peart S, Brennan PJ, Mann AH. Is there any evidence for a protective effect of antithrombotic medication on cognitive function in men at risk of cardiovascular disease? Some preliminary findings. J Neurol Neurosurg Psychiatry. 1997; 62: 269-272. [ Links ]
53. Meyer JS, Rogers RL, McClintic K, Mortel KF, Lofti J. Randomized clinical trial of daily aspirin therapy in multi-infarct dementia: A pilot study. J Am Geriatr Soc 1989; 37: 549-555. [ Links ]
54. Price JF, Stewart MC, Deary IJ, Murray GD, Sandercock P, Butcher I, et al. Low dose aspirin and cognitive function in middle aged to elderly adults: randomised controlled trial. BMJ. 2008; 337:a1198. [ Links ]
55. Pearce LA, McClure LA, Anderson DC, Jacova C, Sharma M, Hart RG, et al. Effects of long-term blood pressure lowering and dual antiplatelet treatment on cognitive function in patients with recent lacunar stroke: a secondary analysis from the SPS3 randomised trial. Lancet Neurol. 2014;13(12):1177-1185. [ Links ]
56. Fioravanti M, Yanagi M. Cytidinediphosphocholine (CDP-choline) for cognitive and behavioural disturbances associated with chronic cerebral disorders in the elderly. Cochrane Database Syst Rev.2005;2: CD000269. [ Links ]
57. British Psychological Society. Medicines Other than acetylchollinesterase inhibitors/memantine for the treatment of cognitive symptoms of dementia. In: National Collaborating Centre for Mental Health. Dementia: A NICE-SCIE Guideline on supporting people with dementia and their carers in health and social care. Leicester: British Psychological Society; 2007. p. 195-200. [ Links ]
58. Birks J, Grimley-Evans J. Ginkgo Biloba for cognitive impairment and dementia. Cochrane Database Syst Rev. 2002; 4:CD003120. [ Links ]
59. Van-Dongen M, Van-Rossum E, Kessels A, Sielhorst H, Knipschild P. Ginkgo for elderly people with dementia and age-associated memory impairment: a randomized clinical trial. J Clin Epidemiol. 2003;56: 367-376. [ Links ]
60. Dozono K, Ishii N, Nishihara Y, Horie A. An autopsy study of the incidence of lacunes in relation to age, hypertension, and arteriosclerosis. Stroke. 1991; 22:993-996. [ Links ]
61. Perry E, Ziabreva I, Perry R, Aarsland D, Ballard C. Absence of cholinergic deficits in “pure” vascular dementia. Neurology. 2005;64:132–133. [ Links ]
62. Erkinjuntti T, Kurz A, Gauthier S, Bullock R, Lilienfeld S, Damaraju CV. Efficacy of galantamine in probable vascular dementia and Alzheimers disease combined with cerebro vascular disease: a randomised trial. Lancet. 2002;359:1283-1290. [ Links ]
63. Auchus AP, Brashear HR, Salloway S, Korczyn AD, De-Deyn PP, Gassmann-Mayer C, et al. Galantamine treatment of vascular dementia: a randomized trial. Neurology. 2007; 69: 448-458. [ Links ]
64. Black S, Roman GC, Geldmacher DS, et al. Efficacy and tolerability of donepezil in vascular dementia: positive results of a 24-week, multicenter, international, randomized, placebo-controlled clinical trial. Stroke. 2003; 34: 2323-233. [ Links ]
65. Wilkinson D, Doody R, Helme R, et al. Donepezil in vascular dementia: a randomized, placebo controlled study. Neurology.2003; 61:479–486. [ Links ]
66. Román GC, Salloway S, Black SE, Royall DR, De-Carli C, Weiner MW, et al. Randomized, placebo controlled, clinical trial of donepezil in vascular dementia: differential effects by hippocampal size. Stroke. 2010; 41:1213-21. [ Links ]
67. Ballard C, Sauter M, Scheltens P, He Y, Barkhof F,van-Straaten EC, et al. Efficacy, safety and tolerability of rivastigmine capsules in patients with probable vascular dementia: the Vantag study. Curr Med Res Opin. 2008;24:2561-74. [ Links ]
68. Wilcock G, Möbius HJ, Stöffler A. A double-blind,placebo-controlled multicentre study of memantinein mild to moderate vascular dementia (MMM500). Int Clin Psychopharmacol. 2002; 17:297-305. [ Links ]
69. Orgogozo JM, Rigaud AS, Stöffler A, Möbius HJ, Forette F. Efficacy and safety of memantine in patients with mild to moderate vascular dementia: a randomized, placebo-controlled trial(MMM 300). Stroke. 2002; 33:1834-1839. [ Links ]
70. Kavirajan H, Schneider LS. Efficacy and adverse effects of cholinesterase inhibitors and memantine in vascular dementia: a meta-analysis of randomized controlled trials. Lancet Neurol. 2007;6:782-792. [ Links ]
Correspondencia:
Nilton Custodio
Instituto Peruano de Neurociencias
Bartolomé Herrera 161
Lince, Lima, Perú.
Teléfono: 51-1-2653834
Correo electrónico: ncustodio@ipn.pe
Conflicto de intereses: Ninguno
Recibido: 18/08/2016
Aceptado: 19/09/2016













