Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Neuro-Psiquiatría
Print version ISSN 0034-8597
Rev Neuropsiquiatr vol.80 no.2 Lima Apr. 2017
http://dx.doi.org/https://doi.org/10.20453/rnp.v80i2.3094
REPORTES DE CASO
Miastenia gravis de tipo bulbar en niños: un caso de difícil diagnóstico
Bulbar Myasthenia Gravis in children: a case of difficult diagnosis
Rosa Y. Alvarado-Merino 1,a;2, Elizabeth R. Espíritu 1,a;2, Tania Juárez 1,d, Jaime Cok 1,c;2, María C. Ferrufino 1,b;2, Susan K. Samalvides 1,d, Iván O. Espinoza 1,d;2, Judith R. Vila 1,d, Daniel Guillén-Pinto 1,d,e;2.
1 Hospital Nacional Cayetano Heredia. Lima, Perú.
2 Facultad de Medicina Alberto Hurtado, Universidad Peruana Cayetano Heredia. Lima, Perú.
a Residente de Neurología Pediátrica; b Médico Residente Patología; c Patólogo; d Neurólogo Pediatra ; e Jefe del Servicio de Pediatría.
RESUMEN
La miastenia gravis (MG) es un trastorno autoinmune caracterizado por debilidad y fatigabilidad de los músculos esqueléticos debida a la disfunción de la unión neuromuscular. Se presenta el caso de una adolescente de 11 años de edad, con diagnóstico de miastenia gravis de tipo bulbar. La paciente presentó dos crisis de MG previamente diagnosticadas de manera equivocada como crisis asmáticas. Recibió tratamiento con inmunoglobulina humana, corticoides, piridostigmina y timectomía. Se discute la evolución clínica y riesgos atribuibles a situaciones sociales que pueden retrasar el diagnóstico y su manejo efectivo.
PALABRAS CLAVE: Niños, Unión neuromuscular, anticuerpos anti-receptor de acetilcolina, miastenia gravis, timectomía.
SUMMARY
Myasthenia gravis (MG) is an autoimmune disorder characterized by weakness and fatigability of the skeletal muscles due to dysfunction of the neuromuscular junction. We report the case of an 11-year-old girl diagnosed with bulbar myasthenia gravis. The patient had two previous crises of myasthenia gravis erroneously diagnosed as asthma attacks. She received treatment with human immunoglobulin, corticosteroids, pyridostigmine and thymectomy. We discuss the clinical course and the risks attributable to social situations that can delay the diagnosis and its effective management.
KEYWORDS: Children, neuromuscular junction, acetylcholine antireceptor antibodies, myasthenia gravis, thymectomy.
INTRODUCCIÓN
La Miastenia gravis (MG) cuya denominación proviene de: mio músculo, astenia debilidad y gravis intensa, es un trastorno neuromuscular autoinmune caracterizado por debilidad y fatigabilidad de los músculos esqueléticos (1). Fue descrita por primera vez por el médico inglés Sir Thomas Willis en 1672 (2). Se desconoce la incidencia en Perú; sin embargo, los reportes de otros países estiman que se presenta de 50-125 casos por cada millón de habitantes, en el Reino Unido la prevalencia es de 15 casos por 100 000 habitantes (3), de los cuales sólo del 10 al 15% son menores de 16 años (4) siendo más prevalente en mujeres en etapa post-puberal. En la mayoría de los casos, comienza con afectación de los músculos oculares, con diplopía o ptosis palpebral. La debilidad puede permanecer confinada a los músculos oculares, o comprometer la musculatura que controla la masticación, deglución y articulación de la palabra, llamados músculos bulbares; en estos casos puede ser difícil el diagnóstico (5). Cuando la debilidad compromete a la musculatura de las extremidades el diagnóstico es más evidente.
Caso clínico
Paciente mujer de 11 años de edad, se presentó con 15 días de enfermedad, que inicia con debilidad facial tanto que no podía sonreír, y durante los tres primeros días progresa con caída de los parpados y de debilidad del cuello; síntomas que se acentuaban al transcurrir el día. Al cuarto día, aparece dificultad para deglutir líquidos más que los sólidos y menor tono vocal, por este motivo acude a un Centro de Salud donde fue diagnosticada de faringitis y asma, por tanto, le indican amoxicilina, ambroxol, salbutamol y beclometasona. No mejoró. A partir del undécimo día se le notó agotada por las tardes, se agrega dificultad para respirar a medianos esfuerzos, mayor disfonía y disartria. A los 15 días de enfermedad, dificultad respiratoria empeora, y presenta sialorrea excesiva, motivo por el cual fue trasladada a emergencia. Al examen, se le encuentra frecuencia cardíaca 146 latidos por minuto, frecuencia respiratoria 44 por minuto, y saturación de oxígeno en 92%, índice de masa corporal inferior al percentil 3 para la edad, con múltiples tirajes y sibilantes inspiratorios y espiratorios.
En la emergencia fue diagnosticada de crisis asmática severa, nebulizada con salbutamol de acuerdo a protocolo de tratamiento de crisis asmática por tres horas y se le prescribió corticoides por vía endovenosa con aparente mejoría. Horas después, con la evaluación de Neuropediatría, se amplía la información y la familia refiere que el tiempo de enfermedad es de 21 meses.
Durante este tiempo la niña había presentado tres episodios de debilidad, que iniciaban en los músculos de la cara, y se continuaban con disfagia, disartria y dificultad respiratoria hasta por dos semanas. En cada uno de estos episodios había recibido tratamiento con corticoides orales y, en dos ocasiones, había requerido hospitalización en cuidados intensivos, llegando al soporte ventilatorio por insuficiencia respiratoria, siempre con diagnóstico de egreso de crisis asmática severa. Por la hipofonía, había sido evaluada en otorrinolaringología; por la disfagia, en gastroenterología; por la anorexia, en psiquiatría; y, por la dificultad respiratoria, en neumología.
El examen neurológico especializado, reveló una paciente, adelgazada, con dificultad respiratoria que incluía músculos accesorios, posición en trípode, con salivación excesiva, cabeza flexionada hacia delante. Orientada, con lenguaje y memoria sin alteraciones, ptosis palpebral bilateral que mejora con el test del hielo,fuerza muscular 4 / 5 a nivel proximal en miembros superiores e inferiores, con trofismo disminuido, hipotonía, coordinación normal, paresia facial periférica bilateral, dificultad para la deglución, voz de baja intensidad, resto de nervios craneales y sensibilidad táctil y dolorosa normales, hiperreflexia (3+) y reflejo cutáneo plantar flexor indiferente (figura 1).

Con la presunción diagnóstica de MG de tipo bulbar, de grado V de acuerdo a la clasificación clínica de la Fundación Americana de Miastenia Gravis (MGFA), se hospitalizó en cuidados intensivos por la insuficiencia respiratoria requiriendo ventilación mecánica, se instauró inmediatamente tratamiento con piridostigmina 30 mg cada 4 horas y prednisona a 1mg/kg/día, se solicitaron los anticuerpos anti-receptor de acetilcolina (AChr) que se informaron en 35,4nmol/l, y una tomografía de tórax que mostró una tumoración de mediastino sugerente de timoma.
Al cuarto día de su estadía en cuidados intensivos se agrega al tratamiento inmunoglobulina (0.4 g/Kg/día EV por 5 días), con buen control de sintomatología. Sale de alta, con indicaciones de continuar con piridostigmina, prednisona y controles por consultorio externo. Por el hallazgo de la tumoración en el timo y la evolución de la paciente se indicó realizar timectomía. La familia, por problemas socioeconómicos interrumpió el control; motivo por el que cinco meses después vuelve a presentar crisis miastenica de severidad IV por suspensión del tratamiento, reingresó a cuidados intensivos por necesidad de ventilación asistida, se le administró inmunoglobulina (0,4 g/kg/día), además de prednisona y piridostigmina.
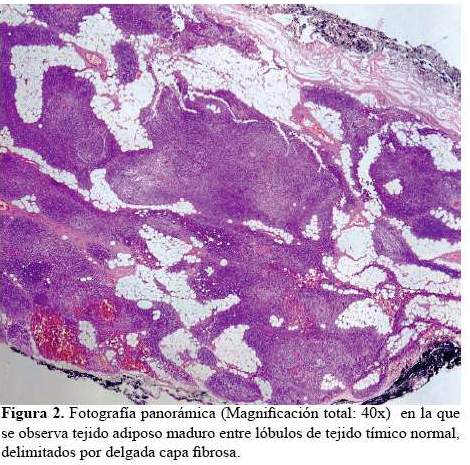
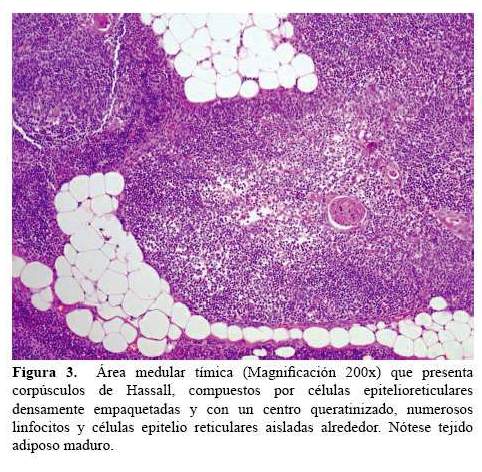
Finalmente, al sexto mes, la familia comprende la gravedad de la condición y se realiza la timectomía. El examen anatomo patológico informa timolipoma, caracterizado por la presencia de tejido adiposo maduro entre lóbulos de tejido tímico normal, delimitados por una delgada cápsula fibrosa (figura 2 y figura 3). Posteriormente, la familia fue orientada e instruida sobre los riesgos y características de la enfermedad. La paciente quedó con tratamiento a base de piridostigmina, prednisona y azatioprina. Seis meses después de la timectomia, presenta buen control, fuerza muscular 4+/5 proximal en cuatro extremidades, ausencia de paresia facial y de ptosis palpebral, sin dificultad para deglutir, ni disartria, normoreflexia. Función pulmonar normal. Mantiene tratamiento con prednisona 30 mg/d, piridostigmina 60 mg cada 4 horas y azatioprina 30 mg por día (dosis preparada en “chátulas”).
DISCUSIÓN
La MG es un desorden poco común con una incidencia anual de 7 a 23 nuevos casos por millón de habitantes, de los cuales 15 % son menores de 16 años (6). La relación mujeres: varones en etapa prepuberal es 1:1 y cambia a 4:1 en etapa postpuberal (7). Puede estar asociada a mayor mortalidad, modificada por las medidas actuales de soporte de vida y terapia inmunosupresora intensa (8), la mortalidad reportada de los pacientes que iniciaron su enfermedad entre 1940 y 1960 fue de 33%, 6% en 1970 y 4 % en 1997 (9,10). En un estudio basado en la población de Dinamarca, la mortalidad global aumentó significativamente para los sujetos con MG con anticuerpos a AchR en comparación con los controles pareados de la población general, esta es mayor durante los primeros 5 años de iniciada la enfermedad, debido principalmente a la severidad y falta de compensación de la miastenia, a la demora en el diagnóstico y a la severidad del problema respiratorio (Crisis de Miastenia) (6).
Existen tres formas clínicas de MG, ocular, bulbar y generalizada. La MG ocular es la más frecuente, estos pacientes refieren diplopia y ptosis palpebral rápidamente progresiva, que se incrementa durante el día, bilateral y asimétrica, sin afección pupilar. Sólo en 25% de los casos la enfermedad se generaliza en el curso de dos años y es frecuente que los anticuerpos AchR estén positivos (4,10). La MG generalizada se inicia con síntomas oculares, para luego de semanas o meses, afectarse los músculos de los miembros superiores e inferiores predominantemente en su segmento proximal; además la debilidad del cuello y la debilidad de los músculos bulbares son predictores de la necesidad de asistencia ventilatoria; siendo las infecciones las que pueden precipitar estos últimos síntomas (11). La paciente que reportamos tuvo una presentación típica de la MG de tipo bulbar; inició su enfermedad con debilidad facial y en pocos días se añadió ptosis palpebral y debilidad del cuello; pero también disartria, hipofonía, disfagia y dificultad respiratoria; síntomas que se acentuaban al transcurrir el día y que mejoraban transitoriamente con el descanso; estas manifestaciones reflejan la fatigabilidad de los músculos bulbares (12) que se soslayaron en las primeras atenciones.
Esta forma de presentación, fue descrita por primera vez en 1868 por Hérard como una variante de “parálisis del glosofaríngeo” (2), afecta a los músculos de la masticación acompañada de una marcada dificultad para tragar líquidos con regurgitación nasal, disfagia mayor a los líquidos que a los sólidos, y disartria, sintomatología que refirió la paciente. Es común la voz nasal y de baja intensidad originada por la debilidad de los músculos del paladar. Con frecuencia esta forma de MG es difícil de diagnosticar y se complica con neumonía. Nuestra paciente estuvo 21 meses sin el diagnóstico correcto, y fueron confundidos sus síntomas con asma, tal y como se describe en la literatura. Otros hallazgos frecuentes de MG bulbar, son la pérdida de peso, que se confunde con anorexia primaria como fue el caso de la paciente motivo por el que fue evaluada por psiquiatria (13).
Cuando la paciente inició su enfermedad con afección de los músculos de la cara y después de los músculos bulbares ya tenía una condición seria, pensamos que la severidad fue confundida porque no se tomó en cuenta toda la información, no se reconoció la fatigabilidad y, porque posiblemente la mejoría parcial fue efecto de los corticoides, hasta que se comprometieron los músculos respiratorios y de la deglución (20-30% de los pacientes). La niña alcanzo nivel V, nivel máximo de severidad en la clasificación clínica de la MGFA. Al respecto, se recomienda clasificar la enfermedad para iniciar las estrategias terapéuticas (11,12,14,15).
El dosaje de anticuerpos AchR fue positivo en la paciente, se ha descrito que están presentes en el 80 a 90 % de los pacientes afectados, y entre el 5 y 8% se encuentran anticuerpos contra otras moléculas de la unión neuromuscular como la tirosinakinasa del músculo (MUSK) (4, 16-21). Sin embargo aproximadamente el 6% de pacientes son doblemente seronegativos, no tienen anticuerpos anti-AchR ni anti-MUSK y en este subgrupo algunos pacientes pueden ser positivos para anticuerpos anti proteína 4 relaciona a lipoproteína (LRP4) (22,23).
En la paciente se extirpo un timolipoma, los timolipomas son tumores mediastínicos de crecimiento lento muy poco frecuentes que constituyen tan solo el 2-9% del total de neoplasias tímicas, suelen presentarse como tumores asintomáticos. En ocasiones, estas neoplasias benignas pueden asociarse a ciertos trastornos autoinmunes como miastenia gravis como en este caso (24). Al parecer la presentación de antígeno por células tímicas a través de moléculas MHC de clase II puede ser anormal en pacientes con miastenia (25).
En particular, se ha observado en el tejido tímico de pacientes con miastenia y timoma la sobreexpresión de la catepsina V, aunque no está claro el vínculo entre la sobreexpresión enzimática y la producción de auto anticuerpos (26). La enfermedad mejora o desaparece después de la timectomía (27), con este fundamento se realizó esta estrategia terapéutica.
La Miastenia Bulbar, es una forma de MG muy difícil de diagnosticar, porque, la afección de los músculos de la deglución, de la cara, de cuello, y respiratorios, se presenta disfagia, disartria, animia, anorexia, debilidad cervical y dificultad respiratoria. Estos signos, explorados en forma aislada, desvían la atención y pueden confundirse con crisis asmática (27,28) por lo cual se debe realizar anamnesis exahustivas.
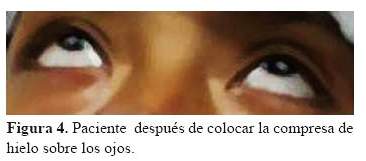
El electromiograma de fibra única (SFEMG), es un examen útil para diagnosticar la enfermedad, y tiene alta especificidad y sensibilidad en pacientes con anticuerpos positivos, la prueba con inhibidores de la colinesterasa como el Edrofonio tiene alta sensibilidad en pacientes con anticuerpos a AchR, no observándose lo mismo en pacientes con anti-Musk (1) (7,8), por las condiciones al ingreso de la paciente y teniendo los resultados de anticuerpos a AchR positivos , no se realizaron estas pruebas en la paciente; pero si utilizamos la prueba del hielo que fue positiva, ésta se trata de una prueba simple y eficaz, que consiste en colocar un recipiente de hielo sobre los párpados cerrados del paciente durante un período de 2 minutos para ptosis y 5 minutos para oftalmoparesia . Los déficits de motilidad ocular y la apertura palpebral deben medirse antes y después de la prueba. Aunque no hay parámetros exactos para interpretarla, se considera positiva cuando el párpado superior se eleva por lo menos 2 mm después de la aplicación del hielo (figura 4). Se entiende que el enfriamiento reduce la actividad anticolinesterasa (AChE), aumentando la cantidad de ACh disponible en la unión neuromuscular. Por lo tanto, hay un aumento en la eficiencia de ACh (29).
Respecto al tratamiento de la paciente se incluyó las recomendaciones internacionales. La piridostigmina, que mejora la transmisión neuromuscular, aumentando la concentración de acetilcolina. La prednisona y la azatioprina, como fármacos inmunosupresores, que interfieren con la actividad de auto anticuerpos en la unión neuromuscular, y la inmunoglobulina que disminuye los autoanticuerpos circulantes. La timectomía modifica la historia natural de la enfermedad (12,29,30) por ello es obligatoria en pacientes con timoma y es recomendado como opción para los pacientes con MG generalizada sin timoma, en particular aquellos con anticuerpos de acetilcolina y menores de 60 años, porque aumenta la probabilidad de mejoría o remisión (31).
En conclusión, se presenta el caso de una niña con MG bulbar, diagnóstico a tener en cuenta en pacientes con asma severa. Se destaca la importancia de tomar la información ordenada, valorar los signos de fatigabilidad y debilidad muscular. Recordar que el test del hielo puede ser muy útil y que los riesgos deben valorarse en todos los pacientes, particular atención a los problemas socioeconómicos y patrones culturales de la familia. Finalmente, el seguimiento clínico debe incluir un equipo multidisciplinario.
REFERENCIAS BIBLIOGRAFICAS
1. Zisimopoulou P, Evangelakou P, Tzartos J, Lazaridis K, Zouvelou V, Saruhan-direskeneli G, et al. A comprehensive analysis of the epidemiology and clinical characteristics of anti-LRP4 in myasthenia gravis. J Autoimmun. 2014;52:139–45. doi: http://dx.doi.org/10.1016/j.jaut.2013.12.004 [ Links ]
2. Mimenza-Alvarado a, Tellez-Zenteno J, Garcia-Ramos G, Estañol B. La historia de la miastenia gravis: Los hombres y las ideas. Neurologia. 2007;22:313-26. [ Links ]
3. Sudulaguntal SR, Sepehrar M, Sodalagunta MB, Nataraju AS, Raja S, Sathyanarayana D, et al. Refractory myasthenia gravis – clinical profile, comorbidities and response to rituximab. Ger Med Sci. 2016;14:12. [ Links ]
4. Rybojad B, Lesiuk W, Fijalkowska-Nestorowicz A, Rybojad P, Sawicki M, Lesiuk L. Management of myasthenic crisis in a child. Anestezjol Intens Ter. 2013; 45(2):82–4. [ Links ]
5. Melzer N, Ruck T, Fuhr P, Gold R, Hohlfeld R. Clinical features , pathogenesis , and treatment of myasthenia gravis: a supplement to the Guidelines of the German Neurological Society. J Neurol. 2016;263(8):1473-1494. doi: 10.1007/s00415-016-8045-z
6. Breiner A, Widdifield J, Katzberg HD, Barnett C, Bril V. Epidemiology of myasthenia gravis in Ontario, Canada. Neuromusular disorders. 2016; 26(1):41–6. doi: http://dx.doi.org/10.1016/j.nmd.2015.10.009
7. Lee HN, Kang H-C, Lee JS, Kim HD, Shin HY, Kim SM, et al. Juvenile Myasthenia Gravis in Korea: Subgroup analysis according to sex and onset age. J Child Neurol. 2016;31(14):1561-8. [ Links ]
8. Hansen JS, Danielsen DH, Somnier FE, Frøslev T, Jakobsen J, Johnsen SP, et al. Mortality in myasthenia gravis: A nationwide population-based follow-up study in Denmark. Muscle Nerve. 2016;53(1):73-7. doi: 10.1002/mus.24697. [ Links ]
9. Wendell LC, Levine JM. Myasthenic crisis. The Neurohospitalist. 2011;1(1):16–22. doi:10.1177/1941875210382918. [ Links ]
10. Schneider-Gold C, Gajdos P, Toyka K, Hohlfeld R. Corticosteroids for myasthenia gravis. Cochrane Database Syst Rev. 2011;6:0-0. [ Links ]
11. Jayawant S, Parr J, Vincent A. Autoimmune myasthenia gravis. Handb Clin Neurol. 2013; 113:1465-8. doi: 10.1016/B978-0-444-59565-2.00015-0. [ Links ]
12. Berrih-Aknin S, Frenkian-Cuvelier M, Eymard B. Diagnostic and clinical classification of autoimmune myasthenia gravis. J Autoimmun. 2014; 48:143-8. doi: 10.1016/j.jaut.2014.01.003. [ Links ]
13. Oger J, Frykman H. An update on laboratory diagnosis in myasthenia gravis. Clin Chim Acta. 2015;449:43-8. doi: 10.1016/j.cca.2015.07.030. [ Links ]
14. Jaretzki A, Barohn RJ, Ernstoff RM, Kaminski HJ, Keesey JC, Penn AS, et al. Myasthenia gravis: recommendations for clinical research standards; Task Force of the Medical Scientific Advisory Board of the Myasthenia Gravis Foundation of America. Neurology. 2000; 55(1): 16-23. [ Links ]
15. Khadilkar SV, Chaudhari CR, Patil TR, Desai ND, Jagiasi K, Bhutada AG. Once myasthenic, always myasthenic? observations on the behavior and prognosis of myasthenia gravis in a cohort of 100 patients. Neurol India. 2014;62(5):492–7. [ Links ]
16. Marx A, Frederick P, Schalke B, Saruhan-Direskeneli G, Melms A, Ströbel P. The different roles of the thymus in the pathogenesis of the various myasthenia gravis subtypes. Autoimmunity reviews. 2013;12:875–84. [ Links ]
17. Phillips WD, Vincent A. Pathogenesis of myasthenia gravis: update on disease types, models, and mechanisms. F1000Research. 2016; 5:1513. doi: 10.12688/f1000research.8206.1
18. Sieb JP. Myasthenia gravis: an update for the clinician. Br Soc Immunol Clin Exp Immunol. 2013;17(175): 408–18. [ Links ]
19. Finnis MF, Jayawant S. Juvenile myasthenia gravis: A paediatric perspective. Autoimmune Dis. 2011; 2011: 404101. [ Links ]
20. Meriggioli M, Sanders D. Autoimmune myasthenia gravis: emerging clinical and biological heterogeneity. Lancet Neurol. 2009; 8(5): 475-490. doi: 101016/S1474-4422(09)70063
21. Ha JC, Richman DP. Biochimica et Biophysica Acta Myasthenia gravis and related disorders : Pathology and molecular pathogenesis. BBA - Mol Basis Dis. 2015;1852(4):651–7. doi: http://dx.doi.org/10.1016/j.bbadis.2014.11.022. [ Links ]
22. Cortés-Vicente E, Gallardo E, Martínez MÁ, Díaz-Manera J, Querol L, Rojas-García R, et al. Clinical characteristics of patients with double-seronegative myasthenia gravis and antibodies to cortactin. JAMA Neurol. 2016;73(9):1099–1104. doi: 10.1001/jamaneurol.2016.2032
23. Gilhus NE, Verschuuren JJ. Myasthenia gravis: Subgroup classification and therapeutic strategies. Lancet Neurol. 2015;14(10):1023–36. doi: http://dx.doi.org/10.1016/S1474-4422(15)00145-3 [ Links ]
24. Obeso G, Garcia E, Cañizares M. Timolipoma gigante : presentación de un caso de tumor mediastínico inusual. Arch Bronconeumol 2014;50(12):557-9. doi:10.1016/j.arbres.2013.11.028
25. Avidan N, Le R, Berrih-aknin S, Miller A. Genetic basis of myasthenia gravis - a comprehensive review. J Autoimmun. 2014;52:146–53. Doi: http://dx.doi.org/10.1016/j.jaut.2013.12.001 [ Links ]
26. Leite MI, Jones M, Ströbel P, Marx A, Gold R, Niks E, et al. Myasthenia gravis thymus. Am J Pathol. 2007;171(3):893-905. [ Links ]
27. Cufi P, Soussan P, Truffault F, Fetouchi R. Thymoma associated myasthenia gravis : On the search for a pathogen signature. J Autoimmun. 2014;52:29-35. doi: 10.1016/j.jaut.2013.12.018. [ Links ]
28. Berrih-aknin S, Le R. Myasthenia gravis: A comprehensive review of immune dysregulation and etiological mechanisms. J Autoimmun. 2014;52: 90–100. Doi: http://dx.doi.org/10.1016/j.jaut.2013.12.011
29. Mantegazza R, Bonanno S, Camera G, Antozzi C. Current and emerging therapies for the treatment of myasthenia gravis. Neuropsychiatr Dis Treat. 2011;7:151-60. doi: 10.2147/NDT.S8915 [ Links ]
30. Fernandez LG. Electromiografía de fibra única en el diagnóstico de la miastenia gravis. Rev Neurol (Paris). 2000;30(7):609–13. [ Links ]
31. Leuzzi G, Meacci E, Cusumano G, Cesario A, Chiappetta M, Dall’armi V, et al. Thymectomy in myasthenia gravis: Proposal for a predictive score of postoperative myasthenic crisis. Eur J Cardio-thoracic Surg. 2014;45(4):5–9. [ Links ]
Correspondencia:
Rosa Y. Alvarado Merino
Urb. El Pacifico Mz J’ lote 8. Lima 31, Perú
Dirección electrónica: ryalvaradomerino@gmail.com
Celular: 51992998278
Recibido: 20/12/2016
Aceptado: 16/06/2017













