Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Neuro-Psiquiatría
versión impresa ISSN 0034-8597
Rev Neuropsiquiatr vol.81 no.1 Lima ene./mar. 2018
http://dx.doi.org/https://doi.org/10.20453/rnp.v81i1.3268
ARTÍCULO ORIGINAL
Ausencia de la mutación A53T del gen SNCA en una muestra de pacientes con Enfermedad de Parkinson en el Perú
A53T-SNCA absence in a Peruvian sample of Parkinson’s disease patients
Karina Milla-Neyra 1,a, Erick Figueroa-Ildefonso 1,a, Victoria Marca 1,b, Olimpio Ortega 1,c, Elison Sarapura- Castro 1,d, Luis Torres 2,d, Carlos Cosentino 2,3,d, Miguel Inca-Martinez 1,a, Maryenela Illanes-Manrique 1,e, Pilar Mazzetti 1,3,d, Mario Cornejo-Olivas 1,d.
1 Centro de Investigación Básica en Neurogenética,Instituto Nacional de Ciencias Neurológicas. Lima, Perú.
2 Centro Básico de Investigación en Movimientos Involuntarios y Enfermedades Degenerativas del Sistema Nervioso. Instituto Nacional de Ciencias Neurológicas. Lima, Perú.
3 Facultad de Medicina, Universidad Nacional Mayor de San Marcos. Lima, Perú.
a Biólogo Genetista Biotecnólogo; b Magister en Bioquímica; c Biólogo con mención en Genética; d Médico neurólogo; e Médico psiquiatra
RESUMEN
Introducción. La enfermedad de Parkinson (EP) es un trastorno neurodegenerativo común, el segundo más frecuente después de la enfermedad de Alzheimer. La mutación A53T en el gen SNCA, fue la primera identificada en asociación con EP. La mayoría de casos de EP en familias con esta mutación provienen de regiones cercanas al lugar del descubrimiento original. Objetivos: Evaluar la presencia de la mutación A53T en el gen SNCA en una muestra peruana de casos con EP de incidencia familiar, esporádicos y controles sanos. Material y Métodos: Se analizaron, mediante la técnica de PCR-RFLP, las muestras de ADN de 34 casos con EP esporádico, 7 casos de EP familiar y 32 individuos control. Resultados: No se encontró la mutación A53T en la muestra analizada, por lo que se infiere que ella estaría confinada a pocas familias de origen caucásico (europeo) asociadas a aquéllas con los casos originalmente descritos. Conclusiones: La mutación A53T no sería un factor causal o primario de EP en los casos evaluados.
PALABRAS CLAVE: Enfermedad de Parkinson, genética, SNCA.
SUMMARY
Introduction. Parkinson’s Disease (PD) is a common neurodegenerative disorder, the second most frequent after Alzheimer’s Disease. The A53T mutation in the SNCA gene was the first one identified in association with PD. Most of familial PD cases with this mutation come from regions close to the original discovery site. Objectives: To evaluate the presence of the A53T-SNCA mutation in a Peruvian sample of Parkinson´s Disease cases familial, sporadic and healthy controls. Material and Methods: DNA samples from 34 cases with sporadic PD, 7 cases of familial PD, and 32 control individuals were analyzed by PCR-RFLP. Results: The A53T mutation was not found. This mutation would be confined to a few families of European or Caucasian origin linked to the cases originally described. Conclusions: The A53T mutation would not be the primary causal factor of PD in the evaluated cases.
KEYWORDS: Parkinson’s disease, genetics, SNCA.
INTRODUCCIÓN
La Enfermedad de Parkinson (EP) es un trastorno neurodegenerativo común, que constituye la segunda en frecuencia después de la Enfermedad de Alzheimer, caracterizada por la muerte relativamente selectiva de las neuronas dopaminérgicas de la vía nigroestriatal (1). En la actualidad existe evidencia que la etiología de la EP es multifactorial y genéticamente compleja. Se reconoce que las formas de la EP contienen un factor genético que está interactuando con factores ambientales y epigenéticos (2).
El gen de la alfa-sinucleína o SNCA es el primer gen causal asociado a formas familiares monogénicas en EP. El gen SNCA(cromosoma 4q22.1), con un peso molecular de 111,43 kb y 6 exones, codifica la proteína alfa-sinucleína o SNCA, la cual está conformada por 140 aminoácidos, localizada en la región pre sináptica del axón. La función de SNCA no se conoce con exactitud, pero podría estar involucrada en la transmisión sináptica mediante la regulación de la liberación y el transporte de dopamina. La SNCA es el principal componente de los cuerpos de Lewy o agregados proteicos intraneuronales, hallazgos neuropatológicos característicos no solo de los casos asociados a mutación de este gen sino también de la EP esporádica (3).
En 1997 se identificóla mutación A53T en el gen SNCA en una extensa familia de origen ítalo-griego con múltiples casos de EP, conocida como “Contursi Kindred”, siendo identificada en otras familias de la misma región (4). Esta mutación , asociada a una forma autosómica dominante de EP, es la sustitución de un residuo de alanina por treonina en el codón 53 del gen SNCA(5). La mutación A53T-SNCA se ha detectado principalmente en casos de EP familiar, en su mayoría relacionados a las primeras familias griegas identificadas y en algunos casos de EP esporádico(6-8).
El objetivo de este estudio fue evaluar la presencia de la mutación A53T en el gen SNCA en una muestra peruana de casos con EP familiar, esporádico y controles sanos.
MATERIAL Y MÉTODOS
Se seleccionaron 73 muestras de ADN,con información clínico-demográfica asociada, disponibles en la ADNteca del Centro de Investigación Básica en Neurogenética del Instituto Nacional de Ciencias Neurológicas: 41 muestras de pacientes con diagnóstico clínico de EP y 32 muestras de individuos controles sin antecedente de enfermedad neurodegenerativa. Los casos de EP fueron diagnosticados por neurólogos expertos en movimientos anormales y reclutados previamente para un estudio sobre EP durante el periodo 2007-2014. Esta muestra incluye 7 probandos con diagnóstico clínico de EP familiar (al menos dos individuos emparentados o en primer o segundo grado con diagnóstico de EP y muestra de ADN disponible) y 34 casos de EP esporádico. Para evaluar la presencia de la mutación c.209G>A (A53T) en el gen SNCA, se realizó la amplificación del gen por PCR, en los tres grupos, empleando los cebadores descritos por Polymeropoulos et al., (4). Los productos de amplificación fueron digeridos con la enzima de restricción Tsp45I, para lo cual se empleó un control de corte con un producto de amplificación de 290pb del gen ACTB que mostraba un patrón de migración correspondiente a dos fragmentos de 139 pb y 151 pb (figura 1). El fraccionamiento electroforético de los productos de digestión se realizó en geles de poliacrilamida no desnaturalizante al 8%, y se visualizaron mediante tinción argéntica. El estudio contó con aprobación del Comité Institucional de Ética en Investigación del INCN.
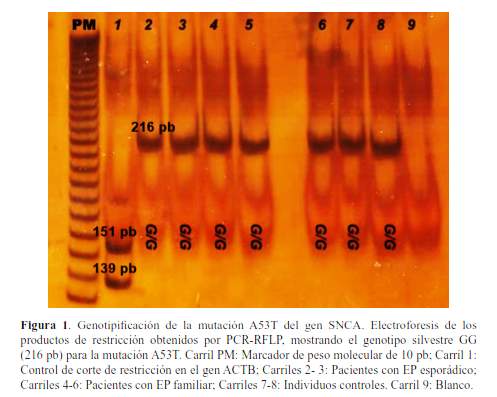
RESULTADOS
Se analizaron 41 casos con EP, 20 de ellos de sexo masculino. La edad de inicio de los síntomas motores fue de 51,2± 15,23, 56,1% de ellos presentaron temblor de reposo como síntoma inicial. El 36,5% de los casos declararon lugar de nacimiento en la región de Lima. Los 32 controles, 11 de ellos de sexo masculino, con edad a la toma de muestras de 53,9± 14,02, 56,25% de los controles declararon lugar de nacimiento en la región de Lima.
No se encontró la mutación A53T en las 73 muestras analizadas, correspondiente a los tres grupos: EP esporádico, EP familiar y controles como se muestra en la figura 1.
DISCUSIÓN
La mutación A53T no sería la causa de EP en la muestra peruana estudiada. No se encontró la mutación A53T en los 34 casos de EP esporádico, 7 probandos de EP familiar y 32 controles. Los casos de EP con la mutación A53T descritos hasta la fecha, en su mayoría, están ligados a las familias griegas e italianas en las que se describió la mutación inicialmente, en las cuales se describieron no sólo casos de EP sino también en demencia de cuerpos de Lewy y demencia frontotemporal (tabla 1)(9-14).
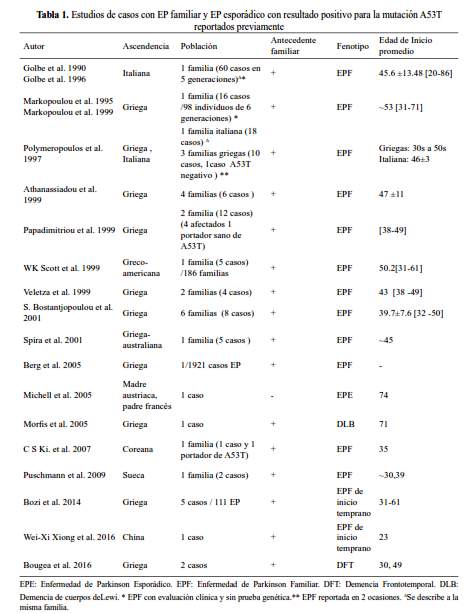
La mutación A53T es poco frecuente en poblaciones de ascendencia distinta a la griega e italiana. Aunque esta mutación ha sido descrita también en cuatro familias no relacionadas en Suecia, Corea, China y Polonia, los estudios de haplotipos realizados en las familias sueca y coreana sugieren posibles mutaciones denovo (6-8,15). La frecuencia de esta variante es muy baja (1/1921) en población de EP esporádico de origen caucásico(16). Otros estudios de grandes cohortes de casos EP esporádico y familiar en poblaciones caucásicas, asiáticas y afroamericanas no encontraron otros casos de EP asociados a la mutación A53T (tabla 2). En Latinoamérica, estudios realizados en casos de Brasil y en una familia de ascendencia portorriqueña no se encontró esta mutación (17–19). Estos hallazgos sugieren que la mayoría de casos de EP asociado a la mutación A53T estarían vinculado a un efecto fundador asociado a las familias griegas e italianas; mientras que los pocos casos descritos en otras regiones del mundo corresponderían a mutaciones de novo.
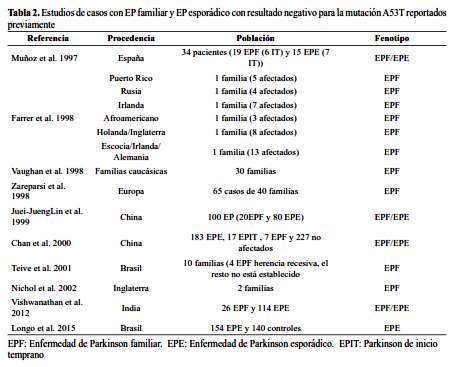
En los casos analizados, la ausencia de la mutación A53T podría ser explicada, al menos en parte, por la composición mestiza de nuestra población que tiene un alto porcentaje de componente amerindio (20); sin embargo, no podemos excluir la intervención de otros factores genéticos y ambientales que no han sido considerados en este estudio.
La ausencia de la mutación A53T en la población estudiada, contribuye al conocimiento de la epidemiología genética de EP, más allá de las limitaciones de este estudio. Los resultados de este estudio no son generalizables a la población peruana debido al tamaño muestral pequeño y no aleatorio, ya que se analizaron casos y controles con ADN disponible y con información demográfica completa. En este estudio no se han evaluado otras mutaciones puntuales o por efecto de dosis en el gen SNCA ni en otros genes asociados a EP, aunque existen estudios previos que describen casos de mutaciones en LRRK2 y PARK2 en población peruana (21,22). A pesar de no contar con un control positivo para esta mutación se empleó un control positivo para la actividad de la enzima de restricción.
En conclusión, la mutación A53T en el gen SNCA no sería la causa de EP familiar ni esporádico en la muestra peruana estudiada, Esta mutación estaría confinada a pocas familias de origen caucásico europeo relacionadas a las familias originalmente descritas por un efecto fundador, y casos esporádicos aislados explicados por probables mutaciones de novo. Este estudio evalúa por primera vez la frecuencia de la mutación A53T-SNCA en EP en una población mestiza latinoamericana con un alto componente de ancestría amerindia; sin embargo, se requieren estudios posteriores con mayores tamaños muestrales y mejor representatividad, así como estudios que se enfoquen en la búsqueda de otros factores que se asocien a EP en la población peruana.
REFERENCIAS BIBLIOGRAFICAS
1. Kalia LV, Lang AE. Parkinsons disease. Lancet Lond Engl. 2015;386(9996):896-912. doi: 10.1016/S0140-6736(14)61393-3. [ Links ]
2. Lill CM. Genetics of Parkinsons disease. Mol Cell Probes. 2016;30(6):386-96. doi: 10.1016/j.mcp.2016.11.001 [ Links ]
3. Spillantini MG. Parkinsons disease, dementia with Lewy bodies and multiple system atrophy are alpha-synucleinopathies. Parkinsonism Relat Disord. 1999; 5(4):157-62. [ Links ]
4. Polymeropoulos MH, Lavedan C, Leroy E, Ide SE, Dehejia A, Dutra A, et al. Mutation in the alpha-synuclein gene identified in families with Parkinsons disease. Science. 1997;276(5321):2045-7. [ Links ]
5. Rocha EM, De Miranda B, Sanders LH. Alpha-synuclein: Pathology, mitochondrial dysfunction and neuroinflammation in Parkinsons disease. Neurobiol Dis. 2017; S0969-9961(17):30080-3. doi: 10.1016/j. nbd.2017.04.004. [ Links ]
6. Xiong W-X, Sun Y-M, Guan R-Y, Luo S-S, Chen C, An Y, et al. The heterozygous A53T mutation in the alpha-synuclein gene in a Chinese Han patient with Parkinson disease: case report and literature review. J Neurol. 2016;263(10):1984-92. [ Links ]
7. Michell AW, Barker RA, Raha-Chowdhury R, Raha SK. A case of late onset sporadic Parkinsons disease with an A53T mutation in a-synuclein. J Neurol Neurosurg Psychiatry. 2005;76(4):596-7. [ Links ]
8. Puschmann A, Ross OA, Vilariño-Güell C, Lincoln SJ, Kachergus JM, Cobb SA, et al. A Swedish family with de novo a-synuclein A53T mutation: Evidence for early cortical dysfunction. Parkinsonism Relat Disord. 2009;15(9):627-32. [ Links ].
9. Athanassiadou A, Voutsinas G, Psiouri L, Leroy E, Polymeropoulos MH, Ilias A, et al. Genetic analysis of families with Parkinson disease that carry the Ala53Thr mutation in the gene encoding alpha-synuclein. Am J Hum Genet. 1999;65(2):555-8. [ Links ]
10. Scott WK, Yamaoka LH, Stajich JM, Scott BL, Vance JM, Roses AD, et al. The alpha-synuclein gene is not a major risk factor in familial Parkinson disease. Neurogenetics. 1999;2(3):191-2. [ Links ]
11. Markopoulou K, Wszolek ZK, Pfeiffer RF, Chase BA. Reduced expression of the G209A alpha-synuclein allele in familial Parkinsonism. Ann Neurol. 1999;46(3):374-81. [ Links ]
12. Bozi M, Papadimitriou D, Antonellou R, Moraitou M, Maniati M, Vassilatis DK, et al. Genetic assessment of familial and early-onset Parkinsons disease in a Greek population. Eur J Neurol. 2014;21(7):963-8. [ Links ]
13. Bougea A, Koros C, Stamelou M, Simitsi A, Papagiannakis N, Antonelou R, et al. Frontotemporal dementia as the presenting phenotype of p.A53T mutation carriers in the alpha-synuclein gene. Parkinsonism Relat Disord. 2017;35:82-7. [ Links ]
14. Morfis L, Cordato DJ. Dementia with Lewy bodies in an elderly Greek male due to alpha-synuclein gene mutation. J Clin Neurosci Off J Neurosurg Soc Australas. 2006;13(9):942-4. [ Links ]
15. Ki C-S, Stavrou EF, Davanos N, Lee WY, Chung EJ, Kim J-Y, et al. The Ala53Thr mutation in the alpha-synuclein gene in a Korean family with Parkinson disease. Clin Genet. 2007;71(5):471-3. [ Links ]
16. Berg D, Niwar M, Maass S, Zimprich A, Möller JC, Wuellner U, et al. Alpha-synuclein and Parkinsons disease: implications from the screening of more than 1900 patients. Mov Disord Off J Mov Disord Soc. 2005;20(9):1191-4. [ Links ]
17. Longo GS, Pinhel MAS, Gregório ML, Oliveira BAP, Quinhoneiro DCG, Tognola WA, et al. Alpha- synuclein A53T mutation is not frequent on a sample of Brazilian Parkinsons disease patients. Arq Neuropsiquiatr. 2015;73(6):506-9. [ Links ]
18. Teive HAG, Raskin S, Iwamoto FM, Germiniani FMB, Baran MHH, Werneck LC, et al. The G209A mutation in the alpha-synuclein gene in Brazilian families with Parkinson’s disease. Arq Neuropsiquiatr. 2001;59(3B):722-4. [ Links ]
19. Farrer M, Wavrant-De Vrieze F, Crook R, Boles L, Perez-Tur J, Hardy J, et al. Low frequency of alpha- synuclein mutations in familial Parkinsons disease. Ann Neurol. 1998;43(3):394-7. [ Links ]
20. Sandoval JR, Salazar-Granara A, Acosta O, Castillo- Herrera W, Fujita R, Pena SD, et al. Tracing the genomic ancestry of Peruvians reveals a major legacy of pre-Columbian ancestors. J Hum Genet. 2013;58(9):627-34. [ Links ]
21. Mata IF, Wilhoite GJ, Yearout D, Bacon JA, Cornejo- Olivas M, Mazzetti P, et al. Lrrk2 pQ1111H substitution and Parkinsons disease in Latin America. Parkinsonism Relat Disord. 2011;17(8):629-31. [ Links ]
22. Cornejo-Olivas MR, Torres L, Mata IF, Mazzetti P, Rivas D, Cosentino C, et al. A Peruvian family with a novel PARK2 mutation: Clinical and pathological characteristics. Parkinsonism Relat Disord. 2015;21(5):444-8. [ Links ]
Correspondencia:
Karina Milla-Neyra
Centro de Investigación Básica en Neurogenética
Jr. Ancash 1271, Barrios Altos. Lima, Perú.
Teléfono: 51 1 328 5189
Correo electrónico: karina.milla.n@incngen.org.pe
Agradecimientos: A los pacientes que participaron en el estudio.A María Bermejo, Keren Espinoza y Lesly Solis por colaborar con el planteamiento y opinión crítica del estudio. A Latin American Research Consortium on the Genetics of Parkinson Disease (LARGE-PD) por el apoyo y al Dr. Ignacio F. Mata por revisión y comentarios en el manuscrito.
Fuentes de financiamiento: Presupuesto de investigación del Instituto Nacional de Ciencias Neurológicas.
Declaración de conflicto de interés: Los autores declaran no tener conflicto de interés en la publicación de este artículo.
Recibido: 05/10/2017
Aceptado: 20/12/2017














