Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Neuro-Psiquiatría
versión impresa ISSN 0034-8597
Rev Neuropsiquiatr vol.81 no.3 Lima jul. 2018
http://dx.doi.org/https://doi.org/10.20453/rnp.v81i3.3384
ARTÍCULO DE REVISIÓN
Bancos de cerebro. Un reto para Latinoamérica.
Brain Banks. A challenge for Latin America.
Sandro Casavilca-Zambrano 1,a; 2,b, Karina Cancino-Maldonado 1,c, Stéphane Bertani 3,d, Susana Boluda 4,e
1 Banco de Tejidos Tumorales, Instituto Nacional de Enfermedades Neoplásicas. Lima, Perú.
2 Facultad de Odontología, Universidad de Huánuco. Huánuco, Perú.
3 Pharmacochemistry and Pharmacology for Development, Universidad de Toulouse. Toulouse, Francia.
4 Département de Neuropathologie, Hôpital La Pitié Salpêtrière. París, Francia.
a Médico Patólogo Oncológo, Mg.; b Profesor Investigador ; c Biólogo; d Banco de Tejidos; e MD, PhD.
RESUMEN
Muchos de los progresos recientes en la comprensión de la patogénesis de trastornos comunes y raros del sistema nervioso se han producido mediante el uso de tejido cerebral humano post-mortem. Los bancos de cerebros han tenido un papel crucial en este proceso, proporcionando material raro e invaluable. La función de un banco de cerebro moderno es recolectar material post-mortem o de biopsia de casos clínicamente y patológicamente bien caracterizados de manera continua y sistemática, considerando cuestiones de seguridad y éticas que rodean el uso de tejido humano donado para investigación médica. El presente artículo llama la atención sobre la importancia de los bancos de cerebro, en la recolección y almacenamiento de material post-mortem para satisfacer las necesidades de proyectos de investigación específicos, los aspectos tanto técnicos como éticos y legales, relacionados a la donación y manipulación de material biológico, así como proponer el desarrollo de una red en América Latina de bancos de cerebro que permita contar con material de estudio de diversos padecimientos en nuestra población.
PALABRAS CLAVE: bancos de cerebro, investigación, neurociencias
SUMMARY
Many of the latest findings to understand the pathogenesis of common and rare disorders of the nervous system have been produced by the use of post-mortem human brain tissue. Brain banks have played a crucial role in this process, rare and invaluable material. The function of a modern brain bank is the collection of post-mortem material or biopsy of clinically and pathologically well-characterized cases in a continuous and systematic manner, considering safety and ethical issues surrounding the use of human tissue for medical research. This review give importance of brain banks in the collection and storage of post-mortem material to satisfy the needs of specific research projects, the technical, ethical and legal aspects related to donation and manipulation of biological material, as well as proposing the development of a network in Latin America of brain banks that allows us to have material for the study of various diseases in our population.
KEYWORDS: brain banks, research, neurosciences.
INTRODUCCIÓN
Los bancos de cerebro correctamente organizados tienen una historia relativamente reciente desde los noventa (1), y sirven como un enlace entre el clínico, el neuropatólogo y el investigador de ciencia básica, los cuales requieren muestras de tejido cerebral de pacientes que se han sometido a una investigación clínica exhaustiva y estudio neuropatológico detallado de enfermedades neurológicas (2).
El análisis de tejido cerebral humano criopreservado y fijado con formalina, de series bien caracterizadas clínicamente y neuropatológicamente, han conducido a descubrimientos importantes en varios trastornos psiquiátricos y neurológicos. Ejemplos de algunas de las contribuciones científicas, donde el Banco de cerebro ha desempeñado un papel fundamental son: En la Enfermedad de Parkinson una disminución de la concentración de dopamina en regiones específicas del cerebro, condujo al desarrollo del agente terapéutico L-dopa (1). En la enfermedad de Alzheimer y la demencia con cuerpos de Lewy, el hallazgo de la pérdida de neuronas colinérgicas y la reducción de una importante enzima cerebral, la acetilcolinesterasa, en el tejido cerebral post-mortem ha llevado a la terapia de reemplazo colinérgico (1). Los estudios patológicos moleculares han identificado genes que son factores causales o de riesgo, o ambos, en la enfermedad de Alzheimer, la enfermedad de Huntington y la enfermedad de la motoneurona. Estos descubrimientos y las nuevas técnicas desarrolladas por los bancos cerebrales han producido nuevos conocimientos sobre la comprensión de la patogénesis de los trastornos psiquiátricos y neurológicos, así como ofrecer una esperanza real de mejorar el tratamiento.
Antecedentes
En 1998 se funda el “National NeuroAIDS Tissue Consortium” (NNTC), que agrupa originalmente a cuatro bancos de tejidos ubicados en Galveston (Texas, EEUU), los Angeles (California, EEUU), New York (New York, EEUU) y San Diego (California, EEUU), en respuesta a la necesidad de la comunidad científica de contar con tejido y fluidos del sistema nervioso central y periférico, de individuos infectados por el virus de inmunodeficiencia humano (VIH) (3). Además de realizar las funciones rutinarias de bancos de tejido, el consorcio ofrece un modelo único para la integración de entidades de investigación independientes con el fin de proporcionar tejidos y fluidos bien caracterizados para la comunidad científica internacional, compartiendo protocolos y base de datos, vinculando múltiples sitios independientes con el propósito de bancar los tejidos del sistema nervioso infectados por el VIH.
Para estudiar el proceso de envejecimiento del sistema nervioso humano, los trastornos relacionados con la edad, el tejido cerebral que ha sufrido envejecimiento y alteraciones patológicas puede proporcionar material de estudio valioso para encontrar posibles terapias para los trastornos relacionados con la edad (1). Recientemente se ha visto que el tejido cerebral humano post-mortem también se puede cultivar y manipular experimentalmente (4). Este enfoque permite el estudio de los aspectos celulares del envejecimiento neuronal humano y los procesos neurodegenerativos, complementando los métodos de investigación existentes, tales como imágenes in vivo (RMN, PET-Scan, etc.) y el examen neuropatológico del tejido cerebral post-mortem fijado o congelado. Por lo tanto, la manipulación experimental puede permitir la reactivación de neuronas en cultivos post-mortem de cultivos de tejido de cerebro humano adulto y el estudio del proceso de envejecimiento.
Además de las colecciones o bancos individuales de cada institución, se han creado redes de bancos de tejidos cerebrales para permitir la solicitud de tejido a través de un portal único, como el consorcio BrainNet Europe en 2001 (https://www.brainnet-europe.org) bajo la Comisión Europea o la Red de Bancos de Tejidos Cerebrales del Reino Unido en 2009 por el Medical Research Council. Estas redes son muy útiles para tener un mayor número de casos para estudiar una determinada patología, sobre todo para aquellas enfermedades que son poco frecuentes en la población general.
La preservación del tejido cerebral
Para establecer una instalación reconocida internacionalmente de tejido cerebral humano de alta calidad y con controles adecuados para una amplia gama de aplicaciones en investigación, se debe establecer un sistema se colección sistematizada de muestras (5). Cuando se solicita la aprobación ética para la investigación de alguna enfermedad neurológica, se debe tener cuidado de incluir en el permiso no sólo los propósitos de diagnóstico, sino también para el uso de tejido en proyectos de investigación, así como para el envío de especímenes a otros laboratorios.
El banco de cerebros debe poseer la capacidad de proporcionar muestras de tejido congeladas rápida o lentamente, muestras de tejido fijadas en formalina (inyección/tiempo de fijación prolongado), líquido cefalorraquídeo (LCR) y muestras de sangre, siendo los tiempos promedio de autopsia de entre 3 a 47 horas (2). Los protocolos metodológicos están orientados a proporcionar tejido óptimo para la investigación bajo las normas éticas y legales establecidas.
Inmediatamente a la llegada, se pesan los tejidos y se mide el pH del tejido cerebral y líquido cefalorraquídeo (LCR). Se toman fotografías digitales de las vistas lateral, inferior y superior del cerebro intacto y vistas laterales de la médula espinal. Cualquier cambio patológico grave debe ser documentado (6). Cuando se procesa el cerebro, en su totalidad es cortado en “la mitad” por un corte sagital, resultando en: la mitad del cerebro es fijado con formalina y la mitad restante es criopreservado. Antes de extraer el cerebro, el LCR se extrae de los ventrículos laterales y la sangre del corazón se extrae del ventrículo izquierdo mediante punción transtorácica. La sangre es colectada para la obtención de plasma y suero. El plasma obtenido no es exactamente comparable al plasma de sujetos vivos, ya que la coagulación post-mortem extensa elimina muchos factores de coagulación y otras proteínas. El suero sanguíneo debe ser derivado a un laboratorio de patología clínica comercial para la serología de la sífilis, el VIH y la hepatitis A, B y C (7).
Las muestras de tejido pueden ser conservadas como:
i. Bloques de tejido fresco congelado para extracción de ADN, ARN y mRNA, extracción de proteínas y técnicas de PCR. En este caso, se debe minimizar el tiempo entre la llegada de los tejidos y la conservación.
ii. Tejido fresco congelado para criosección para hibridación in situ, inmunohistoquímica y ensayos de adhesión basados en células.
iii. Fijado en formaldehído y bloques de tejido embebidos en parafina para histología e inmunohistoquímica.
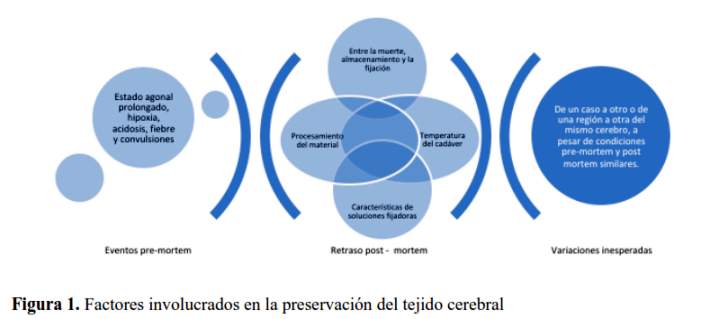
Los bancos de cerebro humano se basan principalmente en tejido nervioso obtenido después de la muerte y por lo tanto, varios factores pueden interferir con el tejido y la preservación molecular de estas muestras. Algunos factores están relacionados con eventos pre-mortem tales como estado agónico prolongado, hipoxia, acidosis, fiebre, infección, convulsiones, etc., (8). Otros se relacionan con el retraso post-mortem entre la muerte y el procesamiento de la muestra para el almacenamiento, la fijación, la temperatura del cadáver, las características de las soluciones fijadoras y el procesamiento del material congelado (figura 1). Por otro lado, es posible detectar variaciones inesperadas de un caso a otro o de una región a otra del mismo cerebro a pesar de condiciones pre-mortem y post-mortem similares (8). La realización de autopsias rápidas con un breve retraso post-mortem y el uso de procedimientos de disección en combinación con un estricto control de procedimientos operativos estándar optimizados, son vitales para evitar distorsiones y artefactos, garantizando una investigación de alta calidad.
El tejido fresco-congelado a -80°C es el método óptimo para la recuperación del ADN. Ya que algunas moléculas son más vulnerables que otras; al igual que para el ARN, la preservación de las proteínas no es homogénea, este aspecto es crucial en el estudio de proteínas incluyendo niveles de expresión y posibles modificaciones post-traduccionales. Los valores del número de la integridad del ARN (RIN) a menudo es considerado como una medida crítica de la calidad de los cerebros humanos post-mortem ya que varias horas post-mortem y después de diversos estados agónicos, la integridad del ARN sufre una alteración compleja. Sin embargo, no están necesariamente relacionados con el intervalo post-mortem entre la muerte y el procesamiento del tejido, ni incluso con retrasos post- mortem relativamente cortos (9,10). En contraste con los ARN, se cree que los microARN son resistentes a los artefactos post-mortem e incluso a la fijación. Sin embargo, la vida media in vivo de los microARN específicos no se conocen, su alto contenido de uridina más adenina y su estructura monocatenaria cuando no forman complejo con el ARNm los hacen potencialmente lábiles a la degradación (8).
A partir de tejido post-mortem, valores de RIN entre 1 a 8,5 y utilizando 1266 Affymetrix Exon Arrays, se ha construido una base de datos de acceso abierto de expresión génica del cerebro humano (11). Esta base de datos permite la evaluación de la variabilidad de la expresión génica según el tejido cerebral y determina la influencia de varios parámetros sobre la calidad de los resultados. Los datos obtenidos son robustos a pesar de la variable integridad del ARN. La demora post-mortem, el estado agónico y la edad tienen poco impacto en los arrays; sin embargo el pH cerebral (<5,9) es el único parámetro que evidencia un pequeño efecto en su rendimiento. Esto confirma la viabilidad práctica de utilizar el tejido cerebral post-mortem para estudiar el transcriptoma del cerebro humano mediante tecnología de arrays.
Los bancos de cerebro en el estudio de la enfermedad de Alzheimer
La existencia de colecciones de tejido cerebral fijado en formol ha permitido determinar los distintos estadios de evolución de la enfermedad de Alzheimer (10). Actualmente, estos estadios son utilizados de forma extensa para el diagnóstico de la enfermedad (13). Además, la observación de la progresión jerarquizada de la patología en la enfermedad de Alzheimer ha puesto de manifiesto la hipótesis de la propagación “prion-like” de la proteína tau como mecanismo que explicaría la evolución de la enfermedad (14,15).
En el caso de estudios de asociación a nivel genómico en la enfermedad de Alzheimer se han puesto de manifiesto la inflamación como un factor causal de la enfermedad más que una consecuencia de la neurodegeneración en curso, se han realizado numerosos estudios para identificar perfiles inmunes específicos asociados con cerebro sano, envejecimiento o enfermedad (7). Sin embargo, estos estudios se han realizado principalmente en modelos in vitro o animales. Es conocido que estos modelos son limitantes ya que, recapitulan sólo algunos aspectos de la fisiopatología de la enfermedad de Alzheimer humana sin reproducir su complejidad, tanto por factores genéticos como ambientales (7). Por ello es interesante el acceso a tejido cerebral humano para el estudio de la fisiopatología de la enfermedad. La caracterización de la respuesta inflamatoria en muestras post-mortem humanas mediante métodos fiables y consistentes proporcionará información valiosa en el campo.
Los bancos de cerebro en el estudio de la enfermedad de Parkinson
La causa de la Enfermedad de Parkinson (EP) es desconocida y aunque probablemente es multifactorial, los principales factores etiológicos son de naturaleza genética y ambiental. Se han hecho importantes avances en develar los posibles mecanismos de degeneración neuronal. Este extraordinario progreso se debe a los nuevos descubrimientos sobre la anatomía y función de los ganglios basales y por estudios de parkinsonismo en modelos experimentales. La EP es una enfermedad generalizada en la que la α-sinucleína no es un componente único, sino que es sólo uno de los actores responsables del complejo deterioro de los procesos bioquímicos y moleculares involucrados en las vías metabólicas (16). El descubrimiento en cerebros post-mortem de una disminución de la concentración de dopamina en regiones específicas del cerebro, condujo al desarrollo del agente terapéutico L-dopa (1).
Los bancos de cerebro en el estudio del cáncer
La optimización de la colección consentida de especímenes tumorales (autopsia) facilita el aprendizaje sobre el proceso de la enfermedad, los efectos del tratamiento, desarrollo de nuevas terapias para muchos tipos de cáncer y mejora de la supervivencia en cáncer. El hallazgo de que los tumores pueden ser genéticamente heterogéneos ha sido cada vez más apreciado. Estudios emergentes ya están demostrando la viabilidad de la recolección de tejido tumoral en el momento de la autopsia, con el propósito de establecer cultivos celulares vivos para la investigación básica y traslacional. Se propone que todos los pacientes que mueren de cáncer deben someterse a autopsia cuando sea posible. Un estudio de muestras de autopsia de glioma difuso pontino indicó que ADN mínimamente degradado podría aislarse en casi el 90% de los casos (aunque la recuperación del ARN fue de sólo el 70%) cuando la autopsia se realizó dentro de las 5 horas de la muerte (17). Otro estudio documentó un 60% En casos de xenoinjerto de tumores pancreáticos primarios y metastásicos recuperados por autopsia dentro de las 6 horas posteriores a la muerte (16). Este intervalo de tiempo no necesita contraindicar la recolección de tejido fresco después de más tiempo; en la experiencia de uno de nuestros autores, los cultivos celulares primarios pueden establecerse a partir de muestras recogidas incluso 18 horas después de la muerte (18).
Los bancos de cerebro en el estudio de otras enfermedades neurológicas
Además de las enfermedades desarrolladas Alzheimer, Parkinson y cáncer, existe la intención de establecer protocolos en los bancos de cerebros para la investigación de otras enfermedades que se beneficiarían del estudio sistemático de las mismas (5).
Diversas sinucleinopatías y tautopatías asociadas con enfermedades neurodegenerativas no tienen modelos animales comparables. Los modelos animales hasta el momento desarrollados, incluidos modelos animales transgénicos, no reflejan de manera realista la biología de las enfermedades neurodegenerativas como la enfermedad de Alzheimer, Parkinson y otras. La mayoría de estos modelos animales reflejan menos del 10% de las características de las enfermedades neurodegenerativas que tienen una base genética para su evolución (19). No hay modelos animales experimentales de trastornos psiquiátricos como esquizofrenia y trastornos bipolares o todavía no han sido desarrollados. (19).
Sobre la donación y consentimiento informado
El uso del tejido para investigación debería de estar regulado. En el Reino Unido, el uso de tejido humano está regulado por la Human Tissue Authority (HTA) y los bancos cerebrales están autorizados para operar como bancos de tejidos de investigación por la HTA bajo la aprobación ética proporcionada por un comité de ética. Esto implica que el uso de tejido humano para un proyecto específico está sujeto a la aprobación del comité de ética de bancos cerebrales. Dos bancos cerebrales también están presentes en América del Sur: Uno en Brasil (el Banco de Cerebro del Grupo Brasileño de Estudio de envejecimiento Cerebral, Sao Paulo) y el otro en Argentina Banco de Cerebros de la Fundación para la Lucha contra las Enfermedades Neurológicas de la Infancia - Fleni) (7).
Los bancos de cerebros implican tomar cerebros y tejidos de personas fallecidas y para proteger los derechos del donante, su funcionamiento está regulado por la ley. El reclutamiento se puede dar en los siguientes contextos (20):
a. Un individuo decide donar y registra sus deseos en una Directiva Anticipada o algún otro formato, y sus familiares son contactados e informados después de su muerte.
b. Un individuo es contactado por un programa de donantes o su equipo de cuidados paliativos y se compromete a donar, haciendo conocer sus deseos y sus familiares son contactados e informados después de su muerte.
c. Un individuo no toma ninguna decisión sobre la donación o por lo menos no informa a nadie de sus deseos alrededor de la donación, y los parientes de una persona pueden ser abordados acerca de la donación después de su muerte, en cuyo caso los familiares se convierten en los principales tomadores de decisiones.
Sin embargo, este proceso de reclutamiento plantea algunas cuestiones prácticas importantes que están (o pueden ser) influenciadas por el modelo de reclutamiento utilizado:
1. ¿Quién debe dar su consentimiento en ausencia de los deseos expresados del fallecido?
2. Si los deseos conocidos del difunto entran en conflicto con los de la familia, ¿quién prevalece?
3. Si se necesita reconsiderar para nuevas investigaciones, ¿quién debe proporcionar esto, especialmente si el fallecido dio el consentimiento original?
Por ello, habitualmente la donación se realiza bajo la autorización de un consentimiento informado en el que se pueden incluir diferentes supuestos que el donante puede aceptar o no. Por ejemplo, la autorización a la utilización del tejido para distintos estudios, la utilización del tejido para estudios de genética, la utilización del tejido para estudios realizados por empresas farmacéuticas. Si se necesita un nuevo consentimiento para nuevas investigaciones,¿quién debería proporcionar esto, especialmente si el difunto dio el consentimiento original? La disposición original de la información debería abordar este escenario de lleno, y el acuerdo para participar debe ser redactado de tal manera que el re-consentimiento o la re-autorización no sea requerida cuando las nuevas investigaciones surgen después de la donación. Los bancos de cerebros deben asegurar que el acuerdo de donar implique todo lo que ello conlleva, no a un objetivo específico de investigación. A su vez, la estructura de gobernanza debe garantizar la transparencia de la toma de decisiones, la claridad y la facilidad de acceso y la disponibilidad de información al público (es decir, debe tener un elemento de comunicación accesible) (20).
Además de las limitaciones legales en la utilización del tejido para investigación hay que añadir el problema de la dificultad en la obtención de tejido cerebral no afectado. En principio, hay que reconocer que las tasas de exámenes post-mortem están disminuyendo, lo que se traduce en una incapacidad para reclutar tejido cerebral para la investigación (20). Se ha encontrado particularmente dificultad en la obtención de tejido cerebral no afectado o “normal”, que actúa como un control necesario en la investigación de la enfermedad. Sin cantidades suficientes de tejido “enfermo” y “normal”, existe un riesgo real de que la investigación, que depende de un número significativo de datos estadísticos y de control, se sofocará o podría conducir a conclusiones incorrectas y a soluciones inadecuadas.
Para mejorar el funcionamiento de la autorización en el contexto de biobancos y bancos cerebrales en algunas regiones de Gran Bretaña: Inglaterra/Gales/ Irlanda del Norte/Escocia, se aboga por una ampliación, pero mejorada, operación de “autorización” en el marco de un banco de cerebros (y un biobanco más amplio), adoptando la “solidaridad” como fundamento y la mejora del “bien público” como objetivo (20). Mediante la operatividad de la “solidaridad”, es un cambio en el pensamiento sobre la donación. Se retiraría del concepto controvertido de la donación como un acto altruista, haciendo avanzar la idea de que la donación es más bien una contribución que se le debe a la sociedad.
Los usuarios de las muestras de cerebro deben someterse a un proceso de acreditación para asegurar que se cumpla un conjunto mínimo de criterios. Estos criterios incluyen la reputación científica, la credibilidad ética, la formación adecuada, las instalaciones adecuadas para el manejo seguro y la eliminación de especímenes humanos, así como la confidencialidad. Desde un punto de vista legal y ético, es muy importante establecer bancos de cerebros como fuentes no lucrativas de tejidos humanos para la investigación científica. Los bancos de cerebros no deben ser manipulados comercialmente. Todas las actividades y gastos técnicos y científicos relacionados con la manipulación y manejo de los tejidos, así como los costos involucrados en la adquisición y/o preservación de los tejidos, pueden ser considerados como un presupuesto que debe ser pagado cuando se solicitan tejidos para la investigación.
Promoción de la investigación en enfermedades del sistema nervioso central
Los estudios neuropatológicos son cruciales para los nuevos conocimientos sobre fisiopatología y tratamiento de enfermedades neurodegenerativas, como la enfermedad de Alzheimer y la enfermedad de Parkinson (6).
El Programa de Donación de Cerebro y Cuerpo (BBDP) en “Banner Sun Health Research Institute” (http://www .brainandbodydonationprogram.org) comenzó en 1987 con donaciones exclusivamente para el cerebro y actualmente tiene más de 1600 cerebros. Los sujetos donantes de esta institución reciben evaluaciones estandarizadas de trastornos neurológicos, neuropsicológicos y del movimiento general durante la vida, y más del 90% reciben exámenes patológicos completos. Debido a que en las enfermedades neurodegenerativas, las biopsias no están indicadas, el examen neuropatológico post- mortem tiene un papel aún más crítico. El programa ha hecho la autopsia rápida una prioridad, con un intervalo post-mortem mediano de 3 horas para toda la colección (21). Se han atendido más de 2500 solicitudes de tejidos y actualmente alrededor de 200 se atienden anualmente. Estas solicitudes han sido hechas por más de 400 investigadores ubicados en 32 estados de Estados Unidos y 15 países. El BBDP ha contribuido a más de 350 publicaciones y más de 200 proyectos subvencionados. El BBDP ha inscrito más de 3100 sujetos desde su fundación, lo que constituye más del 2% de las poblaciones actuales combinadas de las comunidades de jubilados circundantes. El reclutamiento está dirigido a sujetos con diagnóstico clínico de enfermedad de Alzheimer, enfermedad de Parkinson o cáncer o que están libres de otras afecciones neurológicas importantes. Los sujetos inscritos en el BBDP no son una muestra representativa exacta de toda la población de ancianos de los EEUU, ya que carecen de diversidad racial y tienen más educación, tienen mayores ingresos y viven más tiempo que el ciudadano estadounidense medio. El uso de poblaciones homogéneas con mínima variabilidad genética y ambiental disminuye el número de sujetos requeridos pa ra alcanzar un poder estadístico adecuado.
Por otro lado, el banco de cerebros del Reino Unido promete ser un recurso valioso para los investigadores que buscan determinantes de la capacidad cognitiva debido a que considera un “factor g” válido en la evaluación de la capacidad mental de los participantes con datos longitudinales. (22). Cinco pruebas cognitivas se incluyeron, las cuales fueron administradas a través de interfaz de pantalla táctil computarizada: memoria numérica, razonamiento, tiempo de reacción, memoria visual y memoria prospectiva. La evaluación cognitiva consiste en realizar breves evaluaciones cognitivas computarizadas en una población muy grande. Las puntuaciones cognitivas en los participantes con repetición de pruebas, en promedio cuatro años después, muestran una estabilidad razonable principalmente la fiabilidad test-retest para el razonamiento y las tareas de tiempo de reacción (RT task). La tarea de memoria visual no muestra una buena estabilidad a través del tiempo.
El Instituto Neurológico de Montreal (Neuro)- Canadá, anunció en la primavera de 2016 que realizará un experimento de cinco años durante el cual adoptará la política de Ciencia Abierta - datos abiertos, materiales abiertos, sin patentes, evitando los retos organizacionales preservando la independencia de la investigación (23). El experimento busca examinar dos hipótesis. La primera es si la iniciativa “Neuro Open Science” atraerá nuevos socios privados. La segunda hipótesis es que el enfoque institucional de Neuro llevará a las empresas a la región de Montreal, donde está la iniciativa Neuro Open Science, lo que conduce a la creación de un centro de conocimiento local. Las características únicas de esta iniciativa, a saber, la eliminación de la protección de patentes y su naturaleza clínica institucional, la hacen particularmente adecuada para alcanzar estos objetivos. El movimiento de los modelos de investigación tradicionales ha comenzado, utilizando otros proyectos “abiertos” y la iniciativa Neuro Open Science brinda una nueva pieza importante en el rompecabezas de mejorar la eficacia de la investigación traslacional. Por sí mismo, puede ser capaz de acelerar algunas investigaciones. El objetivo de Neuro es desarrollar este enfoque aún más eliminando las patentes. Pero para lograr plenamente los beneficios de la Ciencia Abierta, otras instituciones tendrán que no sólo seguir, sino ampliar, la ventaja de Neuro Open Science. La iniciativa de Neuro Open Science ofrece a las universidades, a los encargados de formular políticas y a las empresas la oportunidad de evaluar si la ciencia abierta mejora la investigación y el crecimiento económico local. Debido a la iniciativa Open Science, Thermo Fisher Scientific acordó asociarse con Neuro Open Science para desarrollar reactivos, incluyendo anticuerpos y líneas celulares knockout, para acelerar la investigación de una serie de enfermedades neurodegenerativas. Los posibles socios reconocen la promesa del modelo de Ciencia Abierta, en particular los beneficios comerciales de compartir el riesgo de la investigación en etapas tempranas y acelerar la velocidad del progreso de la investigación. Iniciativas similares lanzaron el Structural Genomics Consortium (SGC) y el Allen Institute for Brain Science. El Instituto Allen (EEUU) centra su investigación en neurociencia y ha implementado exitosamente una política científica abierta hace casi 15 años. Su trabajo ha llevado a la creación de atlas cerebrales, entre otros instrumentos de investigación, todos ellos abiertamente disponibles, y algunos de los cuales sirven como estándares en el campo.
CONCLUSIONES
Los importantes acontecimientos en la neurociencia básica, clínica y el progreso reciente en el campo de las enfermedades neurodegerativas son en parte resultado de la disponibilidad de especímenes humanos (tejido, LCR, plasma, suero) obtenidos a través de bancos de cerebros (16). Estos bancos han optimizado los procedimientos metodológicos, gerenciales y organizativos; procedimientos operativos estándar y cuestiones éticas, legales y sociales, incluido el código de conducta para los bancos de cerebro del siglo XXI y protocolos novedosos.
Los modelos in vitro y de ratones sólo reproducen parte de la fisiopatología de las enfermedades cerebrales, es por ello que sólo el estudio del tejido cerebral humano post- mortem permite estudiar en profundidad la complejidad de las fisiopatología de estas enfermedades.
Se deben tomar medidas estrictas para comprender las potencialidades y limitaciones del tejido cerebral post-mortem para estudios específicos. Los factores pre-mortem y post-mortem pueden interferir con los estudios moleculares y se pueden extraer conclusiones erróneas como consecuencia de no tener en cuenta las posibles fuentes de distorsión y artefactos. No todos los tejidos post-mortem son adecuados para estudios de ADN, ARN y proteínas; ni todos los tejidos son apropiados para determinados ensayos de funciones enzimáticas. Cada cerebro donado es una pieza única de información y objeto de estudio.
Los bancos de cerebros se han creado para obtener, clasificar, conservar y distribuir muestras de tejidos del sistema nervioso y muestras biológicas para la investigación de enfermedades en contextos éticos muy precisos, siendo un reto para nuestra región el promover y desarrollar una red de bancos de cerebro que permita contar con material de estudio en diversos padecimientos en nuestra población. El desarrollar una red de bancos de cerebros en Latinoamérica es un intento de aumentar nuestra comprensión de las enfermedades neurodegenerativas, por lo que se hace indispensable en el Perú, promover la creación de un banco de cerebros y desarrollar investigación científica con altos estándares de calidad en nuestro medio y en nuestra población.
REFERENCIAS BIBLIOGRÁFICAS
1. Cairns NJ, Lantos PL. Brain tissue banks in psychiatric and neurological research. J Clin Pathol. 1996;49:870-3. [ Links ]
2. Alafuzoff I, Winbald B. How to run a brain bank: potentials and pitfalls in the use of human post- mortem brain material in research. Journal of Neural Transmision. 1993; 39 (Suppl 1): 235-43. [ Links ]
3. Morgello S, Gelman BB, Kozlowski PB, Vinters HV, Masliah E, Cornford M, et al. The National NeuroAIDS Tissue Consortium: A new paradigm in brain banking with an emphasis on infectious disease. Neuropathol Appl Neurobiol. 2001;27(4):326-35. [ Links ]
4. Verwer RWH, Baker RE, Boiten EFM, Dubelaar EJG, Van Ginkel CJM, Sluiter AA, et al. Post-mortem brain tissue cultures from elderly control subjects and patients with a neurodegenerative disease. Exp Gerontol. 2003;38(1-2):167-72. [ Links ]
5. Nacul L, O’Donovan DG, Lacerda EM, Gveric D, Goldring K, Hall A, et al. Considerations in establishing a post-mortem brain and tissue bank for the study of myalgic encephalomyelitis/chronic fatigue syndrome: a proposed protocol. BMC Res Notes. 2014;7:370-370. [ Links ]
6. Lopes B, Aparecida Del-Bel E, Pittella JEH, Tumas V. Influence of external factors on the preservation of human nervous tissue for histological studies: Review article. J Bras Patol E Med Lab. 2014;50(6):438-44. [ Links ]
7. Gomez-Nicola D, Boche D. Post-mortem analysis of neuroinflammatory changes in human Alzheimer’s disease. Alzheimers Res Ther. 2015;7(1):42-42. [ Links ]
8. Ferrer I, Martinez A, Boluda S, Parchi P, Barrachina M. Brain banks: Benefits, limitations and cautions concerning the use of post-mortem brain tissue for molecular studies. Cell Tissue Bank. 2008;9(3):181-94. doi: 10.1007/s10561-008-9077-0 [ Links ]
9. Mueller O, Lightfoot S, Schroeder A. RNA Integrity Number (RIN) – Standardization of RNA Quality Control. Waldbronn,Germany: Agilent Technologies;2016.p.1-7. [ Links ]
10. Sonntag K, Tejada G, Subburaju S, Berretta S, Benes F, Woo T . Limited predictability of postmortem human brain tissue quality by RNA integrity numbers. J Neurochem. 2016; 138(1): 53–59. [ Links ]
11. Trabzuni D, Ryten M, Walker R, Smith C, Imran S, Ramasamy A, et al. Quality control parameters on a large dataset of regionally dissected human control brains for whole genome expression studies. J Neurochem. 2011; 119(2):275-82. [ Links ]
12. Braak H, Braak E. Neuropathological stageing of Alzheimer-related changes. Acta Neuropathol.1991;82(4):239-59. [ Links ]
13. Hyman BT, Phelps CH, Beach TG, Bigio EH, Cairns NJ, Carrillo MC, et al. National Institute on Aging – Alzheimer ’ s Association guidelines for the neuropathologic assessment of Alzheimer ’ s disease. Alzheimers Dement. 2012;8(1):1-13. [ Links ]
14. Boluda S, Iba M, Zhang B, Raible KM, Lee VMY, Trojanowski JQ. Differential induction and spread of tau pathology in young PS19 tau transgenic mice following intracerebral injections of pathological tau from Alzheimer’s disease or corticobasal degeneration brains. Acta Neuropathol. 2015;129(2):221-37. doi:10.1007/s00401-014-1373-0 [ Links ]
15. Clavaguera F, Akatsu H, Fraser G, Crowther RA, Frank S, Hench J, et al. Brain homogenates from human tauopathies induce tau inclusions in mouse brain. Proc Natl Acad Sci USA. 2013;110(23):9535-40. doi: 10.1073/pnas.1301175110 [ Links ]
16. Ravid R, Ferrer I. Brain banks as key part of biochemical and molecular studies on cerebral cortex involvement in Parkinson’s disease. FEBS J. 2012;279(7):1167-76. [ Links ]
17. Spunt SL, Vargas SO, Coffin CM, Skapek SX, Parham DM, Darling J, et al. The clinical, research, and social value of autopsy after any cancer death: A perspective from the Children’s Oncology Group soft tissue sarcoma committee. Cancer. 2012;118(12):3002-9. [ Links ]
18. Embuscado EE, Laheru D, Ricci F, et al. Immortalizing the complexity of cancer metastasis: genetic features of lethal metastatic pancreatic cancer obtained from rapid autopsy. Cancer Biol Ther. 2005;4(5):548–54 [ Links ]
19. Shankar S K. Let us promote bio-banking in India for translational research. Neurol India. 2015;63:644-6. [ Links ]
20. Harmon SHE, Mcmahon A. Banking (on) the brain: From consent to authorization and the transformative potential of solidarity. Med Law Rev. 2014;22(4):572-605. [ Links ]
21. Beach TG, Adler CH, Sue LI, Serrano G, Shill HA, Walker DG, et al. Arizona study of aging and neurodegenerative disorders and brain and body donation program. Neuropathology. 2015;35(4):354-89. [ Links ]
22. Lyall DM, Cullen B, Allerhand M, Smith DJ, Mackay D, Evans J, et al. Cognitive test scores in UK biobank: Data reduction in 480,416 participants and longitudinal stability in 20,346 participants. PLoS ONE. 2016;11(4):1-11. [ Links ]
23. Gold ER. Accelerating translational research through open science: The Neuro Experiment. PLoS Biol. 2016;14(12):1-7. [ Links ]
Fuentes de financiamiento: Autofinanciado Declaración de conflictos de interés: No existe conflicto de interés
Correspondencia:
Sandro Casavilca-Zambrano
Calle Las Lilas 105 Dpto. 302, urbanización Valle
Hermoso, Monterrico. Surco, Perú. Teléfono: (51) 996499092
Correo electrónico: scasavilca@inen.sld.pe
Recibido: 21/08/2018
Aceptado: 24/09/2018














