INTRODUCCIÓN
La demencia frontotemporal (DFT) abarca un conjunto de síndromes resultantes de procesos degenerativos de los lóbulos cerebrales frontal y temporal y donde se expresan progresivamente síntomas de deterioro de la personalidad, la conducta social y la cognición 1. Aunque se atribuye la primacía en su descripción a Arnold Pick, neurólogo checo quien en 1892 describió el caso de un varón de 71 años con deterioro mental progresivo y afasia, y fue el mismo Aloys Alzheimer quien denominó en 1911 a esta patología con su nombre epónimo; apenas en 1982 fue descrita formalmente una de sus dos variantes (la afasia primaria progresiva) 2, y la investigación sobre esta patología ha resurgido recién en las últimas décadas 3. Efectivamente, en los últimos 30 años se han publicado 30 000 artículos sobre el tema y más de 6500 sólo en la última década 4. La DFT representa hoy un fructífero y apasionante paradigma de los vínculos estrechos entre neurología y psiquiatría: hasta el 50% de casos de DFT son inicialmente diagnosticados como trastornos psiquiátricos primarios 5, y múltiples datos apuntan a que la base genética de la DFT podría ser compartida con varias patologías psiquiátricas 6; incluso, en casos seleccionados, los trastornos psiquiátricos podrían constituir una fase “prodrómica” de la variante conductual de DFT (DFTvc) 7.
La DFT es la tercera causa más frecuente de demencia, pero en personas menores de 65 años es la segunda más frecuente. Si bien se la ha reportado desde edades tan tempranas como la segunda década de vida, y hasta tan tardías como la décima década, la edad de inicio de la DFT es, en promedio, los 58 años -con la salvedad de que no es sencillo establecer cuándo comienza una enfermedad caracterizada por la falta de insight- 8; esto implica que a consecuencia de la serie de cambios conductuales y de la personalidad que acarrea, la DFT causa discapacidad a personas aún en edad productiva. Por añadidura, dada esta edad relativamente temprana y las formas de presentación incipientes, donde predominan síntomas conductuales más que cognitivos, suele suceder un intervalo de demora - aproximadamente 3 años en países desarrollados- hasta que el diagnóstico correcto de DFT puede establecerse con buen grado de certeza 9. Se entiende que a estas edades el grado de sospecha a priori de una posible demencia sea bajo, y ello influya en la menor detección de posibles casos 10. Se ha estimado que la expectativa de vida tras el diagnóstico de DFT es de 7 a 8 años, aunque la tasa de progresión varía ampliamente entre pacientes 9.
La DFT se divide en dos grandes grupos clínicos, según la sintomatología y localización cerebral predominante del proceso neurodegenerativo: la DFT variante conductual, en la que predomina el deterioro del funcionamiento interpersonal y social y de los rasgos de la personalidad debido a la degeneración de redes neuronales frontotemporales en el hemisferio derecho; y la afasia progresiva primaria (APP), la cual se expresa como resultado de la degeneración frontotemporal del hemisferio izquierdo y comprende dos subtipos clínicos: la variante semántica y la variante no fluente o agramática 8. Cada uno de estos tres síndromes de DFT posee distintos signos y síntomas clínicos, hallazgos de neuroimagen y de histopatología; sin embargo, en la práctica clínica acontece una frecuente superposición y heterogeneidad, sobre todo a medida que la evolución y deterioro de los casos va sucediendo 4. Se estima que aproximadamente el 60% de casos de DFT se presentan con un cuadro clínico conductual (DFTvc). Asimismo, actualmente está establecido que una serie de síndromes motores como el síndrome córticobasal (SCB), la esclerosis lateral amiotrófica (ELA) y la parálisis supranuclear progresiva (PSP), se hallan estrechamente asociados a la DFT debido a que todos estos síndromes clínicos, aunque muy diversos, son similares en etiología y patogénesis 11.
En la medida en que la transición de la pirámide demográfica irá progresando, aumentando el número de pacientes geriátricos y, por ende, incrementándose la frecuencia de patologías neuropsiquiátricas propias de esta población, será más imperioso el adecuado conocimiento de esta devastadora enfermedad para la cual, aunque aún no existe tratamiento, el debido diagnóstico lleva a sustentar un pronóstico, un riesgo de heredabilidad, y exige un plan de afronte diferenciado. Teniendo en cuenta que la variante conductual de la DFT es la más común y es la que con mayor frecuencia constituye un reto diagnóstico en la práctica psiquiátrica, dada la limitada sensibilidad y especificidad de las neuroimágenes en etapas tempranas de la enfermedad, y que aún no existen biomarcadores moleculares de uso clínico generalizado para el diagnóstico de este tipo de demencia (con excepción de análisis genéticos, en algunos casos específicos con agregación familiar), a la necesidad de un correcto diagnóstico diferencial basado en la clínica se orienta esta breve revisión narrativa.
Definición y criterios clínicos
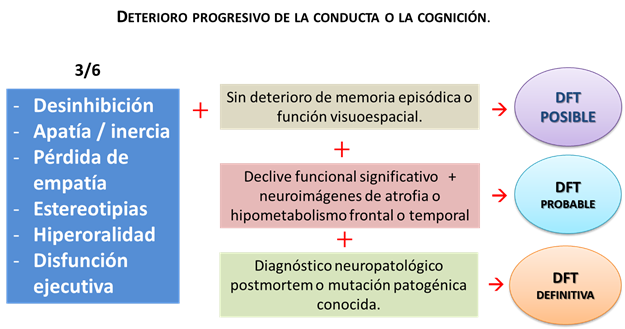
Los criterios que actualmente se emplean para el diagnóstico de la DFTvc fueron establecidos en el año 2011 1,12,13, en base a la experiencia acumulada en más de una década, se constituyó el International Behavioural Variant FTD Criteria Consortium (FTDC) para revisar criterios propuestos previamente y elaborar nuevos criterios de consenso. En general, como criterio clave de la DFTvc se estipula que el paciente debe mostrar deterioro progresivo de conducta, personalidad o de la cognición, a partir de la observación o la historia clínica aportada por un informante confiable. Para considerar una “posible” DFTvc deben verificarse al menos tres de los siguientes síntomas conductuales: 1) desinhibición, 2) apatía o inercia, 3) pérdida de la empatía, 4) conductas perseverativas o estereotipadas, 5) hiperoralidad o cambios dietéticos y, 6) perfil neuropsicológico con déficit ejecutivos pero relativa preservación de memoria y funciones visuoespaciales. La desinhibición, apatía o inercia, pérdida de empatía y las conductas perseverativas deben ser “tempranas”, es decir, presentarse en los primeros tres años de inicio del cuadro clínico. Para considerar una “probable” DFTvc, aparte de los criterios antes enunciados, debe evidenciarse declinación funcional significativa y los estudios de imágenes deben ser consistentes (atrofia, hipometabolismo o hiperfusión frontal o temporal). Se considera un caso “definitivo” de DFTvc siempre que se hallan verificado los criterios antedichos y exista evidencia histopatológica de degeneración lobar frontotemporal (por biopsia o microscopía postmortem) o se identifique una mutación genética específica. Finalmente se estipula que el patrón de déficits no debe ser mejor explicado por otras patologías o diagnósticos psiquiátricos y que no deben existir biomarcadores que sugieran enfermedad de Alzheimer u otra enfermedad neurodegenerativa (Gráfico 1).
El contexto cultural puede influir poderosamente en la vivencia, expresión y reconocimiento de las anomalías conductuales de diversas patologías neuropsiquiátricas, y las enfermedades neurodegenerativas no son la excepción. Pero además estos factores socioculturales también, hasta cierto punto, pueden influir en el pronóstico. Los diferentes idiomas y dialectos hablados en nuestro continente; los diversos grados de instrucción -con una importante población aún analfabeta-; las idiosincrasias étnicas que modifican la expresión de síntomas; las creencias y prejuicios que retardan la búsqueda de atención o sesgan el relato de la anamnesis; incluso la creencia popular y extendida de que la demencia es una etapa al final de la vida, son un pequeño muestrario de los múltiples factores socioculturales que subyacen en el panorama del abordaje médico y científico de la DFT en América Latina 14. Diversos estudios se han ejecutado en contextos socioculturales diferentes pero escasean en América Latina: por lo tanto debe tenerse en cuenta, en nuestros múltiples y variopintos entornos, que los cambios conductuales y de personalidad podrían fácilmente pasar desapercibidos o ser interpretados desde perspectivas muy distantes al juicio médico 13.
Epidemiología
Según la Organización Mundial de la Salud, globalmente se calcula que 50 millones de personas padecen demencia (el 60% de casos en países de ingresos medios a bajos) y que cada año se suman 10 millones de casos nuevos 15. Se calcula que para el año 2050 habrá 27 millones de personas con demencia en América Latina 16).
La determinación de cifras precisas de personas afectadas con DFT en la población es ardua por la baja frecuencia de la patología en una gran cantidad de personas en alto riesgo, sin contar con la dificultad diagnóstica inherente a la DFT 17. Una de las cifras más citadas es la de Knopman y Roberts, quienes estimaron en EEUU la prevalencia de DFT entre los 45 y 65 años en una cifra de entre 15 a 22 por 100 000 personas, con una incidencia anual de 2,7 a 4,1 casos por 100 000 en el mismo grupo poblacional 18. Sin embargo, se registra importante variabilidad de cifras de prevalencia en diferentes zonas geográficas, algo típico de los trastornos con una alta heredabilidad 19.
A nivel latinoamericano, la menor tasa de escolaridad y el elevado índice de analfabetismo, así como la alta tasa de comorbilidades médicas que influyen negativamente sobre la salud cerebral 20, contribuyen a generar mayores riesgos para el desarrollo de demencia. Sin embargo, los sistemas de salud públicos y privados en la región no están adecuadamente equipados para facilitar el diagnóstico temprano de los distintos síndromes clínicos demenciales. Es por estas y otras razones que la prevalencia exacta de DFT en países latinoamericanos es desconocida. Aproximaciones importantes son los datos encontrados en Venezuela, Brasil y Perú, donde las cifras de prevalencia de DFT oscilan entre 1,2 y 1,8 casos por 1000 personas mayores de 65 años, con cuantía mayor en la serie brasileña 21. Se ha apuntado a una supuesta mayor frecuencia de la DFT en varones, pero en general no hay datos consistentes de ello 10.
Patología
En breve, la neuropatología de la DFT es bastante más compleja y heterogénea que la correspondiente a la EA 22. A nivel macrotisular se caracteriza por atrofia focal grave en los lóbulos frontal y temporal (al punto que el aspecto de los giros cerebrales se describe como “en filo de navaja”), gliosis subcortical, cambios microvacuolares y pérdida neuronal. El término degeneración lobar frontotemporal (DLFT) es un concepto abarcador de todas las formas histopatológicas subyacentes en la DFT así como también de otros síndromes clínicos atípicos 23.
Si bien hace 20 años la patología de la DFT se clasificaba simplemente en aquellos casos con inclusiones intraneuronales de proteína Tau (los clásicos cuerpos de Pick) o sin ella, hoy en día se reconoce un amplio abanico de inclusiones proteicas intracelulares, las que se pueden agrupar en tres grandes grupos: los dos principales dependen de la presencia de proteína τ (Tau) o de proteína ubiquitinada TDP-43, estas dos conforman más del 90% de casos, el resto corresponde a inclusiones de la proteína fusionada en sarcoma (FUS) y algunos subtipos menores 24. Existen múltiples subtipos moleculares dentro de cada variedad histopatológica y cada patrón puede presentarse con diferentes manifestaciones clínicas. Por ejemplo, el patrón de la DFTvc es impredecible: igual número de casos presenta inclusiones Tau positivas y ausencia de estas inclusiones. Las variantes del lenguaje pueden demostrar mejor asociación entre subtipos patológicos y expresiones clínicas 22.
Específicamente, la proteína Tau, sintetizada desde el gen MAPT, tiene la función de facilitar la polimerización de los microtúbulos neuronales (imprescindibles para la estructura celular, formación de dendritas y transporte intracelular). El cerebro adulto presenta 6 isoformas de la proteína Tau que varían entre 352 a 441 aminoácidos. Según la transcripción de determinados exones, se expresan dos formas diferentes de las regiones que se ligan a las proteínas tubulinas: una forma con tres repeticiones de segmentos aminoacídicos (3R) y otra isoforma con cuatro repeticiones (4R). Es fascinante el hallazgo de que sea imprescindible el equilibrio entre cantidad de formas 3R y 4R, pues de lo contrario la neurodegeneración y la demencia se suscitan. Otros factores como la excesiva fosforilación también afectan la capacidad de la proteína tau de interactuar con los microtúbulos 22-24.
Por su parte, TDP-43 (proteína de respuesta transactiva conjugada a ADN, masa molecular de 43 kDa) es una proteína esencial para la vida de las células nerviosas pues regula la expresión genética. Se han caracterizado cuadro subtipos de TDP-43 según la respuesta inmunohistoquímica que permite su identificación: A, B, C, D. Esta tipificación reviste importancia porque se asocia a diferentes factores de riesgo genéticos y expresiones clínicas. Por ejemplo, el tipo B es el presente en casi la totalidad de casos de DFT asociado a ELA, con predominio de DFTvc respecto a otros tipos, asimismo los síntomas psicóticos son prominentes El tipo C tiene una fuerte asociación con la DFT variante semántica. En el tipo A son notables la presencia de apatía y aislamiento social y si subyacen alteraciones en el gen c9orf72 o GRN, los síntomas psicóticos son prominentes 22-24.
Genética
La DFT es una entidad con alta heredabilidad, que alcanza el 40% de los casos, pero solo el 20% tiene un patrón de herencia autosómica dominante claro 24. De estos últimos, el 60% corresponde a mutaciones en los genes MAPT (proteína tau asociada a microtúbulos), GRN (progranulina) y C9orf72 (cromosoma 9 open reading frame 72). Cada uno de estos tres grupos genéticos causa entre el 5 y 10% de todas las DFT. También existen variantes menores como las correspondientes al gen CHMP2B, gen VCP, gen SQSTM1, gen FUS. La DFTvc es la que posee mayor heredabilidad, respecto a las otras variantes clínicas de DFT, sobre todo cuando se asocia a enfermedad de la neurona motora 25. Sin embargo, la DFTvc no es una enfermedad puramente genética, como otras enfermedades neurodegenerativas, aunque tampoco es una condición fundamentalmente esporádica (como la mayoría de casos de EA, aunque existen casos de EA debidos a mutaciones autosomales dominantes). Hay que tener en cuenta que una misma alteración genética puede presentarse con formas fenotípicas diferentes 26,27.
Pacientes portadores de la rara mutación genética VCP (Valosin-containing-protein) tienden a iniciar su enfermedad a edad temprana (edad promedio 40 años), los portadores de la repetición del gen C9orf72 debutan alrededor de los 50 años, los portadores del gen MAPT alrededor de los 55 años mientras que los pacientes que presentan su enfermedad más tardíamente son aquellos con el gen GRN (tan tardíamente como los 65 años o más) 28.
Cuadro clínico
La DFTvc presenta un amplio abanico de signos y síntomas neurocognitivos desde sus estadios más tempranos, que pueden valorarse como cambios de personalidad, desinhibición y pobre control de impulsos, factibles de hallarse en múltiples patologías psiquiátricas (manía, abuso de sustancias, trastornos de personalidad primarios y secundarios, trastornos del control de impulsos diversos como la ludopatía). Pero por otro lado también son ostensibles la apatía y abandono de las rutinas e iniciativas previas en el individuo o el desarrollo de conductas estereotipadas o perseverantes, todo lo cual puede a su vez confundirse con padecimientos como la depresión en sus múltiples formas, trastorno obsesivo compulsivo, síndromes catatónicos, síndrome de Diógenes y hasta trastornos de conducta alimentaria, etc. 29,30. Entre los síntomas de la DFTvc, la apatía es el síntoma más frecuentemente reportado (hasta 84%), seguido de desinhibición (76%), pérdida de empatía (73%), conductas motoras estereotipadas o compulsivas (71%), hiperoralidad y cambios alimenticios (59%) 31. Clásicamente, en la semiología médica se ha distinguido al síntoma como una queja expresada por el paciente y que es subjetiva por no poderse objetivar fácilmente (dolor, pena, ansiedad), mientras que el signo es una queja objetiva y que se puede evaluar de modo externo a la vida psíquica del paciente y tangiblemente (hemiparesia, desinhibición, por ejemplo). Los pacientes con DFTvc prácticamente nunca se presentan con quejas de ningún tipo (síntomas ni signos), y es a través del examen neurológico y mental y la anamnesis obtenida a través del familiar, que recogemos los datos de la enfermedad.
Además, la DFTvc se asocia a la eclosión de síntomas de psicosis en un 25% de casos reportados, lo que puede tornar más abigarrado el cuadro y ampliar el confuso diagnóstico diferencial con múltiples tipos de psicosis primarias, desde esquizofrenias de inicio tardío, trastornos delirantes, psicosis cicloides y psicosis polimorfas 32. Desde luego, si se tiene en cuenta que la prevalencia estimada de DFT (15- 22 por 100 000) es aproximadamente dos órdenes decimales menos frecuente que los trastornos psiquiátricos primarios (4 por 1000 en psicosis primarias), no sorprenderá el sobrediagnóstico de trastornos psiquiátricos primarios frente a DFT, por una cuestión meramente estadística 33, y además por el desconocimiento sobre temas propios de la DFT por parte de los médicos evaluadores y prescriptores 34. Se ha demostrado la dificultad diagnóstica entre DFTvc y trastornos psiquiátricos primarios; por ejemplo, en cohortes de pacientes neuropsiquiátricos diversos, la aplicación de los criterios clínicos diagnósticos de DFTvc posee una baja especificidad (27%) y las pruebas de imágenes cerebrales distan de una sensibilidad óptima 5. Al inicio, la atrofia focal de las estructuras cerebrales puede aún no ser evidente en las neuroimágenes, o ser reportada como inespecífica 35. Ello mismo acrecienta la necesidad de estructurar pautas que mejoren el diagnóstico clínico diferencial (sin dejar de resaltar que en una minoría de casos es factible el diagnóstico certero y “definitivo” cuando se dispone de una prueba genética).
El perfil neuropsicológico de DFTvc parece estar bien caracterizado y correlaciona con los hallazgos patológicos 36; sin embargo la característica disfunción ejecutiva y los trastornos del lenguaje se presentan recién en estadios moderados de la enfermedad 37 (debe señalarse que, en un pequeño porcentaje de casos, la disfunción ejecutiva puede ocurrir en estadios tempranos, cuando los cambios de conducta y personalidad aún no están acentuados, y pueden semejar casos de trastorno de déficit de atención de inicio tardío). Asimismo, es necesario hacer hincapié en que encasillar a los casos de DFTvc como exclusivos de pacientes menores de 65 años de edad puede ser uno de los motivos adicionales del retraso en el diagnóstico oportuno, pues cada vez hay más evidencia que hasta el 25% de los pacientes con demencia después de los 65 años pueden corresponder a DFTvc 38.
Generalidades acerca del diagnóstico diferencial
Recientemente el Neuropsychiatric International Consortium for Frontotemporal Dementia efectuó una revisión bibliográfica destinada a consensuar las mejores prácticas clínicas acerca del diagnóstico diferencial entre DFTvc y diversos trastornos psiquiátricos 5. En esta publicación se remarcó la importancia de una historia clínica bien construida, y se subrayó que dada la característica anosognosia de los pacientes con DFTvc, la historia obtenida y corroborada a partir de uno o más acompañantes o cuidadores, es esencial 39. Es obligatorio elaborar una meticulosa línea del tiempo donde se registre la presentación progresiva de los síntomas, con énfasis en aquellos que suelen ser tempranos en la DFTvc, como anomalías de la conducta, del lenguaje, del estado de ánimo, y la relación de estos con eventuales eventos vitales; es importante recordar que la mayoría de trastornos psiquiátricos primarios empiezan en la adolescencia o adultez joven, pero existen trastornos psiquiátricos de inicio tardío que se presentan a la misma edad que la DFTvc (entre 40 y 70 años). En la DFTvc se espera un inicio insidioso con deterioro progresivo (que puede ser lento, en años) en oposición a un inicio abrupto o un curso fluctuante, con episodios más o menos definidos y remisiones intermedias, característico de los trastornos psiquiátricos primarios 5. Igualmente, a la larga todos los pacientes con DFTvc acabarán perdiendo su independencia funcional, mientras que no todos los pacientes con enfermedades psiquiátricas crónicas sufren pérdida de su independencia.
Asimismo, se incide en que, dado el amplio abanico de diagnósticos diferenciales, es crucial explorar los terrenos neurológico y psiquiátrico adecuadamente. Algunos síntomas de interés particular son aquellos asociados a signos neurológicos específicos como el fenómeno de la mano alienada (SCB), caídas frecuentes (PSP), o disfagia (ELA) 10, y signos parkinsonianos. La presencia de antecedentes psiquiátricos se asocia con una mayor probabilidad diagnóstica de trastornos psiquiátricos primarios, obviamente, pero no debe pasarse por alto la posibilidad de emergencia de síntomas de DFTvc en pacientes con enfermedad mental crónica previamente establecida, como se va revelando en casos reportados cada vez más frecuentemente y asociados a la mutación genética C9orf72 40. Igualmente, la presencia de antecedentes familiares diversos, de tipo psiquiátrico, podría ser una evidencia de neurodegeneración no detectada, y no debiera sesgar precozmente y descartar la posibilidad de una DFTvc 41.
Se ha sugerido también que no necesariamente ante un caso en que se superpongan los síntomas de un hipotético trastorno psiquiátrico primario y de una DFTvc, deba considerarse la exclusión necesaria de una de las dos posibilidades. 31 Por ejemplo, la mayoría de trastornos psiquiátricos suelen iniciarse en edad juvenil, pero al avanzar la edad de algunos pacientes puede parecer que la patología deviene “resistente al tratamiento”, cuando lo que sucede es que está emergiendo la DFTvc. No debe dejar de tenerse muy en cuenta que el diagnóstico psiquiátrico y neurológico muchas veces requiere una perspectiva longitudinal, de seguimiento, que aporte panorama al razonamiento diagnóstico transversal: en el caso de una patología degenerativa como la DFTvc resultará evidente un deterioro progresivo, cognitivo y funcional, aunque de velocidad variable, a lo largo del tiempo 5.
Una observación constante y clave para el diagnóstico diferencial es la presencia del sufrimiento emocional, el padecimiento evidente y notorio que caracteriza a la mayoría de trastornos psiquiátricos primarios y que es ausente en la DFTvc, pues cursa frecuentemente con un prominente aplanamiento afectivo (propio de los síntomas cardinales de pérdida de empatía y la profunda apatía de los pacientes afectados), aunque se ha observado también, en algunos pacientes, quienes describen su estado de ánimo como “perfecto”, una sonrisa superficial y vana, no resonante. Otro elemento discriminador es el grado de preocupación, usualmente presente en los trastornos psiquiátricos primarios (a excepción de las psicosis más severas) a diferencia de la completa anosognosia en la DFTvc 5. La inquietud o la agitación de algunos pacientes con DFTvc no deben ser confundidas con verdadera ansiedad, en la que suele hallarse un correlato psíquico comprensible 29; asimismo, la falta de actividad motora en general, la apatía, y la abulia de otros pacientes con DFTvc no deben ser interpretadas como signos de un cuadro depresivo. Se recomienda una evaluación interdisciplinaria, por más de un médico con experiencia en enfermedades neurodegenerativas, desde diversas especialidades (psiquiatría, neurología, geriatría) para aclarar los casos más difíciles.
En el examen físico deben buscarse con énfasis aquellas anomalías descritas en la historia y aquellas que pueden apuntar a trastornos relacionados con DFTvc como los síntomas motores del parkinsonismo, alteración de los movimientos oculares (sugestivos de PSP). Puede haber signos de degeneración de la neurona motora superior (hiperreflexia, hipertonía, espasticidad, signos de Hoffman y Babinski) e inferior (debilidad, atrofia, fasciculaciones e hiporreflexia). En pacientes con DFTvc igualmente se deben buscar fasciculaciones y atrofia de la lengua, además de disartria y disfagia, sugestivos de involucramiento bulbar o pseudobulbar como en ELA o PSP. Aunque los signos de liberación frontal (aparición de reflejos primitivos como succión, palmomentoniano, prensión, etc.) son expresión de vías neurales afectadas en el córtex prefrontal, son de dudosa utilidad en distinguir DFTvc respecto a trastornos psiquiátricos primarios pues acontecen igualmente en ambos grupos de patologías 41.
Uso de tests clínicos a la cabecera del paciente
En general no existen escalas aplicables “en la cabecera del paciente”, es decir, sencillas y rápidas que permitan una distinción precisa entre DFTvc y trastornos psiquiátricos primarios. Algunas de las pruebas cognitivas breves (PCB) como el Addenbrooke’s Cognitive Examination version III (ACE-III) sí permiten distinguir entre DFT y otros tipos de demencia, como la enfermedad de Alzheimer (EA), pero puede tomar más de 15 minutos en ser administrada pues es una prueba de evaluación cognitiva global que incluye orientación, atención, memoria, lenguaje, fluencia verbal y habilidades visuoespaciales 42. Incluso la detección de disfunción ejecutiva, en acepción amplia, tampoco es un indicador potente de DFTvc pues es inespecífica, y se la encuentra también, en grado variable, en diversos trastornos psiquiátricos primarios; sin embargo, INECO frontal screening (IFS) podría sugerir disfunción ejecutiva en pacientes con demencia, con la ventaja adicional que puede tomar alrededor de 10 minutos y podría ser realizada en el consultorio externo 43. Es recomendable asociar pruebas breves de cognición social para incrementar la especificidad diagnóstica de DFTvc, como la versión abreviada de Social Cognition and Emotional Assessment (Mini- SEA) que permite evaluar motivación, teoría de la mente y reconocimiento de emociones a través de los ojos 44. Adicionalmente, pruebas socio-conductuales administradas al acompañante/cuidador son útiles para discriminar DFTvc de otros desórdenes psiquiátricos primarios, como el Frontal Behavioral Inventory (FBI) 45, Interpersonal Reactivity Index (IRI) 46 y la versión revisada del Self-Monitoring Scale (r-SMS) 47. De hecho, existe un grupo de pacientes, en que la evaluación cognitiva breve debe ser complementada con una evaluación neuropsicológica formal porque sus trastornos no pueden ser detectados o porque la evaluación neuropsicológica puede contribuir al diagnóstico diferencial 48.
Teniendo en cuenta que una PCB debe ser estandarizada, cuantificable, replicable, sensible y válida en la población específica en la que se quiere utilizar 49, a continuación, detallamos brevemente aquellas que se han validado y emplean en Perú para discriminar DFTvc 50:
Addenbrooke’s Cognitive Examination version III (ACE-III): Es una versión revisada de las PCBs ACE (cuya versión ha sido adaptada y validada para Perú por Custodio et al.) 51 y ACE-R. Se compone de cinco subescalas (atención, memoria, lenguaje, fluencia verbal y habilidades visuoespaciales), siendo el puntaje máximo de 100 puntos. Para cada una de las sub-escalas del ACE-III se realizaron los siguientes cambios: se unificaron las subescalas de orientación y atención, y dentro de las mismas se eliminó el deletreo en orden inverso de la palabra «MUNDO» quedando únicamente la serie de substracción. Para la subescala de lenguaje la oración «cierre los ojos» fue removida y la tarea de escribir una oración fue modificada por escribir dos oraciones sobre una temática en común. Las órdenes complejas fueron sustituidas por órdenes de tres comandos simples con un incremento en la complejidad sintáctica, las dos frases utilizadas con anterioridad para la prueba de repetición fueron modificadas y en la prueba de denominación se reemplazaron los dos primeros objetos «reloj y lápiz» por otros dos altamente familiares (cuchara y libro). En el dominio de las habilidades visuoespaciales los pentágonos fueron reemplazados por el diagrama del infinito. Los dominios de memoria y fluencia verbal no fueron modificados. Para Argentina, Chile y Uruguay con un puntaje de corte de 86, es posible distinguir pacientes con Alzheimer de sujetos sanos controles, con una sensibilidad del 98 % y una especificidad del 82 % 48, cuyas normativas pueden ser revisadas en el capítulo de test de evaluación en demencia del Manual de buenas prácticas para el diagnóstico de demencias 52, en los próximos meses, podremos tener los puntos de corte del ACE-III en Perú para población de baja educación.
INECO Frontal Screening (IFS): el IFS evalúa en detalle algunas funciones ejecutivas (8 sub-tests), asignando un total de 30 puntos (programación motora=3; instrucciones conflictivas=3; control inhibitorio motor=3; dígitos en orden inverso=6; memoria de trabajo verbal=2; memoria de trabajo espacial=4; abstracción=3; control inhibitorio verbal=6) donde puntajes más bajos indican peor rendimiento cognitivo. El IFS se inicia con la evaluación de series motoras, pidiendo al individuo evaluado que realice consecutivamente la serie de Luria (puño, canto y palma). Seguidamente se evalúan las instrucciones conflictivas y control inhibitorio motor, mediante la realización de una serie de consignas. Luego, se evalúa la repetición de dígitos hacia atrás y la memoria de trabajo verbal a través de la denominación de los meses del año, empezando desde el último mes. Para la memoria de trabajo visual o espacial, se pide al individuo evaluado señale la serie de los cubos dibujados en el orden inverso al que realiza el evaluador. En abstracción, se evalúa la interpretación de tres refranes. Finalmente, en el control inhibitorio verbal, durante la fase de iniciación se solicita al individuo evaluado que complete lo más rápido posible una frase incompleta con una palabra; mientras que, en la segunda fase, de inhibición se solicita al individuo evaluado se pide que complete la frase con una palabra que no tenga ningún sentido con el contexto de la oración. El IFS en Argentina y Uruguay con un punto de corte de 25 (sensibilidad: 96,2 %; especificidad: 91,5 %) permite diferenciar a sujetos controles sanos de pacientes con demencia 49; mientras que en Perú con un punto de corte de 18 (sensibilidad: 97,1 %; especificidad: 97,9 %) se logró discriminar pacientes con DFTvc de pacientes con EA 53. Las normativas de administración pueden ser revisadas en el capítulo de test de evaluación en demencia del Manual de buenas prácticas para el diagnóstico de demencias 52.
Mini-Social Cognition and Emotional Assessment (Mini-SEA): Comprende dos sub-pruebas, el Faux-pas y el test del reconocimiento de las emociones faciales. El Faux-pas evalúa teoría de la mente y consiste en diferentes escenas ‘sociales’, que permiten probar la capacidad de los pacientes para detectar falsos pases sociales, así como explicar por qué y cómo se produjo un falso pase en cada escena. Se presentan 10 escenas sociales (+ 1 escena de ejemplo). El paciente lee cada historia por sí mismo antes de que el clínico haga algunas preguntas sobre la misma. El paciente puede leer la historia en voz alta, si lo prefiere, y puede volver a leerla en cualquier momento, incluso después de cada pregunta. El test de reconocimiento de emociones faciales requiere que el paciente reconozca las emociones de las caras. El paciente puede elegir entre 7 emociones para cada cara: Felicidad - Sorpresa- Neutral - Tristeza - Miedo - Asco - Ira. El test actual comprende 35 rostros. Cada emoción se presenta 5 veces para los rostros masculinos y femeninos caucásicos. Actualmente el Mini-SEA se emplea en Latinoamérica, incluyendo Perú en el estudio del Multi- Partner Consortium to Expand Dementia Research in Latin America (ReDLat) 54. Las normativas para su administración pueden ser revisadas en el capítulo de test de evaluación en demencia del Manual de buenas prácticas para el diagnóstico de demencias 52.
Frontal Behavioral Inventory (FBI): Es un cuestionario de conducta basado en el informante, desarrollada para identificar DFTvc 45. El FBI se conforma de dos sub-escalas, una de síntomas negativos (por ejemplo, apatía, indiferencia o pérdida de insight) y otra de síntomas positivos (conducta social inapropiada, agresión o hiperoralidad) con rangos de puntajes de 0 a 72, donde elevados puntajes indica severo disturbio conductual. En un estudio peruano con población de baja educación (menos de 6 años) la especificidad del FBI fue ideal con una sensibilidad del 83% reflejando el severo compromiso de cognición social a juicio de sus informantes/cuidadores 55.
El Interpersonal Reactivity Index (IRI) está conformado por cuatro dimensiones independientes de 7 ítems cada una: a) Fantasy (F) que denota la tendencia de los sujetos a identificarse con personajes ficticios como personajes de libros y películas (por ejemplo, después de ver una obra de teatro o una película, me siento como si fuese uno de los protagonistas), b) Perspective taking (PT) que contiene ítems que reflejaban la tendencia o habilidad de los sujetos para adoptar la perspectiva o punto de vista de otras personas (por ejemplo, a veces intento entender mejor a mis amigos imaginando cómo ven las cosas desde su perspectiva), c) Empathic concern (EC) que contiene ítems que evaluaban la tendencia de los sujetos a experimentar sentimientos de compasión y preocupación hacia otros (por ejemplo, a menudo tengo sentimientos de compasión y preocupación hacia gente menos afortunada que yo) y d) Personal distress (PD) que incluye ítems que indicaban que los sujetos experimentaban sentimientos de incomodidad y ansiedad cuando eran testigos de experiencias negativas de otros (a veces me siento indefenso/a cuando estoy en medio de una situación muy emotiva). Los cuidadores fueron entrevistados para contestar cada una de los 28 ítems que reflejan la conducta del paciente en una escala de 1 (no lo describe) a 5 (lo describe muy bien) 52. En el estudio peruano con población de baja educación (menos de 6 años) los pacientes con DFTvc alcanzaron significativamente bajos puntajes en el IRI representando peores rendimientos comparados con los pacientes con EA; mientras que el sub-ítem IRI-EC tuvo una alta sensibilidad y especificidad moderada (87,9% y 66,7% respectivamente), el IRI-PT tuvo alta sensibilidad y especificidad (93,9% y 88,9% respectivamente) 55. Self-Monitoring Scale version revisada (r-SMS): Evalúa la capacidad de adaptar la conducta al contexto social, es un cuestionario diseñado para evaluar el grado por el cual los sujetos atienden las señales socio- emocionales de los otros y permiten que estas señales influencien su conducta. Consiste de sub-escalas diseñadas para medir elementos cognitivos de empatía: la sub-escala Expressive Behavior (EX) la cual mide la sensibilidad de los sujetos para expresar la conducta de los otros, y la sub-escala de Self-Presentation (SP), la cual mide la tendencia de los sujetos para monitorear su auto-presentación. Un informante (familiar cercano) es interrogado para puntuar sobre una escala Likert de 6 puntos (1= ciertamente, siempre falso a 6= ciertamente, siempre verdadero) qué tan bien cada una de las 13 declaraciones del cuestionario describe la capacidad del paciente para modular su comportamiento en diversas situaciones sociales 47. El r-SMS tuvo sensibilidad ideal con especificidad moderada (72,2%) para discriminar pacientes con DFTvc en una muestra de baja educación 55.
En centros especializados de enfermedades neurodegenerativas la evaluación debe incluirse examen clínico, neurológico, neuropsicológico, líquido cefalorraquídeo, biomarcadores, imágenes cerebrales y evaluación genética 5. El examen neuropsicológico recomendado debe incluir atención (dígitos hacia adelante, parte A del Trail Making Test), lenguaje, memoria episódica (verbal y no verbal), memoria de trabajo (dígitos hacia atrás), habilidades visuo-espaciales y funciones ejecutivas (test de Stroop, parte B del Trail Making Test) 52,54. En el afán de obtener instrumentos que sean de uso clínico directo y sencillo, Ducharme y cols. 7 han elaborado un instrumento denominado Lista de chequeo DFT versus TPP (TPP: trastorno psiquiátrico primario) que consiste en una lista de 17 ítems: un puntaje igual o mayor a 11 tiene valor predictivo positivo de DFTvc de 89,2% y un puntaje de 8 a menos tiene valor predictivo positivo de 92,7% para TPP. La especificidad por arriba y debajo de los puntos de corte es mayor a 90%. Su aplicación no toma más de 5 minutos y los ítems son categoriales (sí / no) lo que facilita su aplicación. El valor de esta lista de chequeo es servir como complemento a una amplia evaluación neuropsiquiátrica.
Diagnóstico diferencial con la depresión
Aunque la DFTvc y la depresión mayor comparten algunos síntomas similares como la pérdida de interés, falta de motivación, baja energía y problemas de concentración (que podrían hallarse en una depresión grave, con intensa afectación de la esfera cognitiva), en la DFTvc se echa en falta el profundo desánimo con ideas catatímicas de culpa y de minusvalía, incluso con ideas suicidas, además que resalta el aplanamiento afectivo usual y prominente en la DFTvc. Aunque la depresión puede manifestarse a veces no por ánimo depresivo sino por anhedonia y pérdida de interés en las actividades, lo que puede confundirse con la apatía propia de la DFTvc, es psicopatológicamente posible distinguir ambos fenómenos por cuanto la apatía en la DFTvc no despierta sentimientos de disforia ni sufrimiento psíquico 10. Es decir, el paciente con DFTvc no se queja de su apatía, no la vive con carga de sufrimiento. Se ha señalado que podría haber dificultades en el diagnóstico de DFTvc respecto a la depresión atípica o la depresión grave: con la atípica, pues cursa con incremento del apetito y esto podría confundirse con la hiperorexia que se ve en DFTvc 56. En los casos severos de depresión puede evidenciarse retraimiento social y apagamiento emocional que podrían confundirse con la pérdida de empatía propia de la DFTvc. No debe perderse de vista la totalidad del cuadro sintomático para facilitar el discernimiento en base a los otros síntomas del cortejo 56.
Siempre debe considerarse a la DFTvc en el diagnóstico diferencial de aquellas depresiones de evolución tórpida, sin antecedentes de otros episodios depresivos en edad temprana, y que no muestran respuesta al tratamiento; asimismo aquellos casos con llamativa afectación cognitiva, más aún si esta es creciente (la antes llamada pseudodemencia depresiva) 31.
Diagnóstico diferencial con el trastorno bipolar
Los datos clínicos que pueden ser compartidos entre DFTvc y el trastorno bipolar, específicamente durante los episodios maniacos, son la desinhibición, irritabilidad, distraibilidad, impulsividad, juicio social alterado (con invasión de espacio personal, desenfado, irrespeto, lenguaje profano, comentarios inapropiados o zahirientes) e involucramiento desmedido en actividades placenteras 24. Empero, los pacientes con DFTvc raramente lucen a la extrospección llamativamente joviales y eufóricos o con sentimientos de grandiosidad e invulnerabilidad, como los maniacos habituales, si bien puede observarse en algunos de ellos una hilaridad insulsa, vacía, carente de real sustancia anímica, que enmascara el aplanamiento afectivo. Tampoco se apreciará la disminución de necesidad de sueño o el incremento de energía psicofísica, característicos de la manía. Pero lo más notable, en la DFTvc es inexorable el deterioro de funciones conductuales y cognitivas mientras que el trastorno bipolar implica episodios recurrentes sin deterioro 5,50). Esto debe tomarse con la debida cautela porque estudios recientes demuestran, sin embargo, que, comparados con sujetos sin patología, las personas con trastorno bipolar presentan lesión de las funciones cognitivas y del lenguaje -asociados a la edad- más pronunciada y acelerada 57.
Igualmente, un rasgo compartido entre el trastorno bipolar y la DFTvc es la impulsividad. Es esperable que esta característica aparezca solo durante los episodios maniacos del trastorno bipolar, mientras que en la DFTvc es constante cuando se presenta como síntoma 56. La inquietud psicomotora que se puede ver en bipolares debe deslindarse de los movimientos repetitivos y estereotipados que suelen presentarse en DFTvc 10.
No existe consenso sobre cuál es la edad de corte para asumir que un trastorno bipolar es de “inicio tardío”. Sin embargo, hasta 10% de casos de trastorno bipolar pueden iniciarse después de los 50 años de edad, lo que obliga a efectuar un ponderado diagnóstico diferencial 41.
Se ha tratado de dilucidar si existe homogeneidad en la naturaleza de la relación entre el trastorno bipolar y la DFTvc pero al parecer no hay uniformidad en este aspecto. En ciertos casos, puede suscitarse un episodio maniaco o hipomaniaco como pródromo de DFTvc. Pero también hay casos de real trastorno bipolar de inicio tardío sin relación con DFTvc, (excepto que puede confundir el diagnóstico diferencial en un inicio). En una proporción mucho menor, hay casos que sugieren asociación de una predisposición genética subyacente (C9orf72, GRN u otros) con formas de trastorno bipolar 58. La perspectiva de investigación queda sin embargo abierta pues el trastorno bipolar se asocia a un mayor riesgo de desarrollo de demencias en general y un grupo de pacientes con este trastorno pueden seguir un curso cognitivamente deteriorante en etapas avanzadas de su patología 59,60.
Diagnóstico diferencial con trastorno obsesivo compulsivo (TOC)
Análogamente, si bien los movimientos estereotipados y repetitivos son frecuentes en la DFTvc -como en algunas otras patologías neurodegenerativas-, en el TOC podremos detectar la presencia de obsesiones, esto es pensamientos repetitivos, intrusos, parásitos, desasosegantes y egodistónicos, como disparadores detrás de las compulsiones. En la DFTvc es llamativo que los pacientes rara vez describan alguna obsesión 5. Tampoco se logra identificar la ansiedad como correlato psicopatológico de los rituales, que es lo usual en el TOC 9. Del mismo modo, el conjunto de pacientes con TOC son capaces de discernir que sus obsesiones y compulsiones resultan desmesuradas y carente de lógica, mientras que los pacientes con DFTvc carecen totalmente de autocrítica respecto a sus rituales y conductas estereotipadas. Desde luego, el TOC de inicio después de los 50 años es muy infrecuente. Solo el 15% de casos empieza después de los 35 años 29.
Las conductas repetitivas en la DFTvc van desde las más elementales a las complejas: desde movimientos reiterativos de las manos o pies, repetir palabras o sonidos sin sentido, gestos faciales, toqueteo de objetos, hasta acumulación patológica de pertenencias y rituales más complejos como ir al baño una vez y otra sin necesidad, o la adherencia incomprensible y férrea a rutinas fijas. Estos mecanismos son desencadenados por mecanismos impulsivos más que como estrategia evitativa de ansiedad (mecanismo compulsivo, característico del TOC) y pueden ser ligados a estímulos del entorno 4.
Se ha descrito la aparición de trastorno obsesivo compulsivo como pródromo de DFTvc, antes de todo otro síntoma neurocognitivo, pero solo en muy pocos casos puede certificarse la presencia de un trastorno obsesivo compulsivo bien delimitado, con todos los criterios diagnósticos plenamente cumplidos, que se presente años antes del proceso orgánico cerebral, en este caso la DFTvc 61,62.
Síndrome de Diógenes y DFTvc
El síndrome de Diógenes es la combinación de un severo descuido de la apariencia personal y del entorno inmediato acompañada de acumulación patológica, y es una forma frecuente de presentación en la demencia. Se ha asociado también a esquizofrenia, abuso de alcohol y drogas, depresión y trastorno bipolar, pero en menor cuantía, pues entre el 15 y 23% de personas con demencia de moderada a severa llegan a presentarlo. Usualmente se caracteriza además por ausencia de conciencia de enfermedad y de preocupación del individuo por su situación 63.
Entre los diversos tipos de demencia, el síndrome de Diógenes parece tener una importante relación con la DFTvc, en la que se ha hallado hasta en un 36% de casos: esto puede sustentarse a partir de la presentación de conductas compulsivas, de forma acumulativa, y el descuido de la propia higiene personal. Sin embargo, los pacientes no muestran mayor interés en los objetos que han acumulado e incluso pueden permitir que otros los eliminen sin enfrentar mayor afectación 64. Lo que motiva la conducta de acumulación patológica en los pacientes con DFTvc vendría a ser la orientación predominante de la DFTvc a los estímulos del exterior, que a su vez activa conductas de manipulación y agrupación 63. Es importante la detección y reconocimiento adecuado del síndrome de Diógenes pues se asocia a importante comorbilidad y mortalidad elevada (46% a 5 años de seguimiento) 64.
Los síntomas psicóticos en la DFTvc
Los síntomas psicóticos, sobre todo delusiones y alucinaciones, inicialmente se consideraron raros en la DFT 40. Actualmente se estipula que alrededor de 25% de pacientes con DFT presentan síntomas psicóticos 65: aunque se acepta que los síntomas de psicosis en DFT pueden ser menos frecuentes que en la enfermedad de Alzheimer 66. Sin embargo, este porcentaje puede ser superior en aquellos casos que involucran alteraciones de las motoneuronas, como en el SCB y la ELA. En series de casos con más de 100 pacientes diagnosticados con DFT, la prevalencia de alucinaciones llega hasta el 50%, sin predominio consistente de tipo auditivo o visual, y de otros tipos sensoriales que se presentan en menor proporción, mientras que las delusiones se presentan hasta en el 25% de casos (sobre todo paranoides, de referencia y, llamativamente, varias de tipo somático, etc.) 65,67. En el año 2011 se identificó una expansión repetitiva hexanucleótida (GGGGCC) en el gen C9orf72 68. La presencia de más de 30 secuencias de esta repetición está claramente asociada a patología neuropsiquiátrica mientras que la cifra normal es menos de 20 -pero se pueden presentar acúmulos de cientos y hasta miles de la misma secuencia-. La penetrancia de este gen patológico es variable, por ejemplo (50% a los 58 años de edad y llega a 99,5% a los 83 años) 68. Este gen es el más asociado como causa genética de DFT. Se ha detectado consistentemente en los estudios genéticos que un alto porcentaje de casos de DFTvc que presentan síntomas de psicosis están asociados a la presencia del gen C9orf72 (64% en portadores del gen versus 26% en no portadores) y su expansión, anomalía genética que es la más frecuente en DFTvc y en la combinación DFTvc y ELA 40. Hasta 30% de pacientes DFTvc portadores del gen pueden presentarse con síntomas de psicosis cuatro años antes del diagnóstico 69, lo que convierte al diagnóstico diferencial en un desafío. Las afasias progresivas primarias raramente se asocian con el gen C9orf72 70. Los síntomas psicóticos también se asocian con la presencia del gen GRN, pero menos frecuentemente. Se ha observado presencia de síntomas psicóticos asociados a DFTvc con enfermedad de la motoneurona o con enfermedad asociada a la proteína de fusión en sarcoma (DLFT- FUS) de inicio temprano, casos en los cuales los síntomas psicóticos están presentes hasta en el 50% 12.
A nivel de neuroimágenes se ha demostrado correlación entre la presencia del marcador genético C9orf72 con atrofia en redes corticales y subcorticales de los lóbulos frontales, temporales y occipitales, así como en tálamo, estriado y cerebelo, patrones de afectación similares a los que se hallan en esquizofrenia y trastorno esquizoafectivo 40. El involucramiento cerebeloso es señal de progresión de la enfermedad 61.
Ya Kraepelin, en su época, había concebido a la esquizofrenia como un “trastorno frontotemporal”. Pese a ello, la investigación sistemática que aproxime a esquizofrenia y DFT aún es reducida 5. Por ejemplo, la presencia de síntomas psicóticos no está considerada dentro de los criterios de diagnóstico clínico de la DFT. El desarrollo de psicosis años antes de la eclosión plena de la demencia, específicamente casos asociados a la mutación C9orf72, sugiere la existencia de procesos neuropatológicos en común. Recordemos que hasta 23% de pacientes con esquizofrenia pueden iniciar su cuadro psicótico luego de cumplidos los 40 años de edad 35, aunque los estudios no son extensos al respecto, lo que resalta la importancia de un adecuado diagnóstico diferencial.
Debe señalarse que, sin embargo, no se ha logrado identificar a la mutación C9orf72 como una causa importante de trastornos psiquiátricos primarios. Su prevalencia en cohortes psiquiátricas (0,15%) es solo mínimamente superior a la de controles sanos 6. La mutación C9orf72 puede ser especialmente problemática debido a su heterogeneidad fenotípica, la posibilidad de un curso relativamente lento y la presentación de neuroimágenes no especialmente anómalas, además de su proclividad a manifestarse clínicamente a través de síntomas psicóticos, como se ha manifestado 41.
Catatonía y DFT
Existe solapamiento fenotípico entre la catatonía y la DFT, explicable a partir de la afectación compartida de circuitos frontoestriatales: esto se refleja en la coincidencia de algunos criterios diagnósticos (por ejemplo, la presencia de estereotipias o la conducta impulsiva, tanto en DFTvc como en catatonía). En diversos casos de DFTvc se ha desarrollado catatonía franca y esto se asocia a presencia de la mutación genética C9orf72 (al igual que en casos con síntomas psicóticos prominentes) 71, y que han respondido al tratamiento estándar con benzodiazepinas y terapia electroconvulsiva.
En general, frente a la presencia de un síndrome catatónico definido, cobra prioridad el manejo de éste, antes que la definición diagnóstica, puesto que la catatonía es un síndrome transnosológico y puede ser fuente de complicaciones médicas serias 72. Así como hay casos definidos de catatonía en pacientes con DFT ya establecida, puede haber situaciones en que un paciente, con diagnóstico preexistente de trastorno psiquiátrico primario, en su evolución, presente un síndrome catatónico como debut de DFTvc 73. Se requieren estudios más amplios y con seguimiento más prolongado para definir patrones evolutivos específicos.
Conductas antisociales en DFTvc
Las enfermedades neurodegenerativas pueden llegar a causar disfunción de las estructuras neurales implicadas en las funciones ejecutivas y el juicio, el procesamiento emocional, regulación del impulso sexual y el automonitoreo de la propia conducta 74. Las anomalías adquiridas en el córtex prefrontal pueden conducir a veces a los pacientes con DFTvc a la transgresión de normas como producto de sus síntomas consistentes en falta de empatía, desinhibición y conductas estereotipadas, adunadas a su carencia de autocrítica sobre sus propias conductas y sus consecuencias 75. Se estipula que hasta un tercio de los pacientes que llegan a ser diagnosticados de DFTvc han tenido conductas violatorias de la ley en los pródromos de su enfermedad 4. Los delitos o faltas cometidos por personas con demencia abarcan pequeños latrocinios, agresiones, conductas sexuales inadecuadas o violentas, y hasta homicidios 74. Estas conductas, que acarrean una importante carga individual, familiar y social, muchas veces pueden ser la primera manifestación del proceso demencial en ciernes.
Se ha encontrado que hasta 60% de las conductas antisociales pueden atribuirse a DFTvc y APP variante semántica; en cambio, la EA, que deteriora predominantemente el hipocampo y circuitos parietotemporales posteriores, es responsable de solo 7,7% de las conductas antisociales 74. Asimismo, en la EA estas conductas no suelen ser de presentación temprana como en DFT, sino relativamente tardías. Se ha señalado que, como regla general, la primera presentación de conductas antisociales luego de los 55 años debe obligar a la evaluación de estos comportamientos como posible expresión temprana reveladora de una DFTvc 75,76.
Es necesario, sin embargo, remarcar que aquellos pacientes con DFTvc que incurren en conductas de desinhibición sexual son una minoría. En la mayoría de ellos es prevalente una hiposexualidad global, tanto en el impulso, la excitación, el ejercicio de la cópula y hasta en la manifestación de afecto hacia la pareja sexual 77.
Adicciones y ludopatía como expresión de DFTvc
El primer caso de DFTvc que debutó como un problema de ludopatía fue reportado en el año 2004 78. Desde entonces un número progresivo de casos ha sido reportado en la literatura. Estas formas de juego de apuestas (incluyendo casinos, tarjetas de lotería instantánea, y otras formas) son claramente patológicas por las consecuencias negativas en el bienestar personal, familiar y laboral, con dilapidación de los ingresos personales y hasta necesidad de tomar préstamos de bancos o personas allegadas 78. Adicionalmente, estas formas clínicas se han reportado desde antes de que se cumplieran criterios claros para el diagnóstico de DFTvc. Se han reportado asimismo casos de ludopatía en las variantes lingüísticas de tipo semántico y afásico. Con todo, los casos reportados son bastante escasos 79,80.
El abuso de sustancias psicoactivas es un área de creciente interés en el estudio de las poblaciones geriátricas 81. Una característica prominente de la DFTvc es la desinhibición conductual, la que se puede manifestar clínicamente en abuso de sustancias psicoactivas. Así como hay diversos reportes de caso asociando DFTvc a abuso de alcohol, se ha demostrado que los problemas de drogodependencias también pueden presentarse en otras variantes de DFT como la APP: sobre todo a predominio de alcohol y tabaco. El inicio súbito y a edad tardía de consumo de sustancias psicoactivas, sin antecedentes previos, obliga a considerar entre otras posibilidades una DFTvc 81.
Trastorno de déficit de atención e hiperactividad
Se ha señalado también como un diagnóstico diferencial a tener en cuenta el Déficit de Atención e Hiperactividad (DAH). Muchas veces puede ser pasado por alto en la infancia, y algunas referencias señalan que hasta 4% de la población adulta podría padecerlo. Aparte de los déficits en los tests de atención e inhibición, las funciones ejecutivas se hallan afectadas en los adultos con DAH: automonitoreo, memoria de trabajo, planeamiento, flexibilidad y cambio de perspectiva, entre otros. Estos déficits pueden ser semejantes cualitativamente hablando a aquellos que presentan los adultos con lesión del lóbulo frontal. Si bien es un diagnóstico diferencial marginal, algunos adultos que no fueron diagnosticados en la infancia pueden ser detectados cuando se quejan de déficits cognitivos y conductuales al llegar a una edad relativamente avanzada. La literatura al respecto es aún escasa 82.
¿La memoria en la DFTvc está siempre preservada?
Aunque es un criterio estándar de la DFT la preservación de la función mnésica, creciente evidencia señala que esto no es estrictamente así. Diez a quince por ciento de casos confirmados patológicamente como DFT presentan alteraciones memoria episódica en estadios iniciales de la enfermedad. La evidencia actual es que disturbios de la memoria episódica no permiten distinguir la EA de la DFTvc y la presencia de estas alteraciones no debiera descartar a priori el diagnóstico de DFTvc 83. Un estudio reciente que compara EA y DFTvc desde sus estadios prodrómicos, encuentra que el 84% de pacientes con DFTvc presentan quejas subjetivas de problemas de memoria frente a un 98,8% en pacientes con EA. Estas investigaciones contradicen los criterios establecidos para el diagnóstico de DFT. El reporte subjetivo de alteraciones de la memoria episódica no permite diferenciar adecuadamente la EA de la DFTvc 84.
La perspectiva actual: los síntomas psiquiátricos como pródromos de demencia
Desde los primeros casos históricos reportados por Alzheimer y por Pick, que luego adoptaron sus nombres epónimos, se evidenció que pacientes con enfermedades neurodegenerativas presentaban, en estadios tempranos, prominentes síntomas que no eran exclusivamente los cognitivos. Los síntomas de índole psicótica, afectiva, ansiosa, y de franca desorganización conductual, muchas veces dominaban el cuadro clínico y eran el principal motivo de hospitalización o de búsqueda de atención médica 85. Lamentablemente, existió un prolongado hiato temporal en que no se estudiaron sistemáticamente estos síntomas dentro de la evolución de los cuadros clínicos demenciales.
Recién en la década de 1990 se prestó mayor atención a estos síntomas. La International Psychogeriatric Association los denominó “Síntomas conductuales y psicológicos” de las demencias, mientras que la Alzheimer’s Association los llamó escuetamente “Síntomas no cognitivos” o “Síntomas neuropsiquiátricos” de las demencias (a saber, síntomas conductuales tales como agresión física o verbal, inquietud psicomotriz, agitación, deambulación errática, desinhibición, conductas socialmente inapropiadas, acumulación patológica; y síntomas psicológicos como ansiedad, ánimo deprimido, irritabilidad, alucinaciones y delusiones) 86. Se ha determinado, cada vez más claramente, que estos síntomas pueden ser pródromos del cuadro en sí y mantenerse después de la eclosión de la demencia y a lo largo de toda su evolución, sin importar el tipo específico de demencia 86. Resulta llamativo que estos síntomas psicológicos y conductuales no sean mencionados explícitamente en los criterios diagnósticos del Trastorno Neurocognitivo Mayor del DSM-5, lo que los invisibiliza a la hora de diagnosticar el cuadro clínico respectivo.
En el afán de detectar con mayor sensibilidad los pródromos de los cuadros demenciales, se han elaborado constructos en base a observaciones empíricas, el primero de ellos: el Deterioro cognitivo leve 87. Este constructo fue diseñado con el propósito de detectar las fases precoces de la EA, y andando el tiempo devino en el Trastorno Neurocognitivo Leve (TNL) del DSM-5, en este caso no se trata exactamente de un pródromo pues puede o no tornarse en demencia (el 10 a 15 % de los casos de TNL se convierte en demencia anualmente) 87. A su vez, se bosquejó otro constructo denominado Deterioro Comportamental leve (DCoL) 88 como pródromo específico de la DFTvc y sus criterios se han ido delineando progresivamente: un alto porcentaje de individuos portadores de este DCoL (hasta 70%) han evolucionado a DFTvc al cabo de 5 años 89 y a su vez se ha demostrado que el DCoL puede anteceder a otros tipos de demencia, aparte de la DFTvc.
En el año 2016 la Alzheimer’s Association International Society to Advance Alzheimer’s Research and Treatment (ISTAART) publicó criterios estandarizados para el diagnóstico del Deterioro Comportamental Leve (90) (Tabla 1), donde se consideran operativamente, y fuera de los cánones restringidos de la psicopatología clásica, cinco agrupamientos clínicos denominados: disminución de la motivación, disregulación afectiva, pérdida del control de impulsos, inadecuación social y percepciones anómalas o alteraciones del contenido del pensamiento. A su vez, se ha diseñado un instrumento ad hoc para medir el DCoL, el Mild Behavioral Impairment Checklist 91, que ha sido validado a nuestro idioma 92, (se puede descargar gratuitamente desde https://mbitest.org/).
Tabla 1 Criterios de la International Society to Advance Alzheimer’s Research and Treatment de Deterioro comportamental leve 86.

Es decir, el Deterioro Comportamental Leve es un constructo que describe la emergencia, luego de los 50 años de edad, de síntomas neuropsiquiátricos duraderos y significativos, como precursores de declive cognitivo y demencia. El DCoL describe síntomas neuropsiquiátricos de cualquier intensidad, con una duración mayor a los seis meses, y que no son capturados adecuadamente por la nosología psiquiátrica tradicional 91. En ese sentido, el problema vendría a ser no solo que se ignoren los criterios diagnósticos y las investigaciones necesarias para certificar el diagnóstico de DFTvc, sino que al parecer los psiquiatras y médicos generales podrían estar constriñendo dentro del molde psicopatológico clásico sus hallazgos de determinados síntomas psiquiátricos, y así forzando el diagnóstico de síndromes y trastornos psicopatológicos tradicionales 93. El constructo de Deterioro Conductual Leve pretende evitar este sesgo, al permitir capturar síntomas aislados o en configuraciones irregulares, no características de patologías psiquiátricas específicas. Un ejemplo de ello puede observarse en la apatía, que es uno de los síntomas cardinales de la DFTvc (hasta 90 % de pacientes la presentan desde los estadios precoces de la enfermedad) y cuya configuración psicopatológica ha sido revisada radicalmente 94. De ser definida en los textos clásicos de psicopatología como “incapacidad más o menos prolongada de experimentar sentimientos, inclusive cuando la mente conserva la aptitud de comprender las situaciones. Generalmente se acompaña de abulia. El enfermo es indiferente hasta para las impresiones que tocan más de cerca a la existencia (…) incapacidad no solo para gozar y para sufrir sino en general para expresar los sentimientos, como si la mente hubiese perdido de raíz la vida afectiva” 95. Ha venido a ser operativamente definida como “reducción cuantitativa de actividad dirigida a metas” en los ámbitos de conducta y cognición, interacción social y emocionalidad, por más de cuatro semanas y se elimina el constructo especulativo de “motivación” (96. Estudios recientes corroboran que la apatía es uno de los síntomas cruciales y tempranos y más perniciosos de la DFTvc, además afecta adversamente el pronóstico y la sobrevivencia. Desde la etapa prodrómica es el síntoma más frecuente 97,98. A la luz de estos criterios renovados de investigación, se ha detectado con más claridad, por ejemplo, que los síntomas afectivos presentes en casos de DFTvc no se ajustan a ningún patrón sindrómico propio de los trastornos psiquiátricos primarios, lo que demuestra el valor de estos novedosos constructos y su urgencia de ser introducidos en la formación de todos los profesionales médicos con posibilidad de evaluar casos de demencia 99,100.
Las “fenocopias” conductuales de la DFTvc
El término “fenocopia de la DFTvc” fue introducido por Hodges y Kippsen en el año 2010 y puede complicar aún más el dilema diagnóstico que hemos presentado hasta aquí 23. Recién iniciado el presente siglo empezaron a reportarse casos de DFTvc que diferían de la clínica evolutiva usual por cuanto no se observaba en ellos el deterioro propio de la condición demencial, los pacientes mantenían sus capacidades de desenvolvimiento en la vida diaria (ausencia de deterioro en por lo menos tres años de seguimiento), y tampoco se llegaba a observar la imagenología característica de atrofia y disminución del metabolismo u oxigenación de los lóbulos frontales y temporales 101. Se denominó a estos cuadros “fenocopias”, es decir, con apariencia externa del cuadro clínico, pero sin que se trate necesariamente de la misma condición subyacente (también han sido denominados DFT no progresiva, DFT benigna o DFT lentamente progresiva). En diversas series de casos su frecuencia es dispar: desde 0 % a 52%, y es más frecuente en varones (en relación 10 a 1, respecto a las mujeres). Hasta 2019 no se habían reportado sino alrededor de tres centenares de casos 102.
El perfil clínico de los pacientes con el síndrome de fenocopia es el siguiente: cumple criterios de DFTvc “posible”, son usualmente varones relativamente jóvenes, tienen menos probabilidad de problemas motores y de antecedentes familiares de demencia, rasgos de personalidad predominantes del cluster C, y las neuroimágenes no muestran atrofia ni hipometabolismo frontotemporal. Asimismo, en cuanto a la evaluación neuropsicológica, en estos pacientes no se hallan alteraciones ejecutivas ni de la memoria episódica, lo que se mantiene a lo largo del tiempo. Igualmente, las habilidades funcionales y de desempeño se mantienen intactas y no se alteran con la evolución 101. La alteración de la memoria episódica podría ser un marcador fiable de una real DFTvc y no de una fenocopia.
En primer lugar, si se descartan los diagnósticos inadecuadamente elaborados (DFTvc “por poderes”, trastornos psiquiátricos primarios erróneamente diagnosticados como DFTvc) se han apuntado interesantes posibilidades explicativas: casos de Asperger en estadios tardíos de evolución, trastornos de personalidad descompensados en edades avanzadas, trastornos psiquiátricos de inicio tardío 103. Sin embargo, revisiones recientes postulan que las fenocopias no son sino variantes de la misma DFTvc pero en la que está implicada la mutación genética C9orf72 (6,25% de los casos). El término “fenocopia” devendría incorrecto pues significa “fenotipo que no es producido genotípicamente y que imita o es similar a uno que sí tiene genotipo subyacente”. Las llamadas fenocopias de la DFTvc son, por tanto, un reto clínico diagnóstico y de investigación científica. No debe olvidarse que, en las primeras evaluaciones, y por algún tiempo, estas “fenocopias” son clínicamente indistinguibles de la DFTvc usual y degenerativa. Existen aún muy escasos estudios de histopatología (cerebros postmortem) por lo reciente de estos casos y su sobrevida mayor que la DFT usual. El grupo de casos es aún pequeño y los tiempos de seguimiento relativamente breves. La perspectiva más probable es que estas llamadas “fenocopias” representen una selección heterogénea de síndromes clínicos frontales de causas atípicas, tanto degenerativas como psiquiátricas 102.
Uso de neuroimágenes
Aunque el propósito de esta revisión ha sido fundamentalmente clínico, no puede dejar de mencionarse que la presencia de neuroimágenes que establezcan la atrofia o hipometabolismo / hipoperfusión en los lóbulos frontal y temporal, es crucial para el establecimiento del diagnóstico probable de DFTvc. Sin embargo, en estadios tempranos la resonancia magnética puede no ser claramente anormal 41 o en ciertos genotipos de la DFTvc, como la derivada del gen C9orf72. Esto es así al punto que la presencia de neuroimágenes normales no excluye la presencia de degeneración lobar frontotemporal. Análogamente, algunas patologías psiquiátricas primarias pueden presentar ciertas anomalías (hipometabolismo) en imágenes funcionales 5.
Uso de biomarcadores
Hay prometedoras investigaciones acerca de moléculas en el líquido cefalorraquídeo (LCR) con valor diagnóstico para la DFT o alguna de sus variantes. Existen biomarcadores para la confirmación diagnóstica de EA (proteína Tau, Tau hiperfosforilada y betaamiloide 42). Sin embargo, el incremento aislado de proteína Tau sin disminución de betaamiloide 42 apoya el diagnóstico de DFT, pues en DFT se encuentra betaamiloide 42 en nivel normal y la proteína tau está de normal a incrementada. También hay perspectivas en relación a proteínas de neurofilamentos en el LCR pues estos son componentes del esqueleto neuronal y su presencia se incrementa en procesos neurodegenerativos. Específicamente, las cadenas ligeras de neurofilamentos parecen un promisorio marcador biológico para discriminar DFTvc de trastornos psiquiátricos primarios, no solo en LCR sino también en plasma sanguíneo 104,105.
Uso de pruebas genéticas
Es importante la consideración de las pruebas genéticas por cuanto la demostración de la presencia de una mutación genética es uno de los criterios que permiten el diagnóstico “definitivo” de un determinado caso de DFTvc. El tamizaje para búsqueda de portadores es obligado en familiares cercanos de pacientes sintomáticos. Asimismo, en aquellos casos donde el perfil sintomático sugiera la presencia subyacente de una anomalía genética esto es de la mayor relevancia (por ejemplo, en casos de DFT y ELA). Existen técnicas de secuenciación genética que pueden enfocarse en el análisis de un solo gen o un grupo de genes asociados a una misma enfermedad. El tipo de examen a solicitar depende del tipo de síntomas del paciente y eventuales familiares afectados y del número de genes conocidos para los diagnósticos presuntivos: algunos autores sugieren comenzar tamizando el gen C9orf72 por su mayor frecuencia relativa (25%), igualmente se sugiere considerar análisis del gen MAPT ante presencia de parkinsonismo atípico y DFTvc. Un screening amplio e indiscriminado también ofrece el riesgo de detectar variantes incidentales o de significancia desconocida, lo que debe valorarse. Es importante considerar la consejería genética pre- y postest, por las implicancias que podría tener en los pacientes el tener conocimiento de un resultado positivo. No existen aún en nuestro medio la disponibilidad de estas pruebas 24,28,104.
CONCLUSIONES
Como conclusión de esta revisión planteamos el Gráfico 2 donde se presenta un flujograma diagnóstico ante un caso sospechoso de DFTvc. En la actualidad, la DFTvc es una enfermedad emergente cuyo conocimiento es imprescindible en el arsenal diagnóstico de todos los médicos en contacto con pacientes adultos y adultos mayores. La debida sospecha clínica ante casos atípicos es de enorme importancia, dada la polimorfa presentación de los cuadros, y el amplio diagnóstico diferencial posible (Tabla 2).
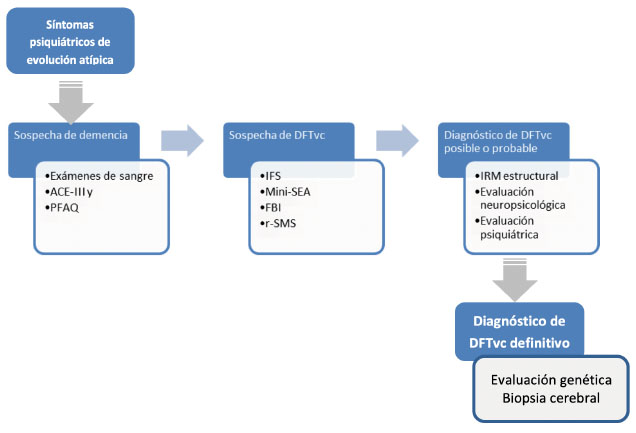
Gráfico 2 Flujograma de evaluación de pacientes con síntomas psiquiátricos que pueden ser expresión de Demencia Frontotemporal variable conductual.