INTRODUCCION
La epilepsia es una causa de morbi-mortalidad prevalentes, afectando a 50 millones de personas 1, el 30% de los pacientes desarrollarán epilepsia refractaria2,3, para ellos se consideran opciones quirúrgicas 4,5,6, que dependerán de hallazgos electroencefalográficos y exámenes auxiliares para la identificación de la zona epileptogénica (ZE)4), y zonas elocuentes 7,8,9. La epilepsia confiere un riesgo elevado (1 de cada 1000 pacientes con epilepsia, 0,01%) de padecer muerte súbita asociada (SUDEP, por sus siglas en inglés) 10, con estragos en calidad de vida 11.
Las herramientas digitales son una parte fundamental del estudio y tratamiento del paciente con epilepsia (PCE). Si una crisis puede ser predicha, hay potencial para tratamiento abortivo de crisis: auto-administrado por un dispositivo (en forma de medicamento o estimulación eléctrica) o por el paciente 12.
¿Qué es la inteligencia artificial?
Inteligencia artificial (IA) se define como una de las ramas de la ciencia de la computación que pretende entender y construir identidades inteligentes, frecuentemente instauradas como programas de software 13,14). La integración de la neurociencia con la IA fue forjada en 1943 por el neurofisiólogo Warren McCulloch y el matemático Walter Pitts, recreando interacciones cerebrales en un circuito neuronal utilizando circuitos eléctricos 15, se refiere a la obra “A Logical Calculus of the Ideas Immanent in Nervous Activity” como el punto inicial de referencia en la historia de la cibernética y un paso fundamental en el desarrollo de la ciencia cognitiva e IA 16,17).
La IA se divide en dos componentes: virtual y físico. La rama virtual incluye aprendizaje de información para el manejo de sistemas de salud (registros de salud, etc.). El componente virtual está representado como el Aprendizaje Automático (Machine Learning o ML, por sus siglas en inglés) 13, está diseñado con algoritmos matemáticos que mejoran el desempeño y aprendizaje a través de la experiencia.
Hay tres tipos de algoritmos de ML: 1. No supervisados (reconocen patrones específicos), 2. Supervisados (basados en ejemplos previos para clasificación y predicción) y 3. Aprendizaje con reforzamiento (secuencias de premios y castigos para estrategias de operación en un problema específico) (14, 18, 19). En las tareas supervisadas, el algoritmo se entrena con un grupo de datos etiquetados. Esto se aplica en epilepsia, cuando se entrena el software de registros de EEG para detectar descargas epileptiformes. Por otro lado, en las tareas de aprendizaje no supervisadas, se utiliza un algoritmo para descubrir tendencias, o valores atípicos en datos no etiquetados que se introducen para su estudio. Un ejemplo en epilepsia son descargas epileptiformes candidatas que se detectan como atípicas en el trazo de EEG 20).
El Aprendizaje Profundo (DL, Deep Learning, por sus siglas en inglés) utiliza computación ultra-rápida para eficientemente optimizar redes de datos en múltiples capas que se organizan en una variedad de configuraciones (¨capas de filtro convolucional¨; ¨capas recursivas¨). El mayor avance de DL sobre ML es la representación de tiempo y espacio. Se aprende automáticamente de datos de entrenamiento y no se asumen por parte de humanos 21).
Medicina personalizada
El 2003 completó la primera secuencia del genoma humano y dio pie al estudio de la medicina personalizada (MP). La medicina genómica utiliza los datos de información genética como herramienta en la toma de decisiones para algunos individuos y sistemas de salud 22. Existen más de 6000 alteraciones/rasgos genéticos con una etiología molecular específica (https://www.omim.org/statistics/geneMap).
El propósito de MP es crear terapéutica individualizada, prevenir y promover salud dependiendo de rasgos individuales del paciente 23. Medicina de precisión se define como un abordaje para el tratamiento y prevención de diversas enfermedades, considerando variabilidades individuales: factores genéticos, ambientales y estilo de vida como iniciativa para recalcar la importancia de la información genética en la toma de decisión 24.
IA en la evaluación del paciente con epilepsia
Detección de crisis
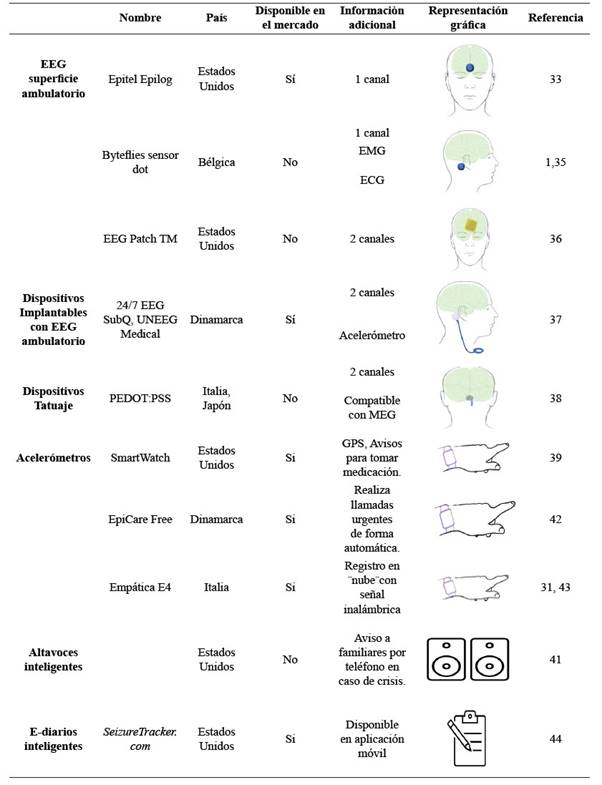
Dispositivos de uso en casa/ambulatorios: El ML es util para analizar bases de datos grandes y complejas y se aplica en detección automática de crisis (DAC) en EEG 25. Se utilizan diversas técnicas para lograr la lectura y clasificación con DL. (20)Se aplican para predecir crisis epilépticas (CE) con EEG, usando bases de datos (Tabla 1).
Los dispositivos que se encuentran enlistados en la parte inferior de esta sección ofrecen versatilidad de realizar actividades diarias, para la detección de crisis de largo plazo con menos invasión y así representan una medición de las características y frecuencia de crisis más fidedigna. Cuando se comparan con el estándar de oro (Video-electroencefalograma de superficie de largo plazo, con el sistema internacional10-20 de electrodos), aun no son superiores para la localización del foco epileptogénico (la mayoría consta solo de unos pocos electrodos de superficie). Sin embargo, sirven para monitorizar frecuencia, severidad y características de crisis a largo plazo en la comodidad del hogar del paciente para poder establecer estrategias de tratamiento.
Electroencefalogramas ambulatorios: Un EEG portátil para el monitoreo continuo del PCE puede proveer información para el manejo de la enfermedad del paciente en tiempo real en la comodidad de su hogar, así como comprender la frecuencia, severidad de las crisis epilépticas en un ambiente de hogar (más habitual y tolerable que en el intrahospitalario). Epilog, un dispositivo con sensor EEG de un canal se comparó directamente con el montaje de EEG de superficie con video para el diagnóstico de CE. Para compararlos, se utilizó el espectro de potencia, gradiente señal-sonido, y frecuencia de banda para comparar la calidad de señal entre ambos registros. Se concluyó que este dispositivo registraba datos confiables. Los resultados fueron similares con otros dispositivos 26,27.
Dispositivos implantables: Los sistemas de monitoreo de EEG bajo la piel del cuero cabelludo continuo/ultra largo tienen evidencia en estudios iniciales que comparan EEG de superficie contra esta técnica. Son favorables y demuestran que las crisis se pueden comprobar electrográficamente28, esta técnica es utilizada en unidades de cuidados intensivos neurológicos en la práctica actual 29.
Dispositivos ¨Tatuaje¨: Existen electrodos cutáneos que se implantan en la epidermis en forma de tinta impresa como un tatuaje polímero en EEG. Tienen el beneficio de pasar desapercibidos por el paciente con adecuada señal. La señal se envía a través de una plataforma ¨fantasma¨ 30.
Dispositivos basados en análisis de movimientos: Estos algoritmos de DAC utilizan el registro de ciclos temporales, fisiológicos o su combinación. Una área de oportunidad es la baja calidad de registro, sobre todo en aquellos de largo uso (artefactos). La acelerometría (ACC) magnetometría, giroscopía y sensores de presión miden con reconstrucción las posiciones del cuerpo usando sensores electromagnéticos o mecánicos 31,32,33. Se usan en las muñecas, tobillos, entre otros; los resultados de estos dispositivos han sido variables; confiables según algunos autores, e inconsistentes para otros 34, algunos colocados en colchones miden el impacto mecánico de movimientos ictales rítmicos35, se resumen en la tabla 1.
Dispositivos con altavoces inteligentes: Existen también estudios utilizando altavoces inteligentes conectados a una red (acústicos y ópticos) de dispositivos de auto-vigilancia que podrían proveer DAC 34.
Uso de diarios electrónicos (E-diarios) para predicción de crisis: Utilizando “E-diarios”, se desarrolló un esquema con ML para predecir el riesgo de crisis a 24 horas según el registro de crisis auto-reportadas de los pacientes, 5000 pacientes ingresaron a SeizureTracker.com, donde incluyeron frecuencia de crisis, tipo de crisis, y duración. Un programa de IA de circuitos recurrentes y un esquema de DL pudo predecir riesgos de crisis a 3 meses. El resultado fue una predicción con pronóstico de crisis válida superior al chance 36, en la tabla I resume los dispositivos ambulatorios.
Genética y epilepsia: Diagnóstico y tratamiento ambulatorio
Diagnóstico: un diagnóstico genético específico podría evitar examinación innecesaria (exámenes séricos, resonancia magnética nucleada (MRI), biopsias, etc.) Las técnicas genéticas (asociación de genomas, exomas, epigenética, mRNA) e ingeniería genética como CAR (antígeno del receptor de células T) y CRSPR (repeticiones regulares inter-espaciadas cortas palindrómicas en racimo) están revolucionando la genética clínica. El auge de subgrupos de estudio molecular (metabolómica, proteómica, micromiómica) con transición a uso clínico ha sido importante en los últimos años 24.
Tratamiento: existen mutaciones específicas que impactan el tratamiento; la más significativa es el Síndrome de Dravet (mutación en gen SCN1A en 80%), con cuadro clínico establecido después de unos años. El manejo agresivo inicial tiene efecto en el desenlace funcional de PCE(cognición y crisis). Los bloqueadores de canales de sodio como fenitoína, lamotrigina y carbamazepina deben ser evitados en estos pacientes; el ácido valproico , topiramato , clobazam y estiripentol son beneficiosos.
Otras encefalopatías con mutaciones en SCN2A y SCN8A (más raras), se han descrito con perfil de respuesta distinto (neuronas excitatorias; SCN1A codifica interneuronas inhibitorias). Con la mutación en SCN8A, los bloqueadores de sodio pueden ser efectivos en algunos casos. Similares resultados se han descrito con mutaciones en canales de potasio: KCNQ2 responde adecuadamente a FAC (fármacos anticrisis) bloqueadores de canales de sodio.
El transportador de glucosa, GLUT1 es responsable de una encefalopatía severa infantil secundaria a una mutación en el gen SLC2A1. Resulta en alteración de GLUT1 y responde a dieta cetogénica. Lamentablemente, la minoría de las epilepsias genéticas son monogénicas. Los mecanismos de las epilepsias poligénicas aún se están desarrollando 37.
La farmacogenómica es rama de la MP; aplica a la epilepsia por la respuesta altamente variable de los FAC entre pacientes. El genotipo HLA-B*15:02 identifica a individuos descendientes del sur de Asia con alto riesgo de reacción cutánea (RC) a carbamazepina. HLA-A*31:01 identifica aquellos pacientes con riesgo de RC a Carbamazepina o CYP2C9 para RC a fenitoína 38. Un estudio retrospectivo mostró utilizando MP que las características individuales de los pacientes se pueden integrar a un modelo de precisión. Utilizando datos de una base de 235 PCE con un modelo de ML para integrar datos clínicos y genéticos, construyeron un modelo que predijo la respuesta clínica a los fármacos anticrisis, así como una muestra limitada a datos de alta dimensión con datos clínicos para ayudar a la selección de fármaco adecuado 39.
La selección de fármacos adecuada influencia la respuesta clínica de los PCE; una selección inadecuada de fármacos puede ocasionar daño, es complejo seleccionar el medicamento adecuado tomando en cuenta interacciones, edad y tipo de crisis, tras evaluación por 24 expertos en epilepsia, se validó el uso de la aplicación digital de una página web, https://epipick.org; ayuda elegir el FAC (fármacos anticrisis) para el PCE según sus características individuales, utiliza un algoritmo utilizando los conocimientos de epileptólogos 39, fue validado previamente por el mismo grupo de investigación; basado en método Delphi. La selección de FAC se basa en tipo de crisis, y variables clínicas 40.
IA intrahospitalaria
Dispositivos intrahospitalarios para detección de crisis
Detección automatizada de crisis en EEG: Una unidad de monitoreo de epilepsia (UME) requiere varios días para obtener información relevante a través de telemetría 41, esta detección depende de la pericia del equipo y la capacidad económica del centro/paciente, existen diversos métodos para la DAC con ML.
Las limitaciones de UME involucran un registro extenso que al final capta una crisis que dura tan unos segundos-minutos, artefactos, y variantes de la normalidad que pueden dar falsos positivos/negativos de CE 42, cuando se han evaluado los cuatro algoritmos de DAC existentes, no fueron considerados adecuados para la práctica clínica 43.
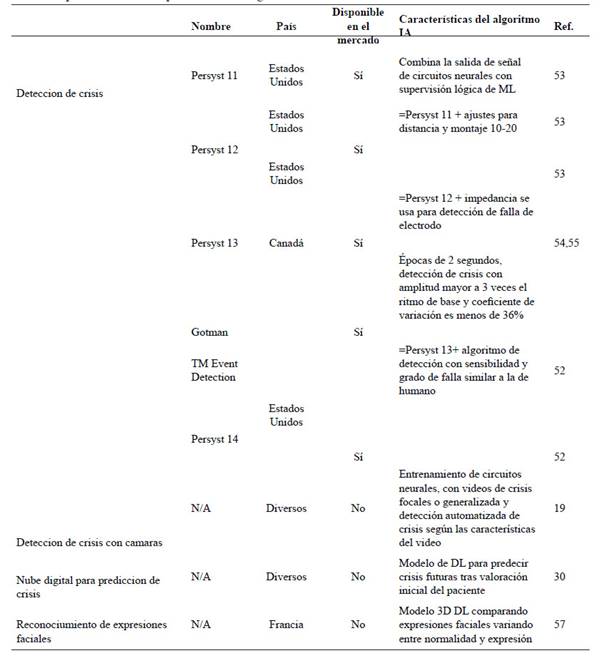
Existen sistemas que se utilizan como método de vigilancia en algunas unidades de cuidados intensivos y con DAC tratar de forma rápida a PCE críticamente enfermos (41,42,44,45, 46,47); estos también se han utilizando EEG cuantitativos, de uso común en algunas unidades de cuidados intensivos neurológicas para tratamiento en tiempo real de las crisis o urgencias neurológicas 47. En una publicación reciente, el software Persyst 14, promete una sensibilidad del 95% para DCA y una sensibilidad similar a la del humano (78,2% y un rango de error de 1,0/día), el primer dispositivo con estos resultados 48, sus características se encuentran en la Tabla 2.
Detección automatizada de crisis con análisis de movimientos: Las técnicas de ML aplican a datos adicionales en la DCA. En PCE neonatal, estudiaron los movimientos de las extremidades en registros de video para entrenar circuitos neurales y clasificar tipos de crisis. Con 120 registros, se llegó a una sensibilidad de DCA de 86-94% y especificidad de 93-98% (mayor en crisis mioclónicas). Adicionales estudios detectaron además espasmos epilépticos, mioclonías, crisis tónicas, tónico-clónicas y focales motoras 20.
“Nube” digital para predicción de crisis: Se propone que el EEG obtenido puede ser enviado del hospital a una “nube” digital en donde un modelo de DL prediga crisis. El análisis con DL se enviaría al clínico mediante el servidor del hospital y si existe riesgo de crisis, contactaría al PCE 49.
Imagen: algoritmos para reconocimiento de lesiones
El estudio ENIGMA reunió expertos utilizando MRI en PCE en 24 centros. Se utilizaron 2149 PCE divididos en: epilepsias genéticas generalizadas (n =367), epilepsia mesial temporal con esclerosis y otras epilepsias (n = 1026); con 1727 controles sanos. Todos los PCE tenían menor volumen en el tálamo derecho y ambos giros precentrales. Se utilizó como la base de datos para la aplicación de DL en modelos de investigación.
Aprendizaje profundo (DL) e imagen: los cerebros con Epilepsia del Lóbulo Temporal (ELT) se pueden discriminar de aquellos cerebros sanos utilizando máquinas de vector soporte (SVM) basados en anormalidades aspecto mesial inferior de los lóbulos temporales 50. Utilizando imágenes multimodales se demostró que la lateralidad de las crisis se puede predecir con exactitud en MRI basado en información hipocampal y temporal, respectivamente. Estas anormalidades que no se disciernen en ELT con MRI normal (no lesional/¨negativa¨), se establecieron anormales con un patrón especial en el lóbulo temporal, además del hipocampo 51, esto se reprodujo también utilizando tensor de difusión (DTI)(52).
Detección de displasia focal cortical (DFC): A diferencia de la ELT con esclerosis mesial temporal que frecuentemente se identifica en MRI, la detección de DFC es más compleja. A pesar de los avances del análisis de MRI, los algoritmos basados en superficie tienen más de 50% de error al detectar DFC.
Utilizando IA-DL, un clasificador entrenado con base de datos con DFC (histológicamente) trabajó con MRI con voxeles para distinguir lesiones de tejido sano. Se entrenó con datos de MRI multimodal en un centro y después globalmente con 6 otros centros, un total de 107 pacientes. Este clasificador demostró adecuada sensibilidad (87%-91%) y especificidad (95%) entre ellos. Podría ser una alternativa para los pacientes con una “resonancia negativa” con alta sospecha de DFC 53.
Otro utilizó pacientes clasificados como ‘no-lesionales’ para realizar MRI de 1.5-3 tesla y ML para detectar automáticamente la DFC tipo II en 19 pacientes basados en morfología e intensidad de imagen con sensibilidad del 74% y especificidad de 100% 54. Utilizando ML se estudió si el modelo de post-procesamiento de MRI detectaba DFC confirmada histopatológicamente en pacientes sin lesiones en MRI con una morfometría cuantitativa 55. Logró identificar lesiones correctamente en 6 de 7 pacientes con MRI lesional. Los pacientes con MRI no lesional fueron identificados por ML en 14 de 24 casos con DFC (58%).
Otro grupo investigó un método en línea para la evaluación cuantitativa del hipometabolismo de PCE focal refractaria (ELT y ELF (epilepsia del lóbulo frontal)) como complemento al análisis visual de 18F-FDG PET CT 56. Incluyeron39 PCE refractaria y probable DFC. Se condujo una cuantificación automatizada de 18F-FDG PET/CT y se compararon con PET-CT analizados visualmente por médicos nucleares. Analizaron las imágenes de forma cuantitativa y cualitativa. En ELT, los análisis cuantitativos y visuales fueron similares; en ELF el análisis visual categorizó al 50% de casos como normales. En ELF el análisis cuantitativo fue crítico para identificar la ZE.
Abordaje prequirúrgico
Se ha establecido previamente el abordaje de la epilepsia como circuito neuronal, más que zonas independientes 4,57. La estimación del riesgo de secuelas neurológicas contra el beneficio de resección de la ZE requiere de valoración previa exhaustiva con estudios invasivos y no invasivos. La predicción de circuitos neuronales permite determinar si ciertos PCE se benefician de cirugía basándose en la capacidad de sincronizarse del área de SEEG. La desincronización cerebral se asoció a mejores desenlaces quirúrgicos y previno complicaciones 58.
Abordaje quirúrgico para estudio de la zona epileptogénica (ZE)
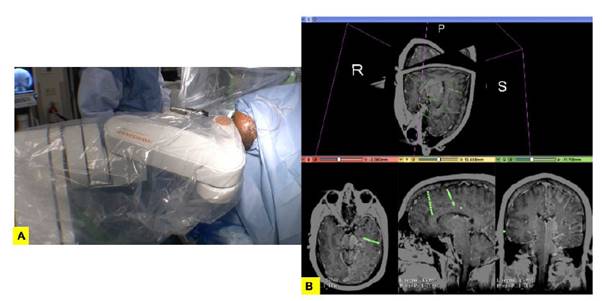
Robots en implantación de SEEG: existen varias plataformas, entre ellas, ROSA (Asistente Estereotáctico Robótico) (ZimmerBiomet/MedTech) y Neuro|MateTMRobot. (Renishaw/Reino Unido). Fueron diseñadas para SEEG y consisten en un brazo de 6 grados de movilidad y ángulos con base fija al piso. Se inserta directamente al ensamble que va al cráneo. Se realiza un co-registro de la IRM y tomografía del PCE 59 (Figura 1).
Los electrodos pueden colocarse en sentido ortogonal u oblicuos. Son útiles en casos de difícil acceso (la ínsula, escondida debajo del opérculo temporal y frontoparietal, sin mencionar el riesgo de compromiso vascular al insertar los electrodos) 60.
Neuroestimulación: Manejo
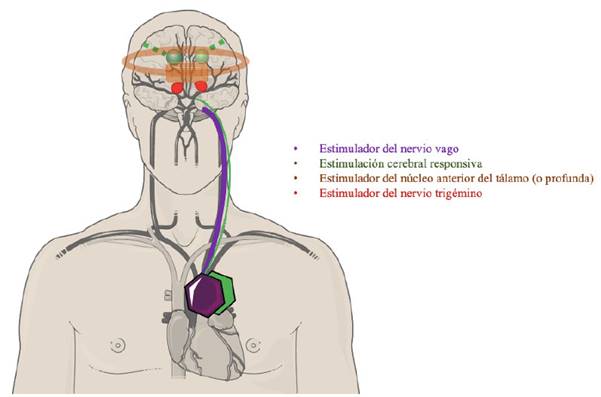
La neuromodulación de circuitos neuronales con implantación de sistemas de estimulación, incluyendo DBS (estimulador profundo cerebral), es una alternativa para aquellos PCE refractaria que no se benefician de resección 61. Entre las dianas terapéuticas se encuentra el núcleo anterior del tálamo (ATN), nodo central del circuito de Papez. Los mecanismos de acción antiepileptogénica del DBS aún no se conocen con exactitud 62,63. La eficacia de la estimulación de ATN se ha demostrado en crisis focales y generalizadas, con reducción de crisis de 71,3% a 1 año, 73,9% a 2 años, y en un rango de 61,8 - 80,0% desde los 3 a los11 años 64, nuestra experiencia indica que el DBS puede ser usado con mejor éxito en pacientes con epilepsia multifocal y sin complicaciones a largo plazo 65.
VNS: Fue el primer neuromodulador aprobado para tratamiento de epilepsia. 66 Sigue demostrando eficacia para crisis de inicio focal y generalizadas 67. Los modelos recientes tienen función de autoestimulación (AutoStim). Permite medir frecuencias cardíacas en rangos extremos ajustado al individuo para prevenir crisis con descargas autonómicas (taquicardia/bradicardia), para crisis nocturnas o sin aura (66). El modelo más reciente de VNS aprobado (SenTiva), además de AutoStim, tiene sistema de circuito cerrado generando estimulación automática 68,69. Con una guía anticipada de programación, se puede ajustar para auto-sugerir próximos ajustes a parámetros de estimulación futura con horario en una sola visita 68.
Estimulación Cerebral Responsiva (RNS): En contraste con los sistemas anteriores, el RNS monitorea continuamente la actividad neural de ZE y responde con estimulación solamente cuando se detecta actividad epileptiforme. Los ensayos clínicos con PCE demuestran constante reducción de crisis a 75% después de 9 años de tratamiento 70,71. Se asoció a mejoría en cognición y calidad de vida en PCE. Esto se ha reproducido en la ínsula con 75% de reducción de crisis 72 y bitemporal en 70% 73.
Estimulación del Nervio Trigémino (TNS): La estimulación del nervio trigémino es utilizada en algunas regiones de Europa, su mecanismo de acción es similar al de VNS y posee efectos moduladores del ánimo; el beneficio más prometedor del TNS es que no es implantado sino aplicado a la piel por vía transdérmica 74.
En la Figura 2 se resume las aplicaciones de Neuromodulación e IA en epilepsia.
Otros beneficios de IA
Estimación de pronóstico de pacientes con epilepsia con IA
Se utilizó ML para predecir muerte temprana y tardía en epilepsia. Utilizaron registros médicos electrónicos; predijeron si un paciente tenía riesgo de mortalidad temprana y tardía. Los factores con impacto en desenlace de muerte tardía fueron causas médicas, sociales individuales, y relacionados con el tratamiento (atraso en inicio de FAC) 75.
Direcciones futuras
“Ómicas”
La medicina de precisión como herramienta para manejo del PCE posee diversas ramas cuyos desenlaces/manifestaciones clínicas se pueden estimar con exactitud (24). La biología de sistemas propone crear un modelo computacional y matemático de sistemas biológicos complejos 76,77. La epilepsia está en la categoría de ¨sistemas¨. Este sistema de epilepsia se intenta integrar como un modelo biológico complejo de patrones establecidos, entre ellos la genética.
La metabolómica, se ha aplicado a tejidos de postoperados de cirugía de epilepsia en comparación con una espectroscopía de alta resolución- MRI, con genómica (análisis de chip de RNA (microarray), histopatología (interactoma celular, neovascularización y microlesiones)). Utilizando el abordaje de biología en sistemas en corteza de los PCE, se encontró evidencia demostrando alteraciones metabólicas en la arquitectura sináptica y neurovascular de los cerebros de PCE. Podría representar potencial biomarcador no-invasivo de epileptogénesis en el futuro y podría impactar su manejo y abordaje 78.
Estimación de desenlace quirúrgico
Un nomograma (diagrama de cálculo matemático) se desarrolló para estimar según las características del PCE el desenlace posquirúrgico si se resecara la ZE. Se estimó predecir libertad de crisis y clasificación de Engel 1 a los 2 años y a los 5 años después de cirugía. 79. El estudio multicéntrico de 846 pacientes iniciales validó a 604. El riesgo basal de Engel 1 fue 0,69 a los 2 años y 0,62 a los 5 años. En la cohorte de validación, los modelos demostrados tuvieron estadística para libertad de crisis de 0,60 y 0,61 para Engel 1. Se espera que este estudio se valide con cohortes prospectivas (79).
CONCLUSIONES
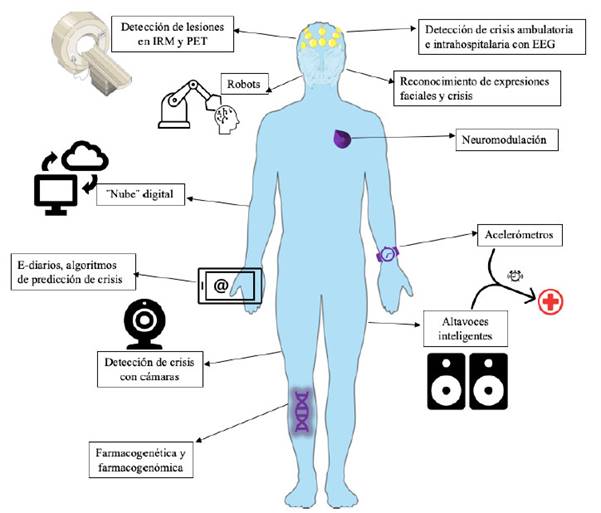
La IA es una rama tecnológica en auge en los últimos años. Las herramientas que provee para el médico a cargo de PCE representan una ventaja a favor del tratamiento (Figura 4) y calidad de vida de los pacientes, así como un mejor entendimiento del comportamiento de esta enfermedad compleja.
Para las poblaciones de latinoamerica, sobre todo aquellas poblaciones marginadas o con pobre acceso a la salud de forma frecuente, estas medidas representan un método de atención médica continua. Como ejemplo, el uso de dispositivos ambulatorios de EEG continuo (aunque sea un solo canal) podría representar para nuestras poblaciones una posibilidad de remotamente vigilar, controlar la frecuencia y severidad de las crisis y llegar a la meta de mejorar la calidad de vida de los pacientes. Las posibilidades de este tratamiento son extensas y ofrecen flexibilidad para aquellos quienes más lo necesitan.