INTRODUCCIÓN
En oncología pediátrica, la radioterapia (RT) es aceptada como una modalidad de tratamiento eficaz para el manejo de gliomas de bajo grado (GBG) no resecable o parcialmente resecado con sobrevida libre de progresión (SLP) a 10 años en el 80% de los casos. En los casos pediátricos de GBG parcialmente resecados, la adición de RT confiere una mejora de la SLP de aproximadamente el 40% en comparación con los que no reciben radioterapia post operatoria, con una supervivencia global (SG) >90% en la mayoría de las series de casos 1,2. No obstante, está asociado a toxicidad tardía, que incluye, vasculopatías 3, neoplasias secundaria 4 y deterioro neurocognitivo5. La mayor preocupación se presenta por el desarrollo de neoplasias malignas secundarias inducidas por radiación (4, 6-8).
Esta preocupación es particularmente importante para los pacientes con síndromes congénitos como Li- Fraumeni, neurofibromatosis-1, esclerosis tuberosa, xeroderma pigmentoso, retinoblastoma, entre otras; que tienen un mayor riesgo de desarrollar tumores malignos secundarios como parte de la historia natural de la enfermedad y más aún en el contexto posterior a la irradiación 5,9,10. En la actualidad se conoce poco sobre la fisiopatología de estas segundas neoplasias, así como la incidencia real 10.
El amplio intervalo de tiempo reportado en la literatura entre el término de la radioterapia y la aparición de segundas neoplasias (> 3 años), nos orienta a postular que ello se deba a un evento multifactorial, y no solo una consecuencia de la dosis de radiación administrada y sus modalidades o técnicas 9. Considerar las características patológicas y genéticas de los pacientes, así como el grado de inmadurez del tejido cerebral y la edad del paciente al momento del tratamiento, juegan un papel importante al realizar el análisis factorial 11,12.
Reporte de caso 1
En la anamnesis, los familiares no indicaron antecedentes familiares de síndromes relacionados a cáncer hereditario o familiar.
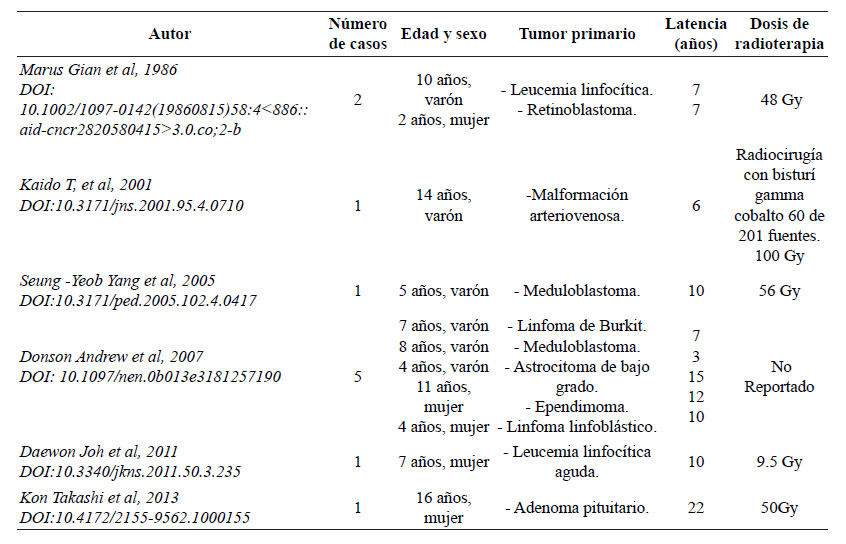
Paciente varón de 5 años de edad sin antecedentes clínicos relevantes, presentó un tumor ubicado en fosa posterior y en consecuencia, sometido a la resección total del tumor en agosto del 2013. El diagnóstico histopatológico fue meduloblastoma desmoplásico nodular (Figura 1). Fue tratado con radioterapia cráneo espinal a dosis de 3600 cGy, 4000 cGy en campos holocraneales, seguido de “boost” en fosa posterior hasta los 5600 cGy en 30 sesiones. Además, recibió ocho cursos de quimioterapia con cisplatino, vincristina y ciclofosfamida; posterior al tratamiento se presentó estable con controles anuales. Cuatro años después, el paciente reingresa por emergencia con un cuadro de vómitos y cefalea. Luego de realizada una resonancia magnética con contraste, se encontró una tumoración captadora de contraste en fosa posterior, en la misma zona de la tumoración anterior. Fue sometido nuevamente a una resección total de la tumoración y el diagnóstico histopatológico fue glioblastoma grado IV OMS (Figura 2). En base al diagnóstico, el paciente recibió radioterapia externa a dosis de 5600 cGy en 28 sesiones concomitante con temozolamida. Tres meses después de la cirugía, el paciente ingresa nuevamente a emergencia por presentar pausas respiratorias. Se procede a realizar una tomografía evidenciándose recurrencia local del tumor. No obstante, se le aplican cuidados paliativos y fallece a los cinco días.
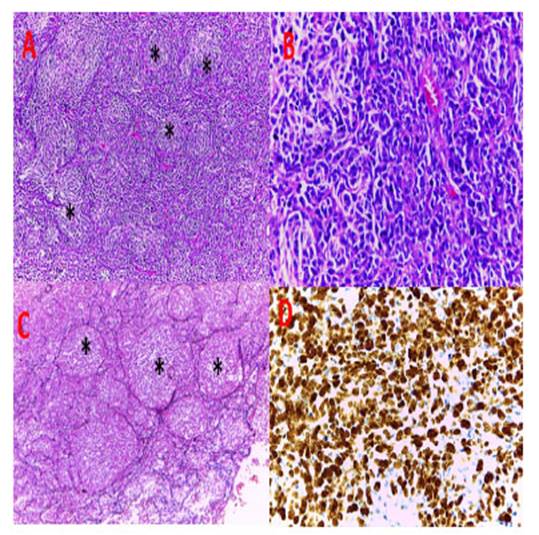
Figura 1 (A) zonas nodulares (asterisco) (4X) (tinción hematoxilina eosina); (B) células densamente empaquetadas, indiferenciadas y altamente proliferativas con núcleos hipercromáticos y moderadamente pleomórficos en zonas nodulares (40X); (C) Densa red de fibras de reticulina (asterisco) alrededor de zonas nodulares (4X) y (D) índice proliferativo elevado, inmunotinción de KI67 (20X).
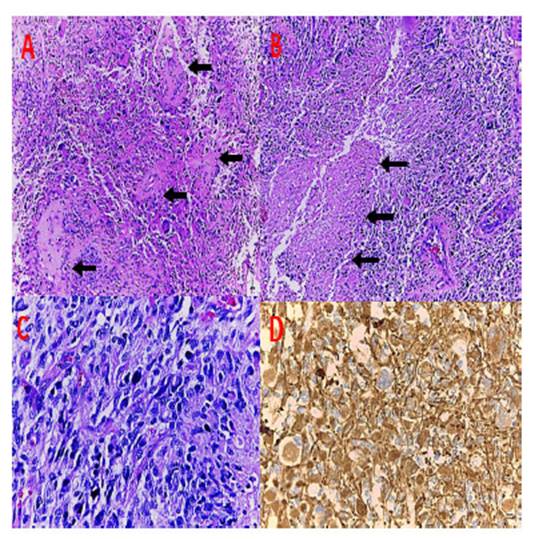
Figura 2 (A) proliferación vascular de aspecto glomeruloide con paredes hialinizadas (flechas), hematoxilina eosina (4X) (B) necrosis en palizada (flechas) (4X) (C) células con atipia nuclear severa (40X) (D) inmunotinción de proteína glial fibrilar acida (40X).
Reporte de caso 2
En la anamnesis, los familiares no indicaron antecedentes familiares de síndromes relacionados a cáncer hereditario o familiar.
Niña de 5 años de edad sin antecedentes clínicos relevantes, presentó tumor cerebral ubicado en el lóbulo fronto-parietal derecho y en consecuencia, fue sometida a la resección total del tumor en julio del 2000. El diagnóstico histopatológico fue tumor neuroepitelial disembrioplásico (Figura 3). Recibió radioterapia (5400 cGy en 30 sesiones) y luego continuó estable con en controles anuales. Siete años después se evidencia recurrencia local (marzo 2007) y recibe radiocirugía, desarrollando como secuela hemiparesia izquierda. En enero 2008, la paciente reingresa a emergencia por presentar movimientos involuntarios en mano izquierda. No obstante, se le realizó una tomografía computarizada con y sin contraste, encontrándose una tumoración sólido quística en la misma zona de la tumoración anterior; siendo sometida a la resección total. El diagnóstico histopatológico fue de neoplasia astrocítica difusa de alto grado y cambios post radioterapia (presencia de necrosis y hialinización de vasos sanguíneos), (Figura 4).
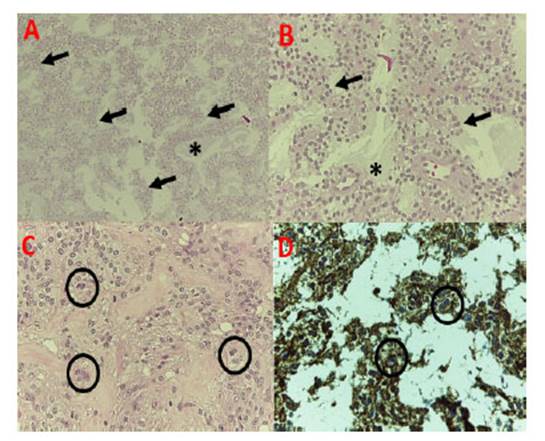
Figura 3 (A y B) columnas (flechas) orientadas perpendicularmente formadas por haces de axones revestidos por pequeñas células similares a oligodendrocitos. Se identifica matriz mucoide (asteriscos), (tinción hematoxilina eosina 4X y 10X) (C y D) neuronas flotantes (círculos) (D) células son positivas para la inmunotinción de proteína glial fibrilar ácida (40X).
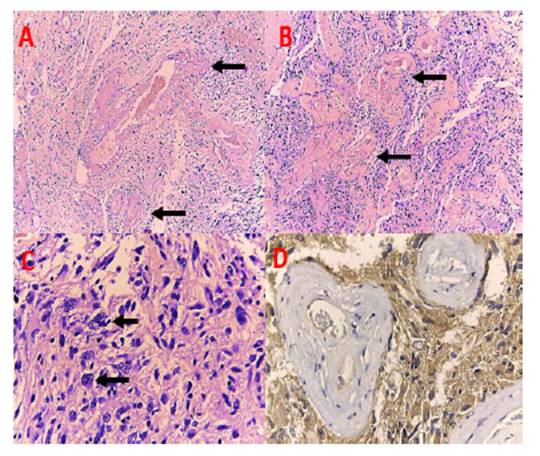
Figura 4 (A y B) estructuras vasculares de paredes hialinizadas en relación a cambios post radioterapia (flechas) (tinción hematoxilina eosina, 4X y 10X) (C) células con atipia nuclear severa (40X) (D) inmunotinción de proteína glial fibrilar ácida (40X).
La paciente recibió temozolamida postoperatoria y continuó con controles anuales en INEN hasta el año 2010. Posteriormente, se perdió de vista y se registra fallecimiento un año después (año 2011).
Diagnosticar un tumor secundario a la radioterapia es un desafío. Dada las características patológicas y clínicas de los casos; así como el seguimiento en el tiempo de los mismos, podemos dilucidar con certeza que corresponden a gliomas de alto grado inducidos por radioterapia.
Consideraciones éticas y limitaciones: Se mantiene en anonimato la identidad y confidencialidad de los pacientes. Los casos corresponden a los años 2007, donde el sistema institucional de base de datos digitalizado de imágenes aún no estaba implementado. El paciente del año 2013 no cuenta con los resultados de estudios de imágenes.
DISCUSIÓN
En 1948, Cahan propuso los siguientes criterios para la definición de GIR: 1) el tumor debe originarse en la región previamente irradiada; 2) debe haber un intervalo de tiempo suficientemente largo desde la irradiación y la aparición del tumor post-radiación; 3) el histotipo del tumor debe ser diferente del primario; 4) todos los tumores deben haber sido probados histológicamente y 5) el paciente no debe tener un fenotipo mutador, síndrome de predisposición al cáncer (SPC) 10,12,13. Los casos reportados en el presente artículo cumplen con todos los criterios antes presentados. Ambos, presentaron un glioblastoma secundario en la misma zona de irradiación previa, el caso 1 tuvo un intervalo de 4 años y el caso 2 tuvo un intervalo de 7 años. Además, a todas las tumoraciones se les realizó análisis histopatológico, determinándose histotipos diferentes post radiación.
Los criterios diagnósticos histológicos de un glioblastoma (GBM), son atípia citológica, actividad mitótica, proliferación endotelial y/o necrosis. En los GIR se encuentra hialinización estromal y vascular, con ectasia, apoptosis e inflamación, lo que dificulta la disquisición histológica entre un astrocitoma anaplásico con cambios post radioterapia y un glioblastoma. En la Tabla 1 se muestra una revisión de reportes de casos de gliomas inducidos post radioterapia (GIR) 14.
Generalmente, los pacientes con lesiones radio inducidas son más jóvenes (< 15 años) que los afectados por formas primarias 15. Las lesiones radio inducidas suelen tener un histotipo maligno 15 que pueden estar situadas en compartimentos cerebrales como la región supraselar y la fosa cerebelosa, rara vez afectados por un glioma primario 3,6; tal como se presentan en los casos de este reporte.
Los tumores cerebrales pediátricos inducidos por radiación difieren de los adultos por la incidencia de los tipos histológicos. Los gliomas de alto grado, de hecho, son los tumores radio inducidos más comunes en los niños, mientras que los meningiomas son, en general, los tumores radio inducidos más frecuentes en adultos 3,4. Los tumores cerebrales radio inducidos han sido reportados en respuesta a altas y bajas dosis de radiación tanto en pacientes pediátricos como adultos 3,9
Los pacientes pediátricos son más susceptibles a las complicaciones inducidas por la radiación, que los pacientes adultos y por lo general, cuanto más joven es el paciente, mayor es la incidencia y más corto el intervalo entre las complicaciones 13. Según los casos que reportamos, las complicaciones se presentan dentro de los 10 años post radioterapia.
Se han reportado alteraciones moleculares similares a las observadas en los astrocitomas primarios (de novo) de alto grado que surgen espontáneamente, con la posible excepción de la ausencia de mutaciones de PTEN en el grupo inducido por radiación 16. Por otro lado, las mutaciones en el gen de la neurofibromatosis tipo 2 (NF2), que se observan en hasta el 50% de los meningiomas espontáneos, generalmente no se observan en los meningiomas inducidos por radiación, ni tampoco mutaciones en los genes PTEN, TP53, HRAS, KRAS y NRAS 17.
La heterogeneidad histológica es un sello distintivo de los GBM de novo. Los GIR como entidad muestran una heterogeneidad genética considerablemente menor que los GBM pediátricos de novo. De hecho, el grado de homogeneidad de los GIR es similar a la homogeneidad genética observada en los astrocitomas pilocíticos y ependimomas 13. El hallazgo de que los GIR tienen una patología molecular más conservada que los GBM pediátricos de novo, puede estar relacionado con el hecho de que los GIR podrían tener más de un evento iniciador común; es decir, la radiación y/o los variados mecanismos etiológicos que causen GBM pediátricos de novo 13. Adicionalmente, los marcadores de linaje oligodendroglial OLIG1, OLIG2, PDGFR y NKX2.2 y el marcador de linaje neuronal BRINP3, un gen neuronal específico regulado por el desarrollo, se encuentran sobreexpresados en los GIR y los astrocitomas pilocíticos. En conjunto, estos datos sugieren que los GIR y el astrocitoma pilocítico, pueden compartir una célula precursora común, aunque con diferencias de grado 13. El único factor ambiental asociado inequívocamente con un mayor riesgo de tumores cerebrales, incluyendo gliomas, es la irradiación X terapéutica 18.
El desarrollo de una terapia molecular dirigida eficaz para GIR exige una mejor caracterización de la biología molecular de este tumor. Los pocos estudios biológicos de GIR hasta la fecha no han identificado marcadores moleculares con los cuales se pueda caracterizar. En GIR se ha encontrado la sobreexpresión de los genes ErbB3 y SOX10 en comparación con otros tumores cerebrales. Un hallazgo interesante es encontrar ErbB3 y SOX10 sobreexpresados en GIR 13 y en menor grado en otros tumores cerebrales, tanto astrocíticos como no astrocíticos 19. Adicionalmente, la sobreexpresión simultánea de ErbB3 y SOX10 se ha identificado previamente en el astrocitoma pilocítico y se considera que está relacionada con la tumorogénesis de este linaje de astrocitomas 19.
Mary Relling et al., evaluaron a un grupo de niños tratados con irradiación profiláctica para leucemia linfoblástica aguda (LLA). La incidencia de tumores cerebrales entre los niños irradiados fue del 12,8% (6 de 52 niños que recibieron radioterapia-profiláctica craneal) 20.
Salvati et al., revisaron 10 casos de gliomas inducidos por radiación entre 1970 y 2000. Los 10 casos descritos recibieron dosis totales que oscilaban entre 30 y 50 cGy, desarrollando todos glioblastomas después de un período de latencia media de 16 años 10. Posteriormente, se han notificado otros casos de glioblastoma inducido por radiación, después del tratamiento de una malformación vascular con “GammaKnife” en niños 9,21. Hay evidencia de que la radioterapia convencional al inducir tumores del Sistema Nervioso Central (SNC), está más relacionada con los meningiomas, pero la mayoría de los casos de tumores inducidos por radiación del SNC relacionados con el “Gammaknife”, son gliomas malignos 10.
El cerebro del niño es particularmente susceptible a los efectos mutagénicos de la radiación ionizante debido a la proliferación fisiológicamente activa de células gliales postnatales, especialmente durante la mielogénesis 21.
También se han descrito gliomas inducidos por radiación de alto grado, en la fosa posterior y la médula espinal después del tratamiento de meduloblastoma y la terapia contra el cáncer de cabeza y cuello (22- 24). El caso clínico 1, que reportamos en este artículo, corresponde a un GIR que se presenta cuatro años después del tratamiento de un meduloblastoma.
Un gran subconjunto de mutaciones en tumores cerebrales pediátricos se originará en la línea germinal como parte del síndrome de predisposición al cáncer (SPC). Las mutaciones germinales en los genes causantes del cáncer dan lugar a un alto riesgo de desarrollar cáncer a lo largo de la vida. Estos SPC son especialmente frecuentes en la población infantil y afectan tanto la supervivencia del paciente como de otros miembros de la familia. El conocimiento del SPC puede alterar el manejo del cáncer, ofrecer nuevas terapias dirigidas que pueden mejorar la supervivencia de estos pacientes y permite la detección temprana de otras neoplasias malignas 25.
Por otro lado, el microambiente tumoral afecta directa e indirectamente a las células malignas a través de células estromales que soportan el crecimiento tumoral. Las respuestas a lesiones del SNC que promueven tumores se recapitulan en el microambiente tumoral y se aumentan después de la radiación previa, afectando el fenotipo celular, la proliferación y la infiltración en el SNC 25. El ochenta por ciento de las recurrencias se producen en el margen de resección, en el que se administran las dosis de radiación más altas 26. Tales alteraciones incluyen hipoxia, activación inmune innata y cambios en la matriz extracelular. La medida en que estos cambios pueden afectar la penetración de medicamentos, la farmacocinética, la farmacodinámica y facilitar la resistencia celular requiere una investigación adicional 26, es importante resaltar, también , que la radioterapia puede producir tumores secundarios con transformaciones malignas 27.
Las técnicas quirúrgicas modernas, permiten un mayor porcentaje de resección tumoral completa, optándose por la observación como alternativa de manejo. Además, el uso de terapia sistémica (quimioterapia adyuvante), en tumores parcialmente resecados, ha logrado reemplazar o retrasar la radioterapia como tratamiento de primera línea para muchos pacientes, reservándola para los casos de alto riesgo o en los cuales se evidencia un rápido deterioro o progresión 2.
Gracias a un equipo multidisciplinario de especialistas ha sido posible reportar dos nuevos casos de GIR. Ambos casos, son coincidentes con lo reportado en la literatura respecto a la definición y riesgos implicados en el desarrollo de los GIR. Esto enfatiza la necesidad de determinar factores de riesgo, vías moleculares de tumorogénesis post radioterapia y probables blancos terapéuticos de estos casos singulares.