INTRODUCCIÓN
La corioamnionitis es la lesión aguda inflamatoria de la placenta causada por la infiltración de polimorfonucleares (PMN). Su incidencia tiene una relación inversa con la edad gestacional, que puede ser de 95 % en los prematuros menores de 24 semanas 1 y 80 % en los menores de 30 semanas 2.
En el Perú, Guillén 3 reportó que entre el 4-6 % de los partos corresponden a prematuros, y de ellos la mitad son prematuros menores de 34 semanas. Este último grupo presentó una incidencia mayor de lesiones cerebrales; y en aquellos con antecedente de corioamnionitis histológica (CAH) fue significativa la asociación con encefalopatía hipóxico-isquémica.
En el mundo, la sobrevida de los prematuros de menor edad gestacional tiende a aumentar, y nuestro país no es la excepción. Según el Instituto Nacional de Estadística e Informática 4), entre el 2019 y 2022, el 21-23 % de los nacimientos son prematuros. Sin embargo, diferentes factores concurrentes pueden afectar los finos procesos biológicos de maduración de los órganos mayores, entre ellos el cerebro.
En este contexto, la corioamnionitis es una causa importante de parto prematuro y de mortalidad neonatal. Su relevancia como problema de salud pública va de la mano con estas dos complicaciones obstétricas 5). A su vez, también está asociada a un mayor riesgo de hemorragia intraventricular, leucomalacia periventricular y, a largo plazo, parálisis cerebral 6), por daño directo y daño a distancia de la sustancia blanca por medio de citoquinas 7).
Por otra parte, el perímetro cefálico (PC) es la medida antropométrica más eficaz para monitorizar el crecimiento cerebral desde la vida intrauterina hasta los primeros años. Este parámetro podría poner en evidencia el efecto deletéreo de agentes tóxicos, infecciones congénitas, malnutrición y síndromes genéticos, que provocan retraso del crecimiento del PC y menores habilidades del desarrollo 8-10.
En 1974, Dobbing 11 encontró que el período de mayor crecimiento cerebral está situado entre las 28 semanas de edad gestacional y el tercer año de vida, por lo que una injuria cerebral en este período crítico podría tener mayor impacto en el desarrollo cerebral.
Recientemente, algunos estudios han enfatizado la importancia del examen histopatológico de la placenta, en desmedro de la definición clínica de la corioamnionitis y los eventos neonatales como sepsis y ruptura prematura de membranas (12, 13).
Dado que hay pocos estudios que exploran el efecto de la corioamnionitis sobre el crecimiento cerebral y ninguno lo realiza de manera longitudinal (14), además que la anatomía patológica es el estándar de oro para definir su diagnóstico, nos planteamos explorar su influencia desde el nacimiento hasta los dos años de edad corregida.
MATERIAL Y MÉTODOS
El objetivo del presente estudio fue analizar la variación del PC de prematuros menores de 34 semanas expuestos a la CAH desde el nacimiento hasta los dos años de edad corregida.
Presentamos un estudio secundario de dos cohortes de prematuros menores de 34 semanas del Hospital Cayetano Heredia, nacidos entre el 1 de mayo de 2012 y el 31 de diciembre de 2015. Todos los pacientes incluidos tuvieron examen histopatológico de la placenta, evaluaciones neurológicas que incluyeron medidas del PC y ecografías cerebrales, al nacimiento, a las 40 semanas y a los 2 años de edad corregida.
Los datos se tomaron de los estudios «Riesgo de daño cerebral en prematuros menores de 34 semanas expuestos a CAH en Lima, Perú» 2 y «Randomized controlled trial of bovine lactoferrin for prevention of sepsis and neurodevelopment impairment in infants weighing less tan 2000 grams» 15).
El primero 2 fue un estudio de cohorte prospectiva que incluyó prematuros menores de 34 semanas de edad gestacional que nacieron en el Hospital Cayetano Heredia durante el año 2015 y que contaron con examen histopatológico de placenta. La edad gestacional fue calculada por fecha de última menstruación, ecografía del primer trimestre o escala de Ballard. Se excluyó a los recién nacidos con malformaciones severas y a los hijos de madres con enfermedad neuropsiquiátrica no controlada. El tamaño muestral se estimó en 36 nacidos con CAH para un nivel de confianza de 95 %, potencia de 80 % y una precisión de 0,133. Los pacientes tuvieron examen neurológico, medición del PC y ecografía cerebral al nacimiento, luego con frecuencia semanal hasta las tres semanas, y posteriormente cada 4 semanas hasta cumplir 40 semanas de edad corregida. Finalmente, se continuó el seguimiento clínico hasta los dos años de edad corregida.
El segundo estudio 15 fue un ensayo clínico doble ciego, aleatorizado y controlado contra placebo, realizado en tres hospitales de Lima, Perú. Se incluyó a los prematuros que tuvieron un peso de nacimiento entre 500-2000 gramos. La edad gestacional fue determinada por la escala de Ballard. Fueron excluidos los prematuros que tenían enfermedad gastrointestinal que contraindicaba la alimentación enteral, condiciones predisponentes que alteraran el crecimiento y desarrollo, e historia familiar de alergia a la leche de vaca. Todos los prematuros que nacieron en el Hospital Cayetano Heredia contaron con un examen histopatológico de placenta. Igualmente, estos niños tuvieron evaluación neurológica clínica y ecográfica cerebral hasta que egresaron del hospital. Posteriormente, tuvieron controles neurológicos, que incluyeron la medición del PC a los 6, 12 y 24 meses de edad corregida.
Los datos maternos y neonatales fueron tomados de las bases de ambos estudios, con la autorización correspondiente de los autores principales.
Variables
Definimos CAH como la presencia de neutrófilos (≥ 10/campo) en las membranas amnióticas, cordón umbilical, vasos de la placa y vellosidades amnióticas, a través de la observación directa de la placenta teñida con hematoxilina-eosina por un patólogo entrenado. Utilizamos la clasificación de Redline 16 para definir los subtipos de CAH respecto a su extensión:
Subcorionitis: infiltración individual o racimosa de neutrófilos en el corion o en el espacio subcoriónico.
Corioamnionitis: infiltración de neutrófilos en el tejido conectivo coriónico y/o amnios o en la placa coriónica.
Corioamnionitis más funisitis: subtipo corioamnionitis asociado a la inflamación que involucra estructuras del cordón umbilical (vena umbilical, arteria umbilical y gelatina de Wharton).
El PC fue la variable explorada que se obtuvo al medir la circunferencia occipitofrontal en centímetros con una cinta métrica estandarizada no elongable según la técnica aceptada por la OMS/OPS 17). Se consideró microcefalia cuando el valor del PC estaba por debajo del percentil 3, y macrocefalia cuando estaba por encima del percentil 97 según la escala de Fenton 18).
Para la evaluación de los casos de sepsis neonatal se consideraron casos de sepsis probables a los prematuros con signos clínicos de hipoactividad y letargia más evidencia de proteína C reactiva o procalcitonina positiva. Los casos de sepsis confirmados se definieron como la presencia de signos y síntomas de infección con aislamiento de germen por hemocultivo o cultivo de líquido cefalorraquídeo obtenido después de las 72 horas de vida. En el caso de Staphylococcus coagulasa-negativo (CoNS), se requirieron por lo menos dos hemocultivos positivos o uno más un valor de proteína C reactiva mayor de 10 mg/L 19).
De acuerdo con la edad gestacional, la población se dividió en tres grupos: de 24-27 semanas, de 28-32 semanas, y más de 32 semanas. Esta división se realizó considerando que la maduración y la organización cerebral finalizan aproximadamente a las 28 semanas de vida fetal, y la probabilidad de lesiones cerebrales asociadas a la prematuridad es mayor en estos grupos por la inmadurez cerebral 20).
Las variables de riesgo prenatal fueron la edad materna, el número de gestaciones, el nivel educativo y el tipo de parto. Las variables de origen neonatal fueron el sexo, el peso, la talla, el retardo del crecimiento intrauterino (RCIU), la patología no neurológica (enfermedad de membrana hialina, neumotórax, sepsis, enterocolitis necrotizante [NEC]) y neurológica, como la hemorragia intraventricular (HIV), leucomalacia periventricular (LPV), encefalopatía neonatal (EN), vasculopatía lentículoestriada (VLE), hipoplasia cerebral (HC) y ventriculomegalia transitoria (VMGT).
Consideraciones éticas
El estudio fue revisado y aprobado por el Comité de Ética e Investigación del Hospital Cayetano Heredia y de la Universidad Peruana Cayetano Heredia; y los datos fueron registrados en una base codificada para proteger la identidad de los pacientes.
Análisis estadístico
Los datos fueron analizados utilizando el paquete estadístico STATA versión 17. Para el estudio de lactoferrina, se realizó un análisis de homogeneidad para verificar que los prematuros que recibieron este medicamento tuvieron medidas similares de PC con los que no recibieron.
En la estadística descriptiva, se usó medidas de tendencia central (media) y de dispersión (desviación estándar) en variables numéricas. Las variables cualitativas fueron presentadas en tablas de frecuencias absolutas y relativas y en gráficos. Para determinar las diferencias entre los grupos según la presencia de CAH, se aplicó la prueba T-Student para variables numéricas. El efecto de la presencia de CAH sobre las variaciones del PC se determinó con modelos de regresión lineal múltiple al nacer, a las 40 semanas y a los 2 años. En todas las pruebas de inferencia se utilizó un nivel de significancia de 0,05.
RESULTADOS
Se analizó una población de 91 prematuros menores de 34 semanas de gestación, nacidos entre mayo de 2012 y diciembre de 2015 en el Hospital Cayetano Heredia, y que contaron con estudio histopatológico de placenta. Fueron 55 prematuros provenientes del estudio de cohorte prospectiva y 36 del ensayo clínico. De este último, 19 recibieron lactoferrina y 17 recibieron placebo; fueron grupos homogéneos.
Características generales de la población de estudio
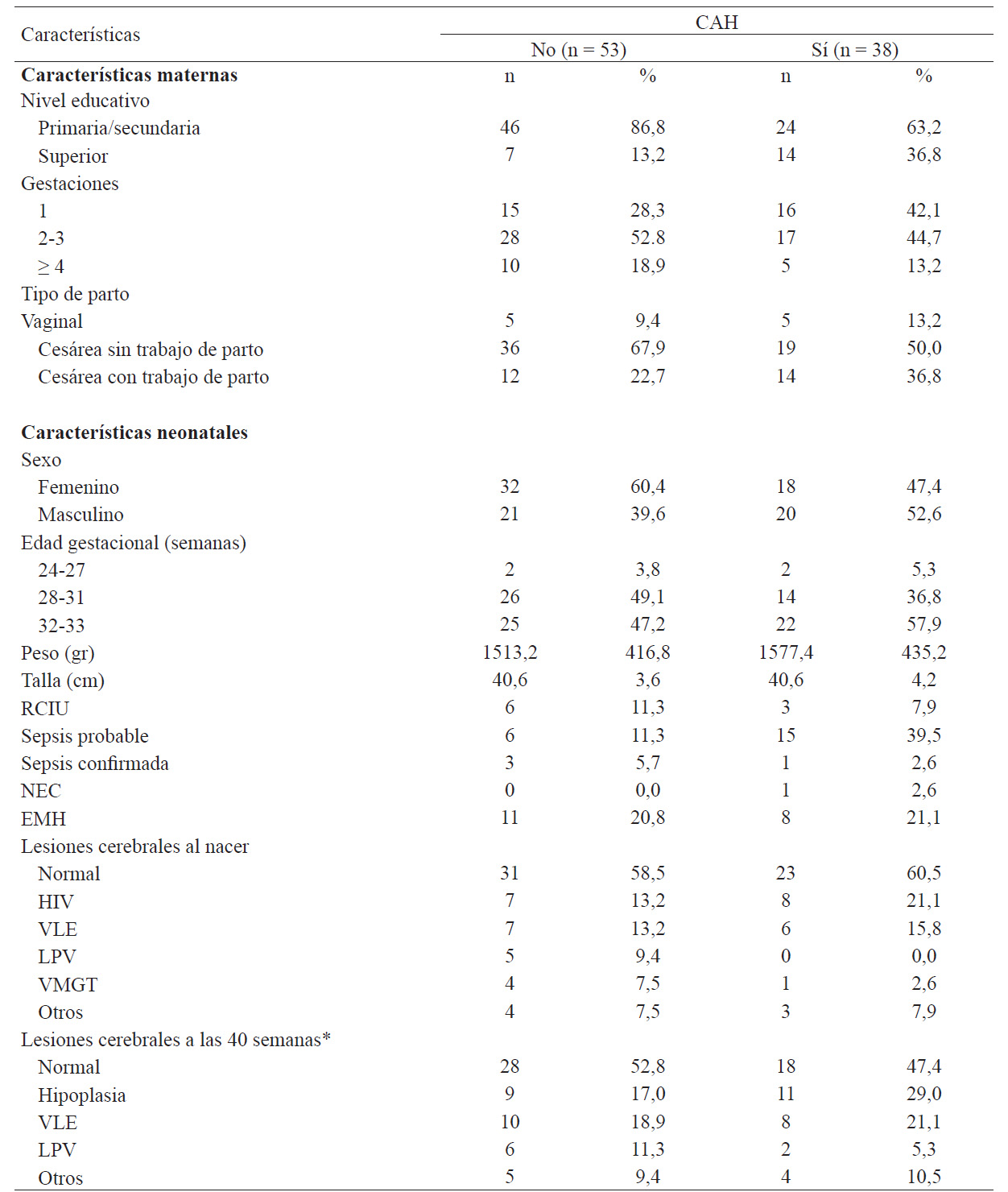
El 41,8 % (38/91) de los prematuros nacieron expuestos a CAH. La edad promedio de las madres de los prematuros sin CAH fue de 27 años; y la de las madres de prematuros con CAH fue de 28 años. El 86,8 % (46/53) de madres de prematuros con CAH tuvieron un nivel de instrucción de secundaria completa o inferior; mientras que en las madres de prematuros sin CAH se observó la misma característica en el 63,2 % (24/38). La proporción de mujeres primíparas fue mayor en el grupo de pacientes expuestas a CAH (42,1 % vs. 28,3%). El tipo de parto fue predominante por cesárea, en el 90,6 % de los recién nacidos no expuestos a CAH y en el 86,8 % de los recién nacidos expuestos a CAH (tabla 1).
Tabla 1 Características maternas y neonatales según la condición de CAH.
*No excluyentes.
RCIU: retraso de crecimiento intrauterino; HIV: hemorragia intraventricular;
VLE: vasculopatía lentículoestriada; LPV: leucomalacia periventricular;
EMH: enfermedad de membrana hialina; NEC: enterocolitis necrotizante;
VMGT: ventriculomegalia transitoria.
La media de peso de nacimiento en los prematuros con CAH fue de 1513,2 (DE: 416,8 g) y en los que no tuvieron CAH fue de 1577,4 (DE: 435,2 g). El 47,4 % y el 60,4 % de los pacientes fueron de sexo femenino en los expuestos y no expuestos, respectivamente.
En ambos subgrupos, la mayoría de prematuros se encontraron entre 28 y 32 semanas de edad gestacional al nacer. El 69,8 % de los prematuros sin CAH recibió tratamiento antenatal con corticoides; mientras que en los casos con CAH fue menor (47,4 %) (tabla 1).
La frecuencia de macrocefalia fue de 2,2 % (2/91), un prematuro en los casos expuestos y uno en los controles, los cuales se normalizaron a las 40 semanas. La microcefalia al nacer se observó en el 12,1 % (11/91) de la población, 7,5 % (4/53) en los prematuros sin CAH y 18,4 % (7/38) en los expuestos a CAH. A las 40 semanas, los 4 casos no expuestos se mantuvieron con microcefalia, pero solo uno de los expuestos. Finalmente, a los 2 años, la microcefalia fue 8,0 % (4/50) en los no expuestos y 8,6 % (3/35) en los expuestos.
La sepsis probable o confirmada ocurrió en el 27,5 % (25/91) de los casos, siendo mucho más frecuente en los casos expuestos a CAH (42,1 % vs. 17 %). La enfermedad de membrana hialina (EMH) fue el segundo factor patológico más frecuente en la población, 20,9 % (19/91), con una distribución similar en ambos grupos de exposición.
La hemorragia intraventricular (HIV) fue la enfermedad neurológica más frecuente, 16,5 % (15/91) de los casos; ocurrió en el 21,1 % (8/38) de los casos expuestos a CAH vs. 13,2 % (7/53) de los casos no expuestos. La segunda patología fue la vasculopatía lentículoestriada (VLE), 14,3 % (13/91), seguida de la leucomalacia periventricular (LPV) y otros, de distribución semejante en ambos grupos.
La hipoplasia cerebral fue la alteración más frecuentemente observada por ecografía cerebral a las 40 semanas de edad corregida en el 29 % (11/38) de los casos expuestos a CAH vs. 17 % (9/53) de los no expuestos a CAH.
Rol de la exposición a la corioamnionitis histológica
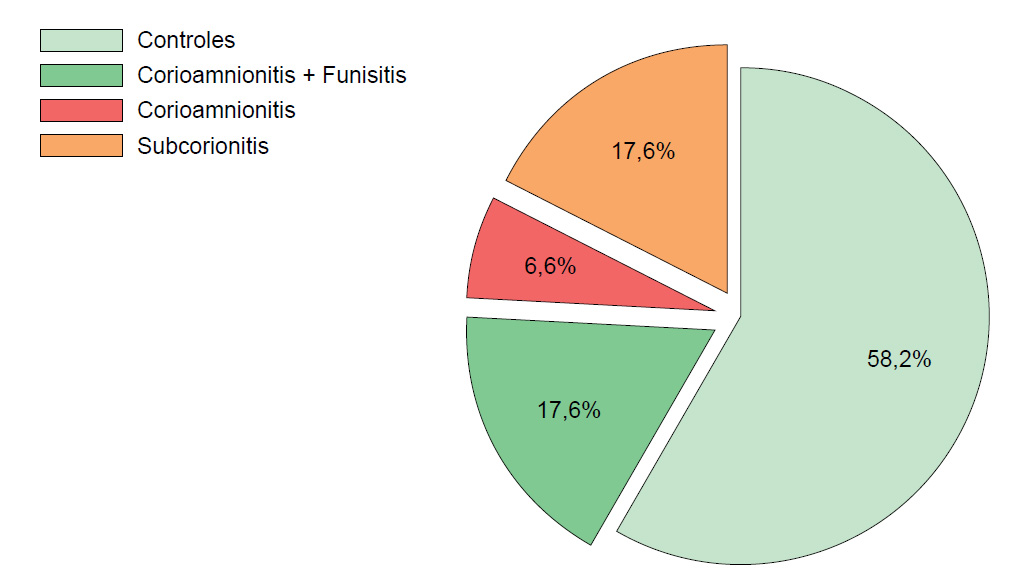
La distribución de los subtipos de CAH fue como sigue: el subtipo corioamnionitis más funisitis en 7,6 % (16/91), solo corioamnionitis en 6,6 % (6/91) y subcorionitis en 17,6 % (16/91) (figura 1). Los casos tuvieron en conjunto mayor variación del PC, pero esto dependió del subtipo de CAH analizada.
A las 40 semanas, todos los subgrupos tuvieron incremento del promedio de los percentiles del perímetro cefálico (PPC). Sin embargo, a los 2 años, se observó descenso de los PPC en los controles (-13,1) y en los casos del subtipo corioamnionitis (-17,1) (tabla 2).
Tabla 2 Variaciones de los percentiles del perímetro cefálico según el subtipo de CAH.
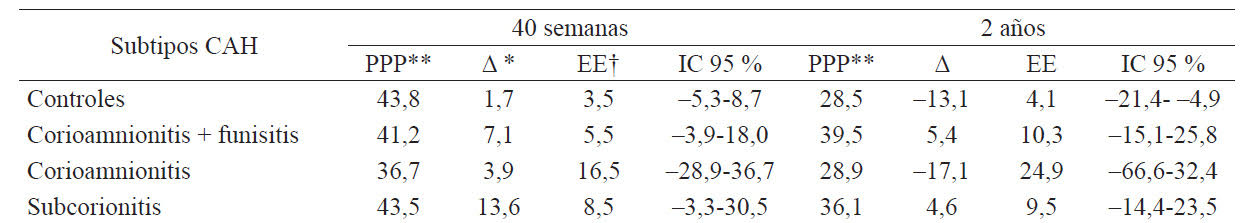
Δ *: diferencia con respecto al promedio de percentil al nacimiento.
†EE: error estándar.
**Percentil promedio del PC.
No se observó mayor variación en los promedios del PC por edades en los expuestos vs. los no expuestos a CAH. En los prematuros sin CAH, la media al nacer fue de 28,3 cm (percentil 42); 34,3 cm (percentil 43,8) a las 40 semanas de edad corregida; y 47,3 cm (percentil 28,5) a los dos años. Para los prematuros con CAH, la media al nacer fue de 27,7 cm (percentil 31,2); 33,7 cm (percentil 41,6) a las 40 semanas de edad corregida; y 47,9 cm (percentil 36,4) a los dos años (tabla 3).
Tabla 3 Medida del perímetro cefálico de acuerdo a la exposición a la CAH.
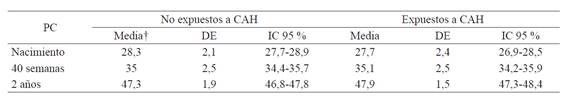
DE: Desviación estándar; IC: Intervalo de confianza
† Medida en centímetros
Según el modelo de regresión múltiple lineal, las variables que se asociaron a un menor PC al nacimiento fueron la CAH (p = 0,024) y el RCIU (p = 0,003). A las 40 semanas, fue la CAH (excluyendo el subtipo subcorionitis/corionitis [p = 0,038]), el RCIU (p = 0,005), el uso de corticoides antenatal (p = 0,046), y la sepsis neonatal confirmada por cultivo (p = 0,006). Finalmente, a los 2 años, las variables fueron la CAH más NEC (p = 0,001), el RCIU (p = 0,012) y el parto por cesárea (p = 0,049) (tabla 4).
DISCUSIÓN
La CAH tiene efecto deletéreo sobre el crecimiento craneal expresado por el PC. El análisis por subgrupos histológicos demostró que los prematuros expuestos al subtipo histológico corioamnionitis (afección del corion y amnios en forma difusa) y la funisitis tuvieron menor tamaño craneal.
El objetivo de este análisis fue evaluar la influencia de la CAH en tres momentos, al nacimiento, a las 40 semanas de edad gestacional y a los 2 años de edad corregida, porque son edades que determinan el pronóstico del neurodesarrollo en el niño prematuro.
Aunque la evidencia de si la CAH está asociada a un mayor riesgo de lesiones cerebrales es cada vez más sólida (2, 5, 21, 22), existe menos certidumbre si la CAH puede afectar el crecimiento cerebral en los prematuros (14, 23).
El menor crecimiento craneal y cerebral suele estar influenciado por varios factores nutricionales, genéticos y de perfusión vascular fetal. También son causas muy importantes las infecciones intrauterinas, las exposiciones tóxicas al tabaco, alcohol y a los metales pesados 8-10). Menos conocidos son los factores inflamatorios derivados de las infecciones genitourinarias y de la placenta.
En los años recientes, se ha establecido que el mejor criterio diagnóstico de corioamnionitis se obtiene con el examen histológico de la placenta 13). Dependiendo de la edad gestacional, diferentes estudios mostraron un amplio rango de CAH en series de prematuros. En este estudio se demostró que el 41,8 % de las placentas presentaron signos de algún tipo de CAH en menores de 34 semanas, proporción que ha sido reportada anteriormente (4, 23), y que tiende a ser mayor cuanto menor es la edad gestacional, como expresión del efecto inductor de las prostanglandinas sobre el trabajo de parto pretérmino.
La corioamnionitis genera importantes consecuencias neurológicas al prematuro, independientemente de los agentes bacterianos. Puede desencadenar el síndrome de respuesta inflamatoria fetal (FIRS), que propicia la liberación de citoquinas proinflamatorias (IL-α, ILβ, IL-6, IL-8), las cuales podrían lesionar la sustancia blanca en el cerebro inmaduro con subsecuentes consecuencias, como la parálisis cerebral (24, 25).
El presente estudio se realizó en una población bastante homogénea entre los prematuros expuestos y no expuestos a CAH, con la única diferencia de tener mayor proporción de casos de sepsis y de HIV en la población expuesta. Solo al nacer las medidas del PC de ambos grupos fueron significativamente diferentes, siendo menor en los pacientes expuestos a CAH. Sin embargo, aunque no tenemos una clara explicación sobre el mecanismo de esta asociación, postulamos que la asociación con el RCIU potencia su efecto hasta los 2 años, sin dejar de tener en cuenta otros factores durante el crecimiento del niño.
Como se esperaba, los prematuros con el subtipo subcorionitis/corionitis (menor proporción de tejido placentario comprometido) tuvieron mejor evolución y recuperaron sus percentiles de crecimiento craneal en los siguientes meses. Sin embargo, los prematuros con el subtipo corioamnionitis y corioamnionitis más funisitis progresaron con menores percentiles en el tiempo, evidencia que aún requiere mayor tamaño muestral y análisis de otros factores, como enfermedades intercurrentes, nutricionales, discapacidad y socioeconómicos.
Entre las limitaciones del estudio, destacan no contar con aislamientos microbiológicos con el fin de caracterizar la especie y la virulencia del germen, y no tener registro del tipo de corticoide prenatal 26). Entre las fortalezas, destacan haber contado con los registros completos anatomopatológicos de la placenta, las evaluaciones neurológicas, las ecografías; y que las mediciones del PC fueron llevadas a cabo por un equipo médico calificado.
CONCLUSIONES
Los prematuros menores de 34 semanas expuestos a la CAH tuvieron menor PPC al nacimiento; se observó recuperación del PPC a las 40 semanas; y, finalmente, el subtipo corioamnionitis (afección del corion y del amnios) se relacionó con menor PC a los 2 años de edad corregida. El factor RCIU potencia esta asociación y la sepsis solo fue influyente a las 40 semanas. Se recomienda que futuros estudios confirmen estos hallazgos.