Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión impresa ISSN 1018-130X
Rev Med Hered v.6 n.3 Lima abr. 1995
Insuficiencia ovárica prematura en mujeres infértiles atendidas en el Hospital Nacional Arzobispo Loayza.
Premature ovarian insufficiency in infertile women at the Hospital Nacional Arzobispo Loayza.
Rechkemmer Prieto Adolfo*, Tovar Mena Hernán**, Jefferson Cortez Luz***.
* Profesor auxiliar, Departamento de Obstetricia y Ginecología, Universidad Peruana Cayetano Heredia y Médico Asistente, Servicio de Ginecología, Hospital Nacional Arzobispo Loayza. Lima, Perú.
** Médico Cirujano.
***Jefe de Departamento de Obstetricia y Ginecología, Universidad Peruana Cayetano Heredia y Jefe de Servicio de Ginecología, Hospital Nacional Arzobispo Loayza. Lima, Perú.
RESUMEN
Objetivo: Determinar la frecuencia y las manifestaciones clínicas de Insuficiencia Ovárica Prematura en las pacientes infértiles. Material y métodos: En un estudio retrospectivo, descriptivo, se revisaron las historias clínicas de las pacientes atendidas en el Consultorio de Infertilidad del Hospital Nacional Arzobispo Loayza (HNAL), entre enero de 1989 y marzo de 1995. Resultados: Se encontró 27 pacientes con el citado diagnóstico, de un total de 1,855 pacientes que acudieron a consulta (1.45%). Todas tuvieron valores de FSH elevado y 25pacientes tuvieron niveles bajos de estradiol. Se observó hipotrofia de genitales externos y de vagina en el 11.11%, y de mamas en el 14.8%. Se realizó biopsia ovárica a 7 pacientes, en seis de ellas se observó ausencia de folículos. El diagnóstico más frecuente fue el de Insuficiencia Ovárica Prematura Idiomática. El tratamiento consistió en terapia hormonal de reemplazo con estrógenos/progestágenos secuenciales. En una paciente se indujo ovulación con menotropinas y se obtuvo gestación gemelar. Conclusiones: La insuficiencia ovárica prematura es poco frecuente en mujeres infértiles del HNAL, generalmente se presenta como amenorrea secundaria. La tercera parte presentó síntomas vasomotores. (Rev Med Hered 1995; 6: 115-120).
PALABRAS CLAVE: Insuficiencia ovárica prematura, infertilidad, hipogonadismo hipergonadotrópico.
SUMMARY
Objective: To know the local incidence and clinical features of premature ovarian failure in infertile patients. Material and Methods: Descriptive, retrospective study was performed. We reviewed the clinical files of the patients evaluated at the infertility clinic of the Hospital Nacional Arzobispo Loayza (HNCH), in Lima, Perú, between January 1989 and March 1995. Results: The incidence of the disease was 1.45% (27 out of 1,75 infertile patients). Everybody had elevated FSH levels and 25 out of 27 had low estradiol levels. 11.11% and 14.8% had external genital and mammary glands hypotrophy, respectively. Ovary biopsy was performed in 7 patients; in six of them ovarian follicles were not found. In these patients, idiopatic premature ovarian failure was the most frequent diagnosis. Hormonal replacement therapy was the main treatment. Ovulation induction with menotropins in one patient was successful and resulted in a twin pregnancy. Conclusions: Premature ovarian failure was an infrequent pathology in infertile women at the HNAL; secondary amenorrhea was the most frequent symptom and a third had vasomotor symptoms. (Rev Med Hered 1995; 6: 115-120).
KEY WORDS: Premature ovarian failure, infertility, hypergonadotropic hypogonadism.
INTRODUCCION
Entre los 45 a 55 años (1,2) la mujer normal empieza a presentar una disminución progresiva de la función ovárica, debido al agotamiento de los folículos ováricos (3). Se produce en consecuencia la pérdida de la capacidad reproductiva y de la actividad hormonal ovárica (1)
El proceso de envejecimiento durante el cual la mujer pasa de la etapa reproductiva a la no reproductiva se denomina climaterio (4,5), durante el cual ocurre la menospausia o última menstruación.
La menospausia normalmente ocurre a los 50 años en promedio (3-5). En el Perú, la edad promedio de la menospausia es de 48.2 años en Lima, a nivel del mar, y de 45.3 en la altura. Sin embargo, existe un pequeño grupo de mujeres en las cuales el cese de la función ovárica ocurre antes de los 40 años (2,6,11). A esta condición se ha denominado Insuficiencia Ovárica Prematura (OIP).
Esta entidad, muy poco estudiada en nuestro medio, tiene un fuerte impacto emocional en quienes la sufren, por tratarse de mujeres jóvenes que no pueden procrear y que además se ven sometidas a un envejecimiento prematuro (3,7).
El presente estudio tiene como objetivo determinar la frecuencia de IOP y sus manifestaciones clínicas más frecuentes, en las pacientes que acudieron al Consultorio de Infertilidad de Hospital Nacional Arzobispo Loayza (HNAL) de Lima.
MATERIAL Y METODOS
Se trata de un estudio retrospectivo, descriptivo, tipo reporte de casos. Se revisaron todas las historias clínicas de las pacientes atendidas en el Consultorio de Infertilidad del Hospital Nacional Arzobispo Loayza, entre enero de 1989 y marzo de 1995.
Los criterios de inclusión fueron (6,8,11):
- Edad menor de 40 años.
- Oligomenorrea o amenorrea secundaria (mínimo 3 meses).
- Desarrollo de caracteres sexuales secundarios.
- Nivel de gonadotropinas séricas elevado (FSH mayor de 30 mUI/ml) en más de una oportunidad.
En total se encontró 27 pacientes con diagnóstico de IOP. Se consignaron los datos relevantes de la anamnesis, examen clínico, el tipo de tratamiento hormonal indicado a cada paciente y la respuesta al mismo y los valores de las determinaciones de FSH, LH, prolactina y estradiol. Las determinaciones hormonales se realizaron en el Laboratorio de Medicina Nuclear del Hospital Nacional Arzobispo Loayza, utilizándose el método de radioinmunoensayo (RIA), según técnica estandarizada por la OMS.
Se consideró como valores normales los siguientes: FSH: 4-20 mUI/ml; LH: 4-20 mUI/ml; prolactina: 0-20 ng/ml y estradiol: 30-400 pg/ml en la fase folicular y 50-150 pg/ml en la fase lútea. El coeficiente de variación (CV) intraestudio fue de 6.5% para FSH y 5.2% para LH. El CV interestudio para FSH fue 7% y para LH 9.1%.
En algunas pacientes se había realizado estudio del cariotipo, los que fueron determinados en cultivo de linfocitos de sangre periférica. Igualmente algunas pacientes tenían biopsia de ovario por laparoscopía o laparotomía.
RESULTADOS
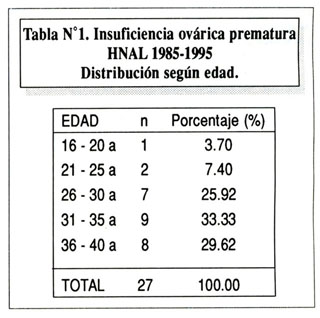
Entre enero de 1989 y marzo de 1995 se atendieron 1855 pacientes en el Consultorio de Infertilidad del HNAL. Veintisiete (1.45%), tuvieron diagnóstico de IOP. La tabla Nº1 , muestra la distribución por edades. La monarquía osciló entre los 11 y los 18 años. Veinte la presentaron entre los 11 a 14 años (74.07%) y siete entre los 15 y los 18 (25.92%).
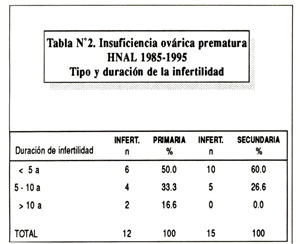
Dieciocho pacientes (66.66%) presentaron amenorrea y nueve presentaron Oligomenorrea. En cuanto al tipo de infertilidad, ésta fue primaria en 12 y secundaria en 15 pacientes, presentando la mayoría menos de 5 años de infertilidad ( Tabla Nº2 ).
En relación a la sintomatología de las pacientes, 9(33.33%) manifestaron síntomas vasomotores (bochornos, sudoración), tres pacientes (11.11%) presentaron cefalea, cuatro pacientes (14.81%) ansiedad, y 4 (14.81%) irritabilidad.
Ninguna paciente tenía antecedente de tuberculosis pélvica, de diabetes ni de haber sido sometida a radioterapia. Una paciente tenía antecedente de hipotiroidismo y otra de nódulo frío en el lóbulo tiroideo derecho. Una paciente tenía antecedente de uso de drogas citotóxicas; se trataba de una paciente con lupus eritematoso sistémico que había sido sometida a pulsos de ciclofosfamida. Dos pacientes (7.4%) tenían antecedente de haber sido sometidas a ooforectomía unilateral; una por quiste ovárico hemorrágico roto y la otra por embarazo ectópico roto. Una paciente tenía el antecedente de ooforectomía bilateral por quistes dermoides en ambos ovarios. Cinco pacientes refirieron haber sufrido parotiditis (a los 5, 8,11 y 23 años).
El peso promedio de las pacientes fue de 57.35 Kg y la estatura promedio de 153.5 cm. El índice de masa corporal fue normal en diez pacientes, y reveló sobrepeso en diez. Los genitales externos y las características de la vagina fueron normales en 24 pacientes (88.88%) mientras que tres (11.11%) presentaban hipotrofia.
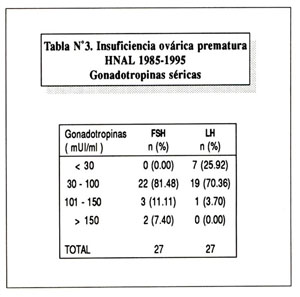
Todas las pacientes tuvieron determinación de gonadotropinas séricas. Veintidós pacientes tenían valores de FSH entre 30 y 100 mUI/ml. Par la LH, 7 pacientes tuvieron valores menores de 30 mUI/ml (25.92%) y 19 (70.36%) los tuvieron entre 30 y 100 ( Tabla Nº3 ).
Veinticuatro pacientes tuvieron determinación de prolactina; 17(74.16%) tuvieron valores normales y 7 pacientes (25.84%) los tuvieron elevados. De las 21 pacientes con determinaciones de estradiol, 19 (90.47%) tuvieron valores bajos.
Once pacientes tuvieron determinaciones de T4 y TSH, siendo los valores normales en todos los casos. En 7 pacientes (25.92%) se hizo estudio de anticuerpos antitiroideos (antitiroglobulina y antimicrosomial), siendo negativo en 4 casos, positivo a anticuerpos antimicrosomiales en un caso; positivo a anticuerpos antitiroglobulina en otra pacientes y positivos a ambos en una tercera pacientes. Se determinó anticuerpos antinucleares en 3 pacientes, siendo en todos los casos, negativos.
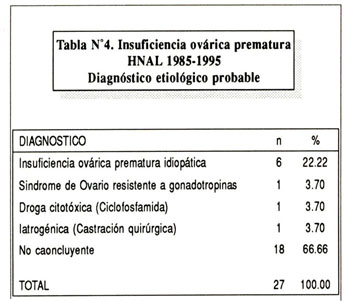
En 6 pacientes se hizo estudio del cariotipo por cultivo de linfocitos de sangre periférica, siendo en todos los casos 46 XX. Se tomó biopsia de ovario a siete pacientes; en cuatro la muestra se obtuvo por laparoscopía; y en tres por laparotomía. La biopsia mostró en 6 pacientes ausencia de folículos primordiales y estroma fibrótico; en una paciente se informa presencia de folículos y estroma normal. El diangóstico probable se muestra en la tabla Nº4 . En seis de las pacientes el diangóstico más probable es el de IOP idiopática ya que la biopsia de ovario mostró ausencia de folículos y estroma fibrótico sin infiltrado de células plasmáticas. En una de las pacientes el diagnóstico probable es el de Síndrome de Ovario Resistente a Gonadotropinas, pues en la biopsia se encuentra presencia de folículos y estroma normal.
A todas las pacientes se les indicó terapia hormonal de reemplazo con estrógenos/progestágenos secuenciales. Sólo 11 de ellas acudieron a control durante el tratamiento, siendo el seguimiento promedio de 4.5 meses. A una paciente se trató de inducir ovulación con clomifeno y gonadotropina menospáusica humana (HMG), no obteniéndose respuesta. Otra paciente fue inducida con dosis altas de HMG más gonadotropina coriónica (HCG) obteniéndose ovulación y gestación gemelar, culminando en parto pretérmino de recién nacidos vivos y normales. Ninguna de estas dos pacientes tenían biopsia ovárica y ambas tenían infertilidad primaria de 3 años, con niveles de FSH de 45 y 35 mUI/ml, respectivamente.
DISCUSION
Gonzáles (2) en un estudio realizado en nuestro medio en mujeres infértiles atendidas en el Hospital Nacional Cayetano Heredia encontró una frecuencia de IOP de 0.85%, comparable con nuestro hallazgo. Algunos estudios realizados en el extranjero reportan una incidencia de IOP en la población general de 1 a 3.7% (6,7).
La etiología de la IOP no es clara. Cohen y Coulam establecen que se produce por una aceleración del proceso natural de atresia de los oocitos, y que esta depleción acelerada puede estar asociada con diferente etiología (7,12). Dentro de las causas que pueden ocasionar esta rápida atresia de los oocitos se mencionan: causas genéticas, autoinmunes, iatrógenas, infecciosas, tóxicas, metabólicas y defectos enzimáticos. (3,4,6,7,10,13,15).
La mayoría de pacientes con IOP tienen cariotipo normal (2,6,7,10). Nelson y col. (11) en un estudio de 28 pacientes, sólo encontró 2 con cariotipo anormal. Se ha descrito IOP en asociación con 45XO, XO/XX, 47 XXX y con una variedad de patrones mosaicos (6,7). En este estudio, por motivos económicos, sólo se realizó determinación de cariotipo a seis pacientes, siendo en todos los casos 46XX, sin embargo esta determinación se hizo por cultivo de linfocitos de sangre periférica, que no siempre descarta la presencia de mosaicismo (6).
Entre 13 a 66% de las pacientes con IOP tienen una asociación con diversos desórdenes y endocrinopatías (2,7), lo que sugiere que un defecto inmunológico común lleva a una disfunción de diferentes tejidos, inclusive el tejido ovárico. Las siguientes observaciones sugieren la evidencia de una etiología autoinmune: 1) la asociación con otros desórdenes autoinmunes; 2) la demostración de anticuerpos circulantes contra tejido ovárico en pacientes con IOP; 3) los hallazgos histológicos de infiltrados de células plasmáticas y linfocitos en la proximidad de los folículos y de las células de la teca del tejido ovárico: y 4) la remisión conseguida de la IOP en las pacientes tratadas por la enfermedad autoinmune coexistente con cortisol o con plasmaféresis (2,7,6).
Betterle y col (17), en un estudio de 50 pacientes con IOP, 99 con Enfermedad de Addison y 3578 con diabetes mellitus insulinodependientes o enfermedad autoinmune tiroidea, establece que hay una fuerte relación entre la insuficiencia ovárica, la enfermedad de Addison y la presencia de anticuerpos contra células productoras de esteroides, y sugiere que estos anticuerpos son marcadores serológicos tanto de hipogonadismo hipergonadotrópico como la enfermedad de Addison.
En nuestro trabajo, se hizo estudio de anticuerpos antitiroideos a siete pacientes siendo positivo en tres. Ninguna de estas tres pacientes tenía alteraciones morfológicas tiroideas evidenciables al examen físico y los valores hormonales de T4 y TSH eran normales. A dos de estas pacientes se les realizó además biopsia de ovario, no encontrándose infiltrado linfocítico.
La irradiación con dosis de 250 a 500 rads causa insuficiencia ovárica permanente en el 66% de las pacientes, mientras que con 800 rads la causa en el 100% (7). Se sabe que las drogas citotóxicas producen irregularidades menstruales y amenorrea. Los agentes alquilantes son los más a menudo incriminados: ciclofosfamida, clorambucil y busulfán. Otras drogas también mencionadas son la vinblastina y la procarbacina. El 5 – fluoruracilo administrado en forma prolongada tendría sólo una débil toxicidad ovárica. La poliquimioterapia tiene efectos más severos. La apariencia histológica de los ovarios después de la quimioterapia revela, presencia de folículos primordiales abundantes, con ausencia de desarrollo posterior, por lo que algunos autores sugieren que la droga citotóxica induce una resistencia folicular a la estimulación gonadotrópica endógena. En nuestro estudio, sólo una paciente tenía antecedentes de pulsos, sólo una paciente tenía antecedente de pulsos de ciclofosfamida por lupus eritematoso sistémico diagnosticado diez años antes.
La ooferectomía bilateral ocasiona una suspensión brusca y permanente de la función ovárica. En nuestro estudio, una paciente había sido sometida a ooforectomía bilateral por quistes dermoides, siendo ésta la causa de su insuficiencia ovárica. El 5% de las mujeres afectadas con parotiditis sufren daño gonadal; cuatro de nuestras pacientes tenían este antecedente, aunque dos de ellas tenían también evidencia de autoinmundad, al presentar anticuerpos antitiroideos.
Se ha establecido una relación inversa entre la edad de la menopausia y el número de paquetes de cigarrillos al año. El cigarrillo reduce el número de folículos primarios y primordiales, y también es tóxico para los folículos de De Graff; asociándose con aparición de la menopausia unos dos años antes.
La galactosemia se debe a una deficiencia de la enzima galactosa - 1 - fosfato uridil transferasa, provocando diversos efectos tóxicos por acumulación de galactosa – 1 – fosfato o galactilol. El desarrollo de insuficiencia ovárica se produce por efecto directo de la galactosa o sus metabolitos sobre el parénquima ovárico, o por cambios en la bioactividad de las moléculas de la gonadotropinas, las cuales contienen galactosa y galactosamina (7).
Otra causa de IOP es el Sindrome de Ovario Resistente a Gonadotropinas. En este caso los folículos están presentes cuando se realiza una biopsia ovárica, pero son resistentes a la estimulación con gonadotropinas. Este síndrome es indistinguible, clínica y endocrinológicamente, de las otras formas de OIP. Sólo pueden diferenciarse mediante biopsia ovárica (6,7). En nuestro estudio sólo 7 pacientes tuvieron biopsia ovárica, encontrándose folículos primordiales en sólo una de ellas, por lo que se plantea como diagnóstico probable en este caso, sindrome de ovario resistente a gonadotropinas.
Las manifestaciones clínicas de la IOP son las mismas que se observan en la menospausia fisiológica, y está relacionada a la disminución de estrógenos endógenos. Los síntomas y signos más frecuentes son: amenorrea secundaria, inestabilidad vasomotora, infertilidad y atrofia genital. También se pueden presentar síntomas psicológicos como ansiedad, irritabilidad, inestabilidad de vejiga y uretra, y osteoporosis (2,6,7). Es importante recalcar que en nuestro estudio solamente la tercera parte de las pacientes refirieron síntomas vasomotores y sólo el 11% presentaban hipotrofia de genitales externos.
Los niveles incrementados de gonadotropinas séricas, en el rango menopáusico, son esenciales para el diagnóstico de IOP, siendo el nivel de FSH desproporcionadamente más alto que el de LH. También se ha establecido que niveles de FSH elevados no son evidencia de IOP irreversible (6). De hecho, puede ser reversible, o con curso fluctuante. Esto ha sido descrito en pacientes con IOP autoinmune, o con síndrome de ovario resistente a gonadotropinas, que han presentado remisiones espontáneas, consiguiéndose gestaciones con altas dosis de gonadotropinas, que han presentado remisiones espontáneas consiguiéndose gestaciones con altas dosis de gonadotropinas y terapia de reemplazo estrogénico (7).
El tratamiento depende del tipo de insuficiencia ovárica, de la etiología, y del deseo de la paciente de lograr gestación. Si la paciente no desea gestación, el tratamiento consistirá únicamente en terapia de reemplazo con estrógenos y progestágenos combinados. En caso contrario se puede intentar inducir la ovulación, primero suprimiendo los niveles elevados de gonadotropinas con dosis altas de estrógenos o con agonistas de la hormona liberadora de gonadotropinas (acetato de leuprolide), seguido por estimulación con gonadotropina menopáusica humana (19). Las pacientes con insuficiencia ovárica autoinmune en tratamiento con corticoides o con plasmaféresis, han tenido una remisión concomitante de la insuficiencia ovárica con un reinicio de las menstruaciones, aunque se han conseguido pocas gestaciones (7). Se ha reportado pacientes con IOP que presentaron gestación durante la terapia de reemplazo estrogénico cíclico (20).
En general en las mujeres con IOP es imperativo mantener la terapia con estrógenos y progestágenos para prevenir los cambios por deficiencia estrogénica, la osteoporosis, la enfermedad vascular aterosclerótica y la dispareunia por fricción. Las pacientes con IOP irreversible, pueden supere la infertilidad mediante las técnicas de donación de oocitos y fertilización in vitro; asociadas a estimulación artificial del endometrio (7). En este estudio se trató de inducir ovulación en dos pacientes, en una no se obtuvo respuesta, y en la obra se consiguió ovulación y gestación gemelar.
Consideramos que sería importante realizar un estudio multicéntrico que incluya, entre otros estudios la biopsia de ovarios, con el fin de determinar la etiología de la IOP en nuestro medio.
Se concluye que la insuficiencia ovárica prematura es una patología poco frecuente en mujeres infértiles de HNAL, generalmente se presenta como amenorrea secundaria y solamente la tercera parte refiere síntomas vasomotores.
REFERENCIAS BIBLIOGRAFICAS
1. Emperaire J, Audebert A, Greenblatt R. Premature Ovarian Failure. Am J Obstet Gynecol 1970; 108: 445-9. [ Links ]
2. Gonzáles CV. Falla Ovárica Prematura.Tesis de Especialista. Lima, Perú: Universidad Peruana Cayetano Heredia, 1973. 63 pp. [ Links ]
3. Wentz AC. Management of the menopause. En: Jones HW, Wentz AC, Burnett LS. Novaks Textbook of gynecology. Williams & Wilkins;1988.p. 397-442. [ Links ]
4. Judd HL. Menopause and postmenopause. En: Pernoll ML. Current obstetric and gynecologic diagnosis and treatment. Appleton & Lange ;1991.p. 1061-83. [ Links ]
5. Elkind – Hirsch K, Sherman L, Malinak R. Hormone replacement therapy alters insulin sensitivity in young women with premature ovarian failure. J Clin Endocrinol Metab 1993; 76: 472-5. [ Links ]
6. Tulandi T, Kinch R. Premature ovarian failure. Obstet Gynecol Surv 1981; 36: 521-6. [ Links ]
7. Cohen I, Speroff L. Premature ovarian failure: update. Obstet Gynecol Surv 1991; 46: 146-62. [ Links ]
8. Miyake T, Taguchi O, Ikeda H, Sato Y, Takuchi S, Nishizuka Y. Acute oocyte loss in experimental autoinmune oophoritis as a possible model of premature ovarian failure. Am J Obstet Gynecol 1988; 158: 186-92. [ Links ]
9. Boyers S, Luborsky J, De Cherney A. Usefulness of serial measurements of serum follicle stimulating hormone, luteinizing hormone and estradiol in patients with premature ovarian failure. Fertil Steril 1988; 50: 408-12. [ Links ]
10. Coulam C, Stringgellow S, Hoefnagel D. Evidence for a genetic factor in the etiology of premature ovarian failure. Fertil Steril 1983; 40: 693-5. [ Links ]
11. Nelson L, Kinsy K, White B, Merriam G. Gonadotropin spontaneous premature ovarian failure: a controlled trial. Fertil Steril 1992; 57: 50-5. [ Links ]
12. Coulam C, Stern J. Immunology of ovarian failure. Am J Reprod Immunol 1991; 25: 169-74. [ Links ]
13. Hill J, Welch W, Faris H, Anderson D. Induction of class II major histocompatibility complex antigen expression in human granulosa cells by Interferon Gamma: a potential mechanism contributing to autoinmune ovarian failure. Am J Obstet Gynecol 1990; 162: 543-40. [ Links ]
14. Hoek A, Van Kasteren Y, De Han M, Schoemaker J, Drexhage H. Dysfunction of monocytes and dendritic cells in patients with premature ovarian failure. Am J Reprod Immunol1993; 30: 207-17. [ Links ]
15. Castillo S, López F, Tobella L, Salazar S, Daher V. The cytogenetics of premature ovarian failure. Rev Chil Obstet Ginecol 1992; 57: 341-5. [ Links ]
16. Ho P, Tang G, Lawton J. Limphocyte subsets and serum immunoglobulins in patients with premature ovarian failure before and after estrogen replacement. Hum Reprod 1993; 8: 714-6. [ Links ]
17. Betterle C, Rossi A, Dalla Pria S, Artifoni A, Pedini B. Premature ovarian failure: autoimmunity and natural history. Clin Endocrinol Oxf 1993; 39: 35-43. [ Links ]
18. Davajan V, Kletzky O, Vermesh M, Anderson D. Ten – year follow – up of patients with secondary amenorrhea and normal prolactin. Am J Obstet Gynecol 1991; 164: 1666-72. [ Links ]
19. Check J. Ovulation and successful pregnancy in a woman with ovarian failure and hipophysectomy and gonadotropin therapy. Am J Obstet Gynecol 1990; 162: 775-6. [ Links ]
20. Gossain V, Carella J, Rovner R. Pregnancy in a patient with premature ovarian failure. Am J Med 1993; 24: 393-402. [ Links ]
Correspondencia:
Dr. Adolfo Rechkemmer Prieto
Consultorio de Infertilidad, Servicio de Ginecología
Departamento de Obstetricia y Ginecología.
Hospital Nacional Arzobispo Loayza.
Av. Alfonso Ugarte 840, Lima1, Perú.