Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión impresa ISSN 1018-130X
Rev Med Hered v.7 n.4 Lima oct. 1996
Rev Med Hered 1996; 7: 150-153
Trombocitopenia asociada a infección con virus de inmunodeficiencia humana tipo 1 (HIV-1): Tratamiento con danazol.
Danazol therapy in thrombocytopenia associated with HIV-1 infection.
Jayaweera Dushyantha T*, Scerpella Ernesto G*, Rodriguez Allan E*, Fischl Margaret A*.
*Departamento de Medicina y Programas de SIDA para adultos. Escuela de Medicina de la Universidad de Miami, Miami – Florida, USA.
RESUMEN
Objetivo: Evaluar la eficacia del danazol para el tratamiento de la trombocitopenia asociada con el virus de la inmunodeficiencia humana tipo 1 (HIV-1). Pacientes y Métodos: Estudio retrospectivo, diseño serie de casos. Se identificaron 8 pacientes con trombocitopenia asociada a infección con HIV-1 que fueron tratados con danazol (300-800 mg/día) por más de 3 meses. El seguimiento fue de 3 meses a 2 años. Se definió respuesta favorable al tratamiento como un incremento en el recuento de plaquetas por encima del 25% con referencia a los valores pre-tratamiento. Resultados: El recuento de plaquetas promedio (± desviación estándar) antes de la terapia con danazol fue de 51± 24 x 109/L, con un rango de 19-88 x 109/L. Siete (87%) de los 8 pacientes tuvieron respuestas favorables al danazol. Los recuentos promedio a 12 y 24 meses de terapia fueron 104± 108 x 109/L, y 112± 28 x 109/L, respectivamente. Se observó una tendencia al incremento de los recuentos plaquetarios durante el tratamiento con danazol. Conclusión: Danazol puede ser de utilidad en el tratamiento de la trombocitopenia asociada a HIV-1. (Rev Med Hered 1996; 7: 150-153).
PALABRAS CLAVE: Trombocitopenia, Danazol, SIDA, VIH.
SUMMARY
Objective: To evaluate the efficacy of danazol for the treatment of thrombocytopenia associated with human immunodeficiency virus tipe 1 (HIV-1) infection. Patients and Methods: Retrospective, case series study. Eight patients with thrombocytopenia associated with HIV-1 infection, and treated with danazol 300 mg to 800 mg a day for more than 3 months were identified. Follow-up ranged from 3 months to 2 years. Response to treatment was defined as a 25% increase in platelet count from pre-treatment values. Results: The mean platelet count before danazol therapy. Mean platelet counts and standard deviations at 12 and 24 months of therapy were 104± 108 x 109/L (range, 19-88 x 109/L). Seven (87%) of 8 patients responsed to danazol therapy. Mean platelet counts and standard deviations al 12 and 24 months of therapy were 104± 108 x 109/L, and 112± 28 x 109/L. There was a trend towards an increase in platelet counts during treatment. Conclusion: Danazol may be effective in HIV-1 induced trombocytopenia. (Rev Med Hered 1996; 7: 150-153).
KEY WORDS: Thrombocytopenia, Danazol, AIDS, HIV.
INTRODUCCION
La ocurrencia de trombocitopenia asociada a la infección con el virus de la inmunodeficiencia humana tipo 1 (HIV-1) ha sido bien descrita en la literatura. La prevalencia de trombocitopenia (definida como un recuento plaquetario por debajo de 100x109/L) en pacientes con HIV-1 varía de 2.8% a 15.5% (1). La trombocitopenia entre usuarios de drogas intravenosas infectados con HIV-1 es 3.9 veces más frecuente que en homosexuales con HIV-1 (1). A pesar de que la trombocitopenia asociada con HIV-1 tiene algunas semejanzas con la púrpura trombocitopénica idiopática (PTI), existen diferencias entre estas 2 condiciones. Anticuerpos antiplaquetas se detectan en los dos casos, sin embargo estos anticuerpos pueden ser también detectados en muchos pacientes infectados con HIV-1 que no presentan trombocitopenia. En contraste a los hallazgos patológicos presentes en las biopsias de médula ósea en PTI, los pacientes con HIV-1 y trombocitopenia presentan una inadecuada trombopoiesis con un número disminuido de megacariocitos (2).
Las modalidades terapéuticas utilizadas para el tratamiento de la trombocitopenia asociada a HIV-1 incluyen el uso de zidovudina (ZDV, AZT), corticoesteroides, esplenectomía, dapsona, alfa-interferón, e inmunoglobulina intravenosa (3-6). Existen varias limitaciones con estas diferentes modalidades de tratamiento. Muchos pacientes no toleran tomar ZDV, mientras que el uso de corticoides puede facilitar el desarrollo de infecciones oportunistas, y acelerar la progresión del sarcoma de Kaposi (7) y hepatitis (8). Alfa-interferón no ha sido todavía probado en estudios clínicos grandes, aunque los resultados iniciales son promisorios. La esplenectomía es obviamente invasiva y puede facilitar el desarrollo de infecciones bacterianas con organismos encapsulados. Se ha observado además que los gestos del tratamiento con esplenectomía o inmunoglobulina intravenosa en el curso de la trombocitopenia puede ser de corta duración.
Danazol es un andrógeno sintético atenuado con efecto anabólico pero mínimamente virilizante, que ha sido utilizado eficazmente en el tratamiento de trombocitopenia refractaria en pacientes con PTI, lupus eritematoso sistémico y síndrome de anticuerpos antifosfolípidos (9-11). En el presente trabajo describimos nuestra experiencia utilizando danazol en 8 pacientes con trombocitopenia asociada a infección a HIV-1.
MATERIAL Y METODOS
Se revisaron las historias clínicas de pacientes de la Clínica de Inmunología Especial de la Universidad de Miami que fueron disgnósticados con trombocitopenia asociada a HIV-1, y que fueron tratados con danazol
Trombocitopenia fue definida como un recuento plaquetario por debajo de 100 x 109/L. Las siguientes variables fueron seleccionadas: edad, sexo, recuento de plaquetas antes del tratamiento con danazol, recuento plaquetario a intervalos de 3 meses luego de comenzado el tratamiento con danazol, dosis de danazol utilizada, uso de otros medicamentos, y recuento de linfocitos CD4.
Una respuesta favorable al tratamiento con danazol fue definida como incremento en el recuento de plaquetas por encima del 25% con referencia a los valores pre-tratamiento. Las medias y desviaciones estándar de los recuentos de plaquetas fueron calculados para cada intervalo de 3 meses. De manera similar, los incrementos en el recuento de plaquetas para cada intervalo de tiempo fueron calculados dividiendo cada nuevo recuento plaquetario por el valor pre-tratamiento, y los resultados fueron expresados como en número de veces (doble, triple, etc.) que este recuento se incrementó.
RESULTADOS
Los sujetos incluidos en el estudio fueron 6 varones y 2 mujeres, con edad promedio de 35 años (rango, 29-41 años). El recuento promedio de linfocitos CD4 al comienzo del tratamiento con danazol fue de 245 células/L (rango, 36-762 células/L), alcanzando 304 células/L (rango, 21-746 células/L) a los 6 meses de tratamiento. Todos los pacientes habían sido tratados con ZDV (en dosis de 300-800 mg/día) por un período mayor de tres meses antes de recibir tratamiento con danazol. Ninguno de los pacientes fue tratado con corticoides o gammaglobulina intravenosa. Las dosis de danazol administradas variaron de 200-800 mg/día.
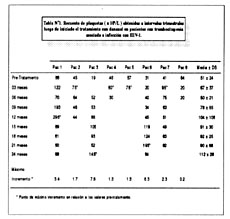
La tabla Nº1 ofrece un resumen de las respuestas individuales al danazol. Siete de los 8 pacientes (87%) respondieron al tratamiento de acuerdo a las definiciones utilizadas. El recuento plaquetario promedio antes del tratamiento con danazol fue 51± 24 x 109/L, con un rango de 19-88 x 109/L. Los recuentos plaquetarios promedio a los 12 y 24 meses de tratamiento fueron 104± 10 x 109L and 112± 28 x 109/L respectivamente.
El incremento máximo en los recuentos de plaquetas para todos los pacientes fue de 3.01 veces (rango, 0.2-7.6 y 7). Cuatro pacientes (pacientes Nº1,3,6 y 7) tuvieron un incremento de más del doble en algún momento durante el tratamiento con danazol. En otros 3 pacientes (pacientes Nº 2, N°4 y N°5) solamente se observó un incremento mínimo (1.3-1.7 veces). Seis de los 7 pacientes (85%) que respondieron al tratamiento lo hicieron antes de un período de 12 meses. Finalmente, en 5 de los 7 pacientes que respondieron a la terapia, el último recuento de plaquetas presente en la historia clínica permanecía por encima de los valores pre-tratamiento.
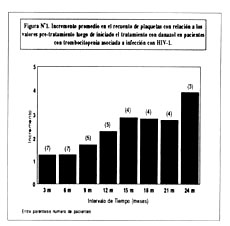
Estadísticamente, no se encontraron diferencias significativas en los recuentos de plaquetas antes y durante el tratamiento; sin embargo se observó una tendencia a recuentos plaquetarios cada vez mayores durante tratamiento con danazol. En la figura Nº1, podemos observar los incrementos promedios en los recuentos de plaquetas para cada intervalo de 3 meses con relación a los valores pre-tratamiento, para los pacientes que se mantuvieron en el estudio.
DISCUSION
La trombocitopenia asociada a HIV-1 ocurre como resultado de mecanismos inmuebles y disfunción megacariocítica. Los anticuerpos dirigidos contra plaquetas y también contra HIV-1 han sido implicados en la disminución de la sobrevida plaquetaria y se ha observado que tanto plaquetas como megacariocitos pueden expresar proteínas pertenecientes a HIV-1 en su superficie. La reducción en el número de megacariocitos, los cambios estructurales y el secuestro de las plaquetas en el hígado y bazo pueden también contribuir a la trombocitopenia que se observa en estos individuos (2,12,13). Por lo tanto, en pacientes infectados con HIV-1, el recuento plaquetario puede declinar debido a la disminución en la sobrevida de las plaquetas, los defectos en la producción de las mismas, o de ambos factores.
En el presente estudio, se observó una tendencia hacia el incremento progresivo del recuento plaquetario durante tratamiento con danazol por un período de hasta 2 años. Los recuentos promedios de plaquetas pre-tratamiento y a los 12 y 24 meses fueron de 51, 104 y 112 x 109/L, respectivamente. Mientras estas cifras pueden sugerir un efecto sostenido del danazol en el incremento de plaquetas hay que tener en cuenta los siguientes. Es posible que en pacientes que no respondieron a la terapia, esta fué suspendida, y esto podría haber acentuado el efecto benéfico de la misma. El presente análisis fue hecho en forma retrospectiva sin controlar factores como el recuento plaquetario inicial, uso de AZT, dosis y duración del tratamiento con danazol, y uso de otras medicaciones.
La experiencia publicada referente al uso de danazol en el tratamiento de trombocitopenia asociada a HIV-1 es bastante limitada. Bierling y colaboradores (14) describen que solamente 5/24 pacientes tratados con danazol tuvieron una respuesta sostenida. Domínguez-Castellano y colaboradores (15) describen un paciente que tuvo una respuesta completa a danazol. En un estudio preliminar realizado en nuestro centro, Fischl y colaboradores (16) estudiaron 8 pacientes con trombocitopenia asociada a HIV-1 que fueron tratados con danazol 200 mg 4 veces al día, y seguidos por un período de 3 meses. Los resultados de este estudio fueron similares a los nuestros, 7/8 pacientes respondieron a la terapia y el incremento máximo en el recuento plaquetario fue de 3.5 veces (rango, 1.0-8.9 veces).
El mecanismo de acción del danazol no está claramente establecido. Mylvaganam y colaboradores (17) estudiando pacientes seronegativos para HIV sugieren que danazol puede incrementar en forma selectiva el reservorio de linfocitos de ayuda (CD4), lo que a su vez activaría la población de linfocitos supresores (CD8). Estos eventos causaría inhibición en la producción de linfocitos B, y cuando los linfocitos B están suprimidos disminuye la producción anticuerpos antiplaquetarios.
Nuestro estudio sugiere que el danazol puede ser una buena alternativa en el tratamiento de pacientes con trombocitopenia refractaria asociada a HIV-1. Los incrementos en los recuentos de plaquetas pueden ser sostenidos por períodos de hasta 2 años. Danazol además, parece tener efectos inmunomodulatorios beneficiosos que pueden ayudar a incrementar el reservorio de linfocitos CD4. Es necesario realizar estudios adicionales para confirmar la utilidad del danazol en el tratamiento de la trombocitopenia asociada a la infección con HIV-1, así como sus posibles efectos en los recuentos de linfocitos CD4 y CD8.
REFERENCIAS BIBLIOGRAFICAS
1.Mientjes GHC, Van Ameidjen EJC, Mulder JW, Van den Hoek JAR, Coutinho RA, Van den Hoek JAR, Countinho RA, Von dem Borne AE. Prevalence of thrombocytopenia in HIV-infected and non-HIV infected drug users and homosexual men. Brit H Haematol 1992; 82: 615-619. [ Links ]
2.Ballem PJ, Belzberg A, Devine DV, et al. Kinetic studies of the mechanisms of thrombocytopenia in patients with human immunodeficiency virus infection. N Engl J Med 1992; 327: 1779-1784. [ Links ]
3.The Swiss Group for Clinical Studies on the Acquired Immunodeficiency Syndrome (AIDS). Sidovudine for the treatment of thrombocytopenia associated with human immunodeficiency virus (HIV). Ann Intern Med 1988; 109: 718-721. [ Links ]
4.Durand JM, Lefevre P, Hovette P, Issifi S, Mongin M, Dapsone for thrombocytopenic purpura related to human immunodeficiency virus infection. Am J Med 1991; 90: 675-677. [ Links ]
5.Landonio G, Cinque P, Nosari A, et al. Comparison of two dose regimens of zidovudine in an open, randomized, multicentre study of severe HIV-related thorombocytonia. AIDS 1993; 7: 209-212. [ Links ]
6.Marroni M, Gresele P, Landonio G, et al. Interferon-alfa in effective in the treatment of HIV-1 related, severe, zidovudine-resistant thrombocytopenia. Ann Intern Med 1994; 121: 423-429. [ Links ]
7.Schulhafer EP, Grossman ME, Fagin G, Bell KE. Steroid-induced Kaposis sarcoma in a patient with pre-AIDS. Am J Med 1987; 82: 313-317. [ Links ]
8.Shafer RW, Offit K, Macris NT, Horbar GM, Ancona L, Hoffman IR. Possible risk of steroid administration in patients at risk for AIDS(letter). Lancet 1985; I: 934-935. [ Links ]
9.Ahn YS, Rocha R, Mylvaganam R, García R, Duncan R, Harrington WJ. Long-term danazol therapy in autoinmu new thrombocytopenia, unmaintained remission and age-dependt response in women. Ann Intern Med 1989; 111: 723-729. [ Links ]
10.West SG, Johnson SC. Danazol for the treatment of refractory autoinmune thrombocytopenia in systemic lupus erytematosus. Ann Intern Med 1988; 108: 703-706. [ Links ]
11.Kavanaugh A. Danazol therapy in thrombocytopenia associated with the antiphospholipid antibody syndrome. Ann Intern Med 1994; 121: 767-768. [ Links ]
12.Zucker-Franklin D, Termin CS, Cooper MC. Structural changes in the megakariocytes of patients of patients infected with the human immunodeficiency virus (HIV-1). Am J Pathol 1989; 134: 1295-1303. [ Links ]
13.Domingo P, Muniz-Díaz E, Fuster M, Ris J, Madoz P, Cadafalch J. A clinical and immunological study of HIV associated thrombocytopenia in drug abusers Abstract MB 2314. VII International Conference on AIDS, Florence, Italy, 1991. [ Links ]
14.Bier ling P, Bettie A, Oksenhendler E. Human inmunodeficiency virus related inmune thrombocytopenia. Semin Thromb Hemost 1995; 21: 68-75. [ Links ]
15.Domínguez Castellano A, Pena JM, López Pastor A, Gonzáles J, Martín R, Vázquez JJ. Epidemiología, curso clínico, pronóstico y tratamiento de la trombocitopenia asociada con infección por el virus de la inmunodeficiencia humana tipo 1: análisis de los 41 casos. Medicina Clínica 1992; 99: 371-375. [ Links ]
16.Fischl MA, Ahn YS, Klimas N, et al. Use of danazol in autoinmune thrombocytopenia in association with acquired inmunodeficiency syndrome. Firs International Conference on AIDS, Atlanta, USA, 1985. [ Links ]
17.Mylvanganam R, Ahn YS, Harrington WJ, Kim Cl. Immune modulation by danazol in autoinmune thrombocytopenia. Clin Inmunolopathol 1987; 42: 281-287. [ Links ]
Correspondencia:
Dr. Ernesto Scerpella G.
University of Miami School of Medicine,
Special Immunology (D-90A).
P.O. Box 016960, Miami, Fl. 33141 USA
Fax: (305) 243-4037. Teléfono: (305) 243-4595.
Rev Med Hered 1996; 7: 150-153