Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión impresa ISSN 1018-130Xversión On-line ISSN 1729-214X
Rev Med Hered v.8 n.1 Lima ene. 1997
Prevalencia de la deficiencia de glucosa - 6 - fosfato deshidrogenasa en donadores voluntarios de sangre que acuden a los hospitales nacionales Cayetano Heredia y Arzobispo Loayza. Lima - Perú.
Prevalence of glucose 6-phosphate dehydrogenase deficiency in the blood of voluntary givers at Cayetano Heredia and Arzobispo Loayza nationals hospitals Lima-Peru.
Ruiz Wilson*, Ulloa Victor*, Bailon Oscar**.
*Profesor Auxiliar, Departamento de Medicina, Facultad de Medicina Alberto Hurtado A. Universidad Peruana Cayetano Heredia. Hospital Nacional Cayetano Heredia. Lima - Perú.
**Serumista Universidad Peruana Cayetano Heredia.
RESUMEN
Objetivos: El presente trabajo tuvo como objetivo, conocer la Prevalencia de la deficiencia de la G-6-PDH, en la población masculina mestiza, aparentemente sana que acude a los Bancos de Sangre de los hospitales nacionales Cayetano Heredia (HNCH) y Arzobispo Loayza (HNAL). Material y métodos: Se examinó 140 muestras de hemodonadores entre junio y julio, 60 (42.85%) correspondieron al HNCH y 80 (57.15%) al HNCH. Se aplicó un cuestionario a todos los donantes indagando por: raza en los ancestros y antecedentes patológicos compatibles con episodios de hemólisis enzimopática. En todas las muestras se empleó el método cualitativo de Brewer (tamizaje) y posteriormente fueron sometidos a la prueba cuantitativa SIGMA. Resultados: Con el método de Brewer resultaron 9 casos positivos (6.42%) de los cuales sólo uno resultó positivo con el método confirmatorio, lo cual da una prevalencia de 0.71%. La totalidad de los participantes fueron de raza mestiza, carecían de antecedentes importantes, las edades estuvieron comprometidas entre los 18 y 58 años y el hematocrito entre 40 y 48%. Conclusiones: Se confirma que la prevalencia de esta deficiencia, en nuestra población es bastante baja. (Rev Med Hered 1997; 8: 11-18).
PALABRAS CLAVE: Anemia hemolítica, enzimopatia, G-6-PDH, crisis hemolítica.
SUMMARY
Objective: The goal of this study was to know the prevalence of the Glucose - 6 - phosphate dehydrogenase 8G-6-PDH) deficiency at the Hospital Nacional Cayetano Heredia (HNCH), and Hospital Nacional Arzobispo Loayza (HNAL) of Lima city. Material and methods: It was tested 140 samples of blood donors between June and July of 1996, using the qualitative Brewer method. The quantitative commercial test was done for detected the enzimatic activity in the abnormal cases of the qualitative method. Sixty blood donors (42.85%) belongs to the HNCH and eighty (57.15%) to the HNAL. The average of age was 32.20 and the range of hematocrit was between 40 and 48%. Results: We observed 9 positive cases (6.42%) using the Brewer method, but only one case (0.71%) was confirmed with the quantitative test. Conclusion: We that the prevalence of this enzymatic deficiency is low between our population. (Rev Med Hered 1997; 8: 11-18).
KEY WORDS: Haemolytic anemia, G-6-PDH deficiency.
INTRODUCCION
El déficit de la Glucosa - 6 - fosfato deshidrogenasa (G-6-PDH) es la eritroenzimopatía más común genéticamente determinada y la mejor conocida, tanto clínica como molecularmente.
La G-6-PDH es la enzima que cataliza el primer paso de la vía del shunt de las hexosas - monofosfato, oxidando la glucosa - 6 - fosfato (G-6-P) a 6 - fosfogluconato (6-PG) y reduciendo el nicotinadenin - dinucleótido - fosforilado (NADP+) a nicotinadenin - dinucleótido - fosforilado - reducido (NAPDH)(1,2).
Las personas portadoras de deficiencias de G-6-PDH al se enfrentadas a sustancias "oxidantes" (cuya lista es bastante grande) desarrollan episodios de hemodiálisis de intensidad variable. Este mismo fenómeno puede ocurrir cuando sufren infecciones preferentemente bacterianas. También se ha señalado una mayor frecuencia y severidad de los episodios de ictericia neonatal en los portadores de esta anomalía.
Esta deficiencia fue descrita por primera vez por Carlson y cols. (3,4) en negros norteamericanos que tenían episodios de anemia hemolítica aguda después de la ingestión de antimaláricos (primaquina); posteriormente se observó que individuos de origen mediterráneo, presentaban cuadros similares luego de la ingestión de habas (Favismo). Tempranamente se hizo evidente su transmisión hereditaria ligada al sexo.
Hasta el momento, el empleo de modernas técnicas de biología molecular, han permitido identificar más de 400 variantes fenotípicas de la G-6-PDH (4-12).
Se calcula existen más de 200 millones de personas afectadas (13). Aunque la distribución es global, la prevalencia de esta anomalía es mayor en regiones tropicales y subtropicales del hemisferio oriental.
El presente trabajo tuvo por finalidad determinar la prevalencia de la deficiencia de la G-6-PDH en la población masculina de hemodonadores que acuden a los Bancos de Sangre de los hospitales nacionales: Cayetano Heredia (HNCH) y Arzobispo Loayza (HNAL) de la ciudad de Lima.
MATERIALES Y METODOS
Se realizó un estudio transversal durante los meses de junio y julio de 1996. Se tomó una población de varones hemodonadores sanos que acudieron a los bancos de sangre del HNCH y HNAL quienes fueron incluidos en forma voluntaria.
Los hemodonadores incluídos en el presente estudio fueron seleccionados según los siguietnes criterios:
Criterios de inclusión:
- Estas clínicamente sanos.
- Hematocrito mayor del 40% o hemoglobina mayores de 12 gr/dl.
- Serología negativa para VDRL, HIV y HbsAG.
- Decisión voluntaria de participación.
Criterios de exclusión:
- Quienes no cumplían los criterios de inclusión.
- Quienes en los últimos 30 días habían usado algunos de los siguiente medicamentos: antimaláricos, sulfas y/o derivados, furazolidona, ácido nalidixico, nitrofurantoína, fenazopiridina, azul de metileno, acetanilida, fenilhidrazina, naftaleno.
Análisis estadístico
Al respecto, se contó con la asesoría del Departamento Estadística y Biometría de la Universidad Peruana Cayetano Heredia. Los resultados son presentados en porcentajes y promedios.
Cálculo del tamaño muestral:
En un estudio piloto previo, de 10 voluntarios, encontramos uno positivo para la diferencia (10%). Usando este dato se aplicó la fórmula siguiente:
n = z2
a Pe qe / E2donde:
Za : Coeficiente de confiabilidad, que cuando se usa un nivel de confianza del 95% para la estimulación, tan como sucede en ciencias de la salud, es 1.96.
Pe: Prevalencia estimada a partir de alguna de las 3 maneras siguientes: Revisión bibliográfica, estudio piloto o asumiendo pe = 50% = qe.
qe: 1 - PE.
E: Error absoluto o precisión, que en este caso se expresa en % o fracción de uno. El error que habitualmente se usa es +/-5% (+/-0.05).
Considerando un nivel de confianza del 95%, un error de estimación de 0.05(5%) y reemplazando en la fórmula se obtuvo n= 139. Con fines prácticos, se tomó n= 140.
Se tomó 5 ml. de sangre mediante punción de las venas del pliegue del codo, usando tubos sellados al vacío conteniendo como anticoagulante la sal de EDTA.
Las muestras fueron procesadas dos veces por semana en el laboratorio de Hematología de la UPCH.
Valoración de los niveles de G-6-PDH:
a)Método de Brewer. Es una prueba cualitativa de tamizaje cuyo principio es el siguiente: La metahemoglobina es reducida a hemoglobina si la generación de NADPH es normal. Este método utiliza azul de metileno al 0.0004 molar, nitrito de sodio 0.18 molar y dextrosa al 0.28 molar. El nitrito de sodio de usa para oxidar la Hb (Fe++) a metahemoglobina (Fe+++); el azul de metileno estimula el shunt de las hexosas-monofosfato cuya primera enzima es la G-6-PDH, por lo que esta reacción refleja la actividad de aquélla enzima. En la sangre normal la metahemoglobina es transformada en hemoglobina por medio del sistema NADPH y la reductasa de la metahemoglobina. La cantidad de metahemoglobina remanente después de 3 horas de incubación de la sangre con nitrito de sodio, azul de metileno y dextrosa provee un índice de generación de NADPH (asumiendo como normal el sistema NADPH - Metahemoglobina reductasa). Se utilizan 3 tubos:
Primer tubo: control normal.
Segundo tubo: control positivo (Deficiente en G-6-PDH).
Tercer tubo: la muestra problema.
Luego de 3 horas de incubación en baño maría a 37º, se agitan los 3 tubos, se apreciará una tonalidad pardusca en el 3er. tubo similar al 2do. por la acción oxidante del nitrito de sodio, que indicaría la deficiencia de la G-6-PDH.
b)Método Cuantitativo SIGMA. Este método (Kit catálogo Nro. 345 B) contiene reactivos que han sido diseñados para la determinación cuantitativa, cinética y ultravioleta de la G-6-PDH, modificando el método espectrofotométrico propuesto por Kornberg, Horecker, Lorh y Waller. Se fundamenta en la siguiente reacción:
G-6-PDH + NADP + ¾ G-6PDH ® 6-PG + NADPH + NADPH + H +
El fosfato de Nicotin Adenin Dinucleótido (NADP) es reducido por la G - 6 PDH en presencia de glucosa - 6 - fosfato (G-6-P). La tasa de formación de NADPH es proporcional a la actividad de G-6+PDH y es medida espectrofotométricamente como incremento en la absorvancia a 340 nm.
El uso de MALEIMIDE, un inhibidos de la 6 - PHOSPHOGLUCONATO DEHIDROGENASA eritromicina (6-PGDH), impide la producción de un segundo equivalente molar de NADPH de acuerdo a la siguiente reacción.
6-PG + NADP ® 6-PGDH ® Ribulosa -5- Phosphato + NADP + H+ + CO2
La Unidad Internacional de actividad enzimática de G-6-PDH, es la cantidad de esta que es capaz de metabolizar un micromol de substrato por minuto. Puede ser expresada en número estándar de células o en cantidad de hemoglobina. Los valores normales en muestras procesadas de 30º es de 4.6 a 13.5 U/gr Hb.
El método cualitativo de Brewer se empleó en el total de la población estudiada. Los pacientes que resultaron positivos o dudosos fueron sometidos al método cuantitativo, definiéndose así el diagnóstico de la deficiencia de G-6-PDH.
RESULTADOS
Se analizaron las muestras sanguíneas de 140 hemodonadores varones sanos. En el HNCH fueron captados 60 voluntarios (42.85%) y en el HNAL, 80 (57.15%).
Solo encontramos un hemodonador con deficiencia de la enzima G-6-PDH eritrocitaria, lo que hace una prevalencia de 0.71% para esta población.
El 100% de nuestros donadores fueron raza mestiza, con similares características para los ancestros.
En cuanto a los antecedentes personales y/o familiares, ninguno reportó antecedentes de: ictericia neonatal, paludismo, paludismo, anemia hemolítica o diabetes. Ninguno refirió crisis de anemia aguda (hemolítica) asociado a infecciones (virales o bacterianas) o secundarios al consumo de fármacos oxidantes. Ninguno refirió cuadros de favismo.
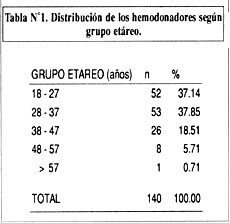
En la tabla Nº1, se muestra la distribución de la población por grupos etáreos, siendo más frecuente entre los 18 y los 37 años (74.99%).
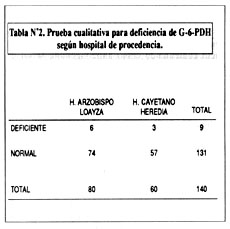
La tabla Nº2, muestra los resultados de la prueba de tamizaje (cualitativa) aplicada al total de la población. Resultaron con diferencia para la G-6-PDH: 9 donadores (6.42%) y normales 131 (93.58%). De los deficientes: 3 correspondieron al HNCH y 6 al HNAL.
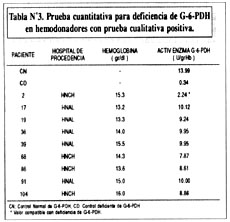
En la tabla Nº3, se muestran los resultados de la prueba cuantitativa de la G-6-PDH en los donantes que se mostraron deficientes en la prueba cualitativa.
El paciente Nº002 presentó una actividad enzimática d G-6-PDH (A) de 2.24 U/gr Hb; siendo los valores normales esperados según este método de: 4.5 a 13.5 U/gr Hb, cuando se realiza la prueba de 30ºC (catálogo SIGMA). También se indica la actividad enzimática para los controles: normal (CN) y deficiente (CD), así como sus correspondientes cifras de hemoglobina.
DISCUSION
El eritrocito cumple funciones tales como el transporte de oxígeno a los tejidos, eliminación del CO2 y protege formados por el metabolismo celular durante 120 ± 6 días de vida, cumpliendo aproximadamente 1.7 x 105 ciclos (14), debiendo atravesar el filtro esplénico constituido por espacios intercelulares de diámetros 10 veces menor al suyo.
El eritrocito maduro presenta cuatro vías metabólicas principales (carecen del ciclo de krebs) (5,13): a) La vía glicolítica directa o anaeróbica o vía de Embden Meyerhof; b) metabolismo oxidado o shunt de la hexosas monofosfato (pentosas -fosfato) y síntesis de glutación, c) metabolismo nucleotídico y d) sistema diaforásico.
La vía glicolítica anaeróbica se encarga de producir energía (2 mol de ATP por mol de glucosa), mientras que el shunt de hexosas-monofosfato, que cataboliza alrededor del 10% de la glucosa consumida por el hematíe, tienen como principal función la de reducir el NADP + a NADPH y simultáneamente se estaría generando cantidades adecuadas de NADPH para que se pueda mantener el glutation en la condición reducida (GSH). De esta manera se protege, tanto a la hemoglobina como a la membrana celular, del efecto de los oxidantes exógenos. Los factores limitantes en esta vía son: la relación NADP+/NADPH y la actividad de la G-6-PDH (15-17).
La G-6-PDH es la enzima que cataliza el primer paso en la vía del shunt de las hexosas-monofosfato, oxidando la G-6-P a 6-PG y reduciendo el NADP + a NAPDH (1,2).
La carencia de G-6-PDH induce en el eritrocito con esta deficiencia un marcado deterioro en su capacidad para enfrentar agresiones oxidantes. En los eritrocitos deficientes sometidos a estés se oxidan los grupos sulfihidrilo libres y quizás los puentes disulfuro esenciales, el fierro se libera de la globina y ésta se desnaturaliza conformando masas insolubles que precipitan (unido a material estromal) formando los cuerpos de Heinz, fijándose a la membrana eritrocitaria afectando la plasticidad de la misma, aumentando su filtración de cationes, disminuyendo la capacidad osmótica y de deformación celular así como también promoviendo la opsonización pre fagocitosis (por agrupamiento de moléculas de proteínas de la banda 3 con IgC y complemento) (9,11), todo lo cual facilita el atrapamiento de los hematies por el RES del bazo.
Recientemente aportes a la fisiopatología ponen de manifiesto que el H2O2 inactiva la ATPasa Ca2+- Mg2+, la combinación de niveles elevados de Ca2+ intracelular y la oxidación intracelular reducen el nivel de proteasas del hematíe (éstas ordinariamente protegen de la oxidación a las proteínas de la membrana). En consecuencia el resultado es hemólisis intravascular y extravascular (5,14).
El gen que codifica la G-6 PDH se encuentra en el cromosoma X (banda q28). Su transmisión hereditaria por lo tanto está ligada al sexo en forma recesiva. Los varones afectados heredan el gen anormal de sus madres, que por lo general son portadoras (heterocigotas) y la carencia enzimática en ellos se expresa con plenitud (hemizigotos). Es mucho menos frecuente ver el cuadro clínico en las mujeres homozigotas (4,9,10,11,18).
En general, en mujeres heterozigotas, la actividad de la G-6-PDH es intermedia entre la de los varones afectados y los sujetos sanos; sin embargo, algunas tienen un comportamiento similar al de los varones hemizigotos. Para explicar esta presunta paradoja, Beutler planteó la hipótesis de la inactivación del cromosoma X (Hipótesis de Lyon-Beutler), sosteniendo que : uno de los cromosomas X de la células embrionarias femeninas se neutraliza y permanece en este estado durante toda la vida. El resultado es un mosaico de actividad del cromosoma X generalmente equilibrado (50% de actividad) (5,9,14,18).
Una de las características genéticas más importantes del déficit de la G-6 PDH es su comportamiento "polimórfico balanceado", es decir una mutación como ésta otorga a quien la posee, ventajas comparativas para enfrentar ciertas condiciones ambientales desfavorables (específicamente hablando: la malaria), pero también potencialmente pueden producir estado de enfermedad (5).
En los años cincuenta y con ayuda principalmente de la electroforesis se pudieron identificar las principales variantes (mutaciones) de esta enzima. En la actualidad, la variante más común de G-6-PDH en todo el mundo se denomina tipo B y se considera como la normal. En poblaciones de raza negra se encuentran dos variantes conocidas como A(+) y A (-) presentes en el 20% y 12% respectivamente (4,11).De estas dos, la variante asociada a mayores anomalías es la G-6-PDH A(-). Se encuentra principalmente en negros del Africa Central.
En la actualidad, la más de 400 variantes fenotípicas de la G-6-PDH descubiertas gracias a la biología molecular (1,19,22), se clasifican clínicamente en cinco grandes grupos (1).
El cuadro clínico entre los varones deficientes de G-6-DH es variado, así tenemos: 1) Ictericia neonatal, 2) anemia hemolítica aguda adquirida (drogas y/o infecciones), 3) favismo y 4) anemia crónica no esferocítica congénita.
El cuadro clínico suele presentarse bajo la forma de un síndrome anémico hemolítico agudo. Estos pacientes presentan de manera característica hemoglobinemia, hemoglobinuria e ictericia aguda, todas ellas secundarias a una infección o pocas horas después (a veces uno o dos días) de la exposición al agente oxidante. En casos graves puede haber notable dolor abdominal o de espalda, síntoma de anemia aguda severa (mareos, cefalea, palpitaciones, disnea, etc.) y, si la hemoglobinuria es grave, hay peligro de necrosis tubular e insuficiencia renal (1,10,13,19,23,24).
En nuestro país, no existen estudios de prevalencia de la deficiencia de G-6-PDH en neonatos con ictericia neonatal. Estrada y cols. en Cuba, encuentran 8.7% de deficiencia de la G-6-PDH en neonatos ictéricos (25). Vaca en un estudio similar en México encuentra 1.05% de deficiencia de la G-6-PDH en neonatos ictéricos (26).
Sólo algunas de las variantes de la G-6-PDH ocasionan ictericia neonatal (13), es mayor en los países con prevalencia de la G-6-PDH mediterránea. En los lactantes de raza negra estadounidenses con variante A(-) de la G-6-PHD el riesgo parece ser mínimo, mientras que en los africanos y jamaiquinos es acentuado. En Jamaica la carencia de la G-6-PDH es responsable del 69% de los cuadros de ictericia neonatal no inmunológica (13).
Las enfermedades infecciosas son factores desencadenantes. El mecanismo propuesto sugiere que durante la infección el elemento nocivo es la mayor generación de peróxido de hidrógeno derivado de los granulocitos estimulados (10,13). Los microorganismos involucrados son diversos incluyendo los virus, como el de la hepatitis viral en donde la hemólisis es inminente (1,9,10,11,13).
Debido a que la prevalencia de la deficiencia de la G-6-PDH es elevada en regiones donde el paludismo es endémico, se cree que dicho déficit podría conferir protección selectiva contra el Plasmodium falciparum (polimorfismo balanceado).Esta evidencia no solo es epidemiológica, se ha observado también, in vitro, un crecimiento deficiente de los parásitos (P. falciparum) en eritrocitos con deficiencia de la G-6-PDH.
También se ha observado la presencia de parásitos en los eritrocitos normales de las mujeres heterocigotas. El mecanismo propuesto para explicar estos hallazgos supone que el estrés fulminante y la inestabilidad del GSH aniquilan a los eritrocitos y los parásitos (7,11,13,27,28,29).
En la acidosis diabética, los mecanismo serían las modificaciones en el pH, la glicemia y el piruvato. La corrección de la acidosis y la restauración de la homeostasis de la glucosa revierte el proceso hemolítico (13).
Nuestro paciente deficiente en G-6-PDH, refirió consumo frecuente de habas, pero negó manifestaciones clínicas de crisis hemolíticas secundarias. El favismo es prevalente en regiones con variantes G-6-PDH mediterráneo. No se ha observado favismo en los negros con la variante A(-). El cuadro clínico es más intenso, algunos padecen anemia hemolítica crónica (incluso en ausencia a cualquier exposición a oxidantes) y una minoría puede presentar una crisis hemolítica fulminante. Los componentes tóxicos de las habas serían: vicine y convicine (compuestos b -glucósidos de pirimidina) quienes son convertidos en divicine y isouramil, en combinación con el ascorbato. El mecanismo fisiopatológico exacto no se conoce aún con precisión (13,14,19,27).
El antecedente de consumo de fármacos oxidantes es importante dado que la deficiencia de G-6-PDH se descubrió al observar que soldados de raza negra de los EEUU desarrollaban hemólisis explosivas después de recibir primaquina para el paludismo (1,7,15).
La primaquina es solo uno de varios fármacos que pueden desencadenar hemólisis (13,19). Sin embargo, la expresión clínica de esta característica depende del tipo de variante de la G-6-PDH y la dosis del medicamento.
Aunque la lista de agentes incriminados es larga, muchos se incluyeron antes de saber las infecciones pueden similar los afectos adversos de las drogas, en consecuencia muchos eventos hemolíticos adjudicados a éstas, se debieron realmente a las infecciones. Es importante informar a los pacientes, la lista de medicamentos implicados.
En cuanto a las razas, la mayor incidencia ocurre en la raza negra: 20 en los bantúes africanos, 12% en los norteamericanos, 8% en brasileros, etc. La raza blanca afectada con más frecuencia corresponde a la del litoral mediterráneo (italianos, griegos, judíos sefardíes, sarinianos, etc.). En el Asia por ejemplo se encuentra un 14% en Camboya y 12% en la India (13). La población peruana se caracteriza por ser mestiza, con aportes variables de los diversos grupos raciales indicados. La raza en nuestro estudio fue 100% mestiza. El paciente que resultó deficiente para la G-6-PDH, era mestizo al igual que sus ancestros.
La prevalencia obtenida en nuestro estudio fue de 0.71%, aun cuando nuestra población estudiada no es grande, esta cifra es muy baja comparada con la encontrada en la población negra estadounidense (12%) y de 35% en raza blanca mediterránea (13).
Cabezudo J. en 1989 encuentra un 5% de positividad a la prueba cualitativa de Brewer (no uso prueba confirmatoria) en 100 personas de raza mestiza (30).
En el informe del "Groupe de Travail de L'OMS" (31) en 1990, los porcentajes de deficiencia de la G-6-PDH asignados a la población masculina hemizigota de México, Ecuador y Perú eran menores al 0.5%. Sin embargo, en México en 1977 ya se describían las primeras variantes nativas de la G-6-PDH: LA "G-6-PDH México" y la G-6-PDH Castilla". Guevara A. y col. (32) examinando 1054 muestras de población de raza negra ecuatoriana, encontraron una prevalencia de 12.8%. En Brazil, Ramalho A. (33) en 440 neonatos masculinos, encuentra una prevalencia de 10.3% en los de raza negra y 1.5% para los caucásicos.
Nuestros hallazgos y todos estos estudios demuestran que la prevalencia del déficit de la G-6-PDH, tanto en nuestro país como en el resto de Sudamérica, sería ligeramente mayor que la estimada por la OMS.
En cuanto a la metodología diagnóstica, la OPS recomienda en general utilizar un método cualitativo de tamizaje y posteriormente confirmarlo con un método cuantitativo (34,35), tal como se realizó en el presente estudio.
El método de Brewer es útil para descubrir deficientes completos, como el varón hemizigoto la mujer homozigota y la madre embarazada cuando la deficiencia enzimática es mayor al 50%. Sin embargo no es suficiente sensible para descubrir
mujeres heterozigotas y puede dar resultados equívocos luego de un episodio hemolítico agudo, en éste caso la prueba debe repetirse tiempo después cuando vuelva a existir una población eritrocítica adulta (19-30). La prueba puede ser positiva en otras deficiencias enzimáticas como metahemoglobina-reductasa-NADPH, NADPH- diaforasa y en presencia de hemoglobinas inestables, hemoglobina M y en presencia de drogas oxidantes (30). Por estas razones el métodos de Brewer, como prueba de tamizaje es útil (29).
En conclusión, en nuestra población masculina, de raza mestiza, aparentemente sana que acude a los bancos de sangre del HNAL y HNCH, la prevalencia de la deficiencia de la G-6-PDH en baja.
REFERENCIAS BIBLIOGRAFICAS
1.Vives JK. Introducción al estudio de la patología eritrocitaria. Bases bioquímicas y fisiológicas. En: Sans Sabrafen J Hematología Clínica. Barcelona: Editorial Mosby-Doyma Libros; 1994: 80-97. [ Links ]
2.SIGMA.Glucosa-6-phosphate deshidrogenase (G-6-PDH). Qualitative, ultraviolet, Kinetic determination in blood al 340 nm. (Procedure Nº345-UV). Sigma diagnostics. 1992:1-9. [ Links ]
3.Reyes P, Paucar J, Muñoz E, Ramos A. Estudio de la deficiencia de la Glucosa-6-fosfato deshidrogenasa (G-6-PDH) en un grupo de mestizos. Revista de la sanidad de las fuerzas policiales del Perú 1985; 46(1):8-11. [ Links ]
4.Lisker R. Panorama de la deficiencia de la glucosa-6-fosfato deshidrogenasa eritrocítica. Revista de Investigación Clínica 1981; 33(2): 209-11. [ Links ]
5.Beutler E. The molecular biology of G-6-PDH variants and other red cell enzyme defects. Annual Review Med 1992; 43: 47-59. [ Links ]
6.Beutler E, Westwood B, Prchal K, Vaca G, Bartsocas C, Baronciani L. New glucose-6-phosphate deshydrogenase mutations from various ethnics groups. Blood 1992; 80(1): 255-56. [ Links ]
7.Beutler E. G-6-PD: population genetics and clinical manifestations. Blood Reviews 1996; 10: 45-52. [ Links ]
8.Sena L, Ramalho A. Clinical evaluation of glucose-6-phosphate dehydrogenase (G-6-PD) deficiency in a Brazilian population. Rev Bras Genet 1985; 8(1): 89-96. [ Links ]
9.Stanley L, Schrier DG. IV Anemia: Hemolysis. En: Hematology. Sci Am USA. 1995:1-42. [ Links ]
10.Roodman DG. Anemia. En : Stein J. Medicina Interna. Barcelona: Salvat editores S.A. 1991: 1006-8. [ Links ]
11.Lux SE. Defectos hereditarios de la membrana y el metabolismo de los eritrocitos. En: Wyngarden J., Smith L., Bennet J. Tratado de Medicina Interna de Cecil. Madrid: Editorial interamericana - Mc. Graw-Hil. 1994:995-1004. [ Links ]
12.Lessin LS. Anemias hemolíticas. En: Kelley E. Medicina Interna. Buenos Aires: Editorial Panamericana S.A. 1992:1560-62. [ Links ]
13.Luckens JL. Deficit de Glucosa-6-Fosfato deshidrogenasa y otras carencias que afectan la vía de las pentosas fosfato y el metabolismo del Glutation. En: Lee GR, Lukens JL, Bithell T, Foerster J, Athens J. Hematología Clínica.. 9na. Edición. Buenos Aires: Editorial Intermédica; 1994: 876-84. [ Links ]
14.Arese P, De Flora A. Pathophysiology of hemolysis in glucosa-6-fosfato deshidrogenase deficiency. Semin hematol 1990; 27(1): 1-40. [ Links ]
15.Lehninger A, Nelson D, Cox M. Bioenergética y metabolismo. En: Principios de Bioquímica. Barcelona: Ediciones Omega SA. 1994: 390-93. [ Links ]
16.Mayes PA. Vía de las pentosas fosfato y otras vías del metabolismo de la hexosas. En: Murray R, Mayer P, Granner D, Rodwell V. Bioquímica de Harper. 13va. edición. Editorial el Manual Moderno SA. 1994:235-45. [ Links ]
17.Voet DJG. Ruta de las pentosas fosfato. En: Fruton JS, Simmonds, S. Bioquímica. 1ra. edición. Madrid: Ediciones Omega SA; 1992:619-26. [ Links ]
18.Thompson J. Patrón de transmisión de los genes y caracteres. En: Genética Médica. Barcelona: Editorial Salvat; 1983:49-74. [ Links ]
19.Rosse WH., Bunn F. Anemias Hemolíticas. En: Isselbacher K, Braunwald E, Wirson J, Martin J, Fauci A, Kasper D. Harrison Principios de Medicina Interna. Madrid: Editorial Interamericana Mc.Graw-Hill. 1994:2006-11. [ Links ]
20.Rovira A, Vuliamy T, Pujades M, Luzatto L, Vives J. Molecular genetics of glucose-6-phosphate dehydrogenase (G-6-PD) deficiency in Spain: Identification of two new point mutations in the G-6-PD gene. Br J Hematol 1995; 91:66-71. [ Links ]
21.Vives J, Feliu E, Pujades M, et al. Severe glucose-6-phosphate dehydrogenase (G6PD) deficiency associated with chronic hemolytic anemia, granulocyte dysfunction, and increased duceptibility to infecctions: Description of a new molecular variant (G-6-PD Barcelona). Blood 1982; 59(2): 428-435. [ Links ]
22.Xu W, Westwood B, Bartsocas C, Malcora-Arpiazu J, Indrak K, Beuther E. Glucose-6-phosphate dehydrogenase mutations and haplotypes in varios ethnic groups. Blood 1995; 85(1): 257-63. [ Links ]
23.Garassini MA, Garassini ME, Alvarado M. Deficiencia de glucosa-6-fosfato deshidrogenasa: presentación de 2 casos. GEN 1994; 48(1): 54-56. [ Links ]
24.Sena L, Ramalho A, Barreto O, Lima F. Deficiencia de deshidrogenase de 6-fosfato glucose (G-6-PD): dados de prevalencia e de morbidae na regiäo de Natal, RN. AMB Rev Assoc Med Bras 1988; 32:17-20. [ Links ]
25.Estrada M, Gonzales R. Ictericia neonatal y deficiencia de glucosa-6-fosfato deshidrogenasa en la ciudad de la Habana. Revista de Investigación clínica 1983; 35(4): 297-99. [ Links ]
26.Vacca G, Ibarra B, Hernández A, et al. Glucose-6-phosphate dehydrogenase deficiency and abnormal hemoglobins in mexican newborns with jaundice. Revista de Investigación Clínica 1981; 33(3): 259-61. [ Links ]
27.Beutler E. G-6-PDH Deficiency. Blood 1990; 84(11): 3613-56. [ Links ]
28.Golonser J, Chevion M. Oxidant stress and malaria: Hostparasite interrelationships in normal and abnormal eritrocytes. Semin Hematol 1989; 26(4): 313-25. [ Links ]
29.Martinez J, Hadad P. Sindrome hemolítico por primaquina y deficiencia de G-6-PDH. Rev Cubana Med Trop 1989; 41(2): 299-306. [ Links ]
30.Cabezudo J. Prevalencia de la deficiencia de la enzima glucosa-6-fosfato deshidrogenasa en la población negra en 1989. Tesis para obtener el título profesional en laboratorio clínico. Lima, Perú. Centro de formación profesional Servicio de sanidad de la Policía Nacional del Perú. 1989. [ Links ]
31.Groupe de Travail de L'OMS. Deficit in glucose-6-phosphate deshydrogenase. Bulletn de L'Organisation Mondiale de la Santé 1990; 68(1): 13-24. [ Links ]
32.Guevara A, Calvopiña M, Macías G, Guderian R. Deficiencia de glucosa-6-fosfato deshidrogenasa en poblaciones ecuatorianas de raza negra. Acta bioquímica clínica latinoamericana 1991; 25(2): 113-7. [ Links ]
33.Ramalho A. Deficiencia de Deshidrogenase de 6-fosfate de glucode (G-6-PD) em reciem-nascidos brasileiros. AMB Rev Assoc Med Bras 1981; 27(12) 343-5. [ Links ]
34.Vaca G, Velásquez A, Cano J. Las eritoenzimopatías Hereditarias. II. Métodos y procedimientos de tamizaje. Bol Oficina Sanit Panam 1984; 94(4): 336-49. [ Links ]
35.Saenz G, Elizondo J, Arroyo G, Jimenez J, Montero G, Valenciano E. Diagnóstico de hemoglobinopatías y de transtornos afines. Enfoque poblacional del problema. Bol Oficina Sanit Panam 1981; 90(2): 127-139. [ Links ]
Correspondencia:
Dr. Wilson Ruiz Gil
Laboratorio de Hematología de la UPCH.
Instituto de Investigaciones de la Altura.
Hospital Nacional Cayetano Heredia