Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión impresa ISSN 1018-130Xversión On-line ISSN 1729-214X
Rev Med Hered v.18 n.3 Lima jul.-set. 2007
Prevalencia de neuropatía autonómica cardiovascular en pacientes con diabetes mellitus tipo 2 de un hospital general.
Prevalence of Cardiovascular Autonomic Neuropathy in patients with type 2 diabetes mellitus of general hospital.
Ticse Aguirre Ray1, Villena Chavez Jaime2, Pimentel Valdivia Renán.
1
Médico Asistente Departamento de Medicina, Servicio de Medicina Interna. Hospital Nacional Cayetano Heredia. Lima, Perú.2
Médico Asistente Departamento de Medicina, Servicio de Endocrinología del Hospital Nacional Cayetano Heredia. Profesor del Departamento de Medicina. Facultad de Medicina Alberto Hurtado-Universidad Peruana Cayetano Heredia. Lima, Perú.
RESUMEN
Objetivo: Determinar la prevalencia de la neuropatía autonómica cardiovascular (NACV) en pacientes con diabetes tipo 2, que acuden de manera regular al consultorio del servicio de Endocrinología del Hospital Nacional Cayetano Heredia (HNCH) y los factores que se asocian a su presentación. Material y Métodos: Ingresaron 81 pacientes que cumplieron con los criterios de inclusión y exclusión. Se aplicaron cuatro pruebas para el diagnóstico de NACV, según el consenso de San Antonio sobre Neuropatía Diabética: Test de Valsalva, razón 30/15, hipotensión ortostática y variación de la frecuencia cardiaca. Además se tomaron datos demográficos, metabólicos, patológicos y de complicaciones por la diabetes. Se aplicó el test MDNS (Michigan Diabetic Neuropatic Score) y electromiografía para el diagnóstico de neuropatía periférica. Se dividió en dos grupos según la presencia o no de NACV y se buscó diferencias. Resultados: El grupo de pacientes con NACV presentó mayor tiempo de enfermedad (10,36 ± 6,88 vs 6,32 ± 6,75; p=0,008), mayores niveles de glicemia en ayunas (160,55 ± 54,78 vs 120,63 ± 43,68; p=0,001) y de hemoglobina glicosilada (10,47 ± 2,06 vs 9,30 ± 2,14; p=0,013). No se halló diferencias significativas en las demás variables. Conclusiones: La frecuencia de de NACV en pacientes con diabetes mellitus tipo 2 del HNCH es de 41,47%. Se asocia a niveles altos de glucosa en ayunas, hemoglobina glicosilada.y mayor tiempo de enfermedad. (Rev Med Hered 2007;18:129-135).
PALABRAS CLAVE: Neuropatía diabética, diabetes, neuropatía cardiovascular, disautonomia.
SUMMARY
Objective: To determine the prevalence of the Cardiovascular Autonomic Neuropathy (CAN) in patients with type 2 diabetes who go in regular way to the endocrinology service at Hospital Nacional Cayetano Heredia (HNCH), and factors that are associated with its occurrence. Material and methods: Eighty-one patients who fulfilled inclusion and exclusion criteria were studied. Four tests for CAN diagnosis were applied, according to the consensus of San Antonio on Diabetic Neuropathy: Test of Valsalva maneuver, Reason 30/15, Orthostatic hypotension and Variation of cardiac frequency. In addition: demographic, metabolic, pathological data and complications from diabetes were taken. It was applied MDNS test (Michigan Diabetic Naturopathic Score) and electromyography for the diagnosis of peripheral neuropathies. Patients were divided into two groups according to the presence of CAN or not, and we looked for differences. Results: The group of patients with CAN displayed increased duration of disease (10,36 ± 6,88 vs 6,32 ± 6,75; p=0,008), greater levels of fasting glucose (160 ± 54.78 versus 120.63 ± 43.68; p=0.001) and glycosylated hemoglobin (10.47 ± 2.06 versus 9.30 ± 2,14; p=0.008). We didnt find significant difference in the other variables. Conclusions: The prevalence of CAN in our studied with type 2 diabetes mellitus patients was 41.47%. This condition was associated at high fasting glucose levels, glycosylated hemoglobin and increased duration of disease.(Rev Med Hered 2007;18:129-135).
KEYWORDS: Autonomic neuropathy, diabetes, cardiovascular neuropathy, dysautonomia.
INTRODUCCIÓN
La neuropatía autonómica cardiovascular (NACV) es una enfermedad que produce taquicardia al reposo y alteraciones en los reflejos cardiovasculares normales, esto debido al daño producido a nivel de las fibras nerviosas del sistema nervioso autonómico que inerva el corazón y los vasos sanguíneos. A pesar de incrementar la morbimortalidad cardiovascular de manera significativa no es reconocida con facilidad por ser generalmente asintomática (1,2). Entre las complicaciones más frecuentes se describen: reducción de la tolerancia al ejercicio, hipertensión paradójica nocturna, incremento el riesgo de presentar arritmias, intervalo QT prolongado, infarto de miocardio agudo silente y muerte súbita (3,4).
Los estudios sobre su prevalencia presentan un amplio rango de resultados, entre 17% a 44%, lo que en parte se explica porque no siempre se usan los mismos criterios para su definición ni los mismos métodos para su exploración (2,5,6,7). Para su diagnóstico se requiere evaluar la frecuencia cardiaca basal y la integridad de los reflejos cardiovasculares mediante las siguientes pruebas: maniobra de Valsalva, arritmia sinusal respiratoria y la adaptación ortostática tanto de la frecuencia cardiaca (razón 30/15) como de la presión arterial (hipotensión ortostática). Su uso ha sido aprobado por la Asociación Americana de Diabetes y Academia Americana de Neurología. Con dos o más reflejos anormales se tiene el diagnóstico de NACV. No existe consenso sobre incluir a la presencia de intervalo QTc prolongado como prueba diagnóstica de esta enfermedad., se le considera mas bien un predictor independiente de morbimortalidad cardiovascular (8-10).
Nuestro objetivo fue determinar la frecuencia de Neuropatía Autonómica Cardiovascular en pacientes diabéticos que acuden en forma regular a la clínica de diabetes del servicio de endocrinología del Hospital Nacional Cayetano Heredia (HNCH), y determinar los factores asociados a su presentación.
MATERIAL Y METODOS
Se realizó un estudio descriptivo, transversal y comparativo en pacientes diabéticos tipo 2 con edades entre 25 y 75 años, que acudieron para su control regular al consultorio de endocrinología del HNCH desde abril del 2001 hasta marzo 2002.
Criterios de exclusión:
1. Síndrome nefrótico, insuficiencia renal crónica, cirrosis hepática, infarto agudo de miocardio en los últimos seis meses, angina inestable, feocromocitoma, tirotoxicosis, deshidratación y fiebre.
2. Otras causas de neuropatía (medicamentosa, tóxica, alcohólica, inmune, anemia e hipotiroidismo).
3. Síndromes vertebrolumbares, amputaciones mayores de los miembros o secuelas de Accidentes cerebrovasculares.
4. Tratamiento sintomático o específico para la neuropatía.
5. Evidencia de enfermedad metabólica aguda episodios o hipoglicemia dentro de las 48 horas previas.
6. Ingesta de las siguientes drogas en las 18 horas previas a la evaluación: diuréticos tiazídicos, fenotiácidas, antidepresivos triciclicos, beta bloqueadores, aspirina, antihistamínicos, medicación con acción simpática o parasimpática. Alcohol, cafeína o tabaco en las 12 horas previas.
En una ficha se tomó datos antropométricos sobre: perímetro de cintura, peso, talla, índice de masa corporal. Exámenes de laboratorio: glicemia en ayunas, hemoglobina glicosilada (método cromotográfico BIO-RAD), colesterol total, HDL y LDL colesterol y triglicéridos (método enzimático), microalbuminuria (método de Radioinmunoensayo). Comorbilidades: hipertensión arterial, retinopatía diabética, antecedente de dislipidemia, accidente cerebrovascular que no haya producido secuelas mayores.
El diagnóstico de neuropatía diabética se hizo mediante los test del Michigan Neuropathy Screening Instrument (MNSI), el Michigan Diabetic Neuropatic Score (MDNS) (11) y un examen de conducción nerviosa realizado en el Instituto de Ciencias Neurológicas.
Para evaluar el compromiso de la neuropatía autonómica cardiovascular se aplicaron un conjunto de cuatro pruebas aprobadas en consenso de Asociación Americana de Diabetes y Academia Americana de Neurología (8):
Maniobra de Valsalva: Cada paciente sopló mediante un conector acoplado a un manómetro hasta 40mmHg durante 15 segundos. Se calcula el promedio del intervalo RR más largo después del procedimiento y el más corto durante el procedimiento, en 3 ciclos consecutivos y luego se obtiene la razón. Se considera anormal <1,10.
Razón 30/15: se determinó el promedio entre el intervalo RR más largo alrededor del latido cardíaco 30 y el más corto alrededor del latido después de adoptar la posición de pie y luego se obtiene la razón. Se considera anormal <1,00
Variabilidad de la frecuencia cardiaca durante la respiración profunda: Con una frecuencia de 5 respiraciones/minuto se calcula el promedio de la frecuencia cardíaca más alta durante la inspiración y la más baja durante la espiración en 3 ciclos consecutivos y luego se obtiene la diferencia. Se considera anormal < 10 latidos/minuto.
Hipotensión ortostática: Caída de la presión arterial sistólica > 20 mmHg, usualmente dentro de los dos primeros minutos al pasar de la posición acostada a la de pie. Se considera normal anormal > 20 mmHg.
Las tres primeras pruebas evalúan la función parasimpática y la última función simpática.
El diagnóstico de neuropatía autonómica cardiovascular se realizó con respuesta anormal a dos o más pruebas.
Análisis Estadístico
Para comparar proporciones se utilizó la prueba de Chi cuadrado considerando significativo p<0,05. En el presente trabajo las variables presentaron distribución no normal por lo que se usó la prueba de Mann-Whitney. Se realizó regresión logística multivariada entre las variables con significado estadístico para determinar las variables que predicen mejor la presencia de NACV.
El análisis estadístico se realizó con el programa SPSS versión 9.0 con asesoramiento del Departamento de Estadística de la Universidad Peruana Cayetano Heredia.
RESULTADOS
Ingresaron 81 pacientes, quienes cumplieron los criterios de inclusión y exclusión. Se obtuvieron los siguientes resultados:
Neuropatía autonómica cadiovascular:
Variabilidad de la frecuencia cardiaca durante la respiración profunda: Respuesta anormal en 58 (71%) pacientes del grupo total y en 29 pacientes con NACV (85%).
Maniobra de Valsalva: Respuesta anormal en 27 pacientes (33,3%) del grupo total y 22 (64,7%) pacientes con NACV.
Razón 30/15: Respuesta anormal en 19 (23,45%) pacientes del grupo total y en 16 (47,05%) pacientes con NACV.
Hipotensión ortostática:
Se presentó en 9 (11,11%) pacientes del grupo total. Todos correspondieron al grupo de pacientes con NACV. Dos pacientes presentaron síntomas.
Se diagnosticó NACV a pacientes con dos o más pruebas anormales. Su prevalencia fue 41,97%.
Taquicardia sinusal al reposo: solo un paciente presentó una frecuencia cardiaca de115 latidos por minuto. Este paciente presentó además dos reflejos anormales.
Entre los pacientes con NACV; 25 (79,41%) presentaron dos pruebas anormales, 7 (20,58%) tres pruebas anormales y 2 (5,88%) las cuatro pruebas anormales. Se encontró QTc prolongado en 12 (35,3%) pacientes con NACV y en 11 (23,4%) pacientes sin NACV. No hubo diferencias significativas.
Aspectos demográficos y clínicos:
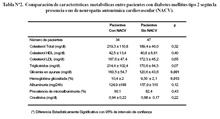
Peso: En el grupo total de pacientes el promedio de peso fue de 66,56 ± 13,42kg, (rango: 42-114kg). En el grupo de pacientes diabéticos con NACV el promedio de peso fue mayor que en los pacientes sin NACV (61,47 ± 12,12Kg; rango: 42-88.5Kg vs 70,24 ± 13,21; rango: 53,5-114Kg), (p = 0,003) (Tabla N°1).
Tiempo de enfermedad: En el grupo total de pacientes diabéticos el promedio de tiempo de enfermedad fue de 8,02 ± 7,0 años (rango: 0,16-27 años). En el grupo de pacientes con NACV el promedio fue mayor que en los pacientes sin NACV (10,36 ± 6,88; rango: 0,25-25 años VS. 6,32 ± 6,75; rango: 0,16-27 años), (p = 0,008).
No se encontraron diferencias cuando se comparó la frecuencia cardiaca basal, intervalo QT corregido, la presión arterial sistólica ni diastólica (Tabla Nº1).
Antecedentes patológicos y complicaciones crónicas:
No se encontró diferencias significativas en: hipertensión arterial, retinopatía diabética, compromiso renal (creatinina sérica y albuminuria/24h), enfermedad cerebro-vascular transitoria, neuropatía diabética periférica (evaluación clínica y por electromiografía), ni neuropatía autonómica sistémica (cuestionario).
Aspectos metabólicos:
Glicemia en ayunas: El promedio de glicemia en el grupo total de pacientes fue de 37,39 ± 52,23; rango: 61-264mg/dl. En el grupo de pacientes con NACV el promedio fue mayor que en pacientes sin NAC (160,55 ± 54,78; rango: 61-264mg/dl vs 120,63 ± 43,68; rango: 64-255mg/dl) (p = 0,001) (Tabla Nº2).
Hemoglobina glicosilada (A1c): El promedio en el grupo total de pacientes fue de 9.79 ± 2,17 %; rango: 6,0-15.0. El promedio en el grupo de pacientes con NACV fue mayor (10,47 ± 2,06; rango: 6,3-15,0 vs 9,308 ± 2,14; rango: 6,0-15) (p = 0,013).
Triglicéridos: El promedio en el grupo total de pacientes fue de 189,06 ± 84,74 (rango: 84,60-453,0mg/dl. El promedio en el grupo de pacientes con NACV fue mayor que los pacientes sin NAC (214,45 ± 102,44; rango: 84,60-453mg/dl vs 170,69 ± 64,33; rango de 87,0 a 327,0mg/dl), (p = 0,07).
Microalbuminuria: La prevalencia en la población total fue de 84%, presentandose en el 90,1%% de los pacientes con NACV y el 82,4% de los pacientes sin NACV. No hubo diferencia significativa (P=0,43).
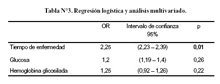
En la regresión logística y análisis multivariado (Tabla Nº3) se consideró las variables con diferencias estadísticamente significativas (glicemia, hemoglobina glicosilada y tiempo de enfermedad) y encontró que el tiempo de enfermedad como factor más importante con OR de 2,25 e intervalo de confianza entre 2,23 y 2,39 (p=0,01).
DISCUSIÓN
La neuropatía autonómica cardiovascular (NACV) es el tipo de neuropatía autonómica más estudiada y la que tiene mayor implicancia clínica. Se le considera el predictor de mortalidad más importante cuando se le compara con: presión arterial sistólica, pie diabético, índice de masa corporal, proteinuria, neuropatía sensitiva y enfermedad macrovascular (12,13). Se puede presentar en ambos tipos de diabetes y en cualquier grupo de edad, ya sea en pacientes jóvenes con diabetes tipo1 o en adultos mayores con diabetes tipo 2. Se recomienda buscar su presencia en todos los pacientes ya sea al momento del diagnóstico de diabetes tipo 2 o después de cinco años en pacientes con diabetes tipo1 (14).
El diagnóstico de NACV se realiza con la aplicación de las pruebas recomendadas por el consenso de San Antonio sobre neuropatía diabética, las cuales son estandarizadas, reproducibles y específicas (8). Nosotros siguiendo estas recomendaciones definimos NACV con respuestas anormales en dos o más pruebas. En nuestro medio este es el primer estudio que utiliza esta definición.
Hallamos una frecuencia de NACV de 41,97%. Los resultados sobre prevalencia de NACV tienen un amplio rango de resultados que varían desde 17 a 44%. Es importante mencionar que no siempre se utilizan los mismos criterios de diagnóstico; por ejemplo varios estudios consideran además el intervalo QT prolongado y otros hacen el diagnóstico de NACV con solo un reflejo anormal. Sin embargo esto último le resta especificidad al diagnóstico (9,14). Nosotros no encontramos asociación entre NACV y el valor del intervalo QT corregido por lo que este último se comporta como un factor independiente.
Se halló mayor número de respuestas anormales en las pruebas que exploran el compromiso parasimpático (Variabilidad de la frecuencia cardiaca en la respiración profunda, Maniobra de Valsalva y la razón 30/15). Esto se debe en parte a que estas pruebas son más sensibles que las que evalúan el sistema simpático (15,16). También se debe considerar que el compromiso simpático es de aparición tardía y es indicador de mal pronóstico, en especial la hipotensión ortostática. Esta última se presenta por una degeneración de las fibras simpáticas preganglionares y postganglionares que inervan el lecho vascular esplácnico. Nosotros solo tuvimos nueve pacientes con hipotensión ortostática, todos pertenecientes al grupo con NACV. Considerando que su presencia es infrecuente, debemos descartar que sea secundario a otras etiologías (hipovolemia, fármacos, etc). El hecho de separar entre pruebas del sistema simpático o parasimpático es solo ilustrativo, en la realidad una prueba anormal se da por afectación de ambos sistemas aunque con predominio de uno (17-19).
En las variables demográficas solo se encontró diferencia significativa en el tiempo de enfermedad. Se sabe que un mayor tiempo de enfermedad incrementa el riesgo de presentar NACV, sin embargo incluso en poblaciones en donde se tiene un diagnóstico temprano de diabetes se puede hallar NACV al momento del diagnóstico (20-24). En nuestro medio no se realiza en la comunidad un diagnóstico temprano de la diabetes y generalmente los pacientes acuden al hospital con complicaciones crónicas producto de la evolución natural de esta enfermedad. Tampoco encontramos diferencias significativas en cuanto a peso.
Dentro de los antecedentes no se halló diferencias significativas entre pacientes con o sin NACV para hipertensión arterial, enfermedad cerebro-vascular y enfermedad coronaria. Esto se puede deber a que la neuropatía es esencialmente microvascular por disfunción endotelial y las enfermedades mencionadas son macrovasculares (25,26,27). Tampoco encontramos diferencias con respecto a los síntomas de otros tipos de neuropatía autonómica.
En las variables metabólicas tenemos que en general la población total del estudio tiene mal control metabólico, siendo peor en el grupo de pacientes con NACV. Esto se expresa por valores mayores de glicemia en ayunas, hemoglobina glicosilada y triglicéridos hallados en los pacientes con NACV. Se sabe que la hiperglicemia aumenta el riesgo de complicaciones cardiovasculares y por el contrario la normoglicemia retrasa el desarrollo de las mismas, además de disminuir los niveles de hemoglobina glicosilada y de triglicéridos. (27-31). El mal control metabólico tiene una gran implicancia clínica ya que junto con la resistencia a la insulina producen, microangiopatía, isquemia microvascular y disfunción endotelial sistémica. Cabe resaltar que estas alteraciones, junto con el déficit de factores neurotróficos son los elementos más importantes en la patogénesis de la neuropatía diabética (27,32).
Dentro de las complicaciones microvasculares la mayoría de pacientes presentó albuminuria (84%) y neuropatía periférica (92,6%). Nosotros no hallamos diferencias significativas respecto a estas dos variables. Se conoce que tanto la microalbuminuria, el cual indica daño vascular generalizado, como la neuropatía periférica generalmente se presentan años antes que la NACV (12,29,33). Esto último puede estar ocurriendo en nuestra población, más aún si consideramos que con la regresión logística y análisis multivariado, es el tiempo de enfermedad el factor de riesgo más importante para presentar NACV. Sin embargo se debe corroborar con un estudio prospectivo.
Se puede concluir que en nuestra población: 1) La prevalencia de NACV es alta por lo que está expuesta a mayor morbimortalidad cardiovascular; 2) Predomina un mal control metabólico (niveles altos de hiperglicemia y hemoglobina glicosilada) siendo peor en los pacientes con NACV; 3) El tiempo de enfermedad es el factor de riesgo más asociado para presentar NACV. Además el uso de pruebas que exploran los reflejos cardiovasculares son aplicables en el consultorio e implican un bajo costo.
El presente trabajo brinda conocimiento de NACV en nuestra población y busca incrementar el interés y conocimiento sobre esta patología para fomentar su diagnóstico temprano. Las implicancias clínicas de esta forma de complicación de la diabetes merecen nuestra especial atención para favorecer una eficiente intervención en el tratamiento y lo más importante en su prevención.
REFERENCIAS BIBLIOGRAFICAS
1. Vinik A, Maser R, Mitchell B, Freeman R. Diabetic autonomic neuropathy. Diabetes Care 2003; 26:1553-79. [ Links ]
2. Vinik AI, Holland MT, Le Beau JM, et al. Diabetic neuropathies. Diabetes Care 1992;15:1926-1975. [ Links ]
3. Maser RE, Mitchell BD, Vinik AI, Freeman R. The association between cardiovascular autonomic neuropathy and mortality in individuals with diabetes: a meta-analysis. Diabetes Care 2003; 26(6):1895-1901. [ Links ]
4. Toyry JP, Niskanen LK, Mantysaari MJ, Lansimies EA, Uusitupa MIJ. Occurrence, predictors, and clinical significance of autonomic neuropathy in NIDDM: ten-year follow-up from the diagnosis. Diabetes 1996;45:308-315. [ Links ]
5. Ziegler D, Gries FA, Spuler M, Lessmann F, Diabetic Cardiovascular Autonomic Neuropathy Multicenter Study Group. The epidemiology of diabetic neuropathy. J Diabetes Complications 1992;6:49-57. [ Links ]
6. Ewing DJ, Clarke BF. Diabetic autonomic neuropathy: present insights and future prospects. Diabetes Care 1986;9:648-665. [ Links ]
7. Razzeto RL. Neuropatía autonómica cardiaca en el paciente diabético: Mito o realidad. Opúsculo Médico 1989;1(1):25-29. [ Links ]
8. American Diabetes Association, Academy of Neurology. Consensus statement: report and recommendations of the San Antonio conference on diabetic neuropathy. Diabetes Care 1988;11: 592-97. [ Links ]
9. Ziegler D. Cardiovascular autonomic Neuropathy: Clinical manifestations and measurement. Diabetes Reviews 1999;7(4):342-357. [ Links ]
10.Veglio M, Sivieri R, Chinaglia A, Scaglione L, Cavallo-Perin P. The Neuropathy Study Group of the Italian Society of the study of diabetes. QT Interval prolongation and mortality in Type 1 Diabetic Patients. Diabetes Care 2000; 23:1381-83. [ Links ]
11.Felman EL, Stevens MJ, Thomas PK, Brown MB, Canal N, Greene DA. A practical two-step quantitative clinical and electrophysiological assessment for diagnosis and standing of diabetic neuropathy. Diabetes Care 1994;17:1281-1289. [ Links ]
12.Astrup AS, Tarnow L, Rossing P, Hansen BV, Hilsted J, Parving H. Cardiac autonomic neuropathy predicts cardiovascular morbidity and mortality in Type 1 diabetic patients with diabetic nephropathy. Diabetes Care 2006; 29(2):334-339. [ Links ]
13.OBrien IA, McFadden JP, Corrall RJ. The influence of autonomic neuropathy on mortality in insulin-dependent diabetes. Q J Med 1991; 79:495-502. [ Links ]
14.Boulton AJM, Vinik AI, Arezzo JC, et al. Diabetic Neuropathies: A statement by the American Diabetes Association. Diabetes Care 2005;28(4):956-962. [ Links ]
15.Hilsted J, Parving HH, Christensen NJ. Hemodynamics in diabetic orthostatic hypotension. J Clin Invest 1981; 68: 1427. [ Links ]
16.Stevens MJ, Raffel DM, Allman KC, et al. Cardiac sympathetic dysinnervation in diabetes: implications for enhanced cardiovascular risk. Circulation 1998; 98: 961-8. [ Links ]
17.Ziegler D, Mayer P, Muhlen H, Gries FA. The natural history of somatosensory and autonomic nerve dysfunction in relation to glycaemic control during the first 5 years after diagnosis of Type 1 diabetes mellitus. Diabetologia 1991; 34:822-829. [ Links ]
18.Gerry Vinik AI. Diabetic neuropathy: pathogenesis and therapy. Am J Med 1999; 107:17S–26S. [ Links ]
19.Ewing DJ, Martyn CN, Young RJ, Clarke BF. The value of cardiovascular autonomic function tests: 10 years experience in diabetes. Diabetes Care 1985;8(5):491-498. [ Links ]
20.Dyrberg T, Benn J, Sandahl Christiansen J, Hilsted J, Nerup J. Prevalence off diabetic autonomic neuropathy measured by simple bedside tests. Diabetologia 1981; 20(3):190-194. [ Links ]
21.Engelgau MM, Narayan KM, Herman WH. Screening for type 2 diabetes. Diabetes Care 2000;23(10):1563-1580. [ Links ]
22.Ziegler D, Gries FA, Spuler M, Lessmann F. Diabetic Cardiovascular Autonomic Neuropathy Multicenter Study Group. The epidemiology of diabetic neuropathy. J Diabetes Complications 1992;6:49-57. [ Links ]
23.Ziegler D. Diabetic cardiovascular autonomic neuropathy: prognosis, diagnosis and treatment. Diabetes Metab Rev 1994; 10:339–383. [ Links ]
24.Ziegler D, Gries FA, Spuler M, Lessmann F, Diabetic Cardiovascular Autonomic Neuropathy Multicenter Study Group. The epidemiology of diabetic neuropathy. J Diabetes Complications 1992; 6:49–57. [ Links ]
25.Zachary S, Feldman E. Update on diabetic neuropathy. Curr Opin Neurol 2002; 15: 595-603. [ Links ]
26.Zochodne D. Diabetic neuropathies: features and mechanisms. Brain Pathol 1999; 9: 369-91. [ Links ]
27.Cameron N, Cotter M. Metabolic and vascular factors in the pathogenesis of diabetic neuropathy. Diabetes 1997; 46 (S2):31S–37S. [ Links ]
28.U.K. Prospective Diabetes Study (UKPDS) Group: Intensive blood glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS33). Lancet 1998; 352:837-853. [ Links ]
29.Savage S, Estacio RO, Jeffers B, Schrier RW. Urinary albumin excretion as a predictor of diabetic retinopathy, neuropathy, and cardiovascular disease in NIDDM. Diabetes Care 1996; 19(11): 1243-48. [ Links ]
30.Centers for disease control and prevention and the American college of sports medicine. Physical activity and Public health: a recommendation. JAMA 1995; 273:402-407. [ Links ]
31.American Diabetes Association. Self monitoring of blood glucose (Consensus statement). Diabetes Care 1994; 7:81-86. [ Links ]
32.Bruna J, Navarro X. Neuropatía autonómica en la diabetes mellitus. Revista de Neurología 2005; 40(2):102-110. [ Links ]
33.Stratton IM, Adler AI, Heil HA, et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UPKDS35). Prospective observational Study. BMJ 2000; 321: 405-12. [ Links ]
Correspondencia:
Dr Ray Ticse Aguirre.
Servicio de Medicina Interna.
Departamento de Medicina Hospital Nacional Cayetano Heredia.
Av. Honorio Delgado s/n San Martin de Porres.
Lima, Perú.
Correo electrónico: rayticse@yahoo.com