Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Medica Herediana
versão impressa ISSN 1018-130Xversão On-line ISSN 1729-214X
Rev Med Hered v.18 n.3 Lima jul.-set. 2007
Quiloperitoneo como forma de presentación del linfoma intestinal difuso: Reporte de un caso.
Chylous Ascites as a clinical presentation of B-cell lymphoma: A case report.
Pamo Reyna Oscar 1, Caballero López José 1, Alfaro Álvarez Julio César 2.
1
Médico Internista del Hospital Nacional Arzobispo Loayza. Profesor del Departamento de Medicina, Facultad de Medicina Alberto Hurtado, Universidad Peruana Cayetano Heredia. Lima, Perú..2
Médico Residente de Medicina Interna, Facultad de Medicina Alberto Hurtado, Universidad Peruana Cayetano Heredia., Hospital Nacional Arzobispo Loayza. Lima, Perú.
RESUMEN
Mujer de 29 años que desarrolló insidiosamente ascitis y dolor abdominal. El estudio del líquido ascítico reveló su aspecto lechoso y de trasudado. El estudio tomográfico mostró un conglomerado ganglionar retroperitoneal. El CA 125 fue más de cien veces el límite superior normal. El estudio reveló que se trataba de un linfoma no Hodgkin intestinal difuso de células grandes, estirpe linfoide B.(Rev Med Hered 2007;18:155-160).
PALABRAS CLAVE: Quiloperitoneo, ascitis quilosa, CA 125, linfoma de células B, linfoma no Hodgkin, linforma intestinal.
SUMMARY
A 29 year old woman insidiously developed an ascites that was a transudate with "milky" appearance. The CAT study revealed a lymph nodes conglomerate in the retroperitoneal space. CA 125 value was more than a hundredth times the normal upper limit. The study showed a large B-cell diffuse small bowel non-Hodgkin lymphoma.(Rev Med Hered 2007;18:155-160).
KEY WORDS: Chyloperitoneum, chylous ascites, CA 125, B-cell lymphoma,non-Hodgkin lymphoma, small bowel lymphoma.
INTRODUCCIÓN
El quiloperitoneo o ascitis quilosa se reconoce de manera característica cuando al realizar una paracentesis se encuentra un líquido ascítico de aspecto lechoso que es debido a la presencia de quilomicrones. Sin embargo la definición de quiloperitoneo o ascitis quilosa, en sentido estricto, e independientemente del aspecto, está dado por la concentración de triglicéridos: cuando ésta excede la hallada en el plasma (> 200 mg/100 ml).
Caso clínico
Paciente mujer 29 años, natural y procedente de Lima, enfermera. Ingresó al Hospital Nacional Arzobispo Loayza de Lima refiriendo un tiempo de enfermedad de ocho semanas, de inicio insidioso y curso progresivo. Los síntomas principales fueron distensión abdominal y dolor abdominal.
Su enfermedad empezó con dolor tipo cólico en el epigastrio, no irradiado, leve y que se incrementaba con la ingestión de alimentos; además, presentó regurgitaciones en dos oportunidades de contenido gástrico amargo. El dolor persistió en las semanas siguientes, asumiendo ella que se trataba de "gastritis".
Dos semanas antes del ingreso presentó aumento progresivo del volumen abdominal, persistía el dolor y se agregó náuseas y acedías por lo que se automedicó con omeprazol y antiácidos de superficie.
Una semana antes del ingreso notó mayor incremento del perímetro abdominal, apareciendo disnea en el decúbito por lo cual tuvo que dormir semisentada.
Tres días antes de internamiento presentó un leve aumento del volumen de los miembros inferiores. Negó haber presentado fiebre. La paciente acudió al Servicio de Emergencia del hospital por la distensión abdominal y la disnea.
Funciones biológicas: apetito conservado; sed conservada; orina: normal; heces normales; peso: aumentado sin precisar la variación; sueño alterado por la disnea en el decúbito.
Antecedentes fisiológicos: menarquia a los 14 años, fecha de la última menstruación: 25-06-06, régimen catamenial 3/28, grávida 0; no empleaba métodos anticonceptivos; último Papanicolaou en enero del 2006, negativo.
Antecedentes patológicos: negó haber padecido de enfermedades importantes en el pasado, hospitalizaciones, cirugía previa y transfusiones. Fue contacto de tuberculosis cuando trabajaba como enfermera en el Programa de Control de Tuberculosis 3 a 4 años antes.
Examen físico: presión arterial 120/70; frecuencia cardíaca 96/min; frecuencia respiratoria 18/min; temperatura 36ºC; peso 57,2kg; talla: 1.47m.
En regular estado general y de nutrición, hidratada. Piel con leve palidez, no ictericia, no cianosis, no estrías, no telangiectasias. Tejido celular subcutáneo: no edemas. Sistema linfático: no adenomegalias. Tórax y pulmones: excursiones respiratorias y murmullo vesicular disminuidos en ambas bases, sin ruidos agregados. Cardiovascular: ruidos cardíacos rítmicos, no soplos. No se evidenció ingurgitación yugular ni reflujo hepatoyugular; pulsos arteriales periféricos presentes.
Abdomen: globuloso, distendido, sin circulación colateral; ruidos hidroaéreos presentes; tenso, doloroso a la palpación en hipocondrio derecho, no se puede precisar visceromegalias por la distensión; signo de la oleada y matidez desplazable presentes; circunferencia abdominal de 94 cm. Génito-urinario: de caracteres normales. Sistema nervioso: lúcida y orientada, sin déficit motor ni sensitivo; reflejos osteotendinosos 2/4 simétricos, no signos meníngeos ni de focalización.
Exámenes Auxiliares
Hemoglobia 9,9g/dl; leucocitos 7500/mm3: segmentados 80%, abastonados 4%, eosinófilos 1%, basófilos 0%, monocitos 4% y linfocitos 11%; plaquetas 395 000/mm3. Tiempo de protrombina 13,7 seg, INR 1.09. Glicemia 88 mg/dl; creatinina 0,5 mg/dl; proteínas totales 7,74 g/dl, albúmina 3,28 g/dl y globulinas 3,46 g/dl; bilirrubinas totales 0,50 mg/dl, bilirrubina indirecta 0.37 mg/dl y bilirrubina directa 0,21 mg /dl. Transaminasa sérica glutámico oxaloacética (SGOT) 13 U/L, transaminasa sérica glutámico pirúvica (SGPT) 9 U/L; fosfatasa alcalina 69 U/L; gamma glutamil transferasa (GGT) 15 U/L; deshidrogenasa láctica (LDH 341 U/L. Colesterol total 135 mg/dl, triglicéridos 96 mg/dl.
Gases arteriales: pO2 96.5 mmHg, pCO2 31.7 mmHg, Sat O2 97,9 %. pH 7,45, HCO3 22,3 mEq/L, sodio 144 mEq/L, potasio 3,5 mEq/L, cloro 107 mEq/L, calcio iónico 0,92 mg/dl.
VIH negativo, AgHBs negativo, anti VHC negativo, anticuerpos antinucleares negativo, Ac antimúsculo liso negativo. Antígenos tumorales CA 125: 3 611 (VN: 0-35 U/ml), CA 19,9: 0,96 (VN: 0-37 U/ml)
La radiografía de tórax fue normal. La ecografía abdominal reveló hígado de tamaño normal, bordes uniformes, parénquima homogéneo, no masas ni colecciones. Vías biliares: intrahepáticas no dilatadas. Vena porta y colédoco de calibres adecuados. Vesícula de tamaño adecuado, paredes delgadas, no se evidenció litiasis. Páncreas, bazo y riñones: no se observaron anormalidades. Presencia de líquido libre en cavidad abdominal hacia la zona pélvica.
Se realizó una paracentesis y el estudio del líquido ascítico resultado de aspecto blanquecino turbio, con 3 900 células/mm3: 100% de linfomonucleares; proteínas 2,07 g/dl, albúmina 1,77 mg/dl. LDH: 222 U/L; ADA 7 mg/dl; triglicéridos: 602 mg/dl; Pap: numerosos linfocitos, monocitos, células mesoteliales reactivas, no células neoplásicas. Tinción Gram: no gérmenes. Cultivo: negativo (Figura N°1).
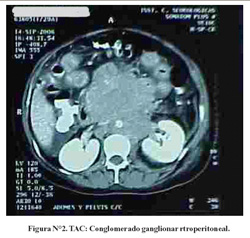
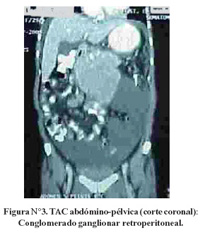
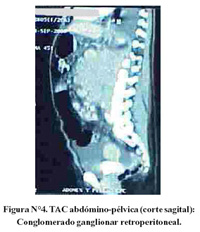
La TAC de tórax reveló solo derrame pleural bilateral y atelectasia pasiva adyacente. La TAC abdómino-pélvica mostró conglomerados ganglionares retrocrurales y paraaórticos que se extendían hacia adelante y englobaban el tronco celíaco, vasos mesentéricos y arterias iliacas primitivas. Ascitis marcada. El resto sin mayores alteraciones (Figura N°2, Figura N°3 y Figura N°4).
Se le realizó una biopsia ganglionar dirigida por tomografía. El estudio histológico sólo demostró una población linfoide heterogénea de aspecto reactivo. El estudio del líquido ascítico mostró células mesoteliales reactivas, otras con cambios degenerativos y polimorfonucleares.
La paciente fue derivada al Instituto Nacional de Enfermedades Neoplásicas (INEN) donde se le repitió el procedimiento invasivo. El estudio reveló un infiltrado difuso de células de tamaño intermedio a grande, de escaso citoplasma en general, no cohesionadas entre sí, con núcleos pleomórficos, de cromatina fina y nucléolo nítido. Pocas mitosis y algunas de ellas atípicas. Los hallazgos histopatológicos llevaron al diagnóstico de neoplasia maligna de células redondas, compatible con Linfoma no Hodgkin.
El tránsito intestinal reveló marcado engrosamiento difuso del intestino delgado. El estudio inmunohistoquímico concluyó que se trataba de un Linfoma no Hodgkin difuso de células grandes, estirpe linfoide B. Los marcadores en general indicaban un pronóstico intermedio a desfavorable.
Se consideró como un linforma intestinal en estadío III (AJCC-Arber). La paciente recibió el esquema CHOP (Ciclofosfamida + Adriamicina + Vincristina + Prednisona) + Rituximab, saliendo de alta cuatro días después en buenas condiciones. La paciente actualmente se controla en EsSalud.
DISCUSIÓN
El quiloperitoneo o ascitis quilosa significa que el flujo linfático está alterado en algún punto de su recorrido desde la cisterna de Pecquet hasta la desembocadura del conducto torácico en el sistema de la vena cava superior.
El quiloperitoneo puede explicarse por tres mecanismos fisiopatológicos (1):
1- El tipo obstructivo, dado por la obstrucción maligna de los conductos linfáticos o de la cisterna de Pecquet, que genera dilatación subserosa de los vasos linfáticos y posterior extravasación a la cavidad peritoneal. Las interrupciones del flujo linfático suele deberse a la distorsión de la arquitectura linfática como es el caso del crecimiento ganglionar en los linfomas o en las metástasis ganglionares. Esta interrupción también ocurre con la fibrosis de los procesos inflamatorios como en el caso de la filariasis; y con la ruptura de los vasos linfáticos de manera traumática (traumatismo quirúrgico o intraoperatorio y traumatismos cerrados).
2- La exudación de linfa a través de las paredes de los vasos megalinfáticos retroperitoneales, los cuales forman una fístula hacia la cavidad peritoneal, como es el caso de la linfangiectasia congénita.
3- La dilatación retroperitoneal de los vasos linfáticos (megalinfáticos) dado por la obstrucción del conducto torácico o de la cisterna del quilo; este fenómeno se puede observar en casos de pericarditis constrictiva o de insuficiencia cardiaca congestiva. La cirrosis puede originar quiloperitoneo bajo esta modalidad por la ruptura de los vasos linfáticos dilatados debido a la hipertensión portal, aunque es infrecuente ya que ocurre en menos del 1% de las ascitis cirróticas.
El efecto crónico del aumento de presión (sea obstructivo, congénito o hipertensivo) produce depósito de colágeno en la membrana basal de los linfáticos y deterioro de la capacidad absortiva que se manifiesta por una enteropatía perdedora de proteínas con esteatorrea y desnutrición consiguiente.
Los reportes de quiloperitoneo suelen ser escasos. En nuestro medio se ha reportado el caso de un varón de 64 años que desarrolló ascitis de tipo quilosa, se le halló un conglomerado ganglionar retroperitoneal y el estudio histológico reveló un linfoma folicular con infiltración al hígado (2).
El linfoma es la causa más importante de quiloperitoneo, aunque excepcionalmente pueden hallarse otros como el mesotelioma (3).
El líquido ascítico quiloso hallado fue un trasudado, lo cual indicaba que se trataba de un proceso obstructivo o hipertensivo de las vía venosas y linfáticas. En caso de que se encuentre un líquido ascítico quiloso de tipo exudado debe sospecharse de traumatismo, post quirúrgico, peritonitis bacteriana concomitante o invasión tumoral de la cavidad peritoneal (4).
La concomitancia de quiloperitoneo con quilotórax es rara. Puede que se deba a una causa común en ambas cavidades (obstrucción linfática por ganglios linfomatosos en el abdomen y en el tórax, traumatismo cerrado torácico y abdominal) o que el líquido quiloso pase de una cavidad a la otra (4). En nuestro caso, la disminución del murmullo vesicular en las bases pulmonares fue interpretada como elevación de los hemidiafragmas por la ascitis, radiológicamente no se evidenció derrames pleurales pero sí con la TAC del abdomen. Como los derrames pleurales no eran importantes, se decidió agotar el estudio a través de la ascitis pero muy bien pudo haberse tratado de quilotórax por trasudación de la cavidad peritoneal.
Si se tiene una ascitis quilosa en pacientes con diarrea crónica y que desarrollan hipoalbuminemia, linfopenia y edema distal debe sospecharse de la linfangiectasia intestinal que es una enfermedad autosómica dominante o adquirida que produce obstrucción de la linfa, con alteraciones en el transporte de quilomicrones y otros problemas concomitantes (5).
En los casos de que se sospeche de ruptura de la vía linfática por traumatismos cerrados o postquirúrgico debe recurrirse a los estudios de medicina nuclear: linfografía o linfoescintigrafía (con dextrán marcado con Tc99m) para precisar el punto de ruptura del conducto torácico y así proceder a su reparación quirúrgica.
Los cirujanos que aborden las regiones adyacentes a las grandes vías linfáticas deben tener en cuenta la posibilidad de esta complicación como consecuencia de su intervención. Por ejemplo, la linfadenectomía lumboaórtica post quimioterapia es el único método que ofrece posibilidades de estadíaje y curación de los ganglios residuales por laparoscopía y puede tener como complicación la ascitis quilosa (6).
El pronóstico del quiloperitoneo o ascitis quilosa depende de la causa que lo origine. En los casos del síndrome de ascitis quilosa agudo –como puede ser el caso de aquella generada por un traumatismo tóracoabdominal cerrado, especialmente de la región dorsolumbar- suele ser bueno, con una mortalidad menor del 4%, a diferencia de lo que ocurre con ascitis quilosas crónicas que alcanzan una mortalidad del 40%. Por eso en estos casos agudos se recomienda un tratamiento conservador con drenajes y nutrición parenteral total (7). La terapia conservadora con dieta sin grasas y con triglicéridos de cadena media (que son directamente absorbidos al sistema venoso portal) o el régimen de nada por vía oral y con nutrición parenteral total concomitante pueden favorecer el cierre espontáneo de la lesión al reducir el flujo y la presión linfática a la vez que se asegura una adecuada nutrición. La laparotomía y la reparación del conducto torácico o cortocircuito peritoneo venoso en los casos intratables suele acompañarse de complicaciones. El drenaje torácico con tubo no reduce el flujo del líquido quiloso y puede originar una mayor pérdida de fluido y desnutrición del paciente; aunque podría efectuarse en casos de emergencia para disminuir la disnea (4).
Comentario aparte merece el hallazgo de la concentración de CA 125 cien veces el límite superior normal. El CA 125 es una glicoproteína producida por el epitelio celómico de la pleura, peritoneo, pericardio, trompas de Falopio, endometrio y endocérvix. Normalmente no se halla en el ovario pero su medición nos ayuda en el diagnóstico y en el seguimiento postratamiento de las pacientes con cáncer de ovario. Sin embargo, se puede hallar valores elevados de CA 125 en otros cánceres como útero, cérvix, páncreas, hígado, colon, mama, pulmón y del tracto digestivo. Entre las condiciones no cancerosas que elevan el CA 125 tenemos endometriosis, enfermedad inflamatoria pélvica, peritonitis, pancreatitis, enfermedad hepática, procesos inflamatorios de la pleura, menstruación y embarazo. Esta gran variedad de condiciones asociadas con elevación de CA 125 puede explicarse porque el origen de este antígeno está en el peritoneo (8-9).
Característicamente el CA 125 ha sido asociado con los linfomas. Está correlación ocurre con los linfomas no-Hodgkin, compromiso abdominal, síntomas B (pérdida de peso, fiebre y sudoración nocturna), estadio avanzado de enfermedad, gran masa tumoral y compromiso de la serosa (10). Los linfomas Hodgkin también pueden elevar el CA 125 cuando comprometen las serosas (8).
La importancia como marcador en el diagnóstico y para el seguimiento del tratamiento de los linfomas todavía no está bien definido (9).
Curiosamente, se ha descrito la elevación excesiva del CA 125 de 939 U/L, en un caso de peritonitis tuberculosa, con ascitis de tipo exudado y ADA normal. El diagnóstico se hizo mediante laparoscopía y biopsia peritoneal, demostrándose los granulomas tuberculosos característicos, con células epitelioides y granulomas caseosos. Aunque los exámenes directos y los cultivos fueron negativos, hubo respuesta al tratamiento antituberculoso y normalización de los valores de CA 125. En la peritonitis tuberculosa puede hallarse valores elevados de CA 125 aunque estos suelen ser menores de 500 U/ml (11).
REFERENCIAS BIBLIOGRÁFICAS
1. Jiménez Co. Ascitis quilosa. Presentación de un caso y revisión de la fisiopatología. En: http://www.encolombia.com/medicina/cirugia/Ciru19204-Ascitis.htm (Fecha de acceso: 14 de enero del 2007). [ Links ]
2. Valdivia J, Rivera S, Ramírez D, et al. Ascitis quilosa como manifestación de un linfoma retroperitoneal. Rev Gastroenterol 2003; 23 (4): 297-301. [ Links ]
3. Iglesias M, Mesías M, Fernández FJ, Sesma P. Ascitis quilosa y quiloperitoneo como forma de presentación de un mesotelioma. Sociedad Gallega de Medicina Interna 2001. En: http://www.meiga.info/meiga.asp?cap=1&mat0=8&mat1=385&mat=387&id=832 (Fecha de acceso: 05 de diciembre del 2006). [ Links ]
4. Zagolín B, Aguilera S, Vojkovic L. Concomitancia de quilotórax y quiloascitis, caso clínico y revisión de la literatura. Rev Chil Enf Respir 2004; 20 (2): 95-100. [ Links ]
5. Rodríguez G. Intestinal lymphangiectasia: a forgotten cause of chronic diarrhea Rev Gastroenterol Mex 2006; 71(1) : 55-58. [ Links ]
6. Castillo O, Kerkere M, Pinto M, Santomil F, García JL, Arellano L. Linfadenectomía lumboaórtica aparoscópica post quimioterapia. Rev Chil Urol 2002; 67 (2): 115-118. [ Links ]
7. Pelayo A, Fermiñán A, Pérez L. Cartas al director. Ascitis quilosa postraumática. Cirugía Española 2000; 67 (4): 407. [ Links ]
8. Epiney M, Bertossa C, Weil A, Campana A, Bischof P. CA 125 production by the peritoneum: in-vitro and in-vivo studies. Human Reproduction 2000; 15 (6): 1261-1265. [ Links ]
9.Levine A. Whats "Hot" in Hematologic Malignancy. 25th Congress of the European Society for Medical Oncology October 13 - 17, 2000, Hamburg, Germany: European Society for Medical Oncology. En: http://www.medscape.com/viewarticle/419927 (Fecha de acceso: 07 de diciembre del 2006). [ Links ]
10.Dilek I, Ayakta H, Demir C, Meral C, Ozturk M. CA 125 levels in patients with non-Hodgkin lymphoma and other hematologic malignancies. Clin Lab Haematol. 2005; 27 (1): 51-5. [ Links ]
11.Çorapçýoðlu F, Güvenç BH, Sarper N, Aydoðan A, Akansel G, Arýsoy ES. Peritoneal tuberculosis with elevated serum CA 125 level mimicking advanced ovarian carcinoma in an adolescent. Turk J Pediatr 2006; 48: 69-72. [ Links ]
Correspondencia:
Oscar G. Pamo Reyna,
Departamento de Medicina,
Facultad de Medicina Alberto Hurtado
Universidad Peruana Cayetano Heredia
Lima, Perú.
Correo electrónico: opamo@upch.edu.pe