Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión impresa ISSN 1018-130Xversión On-line ISSN 1729-214X
Rev Med Hered v.20 n.1 Lima ene. 2009
Trastornos de la consolidación: Retardo y pseudoartrosis.
Bone defect healing: Delay of consolidation and Pseudarthrosis.
Pretell Mazzini Juan Abelardo 1, Ruiz Semba Carlos2, Rodriguez Martín Juan3.
1
Residente IV año Cirugía Ortopédica y Traumatología. Hospital Universitario 12 de Octubre, Madrid. España.2
Médico asistente Cirugía Ortopédica y Traumatología- Jefe de Servicio. Hospital Nacional Cayetano Heredia, Lima.Perú.3
Residente V año Cirugía Ortopédica y Traumatología. Hospital Universitario 12 de Octubre, Madrid.España.
RESUMEN
No hay una definición universalmente aceptada de pseudoartrosis; en general se acepta que si la consolidación no se realiza en 6-8 meses, estamos frente a una pseudoartrosis. El proceso de consolidación puede ser alterado o perturbado por factores mecánicos, biológicos o una combinación de ambos. El retardo de consolidación y la pseudoartrosis, son dos procesos que difieren en su fisiopatología, pronóstico y tratamiento. El tratamiento debe ser individualizado teniendo en cuenta todos los factores presentes en el paciente, para abordar de manera integral el problema. La pseudoartrosis de los huesos largos se puede tratar con un procedimiento quirúrgico único en más del 90% de los pacientes, con buenos o excelentes resultados en la restauración del eje mecánico y longitud del miembro afectado, en 80% de los casos. (Rev Med Hered 2009;20:31-39)
PALABRAS CLAVE: Retardo de consolidación, pseudoartrosis, tratamiento, consolidación.
SUMMARY
There is no universally accepted definition of nonunion of a fracture. Generally, failure of a fracture to heal in 6-8 months constitutes a nonunion. The fracture repair process may be affected by mechanical or biological factors or a combination of both. The delayed union and nonunion are two different entities that differs on their physiophatology, outcome and treatment. Treatment must be tailored to the individual patient to address all components of the problem. Nonunions of long bones fractures can be treated successfully with one operative procedure in more than 90% of patients. In fact, 80% of patients can have good or excellent final restoration of mechanical axis alignment and proper length.(Rev Med Hered 2009;20:31-39)
KEY WORDS: Delayed union, nonunion, fracture repair process, treatment.
INTRODUCCION.
Cuando se produce una fractura, la reparación ósea puede tomar dos caminos: seguir un proceso reparativo exitoso o sufrir algún trastorno en el proceso normal reparativo que retarde el proceso o no lograr realizarlo en ningún momento (1). Para tratar los trastornos de la consolidación, debemos conocer como se produce dicho proceso de manera natural.
El proceso de consolidación no es único y varía según el tipo de tratamiento; pudiendo ser: ortopédico (no quirúrgico) o quirúrgico.; siendo éstos una posible influencia en la presentación de los mencionados trastornos de la consolidación (2,3).
El proceso de consolidación sigue su historia natural durante el tratamiento ortopédico, produciéndose un callo perióstico y otro endóstico. Arrebola describe cinco etapas (3):
1. Inicial/latencia: Durante esta etapa se produce la formación del secuestro fracturario mediante osteolisis. Además, en el hematoma fracturario se produce la acción plaquetaria liberando sustancias como PDGF, TGF-B y FGF-B que asociado a la reducción del pH y de la tensión de oxígeno favorecen la aparición de células inflamatorias para eliminar células muertas, producir factores de crecimiento e iniciar la histogénesis.
2. Organización: Luego de concluida la etapa inicial se produce la decalcificación de los extremos óseos y el hematoma fracturario se organiza dando lugar a la formación del callo fibroso (callo óseo primario o provisional). Esto se produce aproximadamente a las 3 semanas.
3. Normalización, formación de callo óseo secundario o definitivo: Durante esta etapa se produce el nuevo tejido óseo, también llamado hueso laminar. Es en este momento en que se produce la osteogénesis periférica y la osteogénesis medular, que se denomina osteogénesis intrafragmentaria. Esto dará como resultado la formación del callo óseo perióstico y endóstico antes descritos.
4. Remodelamiento: Esta etapa se produce mucho tiempo después de la formación de los callos perióstico y endóstico, se remodela la cortical y el canal medular, desapareciendo los callos interno (endóstico) y externo (perióstico), la cavidad medular se vuelve a abrir y la
arteria medular se reconstruye.
5. Solidificación.
En cambio, con el tratamiento quirúrgico el proceso se puede alterar ya que podemos realizar estabilización relativa o absoluta.
En el caso de la estabilización relativa (enclavado endomedular, fijador externo) el movimiento de los fragmentos incrementa la exudación de sustancias que en conjunto con las células y la neoformación de vasos llevan a la formación de un callo exuberante (callo perióstico), inhibiéndose la formación del callo endóstico (4). En la estabilización absoluta (placas y tornillos), la formación del callo perióstico se inhibe y se promueve la formación del callo endóstico, observándose una consolidación más lenta (3).
El conocimiento de estos conceptos es de vital importancia para poder valorar de manera adecuada la evolución del paciente y la posible aparición de estos trastornos.
Definición
Las alteraciones de la consolidación forman parte de las complicaciones locales de las fracturas (1,3,4,5) y sus causas principales son el exceso de movimiento en el lugar de la fractura (mala estabilización) y la insuficiente vascularización de los fragmentos (1,4,5,6). Se pueden clasificar en: retardo de la consolidación y pseudoartrosis (7).
Si leemos las definiciones clásicas de los trastornos de la consolidación podemos tener una falsa idea que se tratan de procesos que se diferencian sólo por los tiempos de aparición (1,3); sin embargo, son dos procesos que difieren en su fisiopatología, evolución, pronóstico y tratamiento.
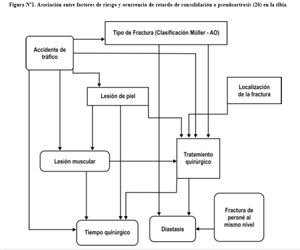
Cuando la consolidación no ha avanzado a la velocidad media esperada para la localización y tipo de fractura (3-6 meses), se habla de retardo de la consolidación (3). En cambio, la pseudoartrosis es la incapacidad completa de la consolidación por fracaso definitivo de la osteogénesis. (1)( Figura Nº1).
Queda claro entonces que el retardo de consolidación es un enlentecimiento de la velocidad del proceso de consolidación, pero ésta llegará a establecerse de forma definitiva y normal, por lo tanto no se le debe considerar como fracaso biológico, y la pseudoartrosis es un proceso terminal, es una cicatriz fibrosa definitiva e irreversible (5,6).
Clasificación
Es importante conocer las principales clasificaciones existentes, ya que nos permitirán entender la conducta biológica de esta patología y así poder entender el por qué de uno u otro tratamiento (2,3,7). La literatura hace referencia a dos clasificaciones:
La clasificación de Judet y Judet (3), se basa en la viabilidad de los extremos de los fragmentos óseos y del aporte sanguíneo. Según esta clasificación las pseudoartrosis se dividen en dos grandes grupos: Hipertróficas (problema mecánico) y atróficas con pérdida de fragmentos intermedios y sustitución por tejido cicatrizal relacionadas con pobre vascularización (problema biológico). Las hipertróficas a su vez se dividen en: "Pata de elefante" (callo abundante e hipertrófico), "casco de caballo" (moderada hipertrofia) e hipotrófica (callo ausente).
Schweiberer (2), considera que las pseudoartrosis hipertróficas y oligotróficas pertenecen a las biológicamente reactivas, mientras que las atróficas a las biológicamente no reactivas.
La clasificación de Paley y col. (3), se basa en el defecto óseo existente.
A. Con pérdida de hueso inferior a 1 cm:
A1. Pseudoartrosis con deformidad móvil y;
A2. Con deformidad fija
B. Con pérdida de hueso superior a 1 cm:
B1. Con defecto óseo;
B2. Pérdida de longitud ósea y;
B3. Ambas
Además existen las pseudoartrosis infectadas las cuales se definen como falta de unión y persistencia de infección por 6-8 meses (8).
El objetivo de una clasificación es no sólo describir un patrón determinado de alguna patología dada, sino también, ayudar a la toma de decisiones para optar por un determinado tratamiento definitivo, es en este sentido que en la práctica ortopédica clínica habitual se utiliza la clasificación de Judet y Judet como lo veremos más adelante.
Epidemiología
Según Clinton y col. (9), se puede presentar retardo de consolidación o pseudoartrosis en el 5%-10% de las fracturas.
Darder y Gomar (10), revisaron una serie de 202 fracturas tibiales y encontraron 44% de casos con retardo de consolidación. Dickson y col, en una serie de 114 fracturas tibiales expuestas encontró que 30% se podían clasificar como retardo de consolidación o pseudoartrosis (11).
La gran mayoría de autores mencionan que la tibia ocupa el primer lugar en frecuencia (1,12-21). Edmonson y Crenshaw en una serie de 122 pacientes la reportan en segundo lugar, superada por el fémur con 10%.
El fémur ocupa el segundo lugar en frecuencia; como lo refiere Ruiz y col. (22) quienes encontraron que en el Hospital Cayetano Heredia representaba el 1%, y ocupaba el segundo lugar en frecuencia después de la tibia y antes que el húmero (0,5%),dichos hallazgos se correlacionan con lo reportado en la literatura (1). Luego, se ubican los huesos del antebrazo, descrito por Ruiz et al (22) con una frecuencia de 0,4% y luego, la clavícula (23).
En general, aproximadamente 53% de las pseudoartrosis ocurren en los miembros inferiores, siendo la tibia la más afectada; además, la tibia es el hueso que más fracturas reporta y debido a su anatomía (ausencia de músculos en su cara anterior e interna) presenta factores de riesgo para que se produzcan dichos trastornos de la consolidación (1,24,25).
Etiopatogenia
El proceso de consolidación puede ser alterado por factores mecánicos (fuerzas de compresión y flexión que favorecen la formación de callo óseo; fuerzas de cizallamiento y torsión que inhiben la formación de callo óseo) (3,6); factores bioquímicos como la producción de colagenasa por los macrófagos y fibroblastos localizados en el foco fracturario lo que contribuye a la aparición de pseudoartrosis. Se ha observado que la ausencia de tejido neural, es también un factor que podría afectar adversamente el proceso de consolidación (8).
En la figura N°1, se puede observar la asociación entre los factores de riesgo y la ocurrencia de retardo de consolidación o pseudoartrosis.
Ramos (25) considera los siguientes grupos de causas:
1. Generales: Edad, se ha demostrado que a mayor edad, hay mayor frecuencia de retardos de consolidación pero no de pseudoartrosis.
2. Enfermedades sistémicas: Tuberculosis, lúes, diabetes, tabes, hipotiroidismo, osteopatía descalcificante.
3. Locales: Localización de la fractura, tipo de fractura, apertura del foco de fractura (1,3,6,25,26)
4. Por tratamiento: Fallas en la reducción, contacto y en la inmovilización.
Se ha visto que una inadecuada inmovilización por sí misma podría ser causa de pseudoartrosis produciéndose una detención en el proceso de reparación natural; el resto de factores mencionados por si mismos producirían más que nada un retardo en la consolidación (6,24).
Si analizamos con más detalle todos estos factores de riesgo la gran mayoría de autores coinciden en que las fracturas diafisiarias que más se complican con pseudoartrosis son las que se asientan en el tercio medio (7,12,14,16,20) y en segundo lugar las que se ubican en el tercio distal. Esto tendría como explicación que el agujero nutricio se encuentra en todas las diáfisis en su tercio medio; en teoría, todas las fracturas en dicha zona, por debajo de los agujeros nutricios, tienen un aporte vascular limitado en la región distal a la fractura (1).
El riesgo de aparición de pseudoartrosis puede relacionarse también al tipo de trazo fracturario, es así que las transversales u oblicuas cortas ocupan el primer lugar de riesgo, seguidas de las conminutas, luego las segmentarias en su foco distal y por último las espiroideas u oblicuas largas. Esto se explica por la zona de contacto entre los fragmentos óseos siendo este pequeño para las transversales y oblicuas cortas y mayor (hasta 3 veces) para las oblicuas largas (1).
Según Volkow entre 3-11% de los casos en donde se realiza apertura del foco fracturario puede desarrollarse pseudoartrosis. Esto se explica por la pérdida del hematoma fracturario (1,3,27,28), esencial en la formación del callo óseo, pérdida de la vascularidad, de inserciones musculares y de periostio.
También se puede observar necrosis focal que no sólo es ósea sino también de las estructuras intraóseas, lo cual retrasa el proceso regenerativo pudiendo detenerse (1,3,7,20,21,27); según Alvarez Cambras (1,24) esta sería la principal causa de pseudoartrosis, opinión que no es compartida por muchos.
Finalmente hay que tener en cuenta lo referido por Wilson (29) quien da vital importancia a una inadecuada inmovilización como causa principal de pseudoartrosis.
Diagnóstico
En esta patología a diferencia de otras, la sintomatología no es tan importante como lo es la radiología (7,24) y la historia natural de la consolidación ósea.
En los estudios radiológicos, el retardo de la consolidación y la pseudoartrosis, presentan características particulares.
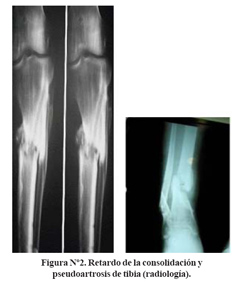
En el retardo de la consolidación hay descalcificación de los extremos óseos, el canal medular no está cerrado, no hay fibrosis marginal y se encuentran sombras de calcificaciones en las partes blandas en torno al foco de fractura (callo óseo incipiente) ( Figura N°2).
En la pseudoartrosis se observa recalcificación y esclerosis de los extremos óseos que se ven redondeados, uno de ellos adopta la forma convexa y el otro cóncavo, simulando una articulación condílea, hay cierre del canal medular, ausencia de sombra de osificación en torno al foco de fractura, separación de los extremos óseos y a veces engrosamiento de los extremos óseos (hipertrófica) por calcificación del tejido fibroso cicatricial ( figura Nº2 y figura Nº3).
En los casos en los que no estén muy claras las imágenes de radiología simple, es útil la realización de una tomografía computarizada (TAC) la cual presenta mayor especificidad con lo que nos ayudará a confirmar el diagnóstico (8).
En todos los casos es recomendable tratar de descartar una etiología infecciosa a través de la clínica (viendo la herida operatoria, cultivando secreciones sospechosas), análisis y estudios de medicina nuclear como la gammagrafía con Tc y Galio, las cuales no confirman la sospecha por si sola, pero en conjunto con las demás pruebas le brindan al cirujano mayor capacidad para definir finalmente cual será su actuar (5,6,8)
Tratamiento
En el retardo de consolidación (7), se debe corregir la causa que lo provoca o mantiene. La principal medida es corregir la inmovilización inadecuada (yeso corto, incontinente, quebrado, etc.) asegurando una inmovilización completa y continua; tratar la infección si está presente, corregir el estado nutricional, estimular la actividad funcional de la extremidad hasta donde sea posible y retirar cuerpos extraños. Hay que tener en cuenta que no es un proceso patológico, simplemente es una disminución de la velocidad del proceso normal de consolidación.
En cambio en la pseudoartrosis, el tratamiento difiere ya que es un proceso patológico que requiere una intervención más agresiva (3,5,6,24,30,31,32,33). El objetivo es curar la pseudoartrosis y lograr una funcionalidad del miembro afectado lo más normal posible, mediante la resección de la cicatriz fibrosa, reavivamiento de los extremos óseos, apertura del canal medular y con frecuencia aplicación de injertos óseos extraidos de la cresta iliaca (de alto poder osteogénico) (5).
La intervención transforma el foco pseudoartrósico en un estado fisiopatológico idéntico a la fractura primitiva, empezando de nuevo todo el proceso de consolidación. Para lograr ésto, debemos abordar tanto el componente quirúrgico como el biológico. Existe una gama amplia de intervenciones quirúrgicas e implantes las cuales se aplicarán según los requerimientos de cada paciente; y para optimizar el componente biológico se pueden utilizar métodos clásicos como decorticación e injertos óseos (3,5,6,9,31,32,33) o utilizar las nuevas sustancias que más adelante mencionaremos.
Ciertos principios básicos deben ser respetados para lograr un tratamiento óptimo:
a) Reducción de fragmentos
a1. Fracturas alineadas: Evitar una disección amplia conservando el periostio, el callo y tejido fibroso ya que mantienen la vascularización y la estabilidad. Cuando el injerto se integra a los fragmentos, el tejido fibroso interpuesto y el callo se osifican.
a2. Fracturas desplazadas: Se reducen mediante tracción gradual y luego se coloca un material de osteosíntesis adecuado (estabilización relativa o absoluta).
b) Injertos óseos
Pueden ser vascularizados o no vascularizados. Los no vascularizados se pueden utilizar como procedimiento aislado asociado a fijación externa o interna o peroné vascularizado (8).
Los vascularizados presentan muchas ventajas pero dependen de técnicas de microcirugía; habitualmente se emplea el peroné libre o la cresta iliaca libre, vascularizados. Una gran ventaja es que se pueden preparar injertos osteocutáneos u osteomiocutáneos que sirven para coberturas de lesiones complejas (8).
El injerto óseo es el tratamiento standard para las pseudoartrosis atróficas (3,7,25). Dentro de éstos, el autólogo sigue siendo el de elección ya que presenta ventajas como no haber reacción inmunológica, no transmisión de enfermedades infectocontagiosas y conservan la capacidad de osteoconducción y osteoinducción. Sin embargo hay algunos autores como Hierholzer (32), que mencionan que tanto con injerto autólogo como con matriz ósea desmineralizada se pueden obtener resultados similares, esta conclusión hay que tomarla con cuidado ya que se trata sólo de un estudio aislado.
c) Estabilización de fragmentos
Es muy importante sobretodo en las de tipo hipertrófico, que de base existe un problema mecánico más que biológico. Hay que evitar las fuerzas de cizallamiento, rotación y distracción como lo hemos mencionado anteriormente y para ello podemos emplear la fijación interna o externa.
c1. Fijación interna
Su elección depende de varios factores como: tipo de pseudoartrosis, condición de los tejidos blandos y del hueso, del tamaño y posición de los fragmentos óseos y del tamaño del defecto.
Placas y tornillos: Este método de fijación produce desperiostización con alteración del aporte vascular (3,4), se elimina el hematoma de la fractura y se lesiona la arteria intramedular. La consolidación es más lenta.
Se observa mejores resultados con hueso no osteoporótico y con fragmentos largos, debido que se logra una buena fijación de los tornillos (3); aunque en la actualidad con las placas LCP (tornillos fijados a la placa) este problema ya no es tan importante.
Enclavado intramedular: Este método se utiliza en pseudoartrosis de huesos largos como la tibia, fémur o húmero (3). No se debe utilizar si existe una deformación severa de la extremidad (7). Se puede utilizar en hueso osteoporótico (34).
El enclavado con fresado es recomendado por muchos autores porque refresca los bordes óseos y da una buena estabilización (4). Sin embargo, Ruiz y col describen el empleo de enclavado sin fresado con buenos resultados (35). Está contraindicado si existe infección previa o en el momento del tratamiento (3).
c2. Fijación externa:
Útil cuando hay defectos óseos, acortamientos o deformidades, y en pseudoartrosis infectadas (3,36).
Tratamiento de la pseudoartrosis
Teniendo claro los principios generales antes descritos recurrimos a la clasificación de Judet y Judet (3) la cual define dos tipos de pseudoartrosis y en función de ello tomar una decisión terapeútica adecuada.
1.- Pseudoartrosis hipertrófica:
El fondo fisiopatológico es de tipo mecánico debido a ello se debe asegurar una adecuada estabilidad de la fractura, siguiendo los principios ya expuestos.
2.- Pseudoartrosis atrófica:
La base del tratamiento radica en la eliminación del tejido fibroso y refrescamiento de los bordes de los extremos óseos; decorticar desde la altura de la fractura hasta llegar al hueso sano y colocar injertos de hueso esponjoso; todo ello asociado a una fijación adecuada.
En general podríamos quedarnos con la idea de Bosch y col quien señala que las pseudoartrosis biológicamente activas (hipertróficas) curan luego de un adecuado debridamiento y corrección de las deformidades con los medios adecuados y estabilización adecuada; mientras que en las biológicamente inactivas (atróficas) para restaurar la capacidad osteogénica se necesitan injertos de hueso adicionales (7), además de la resección del tejido cicatrizal que es esencial.
3.- Pseudoartrosis infectadas:
Su tratamiento se basa en la secuestrectomia, fijación de los fragmentos, tratamiento de la herida e injerto óseo (36); tratamiento antibiótico sistémico específico e incluso algunas veces con rosarios de metilmetacrilato impregnado con gentamicina (8). Una pregunta que surge es si se debe realizar este tratamiento en uno o dos tiempos. Strujis et al (30), realizó una revisión de la literatura sin llegar a una conclusión respecto a cual de los dos era mejor, sin embargo, el de dos etapas ofrecía mejores resultados globales.
No todos los tratamientos posibles son netamente quirúrgicos, existen otras técnicas no invasivas que se emplean como adyuvantes, como la estimulación electromagnética (3,8,9), uso de sustancias osteoinductoras (BMP-7, BMP-2) (8,9,37,31,33) y ultrasonido a baja intensidad (9,38,39,40,41), las cuales han demostrado efectos positivos pudiendo ser empleadas en las de tipo hipertrófica como atrófica.
Dimitriou et al (33), evaluaron una serie de 26 pseudoartrosis en distintos sitios anatómicos como la tibia, femur, rotula, clavicula, etc quienes presentaban 3,2 cirugías previas, en donde se utilizó el BMP-7; en 24 se logró la consolidación clínica en 4,2 meses de promedio y la radiológica en 5,6 meses en promedio. No hubo ninguna complicación ni evento adverso.
Alt et al (31), reportaron el caso de un paciente de 49 años con fractura de fémur bifocal en donde se produjo pseudoartrosis en ambos focos, se realizó cirugías previas con injerto autólogo y cambio de implante de osteosíntesis sin éxito y finalmente se utilizó BMP-2; con esta intervención se logró la consolidación en ambos focos, siendo a las 24 semanas en el cuello femoral y 30 semanas en la diáfisis femoral.
Estos estudios sugieren buenos resultados con estas sustancias pero no se deben considerar sustitutos de los injertos clásicos sino como alternativas y tener en mente que aun faltan más estudios para poder llegar a resultados concluyentes.
Se han planteado lineamientos generales que debemos conocer y aplicar sin olvidar el enfoque individualizado del paciente. A pesar de los múltiples estudios y avances en este campo en los últimos tiempos es necesario aún mayor investigación para determinar cuál es el mejor método que se pueda aplicar para un determinado tipo de pseudoartrosis.
REFERENCIAS BIBLIOGRÁFICAS
1. Escarpenter J. Factores de riesgo para la aparición de seudoartrosis en las fracturas diafisarias. Rev Cubana Ortop Traumatol 1996;9(1). URL disponible en: http://scielo.sld.cu scielo.php?script=sci_arttext&pid=S0864-215X1995000100018 &lng=es&nrm=iso. (Fecha de acceso: enero del 2007). [ Links ]
2. Schaweiberer L, Baumgart R, Deiler S. The biological reaction in atrophic and hypertrophic pseudarthrosis of diaphysis of long bone. Causes and forms of appaearance. Chirurg 1999; 70(11):1193-201. [ Links ]
3. Arrebola C. Pseudoartrosis y retardo de consolidación. URL disponible en http://www.ortoinfo.com. (Fecha de acceso: diciembre del 2007). [ Links ]
4. Niedziolka J. Intramedullary osteosynthesis for treatment of pseudarthrosis. Chir Narzadow Ruchu Ortop Pol 2000; 65(4): 427-30. [ Links ]
5. Fortune J, Paulos J, Liendo C. Manual de Ortopedia y Traumatología. Santiago de Chile: Facultad de Medicina, Pontificia Universidad Católica de Chile. URL disponible en: http://escuela.med.puc.cl/paginas/publicaciones/textotraumatologia/Trau_Portada.html. (fecha de acceso: enero del 2007). [ Links ]
6. Ruter A, Mayr E. Pseudarthrosis. Chirurg. 1999;70(11): 1239-45. [ Links ]
7. Bosch U, Skutek M, Kasperczyk WJ, Tscherne H. Nonunion of the humeral diaphysis- operative and nonoperative treatment. Chirurg. 1999;70(11): 1202-8. [ Links ]
8. Rodriguez-Merchan E, Forriol F. Nonunion: General Principles and Experimental Data. Clin Orthop 2004;419:4-12. [ Links ]
9. Clinton R, Mark B. The use of low-intensity ultrasound to accelerate the healing of fractures. J Bone Joint Surg Am 2001; 83:259. [ Links ]
10. Darder A, Gomar F. A series of tibial fractures treated conservatively. Injury 1975; 6: 225-35. [ Links ]
11. Dickson K, Katzman S,Delgado E, Contreras D. Delayed unions and nonunions of open tibial fractures: Correlation with arteriography results. Clin Orthop 1994; 302:189-93. [ Links ]
12. Alvarez R, Díaz F, Rigau PM, Barreda H, Cintas F. Tratamiento de la pseudoartrosis con el fijador externo del profesor Rodrigo Alvarez Cambras. Rev Cubana Ortop Traumatol 1987; 1(2):7-16. [ Links ]
13. Ceballos A, Zayas D, Pereda O, del Toro G, Ortega R. Inducción eléctrica en el tratamiento de la pseudoartrosis. Rev Cubana Ortop Traumatol 1989; 3(1-2):41-50. [ Links ]
14. Priolli JE, Zanetti OL, Dos Santos Pereira E, Okita T. Tratamento das pseudoartroses com o sistema de fixador externo Rodrigo Alvarez Cambras (RALCA). Rev Cubana Ortop Traumatol 1991; 5(1):7-26. [ Links ]
15. Alvarez R, López JR, Rodríguez MA. Fijación externa: revisión de 270 pacientes. Rev Cubana Ortop Traumatol 1991; 5(2):79-92. [ Links ]
16. Escarpanter JC, Ceballos A. resultados del tratamiento de la pseudoartrosis. Rev Cubana Ortop Traumatol 1993; 7(1-2):42-50. [ Links ]
17. Sarmiento A, Latta L. Uniones tardías y seudoartrosis de la tibia. En: Tratamiento funcional incruento de las fracturas. Buenos Aires: Editorial Médica Panamericana 1982. p.550-84. [ Links ]
18. Nepola J, Seabold J, Marsch L, Kirchner P, El-Khoury G. Diagnosis of infection in ununited fractures: combined imaging with indium111-labeled leukocytes and technetium99m methylene diphosphonate. J Bone Joint Surg 1993; 75A(12): 1816-22. [ Links ]
19.Gallinaro P. External fixation: mechanical and biological treatment for pseudoarthrosis of the long bones. J Bone Joint Surg 1993;75B:204. [ Links ]
20. Lemaire R. Unlocked reamed nailing for pseudoarthrosis of the tibia: retrospective study of 102 cases. J Bone Joint Surg 1993;75B:201. [ Links ]
21. Meskens M, Stuyck J, Feys H, Mulier J. Treatment of nonunion using pulsed electromagnetic fields: a retrospective follow-up study. Acta Orthop Belg 1990;(562):483-8. [ Links ]
22. Ruiz C, Pretell J. Pseudoartrosis diafisaria. Información personal no publicada. [ Links ]
23. Perez S, Escarpanter JC, Cevallos A. Diagnóstico morfológico funcional: Aplicación práctica en pseudoartrosis diafisarias. 1992. [ Links ]
24. Álvarez R, Ojeda M. Retardo de consolidación y seudoartrosis. En: Álvarez R, Ceballos A, Murgadas R. Tratado de cirugía ortopédica y traumatológica. La Habana: Pueblo y Educación, 1986;t 2:348-466. [ Links ]
25. Ramos J. Elementos de traumatología y ortopedia. Buenos Aires: Editorial ECTA, 1970:247-8. [ Links ]
26. Laurent DVM , Griffin D , Bhandari M. Path Analysis of Factors for Delayed Healing and nonunion in 416 Operatively treated tibial shaft fractures. Clin Orthop Relat Res 2005; 438: 221-232. [ Links ]
27. Berg R, Kugelmass I. Calcification in callus formation and fracture repair. Ann Surg 1931;93:1009-16. [ Links ]
28. Swenson O. Biomechanical changes in the fracture hematoma. J Bone Joint Surg 1946;28-A(5):278-93. [ Links ]
29. Wilson J. Fracturas y heridas articulares. En: Watson J. R: Fracturas y traumatismos articulares. La Habana: Editorial Científico-Técnica,1980;t1.p.21-47 [ Links ]
30. Strujis PA, Poolman RW , Bhandari M. Infected nonunion of the long bones. J Orthop Trauma.2007; 21(7):507-11. [ Links ]
31. Alt V, Meyer C, Litzlbauer HD, Schnettler R. Treatment of a double nonunion of the femur by rhBMP-2. J Orthop Trauma. 2007;21(10):734-7. [ Links ]
32. Hierholzer C, Sama D, Toro J. Plate fixation of ununited humeral shaft fractures: effect of type of bone graft on healing. Journal of Bone & Joint Surgery - American 2006; 88(7):1442-1447. [ Links ]
33. Dimitriou R, Dahabreh Z, Katsoulis E. Application of recombinant BMP-7 on persistent upper and lower limb non-unions. Injury. 2005 ;36 Suppl 4:S51-9. [ Links ]
34. Júpiter JB, von Deck M. Ununited humeral diaphyses. J Shoulder Elbow Surg 1998 ;7(6):644-53. [ Links ]
35. Ruiz C, Pretell J. Fracturas de tibia: Tratamiento con clavo intramedular no fresado (UTN). Experiencia en el Hospital Nacional Cayetano Heredia. Rev Med Hered 2004; 15:70-75. [ Links ]
36. Ekkernkamp A, Muhr G, Josten C. Infected Pseudarthrosis. Unfallchirurg. 1996; 99(12):914-24. [ Links ]
37. Morén P. Las proteínas óseas morfogenéticas son aplicables a la clínica. URL disponible en: www.médico.com. (Fecha de acceso: 07 de julio del 2007). [ Links ]
38. Duarte LR, Xavier CA, Choffie M, McCabe JM. Review of nonunions treated by pulsed low-intensity ultrasound. En: SICOT. Proceedings of the1996 Meeting of the Société Internationale de Chirurgie Orthopaedique et de Traumatologie. Amsterdam :SICOT; 1996. p 110.39. [ Links ]
39. Mayr E, Wagner S, Ecker M, Rüter A: Treatment of nonunions by means of low-intensity ultrasound. Unfallchirurg 1997;268: 958-62. [ Links ]
40. Vogel J, Rompe JD, Hopf C, Heine J, Burger R. High-energy extracorporeal shock-wave therapy (ESWT) in the treatment of pseudarthrosis. Z Orthop Ihre Grenzgeb. 1997;135(2):145-9. [ Links ]
41. Alvarez R, Rodríguez MI, García EM, Marrero LO, Vega M. Tratamiento de la pseudoartrosis de la tibia mediante ondas de choque por litotricia extracorpórea. Rev Cubana Ortop Traumatol 2004;18(2). URL disponible en: http://bvs.sld.cu/revistas/ort/vol18_2_04/ ortop08204.htm ( Fecha de acceso: Noviembre del 2007). [ Links ]
Correspondencia:
Juan Pretell Mazzini.
Correo electrónico: el_giova23@yahoo.com