Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión impresa ISSN 1018-130Xversión On-line ISSN 1729-214X
Rev Med Hered v.21 n.1 Lima ene. 2010
Repercusiones endocrinólogicas en el apnea obstructiva del sueño.
Endocrine impact of Obstructive sleep apnea.
Enrique Cipriani 1
1
Profesor Principal de Medicina. Facultad de Medicina Alberto Hurtado. Universidad Peruana Cayetano Heredia. Lima, Perú.
RESUMEN
Las alteraciones en la oxigenación que ocurren en el Sindrome Obstructivo del Apnea de sueño comprometen el funcionamiento tisular de todos los órganos del ser humano; con relación a la disfunción endocrinológica, los aspectos concernientes a esta no son bien conocidos. La intención de este trabajo fue revisar la información existente al respecto, a través de una búsqueda en las referencias MEDLINE entre los años 1995 y 2009.(Rev Med Hered 2010;21:39-45).
PALABRAS CLAVE: Disfunción endocrinológica, apnea obstructiva de sueño.
SUMMARY
The obstructive sleep apnea cause and intermmitent decreased oxigenation in all the organs, compromising the function of all of them; in relation with the endocrine dysfunction they are not well known. This review consists in a search of references in Medline, between 1995 and 2009.(Rev Med Hered 2010;21:39-45).
KEY WORDS: Endocrine dysfunction, obstructive sleep apnea.
INTRODUCCIÓN
El apnea obstructiva del sueño (SAOS) ocurre principalmente en individuos con obesidad y más aun en obesidad extrema; sin embargo hay personas que hacen este síndrome y no son obesos, y en su contraparte muchos obesos no tienen apnea del sueño, es decir, que existen otros factores que determinan la expresión de este cuadro clínico, entre ellos una predisposición de orden genético (1,2).
Wellman et al. (3) demuestran la importancia de la facilidad del colapso de la vía aérea durante el sueño en relación con la ventilación y los índices de apnea-hipopnea; además el apnea de sueño ocurre con un componente central único en muchas personas y mixto (central y periférico) particularmente en aquellas con insuficiencia cardiaca (4-6), donde la sobre - estimulación simpática juega un rol muy significativo (7-12).
La respiración anormal durante el sueño también esta caracterizada por fragmentación del sueño la cual a su vez contribuye a la alteración del funcionamiento del sistema nervioso simpático produciendo exceso de la producción de catecolaminas.
El sueño fragmentado así como la hipoxemia producen disfunción hipotalámica. El hipotálamo actúa como órgano intermediario de la información neural que recibe a través de conexiones anatómicas con otros centros cerebrales y las ordenes que trasmite a la hipófisis ("cerebro endocrinológico") a través de "factores" u hormonas liberadoras de los ejes que controla en última instancia esta glándula; así como remite información a centros cerebrales superiores (sistema límbico). Muchas de las manifestaciones endocrinológicas de este síndrome se dan por disfunción hipotalámica, tema que constituye el motivo de esta revisión (13,14).
Síndrome apnea obstructiva de sueño en relación con obesidad
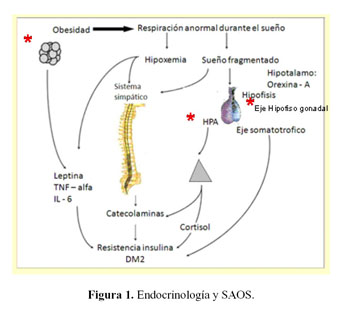
En la obesidad se genera un exceso en la producción de leptina además de factores proinflamatarios como el factor de necrosis tumoral alfa y la interleukina 6, estos factores participan en la resistencia a la insulina la cual en última instancia puede condicionar la presentación de la diabetes mellitus tipo 2 (Figura 1).
La obesidad además condiciona una respiración anormal durante el sueño, dada la disminución en la capacidad vital en el estado de decúbito; también contribuye la acumulación de grasa en la vía respiratoria alta. Esta respiración anormal durante el sueño condiciona disminución de la oxigenación (4,15), generando la estimulación del sistema nervioso simpático (16,17), el que a través de sus terminales periféricos en todo el cuerpo libera norepinefrina (alfa adrenérgico) que pasa a la sangre condicionando también resistencia a la insulina y disminuyendo su secreción pancreática. Asimismo el exceso de norepinefrina genera o puede generar hipertensión arterial a veces muy severa como veremos luego, además de arritmias cardiacas.
La disfunción hipotálamo-hipofiso-adrenal en relación con obesidad (señalada con asterisco en la figura 1) (15), parece deberse principalmente al exceso de grasa abdominal más que al apnea obstructiva del sueño en sí.
En el eje hipofiso gonadal en varones ocurre un fenómeno semejante; pues si no se toma en consideración el exceso de peso; pareciera que estas personas tuvieran un compromiso secundario a la hipoxemia, pero al corregir las cifras por el exceso de peso, la evidencia se inclina a que este último es el que condiciona las alteraciones del eje hipofiso gonadal. Por otro lado en el hipotálamo también se generan los factores liberador e inhibidor de la secreción de hormona de crecimiento y este eje también esta alterado (14).
Otro factor que parece ser importante en este síndrome es la producción de un neuropéptido en el hipotálamo: la orexina-A, cuya secreción está alterada y parece condicionar parte de la disminución de la ventilación en estos sujetos (7).
Síndrome apnea obstructiva de sueño y leptina
La leptina es una adipoquina producida por los adipocitos en relación directa con la cantidad de grasa corporal, en particular la grasa subcutánea abdominal; en condiciones normales actúa como regulador del apetito. En la obesidad existe una resistencia central a la acción de la leptina; los pacientes obesos con niveles plasmáticos mayores a los normales no controlan el apetito (8).
Ratones deficientes en leptina tienen un patrón de ventilación semejante al de los pacientes obesos con síndrome de hipoventilacion, estos animales corrigen su anormalidad ventilatoria con la administración de esta proteína (9).
En humanos con hipoventilación y obesidad los niveles de leptina séricos predicen mejor los grados de hipercapnea durante la vigilia que el índice de masa corporal (10).
En pacientes con apnea obstructiva del sueño sin hipoventilación los niveles de leptina son mayores que en sujetos con obesidad y estos valores disminuyen con el tratamiento de presión positiva continua (CPAP) (11). Es decir que la resistencia central a la leptina se corrige cuando se corrige el trastorno ventilatorio.
En pacientes obesos con SAOS y con hipoventilacion el uso de CPAP redujo significativamente los niveles de leptina así como la retención de CO2; sugiriendo que la mejor oxigenación y la reducción del pCO2 conllevan una mejor función hipotalámica reduciendo la resistencia central a la leptina (12).
Síndrome apnea obstructiva de sueño e inflamación
Las citoquinas inflamatorias se encuentran elevadas uniformemente en la sangre de los individuos con obesidad; se ha establecido una relación entre estos factores inflamatorios en la sangre con los niveles de leptina sérica al estar ambos elevados en la obesidad.
Las citoquinas inflamatorias en el aire expirado en pacientes con SAOS se encuentran elevadas; tanto el 8-isoprostane que mide el stress oxidativo, la interleukina 6 y el factor de necrosis tumoral alfa; pero esta elevación no guarda relación con los niveles de leptina sérica y tampoco se encontraron diferencias entre pacientes fumadores y no fumadores (18); es decir que a nivel del árbol respiratorio habrían otros mecanismos que condicionan la elevación de estos agentes inflamatorios.
Síndrome apnea obstructiva de sueño y Orexina-A
La orexina-A es un neuropeptido hipotalámico que posee acciones estimulantes sobre el apetito y el estado de alerta, y su concentración plasmática esta disminuida en paralelo con los siguientes factores: El índice de alerta, el índice de apnea-hipopnea y la escala de somnolencia de Epworth (19).
La terapia con CPAP no solo mejora la hipoxemia nocturna sino también disminuye la somnolencia diurna que condiciona defectos cognitivos como la ejecución de tareas, tales como la conducción de autos o problemas de aprendizaje. La orexina-A esta disminuida solo en pacientes con SAOS severos y esos niveles tienden a corregirse con la terapia de CPAP (19).
Síndrome apnea obstructiva y Ghrelina
La ghrelina es una hormona polipeptídica de origen gastro-intestinal que parece tener un efecto estimulante sobre el apetito, es decir lo contrario de la leptina; además tiene acción estimulante sobre la secreción de la hormona del crecimiento.
Existen resultados que discrepan en los niveles de esta hormona en SAOS y su variación con la terapia CPAP; algunos afirman no hallar diferencias en los niveles de esta hormona entre sujetos normales y pacientes con SAOS (20), en tanto otros (21) describen niveles elevados de esta hormona en SAOS con tendencia a la normalización con el uso de CPAP. Estos últimos estudiaron una población de pacientes cuya apnea del sueño era más severa que la evaluada por los investigadores citados en primera instancia. Por el momento la interpretación de los resultados referentes a ghrelina son especulativos y merecen mayor investigación.
Síndrome apnea obstructiva de sueño y Eje Hipotalamo-Hipófiso-Adrenal (HPA)
El estudio del eje hipotalamo-hipofiso-adrenal en SAOS ha dado lugar a hallazgos discrepantes pues los pacientes estudiados parecen no ser comparables. Se han incluido pacientes sin excluir de manera explícita aquellos con depresión que altera la actividad del eje HPA (22).
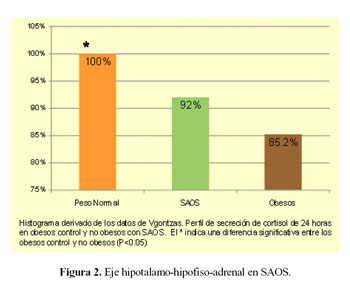
En un trabajo reciente Vgontzas et al (13) tuvieron el cuidado de excluir a los pacientes con depresión. En sus resultados se destacan los siguientes hallazgos (Figura 2):
a) Los niveles de cortisol plasmático a través de muestreo cada 30 minutos durante 24 horas fueron menores en sujetos obesos que en individuos con peso normal.
b) Los pacientes con SAOS tuvieron niveles de cortisol plasmático mayores que los obesos sin SAOS; la diferencia se hizo más notoria durante la noche.
c) La respuesta de ACTH al Factor liberador de ACTH (CRH) es mayor en sujetos obesos con o sin SAOS en relación con sujetos de peso normal.
d) En respuesta a la terapia con CPAP durante tres meses, los niveles de cortisol plasmático se reducen en los pacientes con SAOS y se acercan a los niveles observados en los pacientes solo con obesidad.
El CRH, factor liberador de ACTH tiene una acción estimulante de la respiración potente; los resultados mostrados anteriormente sugieren que la producción de CRH esta disminuida en estos pacientes y que podría jugar un rol mediador en la génesis del SAOS.
Estudiando el eje hipotalamo -hipofiso-adrenal en SAOS con determinaciones de cortisol salival, se ha observado que este no se eleva sobre lo normal en el periodo diurno (23). El cortisol plasmático total tampoco se incrementó en pacientes con SAOS en relación con normales; y no hubo diferencias significativas entre los pacientes con o sin SAOS.
Los pacientes varones obesos tienen niveles disminuidos de cortisol salival y de cortisol plasmático total particularmente en los horarios del nadir y pico del ritmo circadiano.Los niveles de cortisol parecen depender del exceso de grasa visceral más que de la grasa total o subcutánea (23).
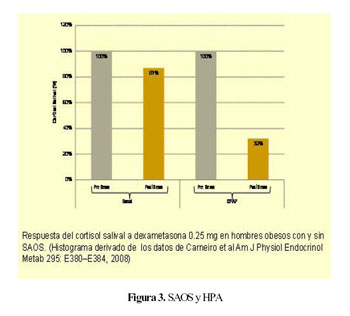
Carneiro y colaboradores recientemente documentan que hay una menor supresión del cortisol con dexametasona en pacientes obesos con SAOS en comparación con pacientes obesos sin SAOS (24), incluso después de corregirlo para el índice de masa corporal (Figura 3); es decir que los pacientes con SAOS tienen una suerte de resistencia a la supresión con dexametasona.
La terapia con CPAP durante 3 meses logra una tendencia significativa para la supresión del cortisol salival con dexametasona, así como también pasa una mayor supresión del cortisol plasmático después de dexametasona (Figura 3). Existe pues una correlación significativa entre la supresión de los niveles de cortisol con dexametasona y la mejoría en el índice de apnea hipopnea; cuanto menos alteración del sueño tienen los pacientes después de la terapéutica con CPAP, mas suprimen sus cifras de cortisol con dexametasona (24).
Síndrome apnea obstructiva de sueño y testosterona
Los trastornos de sueño son mas frecuentes y graves con el envejecimiento, particularmente en los varones (25-27).
Barrett-Connor et al (28) hicieron un estudio longitudinal de 1312 varones durante tres años, los que fueron divididos en cuartiles de acuerdo con los niveles de testosterona total y de testosterona biológicamente activa; tenían un promedio de edad de 72 años. Se les estudió la calidad del sueño en su domicilio para evitar el factor hospitalario como interferencia, y además se hicieron otras medidas como el índice de masa corporal y otras características antropométricas. Encontraron que existía una relación entre niveles bajos de testosterona y mala calidad del sueño, pero al re-evaluar los resultados considerando los índices de masa corporal; solo quedaron como significativos los resultados de los sujetos con índice de masa corporal más elevados.
No fue posible para los autores precisar si el problema respiratorio ocurría primariamente por el sobrepeso o por los niveles de testosterona. Al ajustar estos valores para considerar los índices de masa corporal, los resultados prácticamente perdieron significado estadístico y aun los individuos con mayor peso no mantenían esta diferencia en calidad de sueño en relación con los niveles bajos de testosterona.
Síndrome apnea obstructiva de sueño y Eje hipofiso-somatotrófico
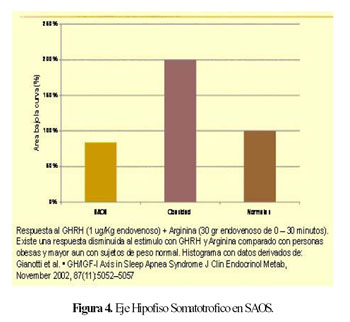
Existe una disminución de la respuesta al estimulo con el factor liberador de hormona de crecimiento y arginina en relación con personas obesas y mayor diferencia aun en los controles de peso normal (14) (Figura 4).
La diferencia es notoria en los niveles basales de estos factores; hormona de crecimiento e IGF-1 son mucho mayores en sujetos con peso normal en relación con los obesos y los obesos en relación con los pacientes con SAOS.
Luego de la estimulación con GHRH (Hormona liberadora de hormona de crecimiento) y arginina los sujetos normales responden de una manera notoriamente mayor que los sujetos con obesidad y estos a su vez tienen una respuesta mayor que los pacientes con SAOS (Figura 4) (14).
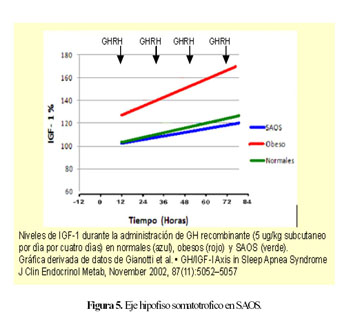
Al estudiar los niveles de IGF-1 y su respuesta al estímulo con pequeñas dosis de hormona de crecimiento recombinante, observaron que los pacientes con SAOS prácticamente no respondieron, mientras que los obesos y los pacientes con peso normal respondieron de manera significativa (Figura 5). La terapia con CPAP corrige las alteraciones en la secreción de hormona del crecimiento.
Síndrome apnea obstructiva de sueño y Catecolaminas
El SAOS puede producir descarga adrenérgica severa (16,17) y dar manifestaciones clínicas de crisis de hipertensión arterial difíciles de controlar y con cifras de catecolaminas urinarias en el rango de las halladas en tumores de la medula suprarrenal. Hoy y colaboradores (29) reportan que SAOS puede producir un cuadro clínico al cual califican como seudo-feocromocitoma (Tabla 1). Los pacientes que ellos describen tienen hipertensión arterial severa, marcada elevación de la excreción urinaria de noradrenalina; esta es producida por todos los terminales del sistema nervioso simpatico además de las glándulas suprarrenales; en tanto que la adrenalina solo es producida por las suprarrenales. En los casos reportados todas las cifras urinarias de adrenalina eran normales. En los pacientes descritos la terapia con CPAP normalizó la excreción urinaria de catecolaminas y la hipertensión arterial que era difícil o imposible de manejar se hizo controlable.
CONCLUSIONES
El SAOS tiene muchos correlatos con disfunción endocrinológica. La relación causa efecto entre ellos es difícil de establecer por su asociación con varias entidades de origen multifactorial. Entre estas: depresión, insuficiencia cardiaca, hipertensión arterial, síndrome metabólico y por último la obesidad con la que tiene un parentesco genético cercano.
La disfunción hipotalámica en SAOS con alteraciones en la función de los péptidos leptina, orexina y CRH abren el camino para desarrollar una corrección farmacológica de esta entidad.
REFERENCIAS BIBLIOGRÁFICAS
1.Redline S, Tishler PV, Tosteson TD, et al. The familial aggregation of obstructive steep apnea. Am J Respir Crit Care Med 1995; 151: 682-687. [ Links ]
2.Patel SR. Shared genetic risk factors for obstructive sleep apnea and obesity. J Appl Physiol 2005: 99: 1600-1606. [ Links ]
3.Wellman A, Jordan A, Malhotra A, et al . Ventilatory control and airway anatomy in obstructive sleep apnea. Am J Respir Crit Care Med 2004;170: 1225-1232. [ Links ]
4.Spaak J, Egui ZJ, Kumbo T, et al. Muscle sympathetic nerve activity during wakefulness in heart failure patients with and without sleeps apnea. Hypertension 2005; 46: 1327-1332. [ Links ]
5.Javaheri S. Treatment of obstructive and central sleep apnea in heart failure: Practical options. Eur Resp Rev 2007; 16:183-188. [ Links ]
6.Amit-Benjamin J, Lewis KE. Sleep disordered breathing and cardiovascular disease. Postgrad Med J 2008; 84: 15-22. [ Links ]
7.Phillar Y, Shehadeh N. Abdominal fat and sleep apnea. The Chicken or the Egg?. Diabetes Care 2008; 31: 5303-5309. [ Links ]
8.Considine RV, Sinha MK, Heiman ML, et al. Serum Immunoreactive-Leptin concentrations in normal-weight and obese humans. N Engl J Med 1996; 334:292-295. [ Links ]
9.ODonnell CP, Schaub CD, Haimes AS, et al. Leptin Prevents Respiratory Depression in Obesity. Am J Respir Crit Care Med1999; 159: 1477-1488. [ Links ]
10.Phipps PR, Starritt E, Caterson I, et al. Association of serum leptin and hypoventilation in human obesity. Thorax 2002: 57(1):75-76. [ Links ]
11.Chin K,Shimizu K, Nakamura T, et al. Changes in intra-abdominal visceral fat and serum leptin levels in patients with obstructive sleep apnea syndrome following nasal continuous positive airway pressure therapy. Circulation 1999; 100:706-712. [ Links ]
12.Yee BJ, Cheung J, Phipps P, et al. Treatment of obesity hypoventilation syndrome and serum leptin. Respiration 2006;73(2):209-12. [ Links ]
13.Vgontzas AN, Pejovic S, Zoumakis E, et al. Hypothalamic-pituitary-adrenal axis activity in obese men with and without sleep apnea: effects of continuous positive airway pressure therapy. J Clin Endocrinol Metab 2007;92:4199-207. [ Links ]
14.Gianotti L, Pivetti S, Lanfranco F. Concomitant impairment of growth hormone secretion and peripheral sensitivity in obese patients with obstructive sleep apnea syndrome. J Clin Endocrinol Metab 2002;87:5052-5057. [ Links ]
15.Punjabi NM, Polotsky V. Disorders of glucose metabolism in sleep apnea. J Appl Physiol 2005; 99: 1998- 2007. [ Links ]
16.Imadojemu VA, Mawji Z. Sympathetic chemoreflex responses in obstructive sleep apnea and effects of continuous positive airway pressure therapy. Chest 2007; 131(5): 1406-13. [ Links ]
17.Narkiewicz K, Somers VK. Sympathetic never activity in obstructive sleep apnoea. Acta Physiol Scand 2003; 117(3): 385-90. [ Links ]
18.Antonopoulou S, Loukides S, Papatheodorou G, Roussos C, Alchanatis M. Airway inflammation in obstructive sleep apnea: is leptin the missing link?. Respir Med 2008; 102:1399-405. [ Links ]
19.Sakurai S, Nishijima T, Takahashi S, et al Low plasma orexin-A levels were improved by continuous positive airway pressure treatment in patients with severe obstructive sleep apnea- hypopnea syndrome. Chest 2005; 127:731-737. [ Links ]
20.Ulukavak T, Kokturk O, Bukan N, et al. Leptin and ghrelin levels in patients with obstructive sleep apnea syndrome. Respiration 2005; 72: 395-401. [ Links ]
21.Harsch IA, Konturek PC, Koebnick C, et al. Leptin and ghrelin levels in patients with obstructive sleep apnoea: effect of CPAP treatment. Eur Respir J 2003; 22:251-257. [ Links ]
22.Wong ML, Kling MA, Munson PJ, et al. Pronounced and sustained central hypernoradrenergic function in major depression with melancholic features: relation to hypercortisolism and corticotropin-releasing hormone. Proc Natl Acad Sci USA 2000; 97: 325-330. [ Links ]
23.Dadoun F, Darmon P, Achard J, et al. Effect of sleep apnea syndrome on the circadian profile of cortisol in obese men. Am J Psysiol Endocrinol Metab 2007;293: E466-E474. [ Links ]
24.Carneiro G, Togeiro M, Hayashi LF, et al. Effect of continuous positive airway pressure therapy on hypothalamic-pituitary-adrenal axis function and 24-h blood pressure profile in obese men with obstructive sleep apnea syndrome. Am J Physiol Endocrinol Metab 2008;295: E380-E384[ [ Links ]STANDARDIZEDENDPARAG]
25.Bailes S, Baltzan M, Alapin I, et al. Diagnostic indicators of sleep apnea in older women and men: a prospective study. J Psychosom Res 2005; 59(6): 365-73. [ Links ]
26.Wolkove N, Elkholy O. Slepp and againg: Sleep disorders commonly found in older people. CMAJ 2007; 176(9): 1299-304. [ Links ]
27.Fetveit A. Late-life insomnia: a review. Geriatr Gerontol Int 2009; 9(3): 220-34. [ Links ]
28.Barrett-Connor E, Dam T, Stone K, et al. The association of testosterone levels with overall sleep quality, sleep architecture, and sleep-disordered breathing. J Clin Endocrinol Metab 2008; 93: 2602-2609. [ Links ]
29.Hoy LJ, Emery M, Wedzocha JA. Obstructive sleep apnea presenting as pseudopheochromocytoma: A case report. J Clin Endocrinol Metab 2004;89:2033-8. [ Links ]