Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión impresa ISSN 1018-130Xversión On-line ISSN 1729-214X
Rev Med Hered v.21 n.2 Lima abr./jun. 2010
Cardiomiopatía periparto temprana complicada con accidente cerebrovascular cardioembólico: A propósito de un caso
.
Early peripartum cardiomyopathy complicated by cardioembolic stroke: A case report.
Germán Málaga1, José Quintana2, David Posadas2 , Jorge Quispe2, Aida Rotta3.
1
Médico Internista Asistente del Hospital Nacional Cayetano Heredia. Profesor Asociado de la Facultad de Medicina Alberto Hurtado, Universidad Peruana Cayetano Heredia. Lima, Perú.2
Alumno Universidad Peruana Cayetano Heredia. Lima, Perú.3
Medico Cardiólogo, asistente Hospital Nacional Cayetano Heredia. Profesora Auxiliar de la Facultad de Medicina Alberto Hurtado, Universidad Peruana Cayetano Heredia. Lima, Perú.
RESUMEN
Presentamos el caso de una paciente con cardiomiopatía periparto quien súbitamente presentó hemiplejia flácida, producido por un accidente cerebrovascular de origen cardioembólico con transformación hemorrágica en la evolución. El diagnóstico fue clínico, ecocardiográfico y tomográfico. La evolución del cuadro neurológico fue favorable, con recuperación parcial de la funcionalidad. Se presenta este caso debido a la presentación atípica de una nosología infrecuente: "la cardiomiopatía periparto", cuyas complicaciones suscitaron controversias en el manejo terapéutico.(Rev Med Hered 2010;21:97-102).
PALABRAS CLAVE: Cardiomiopatía periparto temprana, ACV cardioembólico, anticoagulación.
SUMMARY
We report a case of a patient with peripartum cardiomyopathy, who suddenly suffered left hemiplejia. The neurological status was the result of Cardioembolic Stroke which transformed from ischemic to hemorrhagic in evolution. The diagnosis was based on the clinical, echocardiographical and tomographical findings. The evolution of the neurological status improved, nevertheless the cardiac and neurologic disease recovery almost completely. We present this case due the atypical presentation of peripartum cardiomyopathy in this patient, and the neurological complication that generated controversies in its management.(Rev Med Hered 2010;21:97-102).
KEY WORDS: Early peripartum cardiomyopathy, cardioembolic stroke, anticoagulation.
INTRODUCCIÓN
La cardiomiopatía periparto (CMPP) es una causa poco frecuente de insuficiencia cardiaca que ocurre en el periodo periparto. La prevalencia es variable geográficamente, con reportes tan altos como de 1 en 100 casos en Zaria Nigeria o 1 en 300 partos en Haití a otras tan infrecuentes como de 1 en 15000 partos en Estados Unidos(1,2). Fue descrita en 1849 por Richie (3) y su etiología es aún desconocida (4), sin embargo, ha sido relacionada con algunos factores como la presencia de citoquinas inflamatorias (TNF-a e IL-6, asi como niveles elevados de Proteína C Reactiva) han sido asociadas a mayores dimensiones ventriculares. Miocarditis ha sido hallada en estudios realizados con biopsia endomiocárdica en frecuencias tan altas como de 78%. Respuesta inmune anormal en el embarazo (respuesta inmunológica materna anormal a algún antígeno fetal, llamada también quimerismo).
Asociaciones familiares han sido también descritas. Infecciones virales cardio-trópicas: parvovirus B-19, herpes virus 6 virus, Ebstein Baar y citomegalovirus, fueron hallados en biopsias de endomiocardio. En algunos estudios se ha podido hacer la asociación entre mejora de la fracción de eyección cuando ocurre el aclaramiento del cuadro viral y se ha visto que la apoptosis de miocitos tienen un papel por determinar en CMPP, esta se asocia a proteínas Fas y Fas ligando de membrana, cuya presencia han sido asociadas a mal pronóstico funcional y de sobrevida en estudios longitudinales (5). Entre los factores de riesgo asociados se han descrito multiparidad, edad materna avanzada, embarazo multifetal, preclampsia, hipertensión gestacional y raza negra.
El motivo del reporte está fundamentado en que la CMPP es una entidad clínica infrecuente, de etiología aun no aclarada y a que nuestra paciente tuvo un curso inusual.
Caso clínico
Mujer de 40 años, natural y procedente de Lima, secundigesta de 29 ½ semanas. Ingresó al hospital por presentar disnea progresiva hasta la ortopnea, disnea paroxística nocturna y esputo con rasgos hemoptoicos de una semana de evolución. La primera gestación fue 9 años antes, culminó en parto eutócico, aparentemente sin complicaciones.
Al examen se evidenció una presión arterial en 140/95 mmHg, siendo enfocada como portadora de hipertensión inducida por gestación. La proteinuria en 24 horas fue 456 mg/dL y el recuento plaquetario, pruebas de función hepática y deshidrogenasa láctica fueron normales.
Debido al cuadro clínico de la paciente y por el riesgo de parto prematuro se indicó betametasona para la maduración pulmonar. Fue evaluada por el servicio de cardiología para valorar la severidad de la insuficiencia cardiaca. La ecocardiografia mostró dilatación cardiaca global, dilatación del ventrículo izquierdo (60,4 mm), de la aurícula izquierda (50 mm), fracción de eyección calculada de 23% y presencia de regurgitaciones mitral y tricuspídea severas. Con estos hallazgos se confirmó el diagnóstico de Insuficiencia Cardiaca clase funcional III (NYHA) y se inició terapia con dobutamina (dosis titulable), furosemida 40 mg/d, nitroglicerina 50 mg/d y lanatósido C 0,40 mg. Otros medicamentos que se incluyeron en la terapia fueron gluconato de calcio, alfa- metil dopa, heparina 5000 UI y ranitidina.
Al día siguiente, ante la eminente falla ventilatoria, ingresó a la unidad de cuidados intensivos continuando con el manejo inotrópico y ventilación mecánica no invasiva.
Un día después, se evidenció ausencia de latidos fetales, siendo corroborado con ultrasonografía doppler. Por ello se dio término a la gestación.
Continuó en UCI con ventilación mecánica y se añadió a la terapia, captopril 25mg c/8h, espironolactona 25 mg c/d y amlodipino 10 mg c/d. Una vez estabilizada se indicó carvedilol 6,25mg/12h (dosis titulable), enoxaparina 40 mg c/d y warfarina 5 mg c/d. La dobutamina se retiró al 6to día. La evolución fue favorable, a los ocho días del ingreso, se procedió al destete del ventilador mecánico y suspendió la enoxaparina continuando con warfarina. La paciente estuvo hospitalizada durante 16 días, siendo la evolución extrahospitalaria inicialmente estacionaria con el mismo régimen terapéutico.
Tres meses después, en su control ambulatorio refirió hemoptisis, lo que motivó, la suspensión de la anticoagulación. Siete días después, presentó movimientos involuntarios en hemicuerpo izquierdo con pérdida del tono postural y de la conciencia; recuperandola a los 30 minutos pero notando falta motilidad del mismo hemicuerpo. Este cuadro se repitió en otras cuatro oportunidades siendo llevada al Servicio de Emergencia del hospital.
En el examen de ingreso, la presión arterial fue 100/60 mmHg, frecuencia cardiaca 65 latidos/minuto, regular y rítmica, frecuencia respiratoria 20 respiraciones/minuto y temperatura axilar 36,8º C. La paciente lucía en mal estado general, orientada en tiempo, espacio y persona, moderadamente pálida y con leve ictericia, ingurgitación yugular y reflujo hepato-yugular positivos, crépitos en el tercio inferior de ambos campos pulmonares, ruidos cardiacos rítmicos, de intensidad conservada, presencia de tercer ruido y de un soplo holosistólico II/VI en foco mitral. El span hepático fue 11 cm, con el borde hepático agudo a 2 cm debajo del reborde costal doloroso, de consistencia blanda y bordes regulares. En extremidades inferiores, edema +/+++.
El examen neurológico, mostro a una paciente consciente y orientada, Glasgow 14/15, con funciones cognitivas conservadas (MINIMENTAL 35/35), hemiplejia izquierda directa, fuerza muscular distal como proximal de 1/5 en extremidades derechas, reflejos osteotendinosos 3/4 en el lado izquierdo y 2/4 en el lado derecho y reflejo de Babinski en el lado izquierdo. La sensibilidad, pares craneales y la función cerebelar estaban conservadas. No había signos de frontalización. En cuanto al ánimo, estaba decaída y el afecto se caracterizó por labilidad emocional.
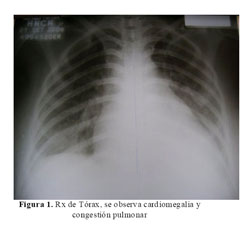
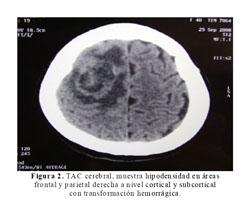
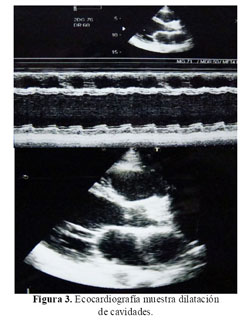
La Rx del tórax mostró cardiomegalia masiva y congestión pulmonar (Figura 1). En la tomografía cerebral se evidenció una hipodensidad en áreas frontales y parietales derechas a nivel cortical y subcortical con transformación hemorrágica (Figura 2). La ecocardiografia era muy similar a la previa, con dilatación e hipocinesia global y fracción de eyección de 25% (Figura 3).
En la evolución presentó neumonía nosocomial, requiriendo ventilación no invasiva en la UCI. Se le indicó antibióticoterapia de amplio espectro, lográndose la resolución completa de la neumonía. La evolución neurológica de la paciente con terapia física, fue satisfactoria, recuperando la marcha en forma autónoma. No se identificó ninguna causa diferente a la insuficiencia cardiaca como causante de hemoptisis, por lo que se reinició anticoagulación y fue dada de alta en buen estado.
A los seis meses de los sucesos relatados la paciente cursaba con mejoría casi completa del déficit neurológico referido y desde el punto de vista cardiaco, su clase funcional le permitía realizar sus actividades de la vida diaria con total autonomía.
DISCUSIÓN
En nuestro medio no hay descripciones recientes de CMPP, la más reciente fue en 1976 en una tesis doctoral (6) en la que fueron descritos 6 casos en un lapso de 7 años. Además, en la búsqueda bibliográfica realizada no encontramos correlación entre cardiomiopatía periparto y accidente cerebro vascular a pesar que la cardiomiopatía per se, constituye un factor de riesgo establecido para ACV embolico (4,5).
Para el diagnóstico de CMPP se deben cumplir los siguientes criterios (7): 1) Desarrollo de falla cardiaca en el último mes de gestación o en los últimos 5 meses posteriores al parto; 2) ausencia de causa identificable de la insuficiencia cardiaca; 3) ausencia de insuficiencia cardiaca reconocible de base hasta el último mes del embarazo; y 4) criterios eco-cardiográficos: fracción de eyección menor de 45%, fracción de acortamiento menor de 30%, diámetro ventricular izquierdo telediastólico mayor de 2,7 cm.
La paciente empezó con los síntomas de insuficiencia cardiaca a las 28 semanas de gestación progresando de manera rápida a clase funcional III (NYHA) en la semana siguiente. La paciente presentaba tres de estos cuatro criterios, además de criterios clínicos, radiográficos y ecocardiográficos definidos y sólidos de insuficiencia cardiaca, sin historia previa ni otra causa identificable de enfermedad cardiaca. Por todo lo expuesto, la paciente fue catalogada portadora de "cardiomiopatía periparto de presentación temprana". Elkayam et al (8) reportó el inicio de la enfermedad a una edad gestacional promedio de 37,7±3,5 semanas (24–42 semanas), y otro grupo de presentación temprana con un promedio de 32,4±6,2 semanas (20–42 semanas).
Han sido descrito como factores de riesgo asociados a CMPP la edad mayor de 30 años, multiparidad, embarazo múltiple, uso de tocolíticos, cesárea e historia familiar de cardiomiopatía, hipertensión inducida por el embarazo y preeclampsia (9,10). Excepto por la edad materna avanzada (39 años) y la preecalmpsia, nuestra paciente no presentaba alguno de los otros factores de riesgo descritos, pues cursaba su segunda gestación única, no tenía historia familiar, no había recibido
medicación descrita de riesgo, ni era de origen africano.
En el caso, la paciente sufrió el accidente cerebro vascular (ACV) a las 12 semanas después del parto. El ACV clínicamente comprometía todo el hemicuerpo izquierdo con un plejia densa y de inicio súbito (Figura 2). La incidencia descrita de ACV en mujeres no gestantes de 15 a 44 años es de 10,7 por 100 000 mujeres (11), mientras la incidencia en el embarazo es de 4,3–210 por 100 000 partos (12). Por el tiempo descrito desde el inicio de la enfermedad actual, se alejarían causas como trombosis venosa cerebral y angiopatía cerebral postparto (11). Debemos tener en cuenta que nuestra paciente desarrolló el ACV pasado el tiempo establecido para el puerperio inclusive.
El tromboembolismo es la principal causa de muerte en pacientes con CMPP. La dilatación ventricular izquierda que ocurre en esta patología y hallada en nuestra paciente, claramente constituía un factor de riesgo de trombos intracavitarios y un factor de riesgo de ACV cardioembólico (13,14). Se reporta una mortalidad de 30 a 50% cuando ocurre un evento cardioembólico (15), Dyker y Biller (16)reportan cinco pacientes que desarrollaron CMPP de las cuales una paciente desarrollo ACV asociada a un trombo del ventrículo izquierdo. La paciente presentó alteración en el ritmo cardiaco, por lo que la CMPP con cadiomiopatia dilatada fue la causa más probable del ACV, a pesar de no haber sido demostrada la presencia de trombo en el ventrículo izquierdo, su gran dilatación la hacía proclive a esta complicación.
Se han reportado también, complicaciones obstétricas como muerte fetal (8), complicación que desafortunadamente también presentó nuestra paciente.
El tratamiento de la CMPP es similar al de otros tipos de insuficiencia cardiaca, pero cuando el manejo médico no controla la disfunción ventricular izquierda se recomienda el uso de inotrópicos y si la insuficiencia cardiaca es refractaria, incluso se pueden utilizar dispositivos de soporte ventricular y trasplante cardiaco (17). Debe tenerse en cuenta que los inhibidores de la enzima convertidora están contraindicados en la gestación, cuidado que se tuvo en la paciente. En cuanto a la terapia inotrópica se prefiere a la digoxina; la dobutamina es droga como de segunda línea (17,18) pero el grado de recomendación es sustentado por "recomendación de expertos" únicamente. En nuestra paciente se utilizó dobutamina, con resultados favorables.
El reconocido estado procoagulante del embarazo (por incremento de factores VII, VIII, X, fibrinógeno y aumento de la adhesividad plaquetaria) sumada a la estasis sanguínea debido a la disfunción y dilatación ventricular izquierda en la CMPP aumenta el riesgo de trombosis, incluso mayor que en la cardiomiopatía dilatada idiopática. Se recomienda el uso de anticoagulantes si la fracción de eyección es menor de 30%. Se usa heparina durante a gestación y anticoagulantes orales hasta el término del periodo de puerperio (19). Es necesario recordar que nuestra paciente desarrolló el evento cardio-embólico después del periodo recomendado.
La historia natural de la enfermedad es variable y el espectro amplio, pudiendo cursar con recuperación espontánea y completa, hasta refractaria a cualquier forma de tratamiento médico con mortalidad superior al 50% dentro de los 3 meses del periodo postparto. Las causas de muerte principales son: fenómenos tromboembólicos, arritmias e insuficiencia cardiaca refractaria. Las tasas de supervivencia son similares a los trasplantes realizados en pacientes miocardiopatía dilatada idiopática, pero la tasa de rechazo es mayor debido a los altos títulos de anticuerpos (9,10,20,21).
Entre los predictores de mal pronóstico, se describen: Fracción de eyección menor a 45% a los dos meses, edad mayor a 35 años y un diámetro ventricular telediastólico mayor a 5,6 cm, siendo este último el de mayor importancia. A pesar de contar nuestra paciente con la mayoría de estos predictores de mal pronóstico, la paciente presentó una evolución favorable.
REFERENCIAS BIBLIOGRÁFICAS
1. Cunningham FG, Pritchard JA, Hankins GD, et al. Peripartum heart failure: Idiopathic cardiomyopathy or compounding cardiovascular events?. Obstet Gynecol 1986; 67:157. [ Links ]
2. Fett JD, Christie LG, Carraway RD, Murphy JG. Five-year prospective study of the incidence and prognosis of peripartum cardiomyopathy at a single institution. Mayo Clin Proc 2005; 80:1602. [ Links ]
3. Richie C. Clinical contribution to the pathology, diagnosis and treatment of certain chronic diseases of the heart. Edinb Med Surg J 1849; 2:333. [ Links ]
4. Sliwa K, Fett J, Elkayam U. Peripartum cardiomyopathy. Lancet 2006; 368:687. [ Links ]
5. Ramajaj R, Sorrel V. Peripartum cardiomyopathy: Causes, diagnosis, and treatment. Cleve Clin J Med 2009;76 (5):272. [ Links ]
6. Pajares A. Miocardiopatia puerperal o peripartum. Tesis Doctoral. Lima, Peru. Universidad Peruana Cayetano Heredia, 1976. [ Links ]
7. Sliwa K, Skudicky D, Bergemann A, et al. Peripartum cardiomyopathy: analysis of clinical outcome, left ventricular function, plasma levels of cytokines and Fas/APO-1. J Am Coll Cardiol 2000; 35:701. [ Links ]
8. Elkayam U, Tummala PP, Rao K, et al. Maternal and fetal outcomes of subsequent pregnancies in women with peripartum cardiomyopathy. N Engl J Med 2001;344:1567-71. [ Links ]
9. Witlin AG, Mabie WC, Sibai BM. Peripartum cardiomyopathy: an ominous diagnosis. Am J Obstet Gynecol 1997;176:182-8. [ Links ]
10. Lampert MB, Lang RM. Peripartum cardiomyopathy. Am Heart J 1995;130:860-70. [ Links ]
11. Pettiti DB, Sidney S, Quesenberry CP, et al. Incidence of stroke and myocardial infarction in women of reproductive age. Stroke 1997;28:280-3. [ Links ]
12. Kittner SJ, Stern BJ, Feeser BR, et al. Pregnancy and the risk of stroke. N Engl J Med 1996;335:768–74. [ Links ]
13. Crawford TC, Smith WT, Velazquez EJ, et al. Prognostic usefulness of left ventricular thrombus by echocardiography in dilated cardiomyopathy in predicting stroke, transient ischaemic attack, and death. Am J Cardiol 2004;93:500-3. [ Links ]
14. Schneck MJ, Xu L, Palacio S. Cardioembolic Stroke: Treatment & Medication. URL disponible en: http://emedicine.medscape.com/article/1160370-treatment (Fecha de acceso: Setiembre del 2009). [ Links ] 15. Amos AM, Jaber WA, Russell SD. Improved outcomes in peripartum cardiomyopathy with contemporary. Am Heart J 2006;152:509-13. [ Links ] 16. Dyken ME, Biller J. Peripartum cardiomyopathy and stroke. Cerebrovasc Dis 1994;4:325-328. [ Links ] 17. Sliwa K, Fett J, Elkayam U. Peripartum cardiomyopathy. Lancet 2006;368:687-93. [ Links ] 18. Lee W. Clinical management of gravid women with peripartum cardiomyopathy. Obstet Gynecol Clin North Am 1991;18:257-71. [ Links ] 19. Phillips SD, Warnes CA. Peripartum cardiomyopathy: current therapeutic perspectives. Curr Treat Options Cardiovasc Med 2004;6:481-8. [ Links ] 20. Pearson GD, Veille JC, Rahimtoola S, et al. Peripartum cardiomyopathy: National Heart, Lung and Blood Institute and Office of Rare Diseases (National Institutes of Health) workshop recommendation and review. JAMA 2000;283:1183-8. [ Links ] 21. Heider AL, Kuller JA, Strauss RA, Wells SR. Peripartum cardiomyopathy: a review of the literature. Obstet Gynecol Surv 1999;54:526-31. [ Links ] Correspondencia: Germán Málaga Rodríguez Calle Chavín 159. CC Monterrico. Santiago de Surco Teléfono: 511-3445356 Correo electrónico: german.malaga@upch.pe