Equivalencia terapéutica de tabletas de diazepam dispensadas en la ciudad de Ica, Perú.
Therapeutic equivalency of tablets of diazepam dispended in the city of Ica, Peru.
Oscar Herrera-Calderon1, Miguel Grande-Ortiz2
1Químico Farmacéutico. Facultad de Farmacia y Bioquímica, Universidad Nacional San Luis Gonzaga. Ica, Perú.
2Químico Farmacéutico. Laboratorio de Biodisponibilidad - Bioequivalencia, Centro Nacional de Control de Calidad, Instituto Nacional de Salud. Lima, Perú.
RESUMEN
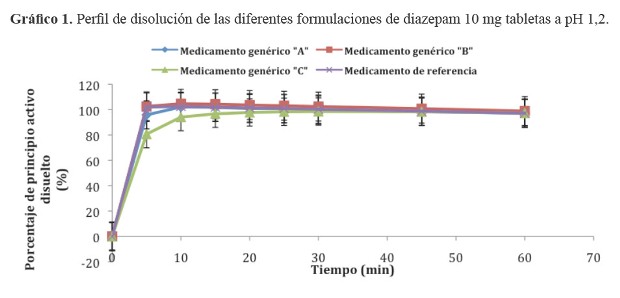
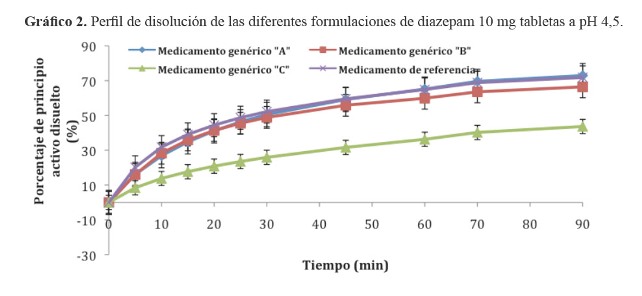
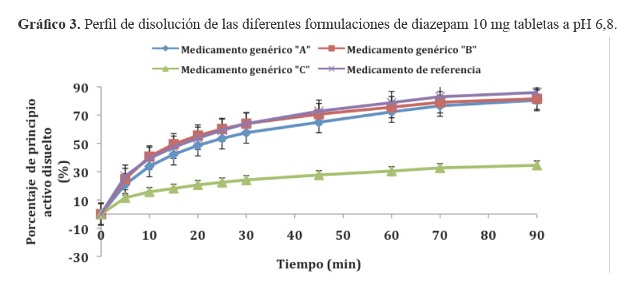
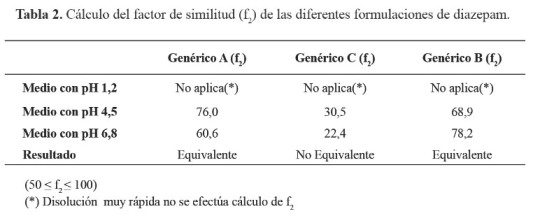
Objetivos: Determinar la equivalencia terapéutica in vitro de tres formulaciones de diazepam 10 mg tabletas, para establecer su intercambiabilidad con el medicamento de referencia original. Material y métodos: Estudio descriptivo, comparativo, realizado en junio del 2010, utilizando tres medicamentos genéricos dispensados en la ciudad de Ica y el medicamento original de referencia: Diazepam (Valium®) de laboratorios Roche. Se determinaron los perfiles de disolución efectuados en medios similares a pH fisiológicos del organismo según lo señalado por la OMS (Reporte Técnico 937). Para establecer la equivalencia terapéutica se empleó el factor de similitud (f2), considerando que dos formulaciones son equivalentes terapéuticos in vitro si los valores están comprendidos entre 50 y 100. Resultados: Los medicamentos evaluados presentaron a pH 1,2 una disolución muy rápida, sin embargo las tres formulaciones de prueba y el de referencia presentaron a pH 4,5 y pH 6,8 una disolución lenta con valores f2 a pH 4,5: Genérico A (f2 = 76,0); Genérico B (f2 = 68,9); Genérico C (f2 = 30,5); y a pH 6,8: Genérico A (f2 = 60,6); Genérico B (f2 = 78,2); Genérico C (f2 =20,4). Conclusiones: Según los valores f2 encontrados para las tres formulaciones de diazepam el medicamento genérico C (genérico nacional) no es equivalente al medicamento de referencia dado que no se pudo demostrar su intercambiabilidad, la que si se logró establecer para los medicamentos genéricos A y B.
PALABRAS CLAVE: Equivalencia terapéutica, diazepam, OMS. (Fuente: DeCS BIREME)
SUMMARY
Objectives:
To determine the in-vitro therapeutic equivalence of three formulations of diazepam in tablets of 10mg to establish their interchangeability with the original brand name product. Methods: Descriptive and comparative study performed in September 2010 using three generic presentations dispended in the city of Ica compared to the original brand name product Diazepam (Valium®) from Roche Pharmaceutical Laboratories. We determined the dissolution profiles performed in similar media at physiologic pH based on WHO recommendations (Technical report 937). To establish therapeutic equivalence, we used the similarity factor (f2) and considered therapeutic equivalence if values were between 50 and 100. Results: All presentations had a very rapid dissolution at pH=1.2. However, the three generic presentations and the brand name product had slower dissolutions with f2 values at pH=4.5 of 76.0 for Generic A; 68.9 for Generic B; and 30.5 for Generic C, and f2 values at pH=6.8 of 60.6 for Generic A; 78.2 for Generic B and 20.4 for Generic C, respectively. Conclusions: Based on the f2 values found for the three generic presentations of diazepam, only the generic C presentation was not equivalent compared to the brand name product.KEY WORDS: Therapeutic equivalency, WHO, diazepam. (Source: MeSH NLM)
INTRODUCCIÓN
Diazepam es una benzodiacepina utilizada para tratar estados de ansiedad y tensión, y es la más efectiva para el tratamiento de espasmos musculares cuyo mecanismo consiste en potenciar los efectos del ácido gamma amino butírico (GABA) aumentando la afinidad del neurotransmisor a su receptor (GABAA) (1).
En muchos países antes de comercializar los medicamentos se exige garantizar su calidad, seguridad y eficacia. Los medicamentos genéricos (multifuentes) demuestran la seguridad y eficacia a través de los estudio de equivalencia terapéutica con el medicamento original con el fin de garantizar su intercambiabilidad (2).
El empleo de estudios de liberación - disolución (equivalencia terapéutica in vitro), se sustenta en el hecho que después de la administración de un medicamento por vía oral, desde una forma farmacéutica sólida, la absorción del principio activo depende de los procesos de liberación, disolución y de la permeabilidad a través de la barrera gastrointestinal (3,4).
Para los productos que contienen el ingrediente farmacéutico activo (IFA) con propiedades biofarmacéuticas clase I (alta solubilidad y alta permeabilidad) como diazepam, la similitud de los perfiles de disolución in vitro puede ser útil para establecer la equivalencia terapéutica entre el medicamento de ensayo y el de referencia (5).
La incorporación en el mercado farmacéutico de los medicamentos denominados "genéricos" tiene un interés económico relevante ya que el costo de tratamiento con estos fármacos suele ser inferior al tratamiento con otros productos que contienen el mismo principio activo y en la misma forma farmacéutica pero con denominaciones comerciales diferentes (6).
En el Perú, el número de productos nuevos que entran al mercado es pequeño frente al gran número de versiones genéricas de productos ya existentes, con sus nombres de marca y en denominación común internacional (DCI).
En el periodo 1990-2008 se registraron 17 442 medicamentos, de ellos 8,8% (1 535) tenían productos innovadores (originales), 61,4% (10 722) similares de marca y 29,7% (5 185) productos genéricos. De los medicamentos registrados; 48,6% (8 482) eran de procedencia extranjera y 51,4% (8 960), de origen nacional (7).
En julio del 2011 se aprobó el Reglamento para el Registro, Control y Vigilancia Sanitaria de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios mediante DSNº016/2011-S.A. que entra en vigencia a fines de enero del año 2012 y establece que todos los medicamentos sean innovadores o genéricos deben cumplir con los mismos estándares de calidad, eficacia y seguridad, lo que permitirá evidenciar la equivalencia terapéutica de los medicamentos que pretendan la inscripción y reinscripción del registro sanitario a exigencias de la autoridad nacional reguladora de medicamentos (DIGEMID) (8).
Diazepam es uno de los medicamentos de mayor consumo a nivel mundial, según la OMS es un medicamento esencial (9). Es por ello que el objetivo de esta investigación fue determinar la equivalencia terapéutica in vitro de tres formulaciones de diazepam 10 mg en tabletas, para establecer su intercambiabilidad con el medicamento original como referencia.
MATERIAL Y MÉTODOS
Estudio descriptivo, comparativo, empleándose cuatro formulaciones de diazepam 10 mg tabletas comercializados en la ciudad de Ica, tres de ellos medicamentos genéricos de laboratorios nacionales y uno original (innovador) de laboratorio multinacional (medicamento de referencia), el estudio se realizó en junio de 2010.
Control de calidad (QC)
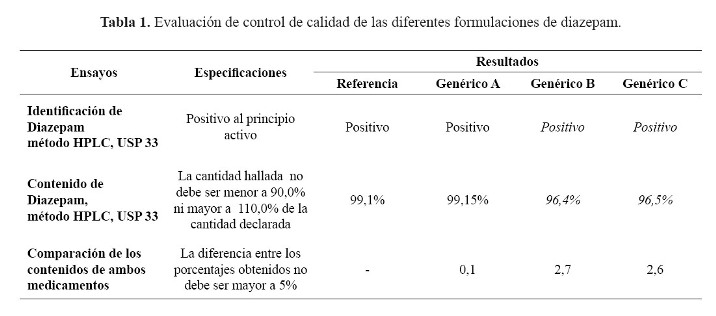
Los análisis de control de calidad (QC); peso promedio (Farmacopea Británica, edición 2010), identificación y valoración del principio activo según la USP 33, para los medicamentos en estudio, se realizaron en el Centro Nacional de Control de Calidad del Instituto Nacional de Salud del Perú (CNCC-INS). Se usaron estándares primarios USP tanto de diazepam (lote J1E043), como de nordazepam (lote H0B150), este último como estándar de resolución (10,11).
Los tres medicamentos genéricos fueron denominados: Genérico A, lotes 00967389 F.V.11/2012, y 01184339 F.V.09/2012 adquirido de la farmacia del MINSA; genérico B (similar de marca) lotes 004018F.V.12/2012, y 00719 F.V. 04/2012 adquirido en la farmacia de EsSalud Ica; genérico C, lote 0120499 F.V.12/2012, adquirido en una botica particular. El medicamento original, lotes RJ0374 y RJ0386, de laboratorio ROCHE Q.F.S.A. de CV con F.V. 07/2014 y F.V. 08/2012 respectivamente, se adquirió en la droguería ALBIS S.A.
Evaluación del contenido de principio activo de las diferentes formulaciones de Diazepam
Las cuantificaciones de diazepam se determinaron según método analítico de la USP 33, empleando equipo de cromatografía líquida (HPLC), modelo Lachrom Elith, marca Merck.
Se usó una columna cromatográfica RP-18 (150mm x 4,6mm i.d.), 4,0 μ, Mono Chrom VARIAN, flujo: 1,00 mL/min, temperatura de la columna 25 °C, volumen de inyección 10μL, detector UV a 254 nm, fase móvil, una mezcla de acetonitrilo: agua: metanol (400mL: 400mL: 200mL) y tiempo de corrida de 10 minutos.
Según las especificaciones de la OMS (3) para establecer equivalencia terapéutica la diferencia del contenido de principio activo entre el medicamento de referencia y el evaluado, preferentemente no debería ser mayor de ± 5%.
Desarrollo de los perfiles de disolución
Los perfiles de disolución fueron realizados usando Aparato 1 USP a 100 rpm empleando equipo de disolución automatizado VANKEL VK 7025 - VARIAN. Los medios de disolución fueron soluciones amortiguadoras USP (11) para simulan los fluidos fisiológicos del sistema gastrointestinal; pH 1,2 (fluido gástrico simulado sin enzimas), el pH 4,5 (solución buffer acetato), y pH 6,8 (solución fluido intestinal simulado sin enzimas o buffer fosfato) a una temperatura de 37 ± 0,5ºC. El volumen de medio de disolución empleado fue 900 mL. Se evaluaron doce tabletas de cada formulación por lote y en todos los procesos, las muestras se tomaron de manera automatizada, empleando un espectrofotómetro de doble haz UV- VIS modelo CARY 50, TABLET VARIAN con celdas de flujo de 0,5 cm a una longitud de onda UV de 242 nm y los tiempos de muestreo establecidos fueron 5, 10, 15, 20, 30, 45, 60, 75 y 90 minutos. Todas las muestras se filtraron a través de membranas de 0,45 µm PVDF Millipore (3).
Tratamiento de los datos
La comparación de los perfiles de disolución fue realizada de acuerdo a la Guía Técnica de la Nº 937, informe 40 de la OMS, calculando el factor de similitud (f2), cuya ecuación se muestra a continuación.

Donde: Rt y Tt son los porcentajes promedios disueltos en cada tiempo del medicamento de referencia y en estudio y n es el número de tiempos de muestreo. Para establecer la equivalencia terapéutica se consideró que dos formulaciones eran equivalentes terapéuticos in vitro si los valores (f2) estaban comprendidos entre 50 y 100.
Para el análisis estadístico se utilizó el programa Microsoft Excel versión 2007.
RESULTADOS
El control de calidad de las formulaciones estudiadas según especificaciones de la Farmacopea Americana USP33 se muestra en la tabla 1.
Los resultados de los porcentajes de principio activo liberados de los tres medicamentos de prueba y el medicamento innovador original se visualizan en los gráfico 1, gráfico 2 y gráfico 3. El cálculo estadístico del factor de similitud se indica en la tabla 2.
DISCUSIÓN
Según los resultados de control de calidad (QC), las formulaciones evaluadas de diazepam, cumplen los criterios de calidad según la USP 33, especialmente la identificación y cuantificación del principio activo. Además se cumplió con el requisito de la OMS para la realización de los perfiles de disolución ya que la variación del porcentaje de contenido de principio activo entre el producto de referencia y los multifuentes no fue mayor a 5%.
Hemos encontrado que el diazepam presenta una disolución rápida a pH 1,2 lo que estaría confirmando su clasificación en el grupo I del Sistema de Clasificación Biofarmacéutica (SCB), y sería considerado como candidato a un estudio de bioexencion. Una disolución de 85% en 0,1N de HCl (pH 1,2) en 15 minutos puede asegurar que la biodisponibilidad del fármaco no esté limitada por disolución. En estos casos, el paso limitante de velocidad de la absorción del fármaco es el vaciamiento gástrico (12).
En el desarrollo de los perfiles de disolución, el medícamento genérico C de procedencia nacional, evidenció una lenta disolución a pH 4,5 y 6,8 en comparación con los otros medicamentos evaluados. Esta variación puede deberse a los diferentes excipientes empleados en la formulación de las tabletas de diazepam (13).
Al presente no existen estudios in vitro relacionados que demuestren equivalencia terapéutica de las variedades de formulaciones genéricas que se expenden en nuestro medio. Anteriormente en un estudio de bioequivalencia realizados a tabletas de Ibuprofeno en el Instituto Nacional de Salud de Perú, demostraron que si existe equivalencia terapéutica en la formulación genérica y de marca (14).
A pesar que todas las formulaciones evaluadas presentan el contenido de principio activo declarado por el fabricante, el comportamiento del medicamento C es diferente y es probable que su biodisponibilidad sea ineficiente tal como lo describen estudios desarrollados en el ámbito internacional haciendo una correlación in vitro in vivo (IV-IV) a drogas que tienen una clasificación tipo I y II en el SCB (15,16).
Durante el ensayo se emplearon dos lotes no consecutivos de cada uno de los productos evaluados con el fin de determinar la variabilidad inter lote, tal cual lo recomienda la, EMA, OMS y otras normas internacionales de equivalencia terapéutica (3).
Según los valores f2 encontrados para las tres formulaciones de diazepam a pH 4,5 y pH 6,8; se concluye que el genérico C (genérico nacional) no es equivalente al medicamento de referencia, no pudiendo demostrar su intercambiabilidad, la cual si se pudo establecer para los genéricos A y B.
Fuentes de Financiamiento: Estudio ejecutado con el apoyo técnico y financiado por el Instituto Nacional de Salud del Perú. Los autores declaran no tener conflictos de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Goodman G, Goodman L, Gilman A. Las bases farmacológicas de la terapéutica. 11ª ed. México DF: Editorial McGraw-Hill; 2006. p. 402 [ Links ]
2. Laguna N, Blázquez A, Pozo C. Legislación sobre autorización de genéricos. Farm Hosp. 2006; 30(6): 379-84. [ Links ]
3. World Health Organization. WHO Expert Committee on Specifications for Pharmaceutical Preparations. Fortieth Report. Geneva: WHO; 2006. [ Links ]
4. Laosa O, Guerra P, López J, Mosquera B, Frías J. Estudio de Bioequivalencia: La necesidad de establecer la fiabilidad de los medicamentos genéricos. Rev Peru Med Exp Salud Pública. 2009; 26(4): 553-62. [ Links ]
5. Tubic-Grozdanis M, Bolger M, Langguth P. Application of gastrointestinal simulation for extension for biowaiver of highly permeable compounds. AAPSJ. 2008; 10(1): 213-26. [ Links ]
6. Zapater P, Horga J. Bioequivalencia y genéricos. Los estudios de bioequivalencia. Una aproximación a sus bases teóricas, diseño y realización. Rev Neurol. 1999; 29(12):1235-46. [ Links ]
7. Dongo V. Ley N° 29459 – Ley de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios. Rev Perú Med Exp Salud Pública. 2009; 26(4): 517-29. [ Links ]
8. Ministerio de Salud del Perú. Decreto Supremo 016-2011-SA. Reglamento para el Registro, Control y Vigilancia Sanitaria de Productos Farmacéuticos y Afines. Lima: MINSA; 2011. [ Links ]
9. World Health Organization. WHO Expert Committee on Specifications for Pharmaceutical Preparations. WHO Model List of Essential Medicines, 15th list. Geneva: WHO; 2007. [ Links ]
10. British Pharmacopoeia Commission. British Pharmacopoeia. London: The Stationery Office; 2010. [ Links ]
11. The United States Pharmacopeial Convention. US Pharmacopoeia. 33th ed. Maryland: The United States Pharmacopeial Convention; 2010. [ Links ]
12. Devane J. Oral drug delivery technology: Addressing the solubility/permeability paradigm. Pharm Technol. 1998; 22: 68-74. [ Links ]
13. European Agency for the Evaluation of Medicinal Products; Committee for Proprietary Medical Products. Note for guidance on the investigation of bioavailability and bioequivalence. London: EMEA; 2000. [ Links ]
14. Villalva O, Grande M, Ortiz J, Isasi J, Yantas D, Fiestas V. Estudio de bioequivalencia del ibuprofeno 400 mg tabletas. Rev Peru Med Exp Salud Pública. 2007; 24 (4):356-62. [ Links ]
15. Azarmi S, Roa W, Lobenberg R. Current perspectives in dissolution testing of conventional and novel dosage forms. Int J Pharm. 2007; 328:12-21. [ Links ]
16. Amidon GL, Lennernäs H, Shah VP, Crison JR. A theoretical basis for a biopharmaceutic drug classification: the correlation of in vitro drug product dissolution and in vivo bioavailability. Pharm Res. 1995; 12(3):413 - 20. [ Links ]
Correspondencia:
Oscar Herrera Calderon.
Departamento de Ciencias Químicas, Facultad de Farmacia y Bioquímica, Universidad Nacional de San Luis Gonzaga de Ica.
Campus Universitario
Panamericana Sur Km 305 - Ica, Perú.
Correo electrónico:
oh2000_4@hotmail.comTeléfono: (5156) 222-201