Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Medica Herediana
Print version ISSN 1018-130X
Rev Med Hered vol.24 no.2 Lima Apr./jun. 2013
Terapia biológica en enfermedades reumatológicas
Biologic therapies in rheumatic diseases
Manuel F. Ugarte-Gil (1), Eduardo M. Acevedo-Vásquez (2), Graciela S. Alarcón (3)
(1) Médico Asistente del Servicio de Reumatología del Hospital Nacional Guillermo Almenara Irigoyen, EsSalud. Profesor de Medicina, Universidad Científica del Sur, Lima, Perú.
(2) Doctor en Medicina. Fellow American College of Rheumatology. Académico de Número. Profesor Principal, Facultad de Medicina, Universidad Nacional Mayor de San Marcos, Lima, Perú.
(3) Doctor en Medicina. Master American College of Rheumatology & Pan American League of Associations of Rheumatology. Académico Asociado. Profesora de Medicina, Universidad Peruana Cayetano Heredia, Lima, Perú. The University of Alabama at Birmingham, EE.UU.
RESUMEN
El advenimiento del uso de terapias biológicas en Reumatología ha modificado significativamente el pronóstico de pacientes portadores de artritis reumatoide (AR), artritis juvenil (AJ), espondilitis anquilosante (EA), entre otras enfermedades. A diferencia de las terapias convencionales estos productos biológicos se dirigen a los llamados blancos terapéuticos ya sea estas una línea celular, un mediador inflamatorio o un receptor de superficie. Estos compuestos son producidos por células vivas mediante la tecnología del ADN recombinante. Estos compuestos pueden tener componentes humano y animal [quiméricos (Xi), humanizados (Zu)], o completamente humanos (H) lo cual se reconoce por las letras que se incluyen en el nombre de cada uno. En el campo de la Reumatología, el primer compuesto utilizado fue el etanercept (anti-factor de necrosis tumoral o anti-TNF) aprobado en 1998, pero otros anti-TNF han demostrado su beneficio en AR, como en EA y AJ. Los inhibidores de Interleucina (IL-1) casi no se usan en AR actualmente, pero si los inhibidores de IL-6, así como los agentes contra las células B y los agonistas de CTLA-4 (Cytotoxic T lymphocyte antigen). Existe asimismo un compuesto dirigido al BLyS (B-lymphocyte stimulator) el cual se usa en lupus eritematoso sistémico y otro dirigido al receptor activador del factor nuclear κB (RANKL, receptor activator of nuclear factor-κB ligand) que se usa en osteoporosis. Con el avance en el conocimiento de la patogenia de las enfermedades reumáticas, se vienen reconociendo otra blancos terapéuticas. En los años venideros, este campo ha de expandirse en proporciones geométricas.
PALABRAS CLAVE: Artritis reumatoide, espondilitis anquilosante, artritis reumatoide juvenil, lupus eritematoso sistémico. (Fuente: DeCS BIREME).
SUMMARY
The advent of biologic therapies in Rheumatology has modified significantly the prognosis of patients with rheumatoid arthritis (RA), juvenile arthritis (JA), ankylosing spondylitis (AS), among others. In contrast to the conventional therapies, these biological therapies are directed at specific targets being those a cell line, an inflammatory mediator, or a surface receptor. These compounds are produced by live cells using recombinant DNA technology. They can have human and animal components [chimerics (Xi), humanized (Zu)] or be completely human (H); this is recognized by the letters included in their names. The first compound used in Rheumatology was etanercept (anti-tumor necrosis factor) which was approved by the FDA in 1998; however other anti-TNF compounds have proven to be beneficial in RA as well as in AS and JA. The interleukin-1 (IL-1) inhibitors are rarely used in RA at the present time, but IL-6 inhibitors and agents directed against CTLA-4 (Cytotoxic T lymphocyte antigen) are. There is also a compound against BLyS (B-lymphocyte stimulator) which is used in systemic lupus erythematosus and other directed at RANKL (receptor activator of nuclear factor-κB ligand) which is used in osteoporosis. With the advances made in the understanding of the pathogenesis of the rheumatic diseases, new therapeutic targets are being recognized. In the years to come this field will expand in geometric proportions.
KEYWORDS: Rheumatoid arthritis, juvenile idiopathic arthritis, ankylosing spondylitis, systemic lupus erythematosus. (Source: MeSH NLM).
INTRODUCCIÓN
El avance vertiginoso del conocimiento y el entendimiento de la compleja patogenia de las enfermedades autoinmunes ha propiciado el desarrollo de productos o agentes biológicos diseñados para actuar sobre los diferentes componentes que participan en el inicio y perpetuación de la respuesta inmune. Las dianas terapéuticas hacia las cuales se dirigen los agentes biológicos incluyen: 1) una línea celular (células B, células T u otras células inmunocompetentes) o moléculas de activación en las mismas; 2) mediadores inflamatorios solubles como citocinas, quemocinas, moléculas de la vía del complemento, enzimas e inmunoglobulinas; y 3) receptores de superficie de estos mediadores. Los agentes biológicos pueden actuar sobre estas poblaciones celulares acoplándose a sus funciones efectoras tales como la cascada del complemento y la citotoxidad celular dependiente de anticuerpos. La depleción de una estirpe celular puede ser inducida por apoptosis luego que el agente biológico se ha ligado al objetivo o blanco para el cual ha sido diseñado (1).
Dos técnicas claves, ADN recombinante e hibridoma que fuesen desarrolladas en las décadas de los 70 y 80 del siglo pasado, han permitido el desarrollo de los productos biológicos. El término "agente o producto biológico", sin embargo, se refiere en la mayoría de los casos a compuestos producidos por células vivas mediante la tecnología del ADN recombinante. En este grupo se hallan los anticuerpos monoclonales y las proteínas fabricadas por bioingeniería como son las proteínas de fusión.
Los anticuerpos monoclonales de uso en medicina pueden ser: Quiméricos (la inmunoglobulina tiene componentes humano y animal, ejemplo murino) como rituximab e infliximab; en estos productos la región variable de la inmunoglobulina de origen murino se une a la región constante de origen humano; anticuerpos humanizados, en los que solo la región determinante de complementariedad (CDR, complementarity-determining regions) es de origen murino, siendo el restante componente del anticuerpo de origen humano, como tocilizumab y certolizumab; y finalmente, anticuerpos monoclonales completamente humanos, como es el caso de adalimumab, denosumab y belimumab (2).
La nomenclatura de los agentes biológicos se describe en la Tabla 1, y en la figura 1, figura 2 y figura 3(3-5).
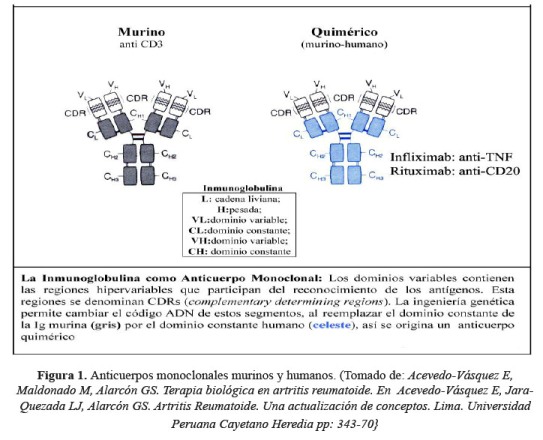
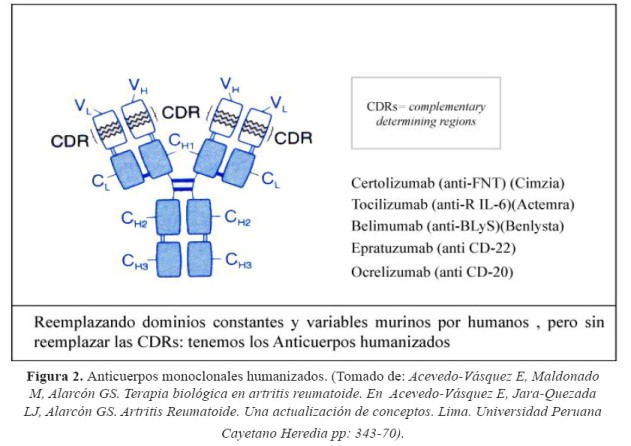

En el otro gran grupo se hallan las proteínas de fusión, que están compuestas típicamente por los dominios extracelulares de proteínas nativas transmembrana, como son los receptores de superficie, unidos a otra molécula. En la mayoría de casos, esta otra molécula es la fracción constante (Fc) de una inmunoglobulina; con ello se incrementan las funciones del medicamento, permitiendo la activación del complemento y la unión a receptores Fc en la membrana celular. El mecanismo primario de acción de estas proteínas de fusión es evitar competitivamente la unión de un ligando con su receptor, previniendo sus efectos posteriores, como la activación de la cascada inflamatoria. Las proteínas de fusión tienen en su nomenclatura el sufijo –cept, ejemplo etanercept o abatacept (1,6,7).
BLANCOS DE LA TERAPIA BIOLÓGICA
Agentes que inhiben citocinas proinflamatorias
a) Inhibidores del factor de necrosis tumoral-α σ anti TNF-α (anti tumor necrosis factor-α)
El TNF-α es una citocina producida por monocitos, neutrσfilos, linfocitos, cιlulas naturales asesinas (
killer cells), células endoteliales y mastocitos, y ejerce su función acoplándose a uno o a los dos receptores de TNF: TNFR I (p75) y el TNFR II (p55); estos receptores tienen una afinidad similar por el TNF-α (8).La sobreproducción del TNF-α que se da en las respuestas inflamatorias de naturaleza autoinmune tiene acción negativa sobre varios órganos y tejidos; es así que en los vasos sanguíneos y células del músculo liso el TNF-α estimula la proliferación e influencia a las células endoteliales para pasar de un estado anticoagulante a un estado procoagulante; en la sinovia, promueve la proliferación y sobreexpresión de
moléculas de adhesión, causando un influjo de células inflamatorias en el tejido; en el sistema nervioso central produce fiebre y desregulación del sueño; en el hueso, favorece el aumento de la reabsorción y erosión ósea. El TNF-α también afecta la reparación y formación de cicatrices mediante su acción sobre los fibroblastos y sobre tumores produciendo lisis de células tumorales (9).
Existen cinco agentes anti-TNF-α aprobados por las autoridades regulatorias en el mercado farmacιutico global para su uso en reumatologνa en enfermedades como artritis reumatoide (AR), espondilitis anquilosante (EA), entre otras; uno de ellos es la proteν
na de fusión, etanercept, y los otros cuatro son anticuerpos monoclonales (infliximab, adalimumab, golimumab y certolizumab) (7). En el Perú solo se disponen de etanercept, infliximab y adalimumab.b) Inhibidores de interleucina (IL)-1
La IL-1 tiene dos formas homólogas IL-1α e IL-1β, y dentro de la familia de esta interleucina se encuentra el antagonista de su receptor (IL-1ra). Existe afinidad de las dos formas de IL-1 y de la IL- 1ra por los dos receptores de IL-1. El receptor de IL-1 tipo I es el que transmite los efectos atribuidos a IL-1, mientras que el de tipo II tiene un dominio intracelular mínimo, no transmitiendo señal, teniendo una función antiinflamatoria. La capacidad del IL-1ra de unirse al receptor sin generar señal es la base de su función inhibitoria, moderando los efectos potencialmente deletéreos de la IL-1 (8). La IL-1 es producida principalmente por los fagocitos mononucleares, aunque también puede ser producida por las células endoteliales, queratinocitos, sinoviocitos, osteoblastos, neutrófilos y células gliales, entre otras (8).
Uno de los efectos biológicos más importantes de la IL-1 es activar los linfocitos T para que produzcan IL-2 y el receptor de IL-2. En el sistema nervioso central induce la aparición de anorexia, fiebre y letargo, en el hígado, incrementa la producción de reactantes de fase aguda, disminuyendo la producción de albúmina. La IL-1 estimula la adherencia de los leucocitos mediante la activación del endotelio y una mayor expresión de moléculas de adhesión ICAM-1 (Intercellular Adhesion Molecule 1) y VCAM-1 (Vascular Cell Adhesion Protein 1), así como de E-selectina. La IL-1 contribuye además a la hipotensión del shock séptico (8).
Existen tres medicamentos biológicos aprobados por las autoridades regulatorias que tienen como blanco IL-1. El primero es un análogo recombinante del IL- 1ra, anakinra para su uso en AR; sin embargo este compuesto en la actualidad tiene un uso muy limitado, entre otras razones por ser de aplicación diaria y muy alto costo); el segundo es el rilonacept el cual es una proteína de fusión que funciona como receptor soluble de IL-1, con una afinidad mayor para IL-1β, luego IL- 1α y menor para IL-1ra; el tercero es el canakinumab que es un anticuerpo monoclonal contra la IL-1β; los dos ϊltimos agentes biolσgicos estαn indicados para el tratamiento de varios síndromes autoinflamatorios como el CAPS (cryopyrin-associated periodic syndromes) (10). Ninguno de estos tres medicamentos se encuentra en el mercado farmacéutico de nuestro país.
c) Inhibidores de IL-6
La IL-6 es producida por fagocitos mononucleares, linfocitos T y B, fibroblastos, células endoteliales, queratinocitos, hepatocitos, y células de la médula ósea. La IL-6 transmite su señal a través de la cadena α del receptor de IL-6 (IL-6Rα) y el componente gp130 (o CD130). El CD130 sirve para la transducciσn de varias citocinas de la familia de IL-6, mientras que el IL-6Rα es exclusivo para esta citocina (8). Por efecto de la IL-6 los linfocitos B se diferencian en cιlulas plasmαticas maduras que secretan inmunoglobulinas. Ademαs, la IL-6 estimula el crecimiento, diferenciación y activación de los linfocitos T, especialmente su diferenciación a Th17. La IL-6 comparte con la IL-1 algunas acciones como la inducción de fiebre y la de reactantes de fase aguda (8).
Se ha desarrollado un anticuerpo monoclonal contra en IL-6Rα denominado tocilizumab que se encuentra en el mercado farmacolσgico nacional y tiene indicaciones aprobadas para su uso en AR y artritis idiopαtica juvenil sistι
mica (11).d) Inhibición del RANKL
La vía del ligando receptor activador del factor nuclear κB (RANKL receptor activator of nuclear factor-κB ligand), su receptor (RANK) y la osteoprotegerina (OPG) median en la activación y diferenciación del osteoclasto. El RANKL es expresado principalmente por el linaje de células osteoblásticas. No obstante otras células, como los linfocitos T, células endoteliales, fibroblastos sinoviales y algunas células tumorales pueden expresar RANKL. El RANKL, al interactuar con el RANK incrementa la resorción aumentando la actividad y el número de los osteoclastos. Por otra parte, la osteoprotegerina es un receptor soluble de señuelo que funciona como un antagonista fisiológico de la vía RANK-RANKL, permitiendo un remodelado óseo adecuado, pero evitando una pérdida excesiva de hueso (12,13).
El denosumab es un anticuerpo monoclonal contra RANKL existente en el mercado farmacológico global y nacional habiendo sido aprobado para el tratamiento de la osteoporosis en mujeres posmenopáusicas con riesgo elevado de fracturas, en pacientes con cáncer de próstata sometidos a supresión hormonal y riesgo elevado de fracturas, en pacientes con cáncer de mama en terapia con inhibidores adyuvantes de la aromatasa, y en la prevención de compromiso esquelético de pacientes con metástasis ósea por tumores sólidos (14).
Agentes contra las células B
a) Anti CD20
El CD20 es un marcador de superficie presente en distintos pasos del desarrollo del linfocito B, desde estadios pre B hasta los linfocitos B de memoria, pero no está presente en las células plasmáticas. El CD20 no se internaliza lo que permite que sea un buen blanco en la terapia contra las células B (2). El linfocito B participa en las enfermedades autoinmunes mediante la producción de autoanticuerpos y de citocinas así como estimulando a los linfocitos T (15).
Existe en el mercado farmacológico el anti CD20 rituximab, un anticuerpo monoclonal quimérico que fuese desarrollado para el tratamiento de algunas formas de linfoma B y cuyo uso se ha extendido a pacientes con AR y con vasculitis ANCA positivos (anticuerpos contra citoplasma de neutrófilo) como la granulomatosis y poliangeitis (antes enfermedad o granulomatosis de Wegener) y la poliangeitis microscópica (16). Este producto se encuentra en el mercado farmacológico nacional.
b) Anti factor activador de linfocitos B o estimulador de linfocitosB y el anti-ligando inductor de proliferación.
El factor activador de linfocito B (BAFF, B cell activator factor) o estimulador de linfocito B (BLyS, B lymphocyte stimulator) y el anti-ligando inductor de proliferación (APRIL, a proliferation-inducing ligand) son miembros de la familia del TNF y son factores de crecimiento y sobrevida importantes para los linfocitos B. El BLyS se une a tres receptores: TACI (transmembrane activator and calcium-modulator and cyclophilin ligand interactor), BAFF-R (BAFF receptor) y BCMA (B-cell maturation protein); APRIL, por otra parte, lo hace con TACI y BCMA (17). La interacción con BAFF-R estimula la generación y mantenimiento de los linfocitos B maduros, la interacción con TACI estimula la activación independiente de linfocitos T, el cambio de clase de inmunoglobulinas y la homeostasis de los linfocitos B; el estímulo de BCMA es importante para la diferenciación y sobrevida de las célula plasmáticas (18,19).
Se ha aprobado un anticuerpo contra el BLyS soluble, belimumab, para el tratamiento de pacientes con lupus eritematoso sistémico activo con positividad a autoanticuerpos antinucleares pero que no tienen compromiso renal (20). Está próximo a ser introducido en el mercado farmacológico nacional.
Agentes con acción en la coestimulación
a) Agonista CTLA-4 (Cytotoxic T lymphocyte antigen 4)
La coestimulación es un proceso básico para la activación de los linfocitos T. Dentro de las vías de la coestimulación una de las más estudiadas es la del CD28-CTLA4 con el CD80-CD86. Esta vía es más importante en los linfocitos CD4+ que en los CD8+, dado que l00% de los linfocitos CD4+ presentan CD28 de forma constitutiva (a diferencia del 50% de los linfocitos CD8+), y que la intensidad del efecto del estímulo del CD28 es mayor en los CD4+. Es así que luego del procesamiento del antígeno por la célula presentadora del mismo y su reconocimiento por el linfocito T (señal 1 de la respuesta inmune adaptativa) sucede la señal 2, (activación del linfocito T mediante unión e interacción del CD28 con el CD80-CD86) que provoca activación, proliferación, sobrevivencia y producción de citocinas por los linfocitos T. Con el fin de evitar la perduración de la señal 2 de la respuesta inmune adaptativa y evitar respuestas prolongadas que se suelen dar en estados de autoinmunidad, aparece el mecanismo regulador que desactiva y frena esta respuesta de los linfocitos T, lo cual sucede con la expresión y acción del CTLA-4, el cual compite con el CD28 para unirse con el CD80-CD86 terminando así la respuesta inmune adaptativa. El CTLA-4 tiene una mayor afinidad que el CD28 para dicha unión (21,22).
El uso de análogos de CTLA-4 produce una disminución de la activación de los linfocitos T, y subsecuentemente, una disminución de la interacción linfocitos T y macrófagos y una disminución de la producción de anticuerpos por los linfocitos B (23).
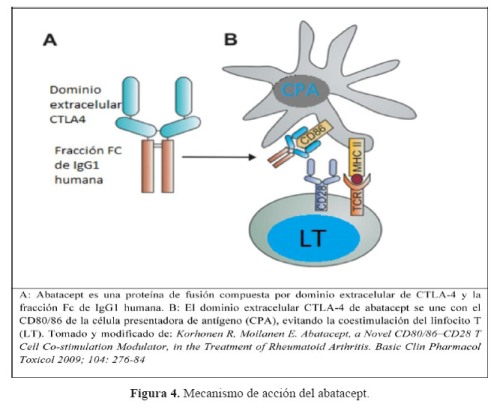
El abatacept es una proteína de fusión recombinante totalmente humana del dominio extracelular de CTLA-4 y de un fragmento del dominio Fc de la inmunoglobulina G1 (IgG1)(
Figura 4). Su uso ha sido aprobado para pacientes con AR y artritis juvenil idiopática poliarticular (24,25).
INDICACIONES
Artritis Reumatoide (AR)
Los métodos de evaluación de la actividad de enfermedad en AR más usados son el del ACR (American College of Rheumatology) y el de EULAR (European League Against Rheumatism). El criterio de mejoría del ACR evalúa siete variables [número de articulaciones tumefactas, número de articulaciones dolorosas, escala visual análoga (EVA) de dolor, EVA global de la enfermedad por parte del paciente, EVA de la enfermedad por parte del médico, reactantes de fase aguda y HAQ (Health Assessment Questionnaire); este último evalúa la habilidad para desempeñar las actividades de la vida diaria (AVD), vida laboral, recreativa o deportiva, actividad sexual, así como la repercusión social y económica de la enfermedad); de acuerdo al porcentaje de respuesta en estos parámetros se define el ACR 20, 50 ó 70, que significa 20, 50 ó 70% de mejoría (26).
EULAR utiliza para la evaluación de mejoría la escala DAS (Disease Activity Score) o DAS28, que incluye el número de articulaciones tumefactas, el de articulaciones dolorosas, los reactantes de fase aguda y el EVA global de enfermedad por parte del paciente. La diferencia entre el DAS y el DAS 28 está dada por el número de articulaciones que se incluyen: 28 en el DAS28 y 44 en el DAS. Utilizando el DAS28, la actividad del paciente se categoriza en remisión (menor a 2,6), actividad leve (entre 2,6 y 3,2), actividad moderada (3,2 a 5,1) y actividad severa (mayor a 5,1) (27).
Además, existen diversos métodos para evaluar progresión radiográfica, los más utilizados son las modificaciones del puntaje de Sharp por van der Heijde y por Genant. El objetivo es el de evaluar de forma estandarizada las radiografías de articulaciones predefinidas, asignando puntajes para la disminución de espacio articular y para erosiones siendo el puntaje total la suma de los dos. El uso de estos puntajes en los estudios de investigación permite definir la superioridad de un fármaco para evitar o retrasar la progresión radiográfica. No obstante, no son de uso habitual en la práctica clínica (28).
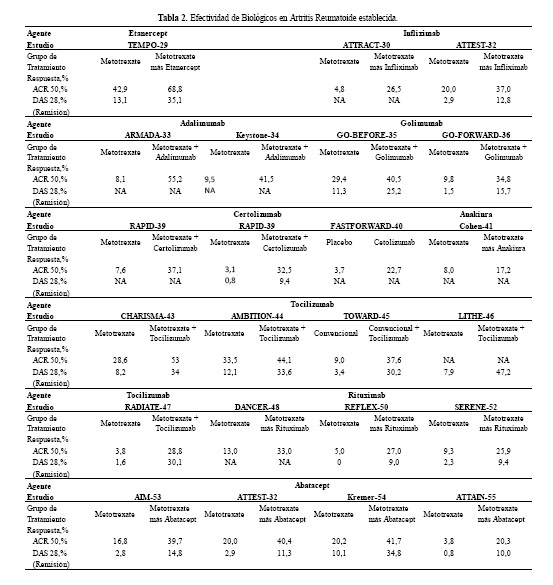
Los cinco anti TNF-α asν como anakinra, tocilizumab, rituximab y abatacept han demostrado eficacia tanto en disminuir la actividad de la enfermedad, mejorar la capacidad funcional y la calidad de vida cuanto en detener el daρo radiogrα
fico (Tabla 2) (29-55). De ellos, anakinra tiene una efectividad menor que los inhibidores de TNF-α, por lo que actualmente casi no se usa en AR como ya se anotσ (56).
Además, etanercept, infliximab, adalimumab, rituximab y abatacept también han demostrado eficacia en AR temprana (
Tabla 3) (57-63).
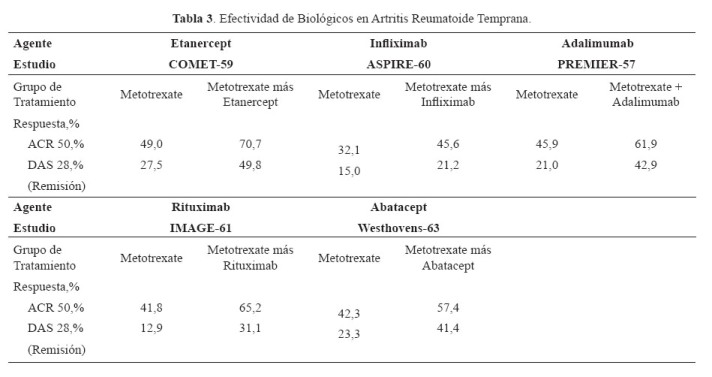
Existen algunas características que pueden ayudar a predecir la respuesta a agentes biológicos; por ejemplo la respuesta a rituximab es mayor en los pacientes que presentan factor reumatoide o anticuerpos contra péptido cíclico citrulinado positivo (64).
Espondilitis Anquilosante (EA)
La evaluación de actividad de los pacientes con EA incluye la evaluación de la actividad de enfermedad (BASDAI, Bath Ankylosing Spondylitis Disease Activity Index) (65), la evaluación funcional (BASFI, Bath Ankylosing Spondylitis Functional Index) (66) y la metrología (BASMI, Bath Ankylosing Spondylitis Metrology Index) (67). Además, se ha propuesto un índice denominado Assessment in Ankylosing Spondylitis (ASAS). Este índice incluye el estado global del paciente, el dolor, la función (BASFI), e inflamación (rigidez matinal). Para definir una respuesta ASAS 20 debe presentarse una mejoría de por lo menos el 20% en tres de los parámetros mencionados y que no empeore en más del 20% el dominio restante; el ASAS 40, por otra parte, implica una mejoría del 40% en tres de estos parámetros y un no empeoramiento de más del 40% en el restante (68).
Cuatro de los anti-TNF han demostrado efectividad en EA (etanercept, infliximab, adalimumab y golimumab) tanto en la evaluación de actividad, de la función y de la metrología así como en el índice compuesto (69-72).
Lupus Eritematoso Sistémico (LES)
El índice de respuesta de lupus SRI (Systemic Lupus Erythematosus Responder Index) ha sido propuesto para la evaluación de los pacientes con LES que participan en estudios de investigación con el propósito de definir un cambio clínicamente significativo. Para definirlo, se utilizaron tres índices de actividad concomitantemente; con el primero se evalúa la actividad global de la enfermedad [SELENA-SLEDAI (Safety of Estrogens in Lupus Erythematosus National Assessment- Systemic Lupus Erythematosus Disease Activity Index)] y se considera que debe haber una disminución de por lo menos cuatro puntos; con el segundo se evalúa la actividad por órganos [BILAG (British Isles Lupus Assessment Group)] y se considera que no debe aparecer ningún nuevo compromiso BILAG A (actividad severa en un órgano que requiere agregar inmunosupresión) y como máximo un nuevo compromiso BILAG B (actividad moderada en un órgano que no requiere agregar inmunosupresión); con el tercero el médico evalúa la actividad global de la enfermedad con un puntaje de 0 a 3, el cual no debe tener un incremento mayor o igual a 0,3 respecto a la evaluación basal (73).
El belimumab ha demostrado efectividad en disminuir la actividad de enfermedad, medida con el SRI (
Tabla 4) (74,75).

Osteoporosis
El denosumab ha demostrado que puede reducir el número de fracturas vertebrales, no vertebrales y de cadera, cuando se le comparó con placebo. Los riesgos relativos de fractura vertebral con denosumab se han reportado en 0,32 [Intervalo de confianza (IC) 95%: 0,26-0,41], no vertebral en 0,80 (IC95% 0,67-0,95) y de cadera en 0,60 (IC95%: 0,37-0,97) en comparación con el grupo que recibió placebo (76).
SEGURIDAD
Infecciones serias
De acuerdo con la revisión Cochrane correspondiente, los agentes biológicos en general incrementan el riesgo de infecciones serias. En esta revisión se incluyeron 160 estudios clínicos y 46 extensiones de los cinco anti TNF-α asν como anakinra, tocilizumab, abatacept y rituximab cuando fueron usados para cualquier indicaciσn excepto el virus de la inmunodeficiencia humana); se encontrσ un OR: 1,37 (IC95% 1,04-1,82) en comparación al tratamiento convencional; de las nueve drogas examinadas, certolizumab y anakinra también tuvieron individualmente un incremento del riesgo [OR 4,75 (IC95% 1,52-18,65) y 4,05 (IC9% 1,22-16,84), respectivamente] (77). El belimumab no incrementó el riesgo de infecciones comparado con el tratamiento convencional en pacientes con LES; sin embargo sólo se cuenta con la información de los estudios aleatorizados controlados, por lo que la evidencia es insuficiente (78). El denosumab incrementó el riesgo de infecciones cutáneas serias así como mostró una tendencia a incrementar el riesgo de infecciones serias en general (79-82).
Dentro de los factores que incrementan el riesgo de infecciones serias tenemos la presencia de enfermedad pulmonar crónica, de enfermedad renal crónica, la edad y el uso de glucocorticoides (83-85).
Tuberculosis
Según la revisión Cochrane, la incidencia de tuberculosis en pacientes que usan terapia biológica se encuentra incrementada (OR: 4,68, IC95: 1,18- 18,60) (86); aparentemente este riesgo sería mayor en los usuarios de anti TNF-α, y menor con los otros productos biolσgicos. En usuarios de anti TNF-α el riesgo de tuberculosis se incrementa entre 1,6 y 25,1 veces (dependiendo de la droga y la poblaciσn escogida), siendo este riesgo aparentemente mayor con los anticuerpos monoclonales que con el receptor soluble (87). Con los otros agentes biológicos no se ha demostrado incremento en la incidencia de tuberculosis, observándose que la tasa de incidencia por cien pacientes año en el grupo que recibió abatacept ha sido de 0,07 (88), con tocilizumab de 0,08 (89), con anakinra de 0,04 (90) y con rituximab de 0,02 (91). Con belimumab y denosumab no se ha reportado el desarrollo de tuberculosis en sus usuarios (78,79).
Debido al riesgo de reactivación de infección tuberculosa latente es importante el contar con estrategias adecuadas para su detección. La prueba más utilizada es el PPD (Protein purified derivative); sin embargo, su sensibilidad y especificidad se encuentra disminuida en los pacientes inmunosuprimidos, en particular en aquellos con AR (92,93). Por tal motivo actualmente se utilizan también las pruebas que detectan liberación de interferón γ en respuesta a los antígenos de mycobacteria, el T-spot.TB y el Quantiferon-TB. El Quantiferon-TB gold in tube ha demostrado una mayor eficacia para el diagnóstico de infección tuberculosa latente en pacientes con AR que el PPD (94); no obstante, esta eficacia disminuye en la población mayor de 60 años (95).
Neoplasias
Los anti TNF contrario a lo que se planteó hace unos años (96) no incrementarían el riesgo de neoplasias en general en pacientes con AR, pero sí incrementarían el riesgo de cáncer de piel no melanoma (97).
El uso de abatacept, tocilizumab, anakinra y rituximab no incrementaría el riesgo de aparición de neoplasias comparado con los pacientes con AR en tratamiento con fármacos no biológicos (91,98,99).
No se ha demostrado incremento en el riesgo de neoplasias con el uso de denosumab y belimumab; sin embargo debe tenerse en cuenta que la información es todavía insuficiente, debido a que se cuenta sólo con la información de los estudios aleatorizados quedando pendiente los reportes de los estudios de registros (78,100,101).
BIOSIMILARES
Biosimilar es un término que debe ser usado para describir versiones subsecuentes de productos biofarmacéuticos desarrollados por diferentes compañías luego de que ha expirado la patente de exclusividad que la compañía que desarrolló el producto innovador poseía; el producto biosimilar debe ser aprobado oficialmente por organismos regulatorios antes de su uso e idealmente debe haber sido sometido a los mismos pasos evaluativos de seguridad y eficacia que el producto original (4).
Sin embargo debe señalarse que un medicamento biológico no puede ser producido o copiado como un medicamento químico convencional, debido a que estos compuestos exhiben una gran complejidad en su estructura y pueden ser muy sensibles a cambios en los procesos de fabricación, por lo que, quienes los produzcan, deberían tener acceso al clon celular de origen, al banco de células original, y al proceso exacto de fermentación y purificación (4) lo cual por lo general no es factible. Como atenuante para su uso y aprobación en países como el nuestro es su costo mucho menor que el del producto original lo cual los hace asequibles a una población mayor.
CONCLUSIONES
La introducción de la terapia biológica en el manejo de enfermedades autoinmunes ha permitido incrementar la probabilidad de alcanzar mejorías clínicamente significativas e incluso remisión en algunos pacientes. Es importante conocer el perfil de seguridad de cada una de las drogas, y los factores predictivos de respuesta, de tal forma que sean utilizados de la mejor forma posible en beneficio de los pacientes. Un acápite de importancia en la seguridad es el riesgo de infecciones, por lo que deben realizarse evaluaciones de riesgo adecuadas, en particular con respecto a la tuberculosis y la infección tuberculosa latente.
Declaración de conflictos de intereses: Los autores declaran no tener conflictos de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Lee SJ, Chinen J, Kavanaugh A. Immunomodulator therapy: Monoclonal antibodies, fusion proteins, cytokines, and immunoglobulins. J Allergy Clin Immunol. 2010; 125: S314-23. [ Links ]
2. Lee SK, Ballow M. Monoclonal antibodies and fusion proteins and their complications: Targeting B cells in autoimmune diseases. Allergy Clin Immunol. 2010; 125:814-20. [ Links ]
3. Baumgart DC, Sandborn WJ. Inflammatory bowel disease: clinical aspects and established and evolving therapies. Lancet. 2007; 369:1641-57. [ Links ]
4. Acevedo-Vásquez E, Maldonado M, Alarcón GS. Terapia biológica en artritis reumatoide. En Acevedo- Vásquez E, Jara-Quezada LJ, Alarcón GS. Artritis Reumatoide. Una actualización de conceptos. Lima: Universidad Peruana Cayetano Heredia pp: 343-70. [ Links ]
5. World Health Organization. International Nonpropietary Names for the biological and biotechnological substances (a review) (Internet). Geneva: World Health Organization; 2011. [ Links ]
6. Johnston SL. Biologic therapies: what and when? J Clin Pathol. 2007; 60:8–17. [ Links ]
7. Singh JA, Furst DE, Bharat A, et al. 2012 Update of the 2008 American College of Rheumatology recommendations for the use of disease-modifying antirheumatic drugs and biologic agents in the treatment of rheumatoid arthritis. Arthritis Care Res. 2012; 64:625–39. [ Links ]
8. Commins SP, Borish L, Steinke JW. Immunologic messenger molecules: Cytokines, interferons, and chemokines. J Allergy Clin Immunol. 2010; 125: S53-72. [ Links ]
9. Calabrese L. The yin and yang of tumor necrosis factor inhibitors. Cleve Clin J Med. 2006; 73:251-6. [ Links ]
10. Dinarello CA, Simon A, van der Meer JW. Treating inflammation by blocking interleukin-1 in a broad spectrum of diseases. Nat Rev Drug Discover. 2012; 11: 633-52. [ Links ]
11. Genentech Inc. BLA 125276 ACTEMRA (tocilizumab). Risk evaluation and mitigation strategy (REMS). (Internet) South San Francisco, CA: Genentech, Inc. (Citado el 21 de enero de 2013). Disponible en: http://www.fda.gov/downloads/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/UCM202044.pdf [ Links ] 12. Lacey DL, Boyle WJ, Simonet WS, et al. Bench to bedside: elucidation of the OPG-RANK-RANKL pathway and the development of denosumab.Nat Rev Drug Discov. 2012; 11:401-19. [ Links ] 13. Tsourdi E, Rachner TD, Rauner M, Hamann C, Hofbauer LC. Denosumab for bone diseases: translating bone biology into targeted therapy. Eur J Endocrinol. 2011; 165:833-40. [ Links ] 14. National Cancer Institute. FDA Approval for Denosumab (Internet). 2011. (Citado el 21 de enero de 2013). Disponible en: 15. Youinou P. B cell conducts the lymphocyte orchestra. J Autoimmun. 2007; 28: 143-51. [ Links ] 16. U.S. Food and Drug Administration. FDA approves Rituxan to treat two rare disorders (Internet). Silver Spring, MD: U.S. Food and Drug Administration. (Citado el 21 de enero de 2013). Disponible en: 17. Zhang X, Park CS, Yoon SO, et al. BAFF supports human B cell differentiation in the lymphoid follicles through distinct receptors. Int Immunol. 2005; 17:779-88. [ Links ] 18. von Bulow GU, van Deursen JM, Bram RJ. Regulation of the T-independent humoral response by TACI. Immunity. 2001; 14:573-82. [ Links ] 19. Benson MJ, Dillon SR, Castigli E, et al. Cutting edge: the dependence of plasma cells and independence of memory B cells on BAFF and APRIL. J Immunol. 2008; 180:3655-9. [ Links ] 20. U.S. Food and Drug Administration. FDA approves Benlysta to treat lupus (Internet). Silver Spring, MD: U.S. Food and Drug Administration; 2011. (Citado el 21 de enero de 2013). Disponible en: 21. Herrero-Beaumont G, Martinez-Calatrava MJ, Castañeda S. Abatacept, mechanism of action: Concordance with its clinical profile. Reumatol Clin. 2012; 8:78–83. [ Links ] 22. Korhonen R, Moilanen E. Abatacept, a Novel CD80/86–CD28 T cell co-stimulation modulator, in the treatment of rheumatoid arthritis. Basic Clin Pharmacol Toxicol. 2009; 104: 276-84. [ Links ] 23. Linsley PS, Nadler SG. The clinical utility of inhibiting CD28-mediated costimulation. Immunol Rev. 2009; 229: 307–21. [ Links ] 24. Bristol-Myers Squib. Briefing document for abatacept (BMS-188667) (Internet). Princeton, NJ: Bristol-Myers Squibb Company Pharmaceutical Research Institute 2005 (Citado el 22 de enero de 2013). p. 1–188. Disponible en:
25. Diak P. Pediatric postmarketing Adverse Events Review (Internet). 2009. (Citado el 22 de enero de 2013). Disponible en: http://www.fda.gov/downloads/advisorycommittees/committeesmeetingmaterials/pediatricadvisorycommittee/ucm192033.pdf [ Links ] 26. Felson DT, Anderson JJ, Boers M, et al. American College of Rheumatology. Preliminary definition of improvement in rheumatoid arthritis. Arthritis Rheum. 1995; 38:727-35. [ Links ] 27. Fransen J, van Riel PL. The Disease Activity Score and the EULAR response criteria. Clin Exp Rheumatol. 2005; 23:S93-9. [ Links ] 28. Boini S, Guillemin F. Radiographic scoring methods as outcome measures in rheumatoid arthritis: properties and advantages. Ann Rheum Dis. 2001; 60:817–27. [ Links ] 29. Klareskog L, van der Heijde D, de Jager JP, et al. Therapeutic effect of the combination of etanercept and methotrexate compared with each treatment alone in patients with rheumatoid arthritis: double-blind randomised controlled trial. Lancet. 2004; 363: 675–81. [ Links ] 30. Maini R, St Clair EW, Breedveld F, et al. Infliximab (chimeric anti-tumour necrosis factor α monoclonal antibody) versus placebo in rheumatoid arthritis patients receiving concomitant methotrexate: a randomised phase III trial. Lancet. 1999; 354: 1932–9. [ Links ] 31. Smolen JS, Han C, Bala M, et al. Evidence of radiographic benefit of treatment with infliximab plus methotrexate in rheumatoid arthritis patients who had no clinical improvement. Arthritis Rheum. 2005; 52: 1020-30. [ Links ] 32. Schiff M, Keiserman M, Codding C, et al. Efficacy and safety of abatacept or infliximab vs placebo in ATTEST: a phase III, multi-centre, randomised, double-blind, placebo-controlled study in patients with rheumatoid arthritis and an inadequate response to methotrexate. Ann Rheum Dis. 2008; 67:1096– 103. [ Links ] 33. Weinblatt ME, Keystone EC, Furst DE, et al. Adalimumab, a Fully human anti–tumor necrosis factor α monoclonal antibody, for the treatment of rheumatoid arthritis in patients taking concomitant methotrexate. Artrhitis Rheum. 2003; 48: 35-45. [ Links ] 34. Keystone EC, Kavanaugh AF, Sharp JT, et al. Radiographic, clinical, and functional outcomes of treatment with adalimumab (a human anti–tumor necrosis factor monoclonal antibody) in patients with active rheumatoid arthritis receiving concomitant methotrexate therapy. Arthritis Rheum. 2004; 50: 1400-11. [ Links ] 35. Emery P, Fleischmann RM, Moreland LW, et al. Golimumab, a human anti–tumor necrosis factor monoclonal antibody, injected subcutaneously every four weeks in methotrexate-naive patients with active rheumatoid arthritis. Arthritis Rheum. 2009; 60; 2272-83. [ Links ] 36. Keystone EC, Genovese MC, Klareskog L, et al. Golimumab, a human antibody to Tumor Necrosis Factor α given by monthly subcutaneous injections, in active rheumatoid arthritis despite methotrexate therapy: the GO
37. Genovese MC, Han C, Keystone EC, et al. Effect of golimumab on patient-reported outcomes in rheumatoid arthritis: results from the GO-FORWARD study. J Rheumatol. 2012; 39:1185-91. [ Links ]
38. Keystone E, van der Heidje D, Mason Jr D, et al. Certolizumab pegol plus methotrexate is significantly more effective than placebo plus methotrexate in active rheumatoid arthritis. Arthritis Rheum. 2008; 58: 3319-29. [ Links ]
39. Smolen JS, Landewé RB, Mease PJ, et al. Efficacy and safety of certolizumab pegol plus methotrexate in active rheumatoid arthritis: The RAPID 2 study. Ann Rheum Dis. 2009; 68:797-804. [ Links ]
40. Fleischmann R, Vencovsky J, van Vollenhoven R, et al. Efficacy and safety of certolizumab pegol monotherapy every 4 weeks in patients with rheumatoid arthritis failing previous disease-modifying antirheumatic therapy: the FAST4WARD study. Ann Rheum Dis. 2009; 68:805-11. [ Links ]
41. Cohen SB, Moreland LW, Cush JJ, Greenwald MW, Block S, Shergy WJ. A multicentre, double blind, randomised, placebo controlled trial of anakinra (Kineret), a recombinant interleukin 1 receptor antagonist, in patients with rheumatoid arthritis treated with background methotrexate Ann Rheum Dis. 2004; 63:1062-8. [ Links ]
42. Jiang Y, Genant HK, Watt I, et al. A multicenter, double-blind, dose-ranging, randomized, placebo-controlled study of recombinant human interleukin-1 receptor antagonist in patients with rheumatoid arthritis: radiologic progression and correlation of Genant and Larsen scores. Arthritis Rheum. 2000; 43:1001-9. [ Links ]
43. Maini RN, Taylor PC, Szechinski J, et al. Double-blind randomized controlled clinical trial of the interleukin-6 receptor antagonist, tocilizumab, in European patients with rheumatoid arthritis who had an incomplete response to methotrexate. Arthritis Rheum. 2006; 54:2817-29. [ Links ]
44. Jones G, Sebba A, Gu J, et al. Comparison of tocilizumab monotherapy versus methotrexate monotherapy in patients with moderate to severe rheumatoid arthritis: the AMBITION study. Ann Rheum Dis. 2010; 69:88-96. [ Links ]
45. Genovese MC, McKay JD, Nasonov EL, et al. Interleukin-6 receptor inhibition with tocilizumab reduces disease activity in rheumatoid arthritis with inadequate response to disease-modifying antirheumatic drugs: the tocilizumab in combination with traditional disease-modifying antirheumatic drug therapy study. Arthritis Rheum. 2008; 58:2968- 80. [ Links ]
46. Kremer JM, Blanco R, Brzosko M, et al. Tocilizumab inhibits structural joint damage in rheumatoid arthritis patients with inadequate responses to methotrexate: results from the double-blind treatment phase of a randomized placebo-controlled trial of tocilizumab safety and prevention of structural joint damage at one year. Arthritis Rheum. 2011; 63:609-21. [ Links ]
47. Emery P, Keystone E, Tony HP, et al. IL-6 receptor inhibition with tocilizumab improves treatment outcomes in patients with rheumatoid arthritis refractory to anti-tumour necrosis factor biologicals: results from a 24-week multicentre randomised placebo-controlled trial. Ann Rheum Dis. 2008; 67:1516-23. [ Links ]
48. Emery P, Fleischmann R, Filipowicz-Sosnowska A, et al. Efficacy and safety of rituximab in patients with active rheumatoid arthritis despite methotrexate treatment: results of a phase IIB randomized, double-blind, placebo-controlled, dose-ranging trial. Arthritis Rheum. 2006; 54:1390-400. [ Links ]
49. Mease PJ, Revicki DA, Szechinski J, et al. Improved health-related quality of life for patients with active rheumatoid arthritis receiving rituximab: Results of the Dose-ranging Assessment: international Clinical Evaluation of Rituximab in rheumatoid arthritis (DANCER) trial. J Rheumatol. 2008; 35:20-30. [ Links ]
50. Cohen SB, Emery P, Greenwald MW, et al. Rituximab for rheumatoid arthritis refractory to anti-tumor necrosis factor therapy: Results of a multicenter, randomized, double-blind, placebo-controlled, phase III trial evaluating primary efficacy and safety at twenty-four weeks. Arthritis Rheum. 2006; 54:2793- 806. [ Links ]
51. Keystone E, Emery P, Peterfy CG, et al. Rituximab inhibits structural joint damage in patients with rheumatoid arthritis with an inadequate response to tumour necrosis factor inhibitor therapies. Ann Rheum Dis. 2009; 68:216-21. [ Links ]
52. Emery P, Deodhar A, Rigby WF, et al. Efficacy and safety of different doses and retreatment of rituximab: a randomised, placebo-controlled trial in patients who are biological naive with active rheumatoid arthritis and an inadequate response to methotrexate (Study Evaluating Rituximabs Efficacy in MTX iNadequate rEsponders (SERENE)). Ann Rheum Dis. 2010; 69:1629-35. [ Links ]
53. Kremer JM, Genant HK, Moreland MW, et al. Effects of abatacept in patients with methotrexate-resistant active rheumatoid arthritis: a randomized trial. Ann Inter Med. 2006; 144: 865-76. [ Links ]
54. Kremer JM, Dougados M, Emery P, et al. Treatment of rheumatoid arthritis with the selective costimulation modulator abatacept. Arthritis Rheum. 2005; 52: 2263-71. [ Links ]
55. Genovese MC, Becker JC, Schiff M, et al. Abatacept for rheumatoid arthritis refractory to tumor necrosis factor α inhibition. N Engl J Med. 2005; 353:1114-23. [ Links ]
56. Nixon R, Bansback N, Brennan A.The efficacy of inhibiting tumour necrosis factor alpha and interleukin 1 in patients with rheumatoid arthritis: a meta-analysis and adjusted indirect comparisons. Rheumatology (Oxford). 2007; 46:1140-7. [ Links ]
57. Breedveld FC, Weisman MH, Kavanaugh AF, et al. The PREMIER study: A Multicenter, randomized, double-blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early, aggressive rheumatoid arthritis who had not had previous methotrexate treatment. Arthritis Rheum. 2006; 54: 26-37. [ Links ]
58. Strand V, Rentz AM, Cifaldi MA, Chen N, Roy S, Revicki D. Health-related quality of life outcomes of adalimumab for patients with early rheumatoid arthritis: results from a randomized multicenter study. J Rheumatol. 2012; 39:63-72. [ Links ]
59. Emery P, Breedveld FC, Hall S, et al. Comparison of methotrexate monotherapy with a combination of methotrexate and etanercept in active, early, moderate to severe rheumatoid arthritis (COMET): a randomised, double-blind, parallel treatment trial. Lancet. 2008; 372: 375–82. [ Links ]
60. St.Clair EW, Van der Heidje DM, Smolen JS, et al. Combination of infliximab and methotrexate therapy for early rheumatoid arthritis. Arthritis Rheum. 2004; 50: 3432-43. [ Links ]
61. Tak PP, Rigby WF, Rubbert-Roth A, et al. Inhibition of joint damage and improved clinical outcomes with rituximab plus methotrexate in early active rheumatoid arthritis: the IMAGE trial. Ann Rheum Dis. 2011; 70:39-46. [ Links ]
62. Rigby W, Ferraccioli G, Greenwald M, et al. Effect of rituximab on physical function and quality of life in patients with rheumatoid arthritis previously untreated with methotrexate. Arthritis Care Res (Hoboken). 2011; 63:711-20. [ Links ]
63. Westhovens R, Robles M, Ximenes AC, et al. Clinical efficacy and safety of abatacept in methotrexate-naive patients with early rheumatoid arthritis and poor prognostic factors. Ann Rheum Dis. 2009; 68:1870-7. [ Links ]
64. Isaacs JD, Cohen SB, Emery P, et al. Effect of baseline rheumatoid factor and anticitrullinated peptide antibody serotype on rituximab clinical response: a meta-analysis. Ann Rheum Dis. 2013 72; 329-36. [ Links ]
65. Garrett S, Jenkinson T, Kennedy LG, Whitelock H, Gaisford P, Calin A. A new approach to defining disease status in ankylosing spondylitis: the Bath Ankylosing Spondylitis Disease Activity Index. J Rheumatol. 1994; 21:2286–91. [ Links ]
66. Calin A, Garrett S, Whitelock H, et al. A new approach to defining functional ability in ankylosing spondylitis: the development of the Bath Ankylosing Spondylitis Functional Index. J Rheumatol. 1994; 21:2281–5. [ Links ]
67. Jenkinson TR, Mallorie PA, Whitelock HC, Kennedy LG, Garrett SL, Calin A. Defining spinal mobility in ankylosing spondylitis (AS): the Bath AS Metrology Index. J Rheumatol. 1994; 21:1694–8. [ Links ]
68. Anderson JJ, Baron G, van der Heijde D, Felson DT, Dougados M. Ankylosing Spondylitis Assessment Group preliminary definition of short-term improvement in ankylosing spondylitis. Arthritis Rheum. 2001;44:1876–86 [ Links ]
69. Brandt J, Khariouzov A, Listing J, et al. Six-month results of a double-blind, placebo-controlled trial of etanercept treatment in patients with active ankylosing spondylitis. Arthritis Rheum. 2003; 48:1667-75. [ Links ]
70. van der Heijde D, Dijkmans B, Geusens P, et al. Efficacy and safety of infliximab in patients with ankylosing spondylitis: results of a randomized, placebo-controlled trial (ASSERT). Arthritis Rheum. 2005; 52:582-91. [ Links ]
71. van der Heijde D, Kivitz A, Schiff MH, et al. Efficacy and safety of adalimumab in patients with ankylosing spondylitis: results of a multicenter, randomized, double-blind, placebo-controlled trial. Arthritis Rheum. 2006; 54:2136-46. [ Links ]
72. Inman RD, Davis JC Jr, Heijde Dv, et al. Efficacy and safety of golimumab in patients with ankylosing spondylitis: results of a randomized, double-blind, placebo-controlled, phase III trial. Arthritis Rheum. 2008; 58:3402-12. [ Links ]
73. Furie RA, Petri MA, Wallace DJ, et al. Novel evidence-based systemic lupus erythematosus responder index. Arthritis Rheum. 2009; 61:1143- 51. [ Links ]
74. Navarra SV, Guzmán RM, Gallacher AE, et al. Efficacy and safety of belimumab in patients with active systemic lupus erythematosus: a randomised, placebo-controlled, phase 3 trial. Lancet. 2011; 377:721-31. [ Links ]
75. Furie R, Petri M, Zamani O, et al. A phase III, randomized, placebo-controlled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus. Arthritis Rheum. 2011; 63:3918-30. [ Links ]
76. Cummings SR, San Martin J, McClung MR, et al. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med. 2009 20; 361:756-65. [ Links ]
77. Singh JA, Wells GA, Christensen R, et al. Adverse effects of biologics: a network meta-analysis and Cochrane overview. Adverse effects of biologics: a network meta-analysis and Cochrane overview. Cochrane Database Syst Rev. 2011:CD008794. [ Links ]
78. Wallace D, Navarra S, Petri M, et al. Safety profile of belimumab: pooled data from placebo-controlled phase 2 and 3 studies in patients with systemic lupus erythematosus. Lupus. 2013; 22: 144-54. [ Links ]
79. Miller PD. A review of the efficacy and safety of denosumab in postmenopausal women with osteoporosis.Ther Adv Musculoskelet Dis. 2011; 3: 271-82. [ Links ]
80. Toulis KA, Anastasilakis AD. Increased risk of serious infections in women with osteopenia or osteoporosis treated with denosumab. Osteoporos Int. 2010; 21:1963–4. [ Links ]
81. Anastasilakis AD, Toulis KA, Polyzos SA, Anastasilakis CD, Makras P. Long-term treatment of osteoporosis: safety and efficacy appraisal of denosumab. Ther Clin Risk Manag. 2012; 8:295- 306. [ Links ]
82. Watts NB, Roux C, Modlin JF, et al. Infections in postmenopausal women with osteoporosis treated with denosumab or placebo: coincidence or causal association? Osteoporos Int. 2012; 23:327- 37. [ Links ]
83. Strangfeld A, Eveslage M, Schneider M. The risk of infections associated with rheumatoid arthritis, with its comorbidity and treatment. Rheumatology (Oxford). 2013; 52:53-61. [ Links ]
84. Strangfeld A, Eveslage M, Schneider M, et al. Treatment benefit or survival of the fittest: what drives the time-dependent decrease in serious infection rates under TNF inhibition and what does this imply for the individual patient? Ann Rheum Dis. 2011; 70:1914-20. [ Links ]
85. Salliot C, Dougados M, Gossec L. Risk of seriousinfections during rituximab, abatacept and anakinra treatments for rheumatoid arthritis: meta-analyses of randomised placebo-controlled trials. Ann Rheum Dis. 2009 Jan;68(1):25-32 [ Links ]
86. Singh JA, Wells GA, Christensen R, et al. Adverse effects of biologics: a network meta-analysis and Cochrane overview. Cochrane Database Syst Rev. 2011:CD008794. [ Links ]
87. Solovic I, Sester M, Gomez-Reino JJ, et al. The risk of tuberculosis related to tumour necrosis factor antagonist therapies: a TBNET consensus statement. Eur Respir J. 2010; 36:1185-206. [ Links ]
88. Hochberg MC, Westhovens R, Aranda R, et al. Long-term safety of abatacept: integrated analysis of clinical program data of up to 7 years of treatment. Arthritis Rheum. 2010; 62:S164. [ Links ]
89. Schiff MH, Kremer JM, Jahreis A, Vernon E, Isaacs JD, van Vollenhoven RF.Integrated safety in tocilizumab clinical trials. Arthritis Res Ther. 2011; 13: R141. [ Links ]
90. Fleischmann RM, Tesser J, Schiff MH, et al. Safety of extended treatment with anakinra in patients with rheumatoid arthritis. Ann Rheum Dis. 2006; 65:1006-12. [ Links ]
91. van Vollenhoven RF, Emery P, Bingham CO 3rd, Keystone EC, Fleischmann RM, Furst DE, Long-term safety of rituximab in rheumatoid arthritis: 9.5-year follow-up of the global clinical trial programme with a focus on adverse events of interest in RA patients. Ann Rheum Dis. 2012 Nov 7 (Epub ahead of print). [ Links ]
92. American Thoracic Society. Targeted tuberculin testing and treatment of latent tuberculosis infection. Am J Respir Crit Care Med. 2000; 161:S221-247. [ Links ]
93. Ponce de Leon D, Acevedo-Vasquez E, Sanchez- Torres A, et al. Attenuated response to purified protein derivative in patients with rheumatoid arthritis: study in a population with a high prevalence of tuberculosis. Ann Rheum Dis. 2005; 64:1360–1. [ Links ]
94. Ponce de Leon D, Acevedo-Vasquez E, Alvizuri S, et al. Comparison of an interferongamma assay with tuberculin skin testing for detection of tuberculosis (TB) infection in patients with rheumatoid arthritis in a TB-endemic population. J Rheumatol. 2008; 5:776–81. [ Links ]
95. Acevedo E, Ponce de León D, Gamboa R. Latent tuberculosis infection in rheumatoid arthritis patients. Rheum Dis Clin North Am. 2009; 35:163- 182. [ Links ]
96. Bongartz T, Sutton AJ, Sweeting MJ, Buchan I, Matteson EL, Montori V. Anti-TNF antibody therapy in rheumatoid arthritis and the risk of serious infections and malignancies: systematic review and meta-analysis of rare harmful effects in randomized controlled trials. JAMA. 2006; 295:2275-85. [ Links ]
97. Keystone EC. Does anti-tumor necrosis factor-α therapy affect risk of serious infection and cancer in patients with rheumatoid arthritis?: A review of long term data. J Rheumatol. 2011; 38:1552-62. [ Links ]
98. Simon TA, Smitten AL, Franklin J, et al. Malignancies in the rheumatoid arthritis abatacept clinical development programme: an epidemiological assessment. Ann Rheum Dis. 2009; 68:1819-26. [ Links ]
99. Lopez-Olivo MA, Tayar JH, Martinez-Lopez JA, et al. Risk of malignancies in patients with rheumatoid arthritis treated with biologic therapy: a meta-analysis. JAMA. 2012; 308:898-908. [ Links ]
100.Anastasilakis AD, Toulis KA, Goulis DG, et al. Efficacy and safety of denosumab in postmenopausal women with osteopenia or osteoporosis: a systematic review and a meta-analysis. Horm Metab Res. 2009; 41:721–9. [ Links ]
101.von Keyserlingk C, Hopkins R, Anastasilakis A, et al. Clinical efficacy and safety of denosumab in postmenopausal women with low bone mineral density and osteoporosis: a meta-analysis. Semin Arthritis Rheum. 2011;41(2):178–186. [ Links ]
Correspondencia:
Dra. Graciela S. Alarcón
Correo electrónico: galarcon@uab.edu