Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Medica Herediana
Print version ISSN 1018-130X
Rev Med Hered vol.24 no.2 Lima Apr./jun. 2013
Gran Ronda de Medicina Interna y Especialidades del Hospital Nacional Cayetano Heredia / Caso clínico 02-2013. Varón de 63 con tos, disnea, fiebre y lesiones pulmonares
Grand Round of Internal Medicine and Specialties at the Hospital Nacional Cayetano Heredia/ Clinical case 02-2013. A 63 year-old man with cough, dyspnea, fever and pulmonary abnormalities
Editor de sección: Dr. Sergio Vásquez Kunze; Editores asociados: Dr. Héctor Sosa Valle, Dr. Ray Ticse Aguirre, Dr. Leslie Soto Arquiñigo, Dra. Elena Zelaya Arteaga.
Héctor Sosa (1), Miguel Barrios (2), Félix Medina (3).
(1) Médico asistente, Servicio de Medicina Interna. Dpto. de Medicina, Hospital Nacional Cayetano Heredia. Lima, Perú.
(2) Médico Residente de 3er año de Medicina Interna. Dpto. de Medicina, Hospital Nacional Cayetano Heredia. Lima, Perú.
(3) Médico asistente, Servicio de Cardiología. Dpto. de Medicina, Hospital Nacional Cayetano Heredia. Lima, Perú.
CASO CLINICO
Dr. Miguel Barrios Josán (Residente de tercer año de Medicina Interna):
Varón de 63 años natural de Junín y procedente de Lima con historia de tos, disnea y fiebre de 3 semanas de evolución. El paciente inició sus síntomas hace 3 semanas presentando tos con expectoración escasa asociada a disnea a moderados esfuerzos; posteriormente se agregó sensación de alza térmica no cuantificada intermitente. Continuó con los síntomas y una semana antes del ingreso la tos se hizo más exigente, la disnea empeoró hasta leves esfuerzos y persistió con sensación de alza térmica, lo que motivó que acuda a un centro de salud donde le indicaron antibióticos por 3 días, sin mostrar mejoría. Un día antes del ingreso, tenía disnea en reposo, intolerancia al decúbito y fiebre de 38°C. Por este motivo, acudió a la emergencia de nuestro hospital siendo admitido.
En las funciones biológicas tenía hiporexia, sed conservada, orina y deposiciones sin alteraciones, pero refería una pérdida de peso no cuantificada durante los últimos 3 meses.
Tenía diagnóstico de hipertensión arterial de larga data en tratamiento con enalapril, amlodipino e hidroclorotiazida. Negaba historia de diabetes mellitus, fiebre tifoidea, fiebre Malta, hepatitis B o C y transfusiones previas.
Había tenido varias hospitalizaciones: Por compromiso pleural con diagnóstico presuntivo de tuberculosis hace 20 años recibiendo tratamiento por 12 meses; por infarto de miocardio agudo hace 6 años y por insuficiencia cardíaca descompensada hace 1 año y medio, en la que cursó con fibrilación auricular paroxística, que revirtió a las 24 horas. Por este motivo recibía amiodarona 200 mg al día, medicación que continuaba hasta la actualidad. No tenía cirugía previa. No consumía alcohol y no fumaba. No refería conducta sexual de riesgo para enfermedades transmisibles. No tenía antecedentes familiares de importancia. Desde hace 30 años, trabaja como chofer de transporte público.
En la revisión anamnésica de sistemas y aparatos mencionó disnea a esfuerzos moderados desde hace aproximadamente 6 meses.
Al examen físico tenía presión arterial 120/70 mm Hg, pulso 74 por minuto, frecuencia respiratoria 28 por minuto y temperatura de 37,5°C. Lucía en regular estado general, en regular estado de nutrición y buen estado de hidratación. La piel era húmeda, caliente, sin palidez ni ictericia. No presentaba edema en extremidades ni clubbing. Había disminución del murmullo vesicular y crepitantes tipo velcro en ambas bases pulmonares. Al examen cardiovascular los ruidos cardíacos eran rítmicos, no se auscultaban soplos; había ingurgitación yugular y reflujo hepato-yugular. El resto del examen no fue contributorio.
Los exámenes de laboratorio al ingreso mostraron: hemoglobina 12,1 gr/dl, leucocitos 11 900/mm3sin desviación izquierda, plaquetas 295 000/mm3, perfil de coagulación normal, VSG 80 mm/h, glucosa 102 mg /dl, urea 35 mg/dl, creatinina 1 mg/dl, Na: 133 mEq/L, K: 3,3 mEq/L, Cl: 103 mEq/L, proteínas totales: 7 g/dl, albúmina: 3,3 g/dl, el perfil hepático era normal. Además se encontró DHL 1 652 UI/L. En la gasometría: pH: 7,44; PO2: 55,9 mm Hg, PCO2: 31,5 mm Hg, HCO3- : 19,5 mEq/L, Sat O2: 90,7 % a FiO2: 21%.
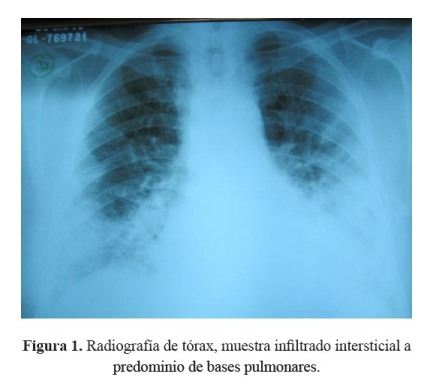
La radiografía de tórax mostró infiltrados intersticiales predominantemente en bases pulmonares ( Figura 1).
El electrocardiograma mostró ritmo sinusal, crecimiento de la aurícula izquierda y extrasístoles supraventriculares aisladas. En la ecocardiografía se evidenció una fracción de eyección de 52% (por Simpson), aurícula izquierda de 58,2 mm, hipokinesia postero-inferior y septo-basal, además se encontró alteración de la relajación del ventrículo izquierdo.
El paciente recibió inicialmente tratamiento con oxígeno, furosemida y antibióticoterapia con ceftriaxona y claritromicina por 3 días, persistiendo con picos febriles, por lo que se cambió la cobertura antibiótica con ceftazidima y amikacina; sin embargo, la evolución fue estacionaria persistiendo con fiebre, disnea y requerimiento de oxígeno.
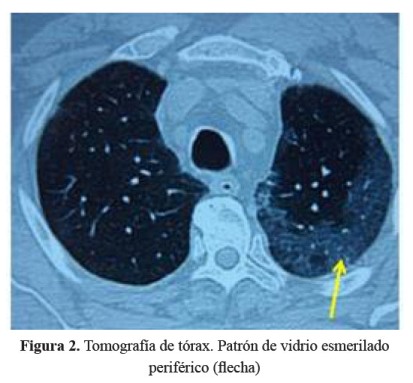
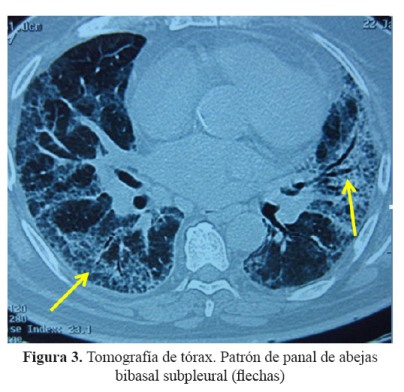
Se realizó una tomografía de tórax que mostró infiltrados intersticiales bilaterales con patrón en vidrio esmerilado en tercio medio e inferior a predominio del pulmón izquierdo (Figura 2), mientras que en las bases se observó patrón en panal de abeja con engrosamiento de los septos y bronquiectasias de tracción ( Figura 3).
DISCUSIÓN
En este punto se inició la discusión, centrándose en el diagnóstico etiológico, el tratamiento y el manejo de las comorbilidades, participando los servicios de Medicina interna, Neumología, Cardiología y el Dr. Amador Carcelén Bustamante como invitado.
Dr. Héctor Sosa Valle (Medicina Interna)
El paciente tenía antecedente de insuficiencia cardíaca y de fibrilación auricular paroxística por lo que recibía tratamiento con amiodarona, acudió con una historia de 3 semanas de tos, disnea y fiebre, llamando la atención desde el ingreso la radiografía de tórax con infiltrado bibasal tipo consolidado pero también con compromiso intersticial en la periferia. Recibió tratamiento para neumonía adquirida en la comunidad con ceftriaxona y claritromicina, además diuréticos por el antecedente de insuficiencia cardíaca. La evolución fue estacionaria, se cambió la cobertura antibiótica a ceftazidima y amikacina; sin embargo, la fiebre persistió. La tomografía de tórax confirmó lo que se evidenciaba en la radiografía, un compromiso intersticial difuso, con áreas de patrón en vidrio esmerilado en la periferie y patrón en panal de abeja en bases.
Sobre el compromiso pulmonar, se podría plantear posibilidades de etiología infecciosa como neumonía por Pneumocyistis jirovecci (PCP), pero el paciente no tenía factores de riesgo ni signos clínicos de inmunosupresión. El patrón radiológico en PCP típicamente es de tipo vidrio esmerilado, de localización perihiliar bilateral, con áreas de compromiso alveolar en parches (1).
Por el antecedente de uso de amiodarona a dosis de 200 mg diarios por 1 año y medio y el compromiso intersticial, otra posibilidad diagnóstica sería toxicidad pulmonar por amiodarona, en el que se describe infiltrados en vidrio esmerilado en la periferie, compromiso reticular en bases, y zonas de atenuación aumentada por acumulo de yodo en el parénquima pulmonar simulando lesión tipo masa pulmonar solitaria (2). En esta enfermedad se encuentran células espumosas en el lavado bronquioloalveolar (LBA), que son complejos de macrófagos con lípidos, que no son diagnósticas puesto que también se encuentran en pacientes que reciben amiodarona pero sin cuadro de toxicidad pulmonar (3); si no lo presenta es excluyente.
También se deben considerar otros causas de neumonitis intersticial aguda con fiebre, como infecciones virales, neumonías atípicas (legionela, micoplasma), neumonitis por hipersensibilidad, neumonitis eosinofílica y neumonitis intersticial aguda (4). El uso de antibióticos sin respuesta adecuada y la evolución del cuadro clínico alejarían las causas infecciosas y la neumonitis intersticial aguda. En la neumonitis eosinofílica se encuentra eosinofilia en sangre periférica en el 80% de los pacientes y requiere para su diagnóstico definitivo eosinófilos en el LBA, el patrón radiológico es de infiltrados periféricos, a predominio de ápices; en nuestro paciente no había eosinofilia y los infiltrados son en panal de abeja a predominio de bases pulmonares. La neumonitis por hipersensibilidad requiere un antecedente de exposición que a veces puede pasar desapercibido y necesita medición de aglutininas específicas en suero, en nuestro paciente no hubo antecedente de exposición a estos antígenos.
En cuanto al antecedente de insuficiencia cardiaca, al momento no impresiona que el paciente tenga insuficiencia cardíaca descompensada, la tomografía pulmonar no sugiere este cuadro, pero requiere ampliar el estudio con la determinación de pro BNP N-terminal.
Dado el uso de amiodarona y el cuadro clínico radiográfico, mi principal diagnóstico es toxicidad pulmonar por amiodarona. Para llegar al diagnóstico se deben realizar exámenes para descartar inmunosupresión por VIH y otras etiologías infecciosas, además la posibilidad de realizar un LBA y biopsia transbronquial para la búsqueda de células espumosas y células inflamatorias y el descarte de las otras causas de neumonitis intersticial aguda antes mencionadas (5). La biopsia pulmonar vía toracoscopía podría ser el mejor método diagnóstico, pero diversos autores lo consideran un método que podría tener riesgos como empeoramiento del cuadro clínico, por lo que su utilización es controversial. También es importante buscar toxicidad por amiodarona en otros órganos como tiroides solicitando pruebas de función tiroidea y de haber compromiso descartando etiología inmune con pruebas como anticuerpos antiperoxidasa.
El compromiso en varios órganos apoyaría la sospecha de toxicidad pulmonar con amiodorana.
En pacientes medicados con amiodarona, con un cuadro clínico e imágenes compatibles con enfermedad pulmonar intersticial difusa, más aun siendo las imágenes similares a las descritas en toxicidad por amiodarona, se debe suspender la medicación e iniciar corticoides equivalente a prednisona 1 mg/Kg con disminución progresiva de la dosis en 6 a 12 meses de manera empírica (6). La broncoscopía se puede hacer posteriormente para descartar otras patologías y corroborar la sospecha diagnóstica.
Dr. Oscar Gayoso Cervantes (Neumología)
El paciente tenía el antecedente de efusión pleural que fue tratada como una pleuresía tuberculosa cuando tuvo 30 años, donde no se le realizaron procedimientos (toracocentesis, biopsia pleural) para la confirmación del diagnóstico. Habría que aceptar que el paciente tuvo tuberculosis y recibió tratamiento por 1 año y que es posible que se haya curado, aunque con algunas secuelas. Posteriormente fue diagnosticado de insuficiencia cardíaca y fibrilación auricular recibiendo amiodarona.
En nuestra serie, en pacientes menores de 40 años la primera posibilidad siempre es tuberculosis, otras posibles etiologías son secundarias a enfermedad del tejido conectivo. En pacientes mayores de 40 años existen otras causas como neoplasias.
El paciente viene con un cuadro subagudo presentando disnea progresiva, fiebre e infiltrados pulmonares difusos de tipo intersticial predominantemente e infiltrados alveolares.
En el diagnóstico diferencial, en primer lugar se debe considerar la etiología infecciosa. Dentro de las infecciones, si el paciente tuviera inmunosupresión, PCP sería una buena opción, sin embargo, hay que considerar otras opciones como una reactivación de tuberculosis y aunque el paciente no tiene el antecedente de viajes recientes a la selva, habría que considerar la posibilidad de infección por hongos.
Dentro de las causas no infecciosas se debería considerar la neumonitis por hipersensibilidad que puede dar fiebre, compromiso intersticial y alveolar difuso. En lo que respecta a enfermedad pulmonar intersticial idiopática, los pacientes generalmente no cursan con fiebre ni efusión pleural.
Otras etiologías, como vasculitis tipo Granulomatosis de Wegener y enfermedades del tejido conectivo son condiciones que también debemos considerar, por lo que el paciente requiere ampliar estudios con ANA y ANCA. Existen casos infrecuentes de enfermedad de Still con compromiso pulmonar intersticial, que debutan con fiebre persistente y compromiso articular.
La posibilidad de toxicidad pulmonar por amiodarona es bien reconocida en pacientes que en el post operatorio son expuestos a amiodarona, presentando compromiso pulmonar intersticial agudo y pudiendo cursar como síndrome de distress respiratorio agudo (SDRA) o como daño alveolar difuso. Los pacientes expuestos crónicamente a amiodarona pueden desarrollar algunas formas de enfermedad intersticial; se describen en la literatura formas agresivas por toxicidad por amiodarona. Hay que recordar que la amiodarona se deposita en el interior de las células y se puede encontrar células espumosas que son macrófagos alveolares con depósitos de amiodarona.
El paciente no tiene evidencia clínica de insuficiencia cardíaca al momento, por lo que esto no representa su problema principal.
El paciente requiere completar estudios con broncoscopía, lavado bronquioalveolar con cepillado y biopsia transbronquial para confirmar el diagnóstico.
Dr. Félix Medina Palomino (Cardiología)
En mi opinión tenemos 3 escenarios: fibrilación auricular (FA) catalogada como paroxística, compromiso pulmonar y comorbilidades relevantes como enfermedad hipertensiva y coronaria. Haré un comentario sobre FA, para luego discutir el problema del paciente.
La FA es la arritmia supraventricular más frecuente, tiene carácter epidémico, de preocupante impacto en la morbimortalidad total y cardiovascular. Por todo, en los últimos 3 años se han publicado diversas guías internacionales (norteamericana, europea, canadiense y japonesa), con el objetivo de uniformizar criterios de diagnóstico y de tratamiento. El enfoque de FA contempla 4 aspectos fundamentales (7):
1.Documentación de la arritmia (electrocardiograma o estudio Holter), así como tipificarla (paroxística, persistente o permanente). Esto último, frecuentemente no es posible determinarlo en la primera evaluación porque se basa en el tiempo de enfermedad (desde días a 1 año). Sin embargo, más relevante y de reciente consenso es la repercusión clínica a través de la sintomatología y el grado de incapacidad derivada de ello (score EHRA).
2. Definir el riesgo de tromboembolismo; que es independiente del tipo de FA, pero sí estrechamente ligado a factores de riesgo asociados (edad, género, hipertensión arterial, diabetes mellitus, enfermedad coronaria, stroke previo, insuficiencia cardiaca). Esto último se ha sistematizado con el score CHADS2 y más recientemente optimizado con CHA2DS2-VASc. Pero no es decidir la anticoagulación arbitrariamente, debe a su vez descontarse el riesgo de sangrado (score HASBLED) para que si hay un claro beneficio clínico neto, se puede indicar la anticoagulación.
Las alternativas para la anticoagulación oral se han ampliado a raíz de la aprobación de nuevos agentes tan efectivos y acaso más seguros que la tradicional y aún vigente warfarina.
3.Definir el dilema de la arritmia per se, es decir:
3.1 Control de ritmo. Aquí el punto es decidir si justifica y si hay demostración basada en evidencias de que nos anime a revertir a ritmo sinusal y mantenerlo como tal. Este es el escenario de las FA paroxóstica y persistente.
En los casos agudos y hemodinámicamente inestables se procede a la cardioversión eléctrica inmediata. Caso contrario, se indican fármacos. Al respecto, la mejor opción es vernakalant, antiarrítmico de última generación y acción ultrarápida. Alternativas: propafenona, flecainida y más alejado amiodarona. La terapia crónica es un dilema, teniendo en cuenta el rol más firme que se está documentando con la técnica de ablación mediada por catéter (ya se han publicado seguimientos de 3 a 5 años y tasas de éxitos superiores al 80%) (8). Las nuevas guías contemplan a esta opción como de primera línea. Amiodarona está contemplada para los casos más refractarios, comorbilidades importantes, cardiopatías estructurales subyacentes (hipertrofia ventricular, disfunción sistólica, isquemia).
3.2 Control de la frecuencia. Reservado para los casos de FA permanente; en cuyo caso se pretende mantener una respuesta ventricular fisiológicamente conveniente (reposo 60-80 cpm ó 110 en ejercicio). Opciones al respecto: calcio antagonistas cronotropos negativos, β-bloqueadores, propafenona, tambiιn amiodarona como última opción. No es infrecuente que nos veamos obligados a terapia combinada.
4. Manejo de las comorbilidades. No tiene sentido preocuparse sólo de FA y perder de vista y control comorbilidades tan relevantes como hipertensión arterial, enfermedad coronaria, dislipidemia, etc.
El caso es muy importante porque nos permite hacer varias reflexiones. En principio sobre la fibrilación auricular (FA), que fue documentada en una hospitalización anterior, el enfoque fue de una FA paroxística en un paciente de alto riesgo de cardioembolismo. Definitivamente cumple criterios para recibir anticoagulación por CHADS-VASc de 2.
Sobre el uso de antiarrítmicos debemos ser muy cautelosos, su uso a largo plazo sólo está recomendado en la FA paroxística que es recurrente. Cuando se contempla el uso de antiarrítmicos, se debe evaluar la existencia o no de cardiopatía estructural; si no existe cardiopatía estructural se tienen varias alternativas terapéuticas dentro de ellas propafenona que está a nuestro alcance y que es menos tóxica que amiodarona. Si existe cardiopatía estructural se puede subdividir en hipertróficas, coronarias o con insuficiencia cardíaca, donde lamentablemente a pesar de su toxicidad, amiodarona es la de elección (9) desde el punto de vista de efectividad; sin embargo, recientemente se dispone de dronedarona, una droga similar a amiodarona (10), menos tóxica al no tener iodo en su composición, pero de mayor costo.
El mensaje principal de este caso es que tiene que estar justificado el uso de antiarrítmicos, basado en el hecho de ser una arritmia muy sintomática, que sea descompensante o ser extremadamente recurrente. Un paciente que tiene un primer episodio no necesariamente debe recibir antiarrítmicos, puede manejarse solo con control de la frecuencia cardiaca (β-bloqueadores, calcio antagonistas, digitálicos). Definitivamente es una enseñanza que debe quedar.
Por lo tanto, existe la posibilidad de toxicidad pulmonar por amiodarona, aunque en nuestro medio no ha sido investigada y no se busca regularmente. El paciente que recibe amiodarona debe ser evaluado periódicamente con radiografías de pulmón, pruebas de función pulmonar, perfil tiroideo, perfil hepático ante la posibilidad de toxicidad por amiodarona (11). En otras latitudes se usa amiodarona con mucha cautela y como último recurso.
Estoy de acuerdo plenamente con la suspensión de la amiodarona; en realidad, en la hospitalización anterior no existía indicación estricta para usar amiodarona y por lo que hemos podido revisar en la historia clínica el paciente no tuvo otros episodios de fibrilación auricular por lo que no se justificaría el uso de terapia antiarrítmica.
Sobre la insuficiencia cardíaca, el paciente necesita una ecocardiografía, el pro-BNP T- terminal tiene un rol importante con valores discriminantes que pueden confirmar el diagnóstico. En este momento, no parece presentar clínicamente insuficiencia cardíaca descompensada, ni ser el problema principal del paciente.
Dr. Amador Carcelén Bustamante (Medicina Interna)
Voy a centrarme en un comentario, a mí me parece que el diagnóstico del paciente es toxicidad pulmonar por amiodarona, lo característico en este cuadro son las lesiones pulmonares que aparecen durante el tratamiento con amiodarona y que desaparecen cuando se descontinúa su uso. Existen reportes donde se describen casos de instalación rápida con características de pulmón blanco y con alta mortalidad. Hacer estudios para identificar células espumosas no es de utilidad, pues su presencia es un indicador de que el paciente está tomando amiodarona sin presentar toxicidad pulmonar necesariamente.
La indicación principal de la amiodarona es el tratamiento de arritmias ventriculares, su indicación no es precisa para el manejo de fibrilación auricular, es una droga que debe ser monitorizada regularmente y puede inducir arritmias fatales en algunos pacientes.
En mi opinión se debe suspender amiodarona e iniciar corticoides, es necesario además hacer estudios de función tiroidea.
EVOLUCIÓN
Se realizaron las siguientes pruebas: NTpro-BNP 364 pg/ml (VN: 0 – 376), ELISA VIH no reactivo, ANA y factor reumatoide, negativos. La búsqueda de bacilos alcohol acido resistentes (BK) en esputo fue negativo en 5 oportunidades; el cultivo de secreción bronquial fue positivo a E. coli sensible a los antibióticos que recibió, el cultivo de hongos fue negativo y el estudio de esputo con coloración Giemsa fue negativo, alejando la posibilidad de PCP.
La broncoscopía con lavado bronquio alveolar, no se pudo realizar por motivos no médicos.
Se descontinuó la amiodarona y se inició prednisona 60 mg/día (equivalente a 1mg/Kg/d), la fiebre remitió a las 48 horas y mejoró la disnea. El paciente fue dado de alta sin requerimiento de oxígeno.
Los resultados de las hormonas tiroideas fueron: TSH : 13,5 uU/L (0,4 - 4), T4L: 0,733 ng/dL (0,8 - 1,9), anti TPO: negativo; teniendo en cuenta que en controles ambulatorios se encontraba eutiroideo, se diagnosticó hipotiroidismo inducido por amiodarona y se inició levotiroxina a 25 μg/d.
El paciente tuvo 2 hospitalizaciones posteriores por recidiva de dificultad respiratoria en las cuales se evidenció insuficiencia cardiaca descompensada y mayor progreso de enfermedad pulmonar intersticial con fibrosis pulmonar, necesitando posteriormente oxígeno ambulatorio permanente.
COMENTARIOS
Dr. Héctor Sosa Valle
La lenta resolución del cuadro pulmonar se debe a que la amiodarona es un fármaco que tiene un tiempo de vida media muy prolongado, 55 días en promedio (26 a 107 días) y su acumulación en los tejidos, hace que su eliminación sea muy lenta, lo que justifica que el tiempo de mejoría y de uso de corticoides sea tan largo como un año. También es importante recalcar que cuanto mayor compromiso en panal de abeja tengan los pulmones más difícil será la remisión del cuadro.
La alteración de la función tiroidea es una de las complicaciones más comunes del uso de amiodarona (10%) (12), presentándose tanto hipotiroidismo como hipertiroidismo; el hipotiroidismo es dos a cuatro veces más frecuente. En nuestro paciente se detectó hipotiroidismo que no tenía causa autoinmune por lo que es lógico pensar que fue inducido por amiodarona. El tratamiento es iniciar reemplazo hormonal con levotiroxina y esperar que al suspender la amiodarona la función tiroidea regrese a la normalidad en 4 meses aproximadamente.
DIAGNÓSTICO FINAL
Enfermedad pulmonar asociada a uso de amiodarona
Hipotiroidismo inducido por amiodarona
Fibrilación auricular paroxística
REFERENCIAS BIBLIOGRÁFICAS
1. Kujlman J, Kavuru M, FishmanE. Pneumocystis carinii pneumonia: spectrum of parenchymal CT findings. Radiology. 1990; 175 (3): 711-714. [ Links ]
2. Dean PJ, Groshart KD, Porterfield JG, Iansmith DH. Amiodarone-associated pulmonary toxicity.A clinical and pathologic study of eleven cases. Am J Clin Pathol. 1987; 87(1): 7. [ Links ]
3. Martin WJ 2nd, Rosenow EC. Amiodarone pulmonary toxicity. Recognition and pathogenesis (Part I). Chest. 1988; 93(5):1067. [ Links ]
4. Vourlekis J, Brown K, Schwarz M. Acute interstitial pneumonitis: current understanding regarding diagnosis, pathogenesis, and natural history. Semin Respir Crit Care Med. 2001; 22(4):399-408. [ Links ]
5. Ohar JA, Jackson F, Dettenmeier PA. Bronchoalveolar lavage cell count and differential are not reliable indicators of amiodarone-induced pneumonitis. Chest. 1992; 102(4):999. [ Links ]
6. Wolkove N, Baltzan M. Amiodarone pulmonary toxicity. Can Respir J. 2009; 16(2): 43-48. [ Links ]
7. European Heart Rhythm Association; European Association for Cardio-Thoracic Surgery, Camm AJ, et al. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J. 2010; 31(19):2369- 429. [ Links ]
8. Shah AN, Mittal S, Sichrovsky TC, et al. Long-term outcome following successful pulmonary vein isolation: pattern and prediction of very late recurrence. J Cardiovasc Electrophysiol. 2008; 19:661-667. [ Links ]
9. Lafuente-Lafuente C, Mouly S, Longas-Tejero MA, Bergmann JF. Antiarrhythmics for maintaining sinus rhythm after cardioversion of atrial fibrillation. Cochrane Database Syst Rev 2007; 4:CD005049. [ Links ]
10. Le Heuzey J, De Ferrari GM, Radzik D, Santini M, Zhu J, Davy JM. A short-term, randomized, double-blind, parallel-group study to evaluate the efficacy and safety of dronedarone versus amiodarone in patients with persistent atrial fibrillation: the DIONYSOS study. J Cardiovasc Electrophysiol. 2010; 21:597-605. [ Links ]
11. Goldschlager N, Epstein AE, Naccarelli G, Olshansky B, Singh B. Practical guidelines for clinicians who treat patients with amiodarone. Practice Guidelines Subcommittee, North American Society of Pacing and Electrophysiology. Arch Intern Med. 2000; 160:1741-8. [ Links ]
12. Wiersinga WM, Trip MD. Amiodarone and thyroid hormone metabolism. Postgrad Med J. 1986; 62:909- 914. [ Links ]
Recibido: 04/05/2013
Aceptado: 14/05/2013