Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Medica Herediana
On-line version ISSN 1729-214X
Rev Med Hered vol.24 no.4 Lima Oct./Dec. 2013
Manifestaciones musculo-esqueléticas en pacientes en hemodiálisis crónica
Muscle skeletal manifestations in patients on chronic hemodyalisis
Raúl Alca-Clares(1), Harold Tabori-Peinado(1), Armando Calvo-Quiroz(2), Alfredo Berrocal-Kasay(3), Cesar Loza-Munarriz(4)
(1) Médico Cirujano. Universidad Peruana Cayetano Heredia. Lima, Perú.
(2) Universidad Peruana Cayetano Heredia. Médico asistente del Servicio de Reumatología del Hospital Nacional Cayetano Heredia. Lima, Perú.
(3) Universidad Peruana Cayetano Heredia. Médico asistente del Servicio de Reumatología del Hospital Nacional Cayetano Heredia. Lima, Perú.
(4) Universidad Peruana Cayetano Heredia. Médico asistente del Servicio de Nefrología del Hospital Nacional Cayetano Heredia. Lima, Perú.
RESUMEN
Objetivos: Determinar la frecuencia y describir las manifestaciones musculoesqueléticas (MME) en pacientes en hemodiálisis crónica (HDC). Material y métodos: Es una serie de casos. Se incluyeron 68 pacientes con edad ≥ 18 años, en HDC ≥ 6 meses, del Centro de Hemodiálisis de la Universidad Peruana Cayetano Heredia. Los datos demográficos, clínicos, tiempo en hemodiálisis, dosis de diálisis e ingesta proteica, y calcio, fósforo y fosfatasa alcalina séricos fueron obtenidos de las historias clínicas, en 38 pacientes se determinó PTH sérico y a 37 pacientes se les realizó densitometría ósea como parte de su evaluación. Resultados: La edad promedio fue 52,1 ± 22,1 años, el 52,9% fueron mayores de 60 años, el tiempo en HDC 21,6 ± 17 meses, la nefropatía diabética fue la etiología más frecuente. El 73,5% de los pacientes presentaron MME. La artrosis y la lumbalgia fueron las más frecuentes. La artrosis se relacionó con edad >60 años (66,7% vs. 12,5%; p=0,000) y la presencia de diabetes mellitus (DM) (68,6% vs. 32,7%; p=0,010). En 64,9% de pacientes se encontró densidad mineral ósea (DMO) disminuida, 11 (29,7%) tuvieron osteoporosis y 12 (32,4%) osteopenia. Conclusión: Las MME tienen frecuencia elevada en pacientes en HDC, siendo la artrosis, la lumbalgia y la DMO disminuida las manifestaciones más frecuentes.
PALABRAS CLAVE: Enfermedades musculoesqueléticas, densidad ósea, diálisis renal, osteoporosis. (Fuente: DeCS BIREME).
SUMMARY
Objectives: To determine the prevalence of muscle skeletal (MS) manifestations in patients on chronic hemodyalisis (CH). Methods: Case series that included 68 patients with at least 18 years of age on CH for at least 6 months in the Hemodyalisis Centre of Cayetano Heredia University. Demographic data, clinical information, time on CH, dose of dyalisis and protein ingestion, calcium phosporus and alkaline phosphatase were investigated. Serum PTH was measured in 38 patients and bone mineral density was evaluated in 37 patients. Results: Mean age was 52.1 ± 22.1 years; 52.9% were above 60 years; time on CH was 21.6 ± 17 months; diabetic nephropathy was the common etiology. MS was observed in 73.5% of patients; arthrosis and lumbar pain were the most common manifestations. Arthrosis was related to age > 60 years (66.7% vs 12.5%; p=0.000) and with diabetes mellitus (68.6% vs 32.7%; p=0.010). Low bone mineral density was observed in 64.9% of patients, 11 (29.7%) had osteoporosis and 12 (32.4%) had osteopenia. Conclusions: MS manifestations are highly prevalent in patients on CH. Arthrosis, lumbar pain and low bone mineral density are the most common abnormalities in these patients.
KEYWORDS: Musculoskeletal diseases, bone density, renal dialysis, osteoporosis. (Source: MesH NLM)
INTRODUCCIÓN
Las manifestaciones musculo-esqueléticas representan desórdenes que comprometen al músculo, hueso, cartílago, ligamentos y otros tejidos blandos. En la literatura se han descrito una serie de manifestaciones musculoesqueléticas (MME) como consecuencia de la enfermedad renal crónica (ERC) así como su presencia en pacientes en hemodiálisis crónica (HDC) (1,2).
Se ha descrito que la hemodiálisis causa complicaciones esqueléticas y articulares, hallazgos que podrían prevenirse mediante el trasplante renal (3). El dolor musculoesquelético es causa principal de dolor crónico en pacientes en HDC, relacionándose a la permanencia en diálisis (4). También, se ha reportado como una manifestación musculo-esquelética frecuente en pacientes en HDC, a la densidad mineral ósea (DMO) disminuida, estando asociada al sexo femenino y relacionándose de forma inversa con la edad y los niveles de paratohormona (PTH) (5).
La ERC es un problema de salud pública a nivel mundial y el número de pacientes en terapia de diálisis viene incrementándose, prolongando su promedio de vida (6), así estos pacientes estarían propensos a padecer complicaciones relacionadas a la ERC en estadio 5 (ERC-5) y a la HDC per sé. Además, no se ha dilucidado completamente los aspectos fisiopatológicos que expliquen la presencia de MME en estos pacientes (7).
En el Perú no se conoce la magnitud de este problema, ni los factores que estarían relacionados a la presencia de estas MME en pacientes en HDC.
Los objetivos del estudio fueron determinar la frecuencia de las MME en los pacientes en hemodiálisis crónica, describir las características clínicas y su relación con la edad, sexo, tiempo en hemodiálisis crónica, etiología de enfermedad renal crónica, comorbilidades, dosis de diálisis, ingesta proteica y los niveles de calcio, fósforo, fosfatasa alcalina y PTH intacta.
MATERIAL Y MÉTODOS
Se realizó un estudio descriptivo transversal, tipo serie de casos. Se incluyeron 68 pacientes en terapia de HDC del Centro de Hemodiálisis de la Universidad Peruana Cayetano Heredia (UPCH) que atiende pacientes del Hospital Nacional Cayetano Heredia, durante el mes de diciembre del 2011.
Los criterios de inclusión fueron: pacientes mayores de 18 años en terapia de HDC ≥ 6 meses con frecuencia de 3 veces por semana en forma regular y que firmaron el consentimiento informado. Los criterios de exclusión fueron: alteración de conciencia, trastornos psiquiátricos, discapacidad física y mental.
Definición de variables
Se consideró manifestaciones musculo-esqueléticas presentes cuando se objetivó al examen clínico una de las siguientes manifestaciones clínicas:
1. Artrosis: Presencia de signos característicos en manos o rodillas al examen clínico; en manos, la presencia de deformación ósea característica, nódulos de Heberden o Bouchard con o sin dolor; en rodilla por la presencia de crepitación y dolor articular o deformación ósea.
2. Síndrome del túnel carpal (STC): Presencia de parestesias en territorio característico durante el test de Phalen o la percusión del túnel carpiano (signo de Tinnel positivo).
3. Cervicalgia, dorsalgia o lumbalgia: Presencia de dolor en región cervical, dorsal o lumbar, respectivamente, al examen, acompañado o no de limitación funcional.
4. Sacroiliítis: Presencia de dolor a la digito presión directa de la articulación sacroiliaca o a la maniobra de Volkmann positiva.
5. Tendinitis bicipital: Presencia de dolor en el tendón bicipital a la digito presión, con o sin limitación funcional.
6. Bursitis olecraneana: Aumento de volumen de la bursa olecraneana con o sin signos inflamatorios.
7. Artritis de metacarpofalángicas o interfalángicas proximales: Presencia de signos inflamatorios en las articulaciones mencionadas.
8. Miopatía proximal: Disminución de la fuerza muscular proximal en extremidades.
9. Fibromialgia: Presencia de los dos criterios según la American College of Rheumatology (8): Historia de dolor generalizado en hemicuerpo derecho e izquierdo, encima y debajo de la cintura y en esqueleto axial durante 3 meses, y dolor a la palpación digital en 11 o más puntos de los 18 puntos gatillo.
10. Artritis por cristales posible: Presencia de dolor en primera articulación metatarso-falángica acompañado de signos inflamatorios de toda la articulación.
11. Densidad mineral ósea disminuida: Presencia de osteoporosis, osteopenia o masa ósea disminuida para la edad. Se usó la Clasificación de la Organización Mundial de la Salud (9) y las recomendaciones del ISCD (10): en pacientes postmenopáusicas y varones mayores de 50 años se consideró el T-score, siendo Normal ≥ -1,0, Osteopenia entre -1,0 y -2,5 y Osteoporosis ≤ a -2,5, y para mujeres premenopáusicas y varones menores de 50 años, el Z score considerándose masa ósea adecuada para la edad > -2 y masa ósea disminuida para la edad ≤ -2.
Se consideró postmenopausia el cese de la menstruación por más de 12 meses al momento de la evaluación y premenopausia cuando tenían menstruación o el cese de la menstrución era menor de 12 meses al momento de la evaluación (11).
Los pacientes fueron examinados por un médico reumatólogo experto que formaba parte del equipo de investigación. Los datos fueron colectados en una ficha elaborada para el estudio. Las características clínicas, demográficas, bioquímicas, dosis de diálisis e ingesta proteica se tomaron de las historias clínicas. Se incluyó la edad, sexo, tiempo en HDC, comorbilidades, etiología de la ERC, dosis de diálisis, ingesta proteica y calcio (Ca), fósforo (P) y fosfatasa alcalina (FA) en sangre.
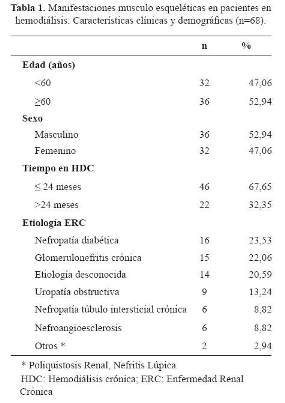
La edad se categorizó en ≤ 60 años (adulto) y > 60 años (adulto mayor); el tiempo en HDC en ≤ 24 y > 24 meses; la dosis de diálisis en ≥ 1,2 y < 1,2 y la ingesta proteica en ≥ 1,2 y < 1,2 g/kg/d, estas últimas de acuerdo a las recomendaciones de la National Kidney Foundation-Kidney Disease Outcomes Quality Initiative (NKF-K/DOQI) (12,13).
En el caso del Ca, P y FA séricas, se consideró el promedio de las últimas tres mediciones en el último año registradas en la historia clínica.
Sólo 38 pacientes aceptaron que se les realice el dosaje de PTH sérico. La determinación de PTH intacta se realizó en el laboratorio universitario de endocrinología de la UPCH, por el método de radioinmunoensayo. El nivel de PTH se categorizó en normal (rango entre 150-300 pg/ml) y anormal fuera del rango, considerando el rango objetivo de la NKF-K/DOQI (14).
De los 38 pacientes a quienes se les determinó PTH, 37 aceptaron la realización de la densitometría ósea (DMO). La DMO se realizó con equipo LUNAR DPXNT 74365 a nivel de columna lumbar, cuello femoral y cadera total.
Se usó el Chi2 y el Test exacto de Fisher para comparar las variables categóricas, y la suma de rangos de Wilcoxon para la comparación de las medias de datos continuos que no tenían distribución normal. Para la comparación de más de dos medias se empleó el análisis de varianza de una sola vía (ONE WAY). La distribución normal de los datos se verificó por medio de la prueba de Shapiro Wilk. Se consideró estadísticamente significativo un valor de p ≤ 0,05. Para el análisis se utilizó el programa estadístico Stata v. 11.
El protocolo de investigación fue evaluado y aprobado por el Comité de Ética de la Universidad Peruana Cayetano Heredia y el Comité de ética del Hospital Nacional Cayetano Heredia.
RESULTADOS
En la tabla 1se muestra las características clínicas y demográficas de la población estudiada. Fueron evaluados 68 pacientes, 52% fueron hombres. La edad promedio fue 52,1 ± 22,1 (18-88) años. El tiempo en HDC fue 21,6 ± 17,0 meses (6-72 meses). La nefropatía diabética fue la etiología más frecuente de la ERC y la hipertensión arterial (HTA) fue la comorbilidad principal.
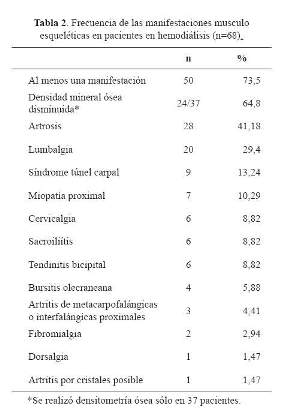
En la tabla 2se muestra la frecuencia de MME, siendo las principales la DMO disminuida, la artrosis, y la lumbalgia.
De los pacientes con DMO disminuida, 11/37 (29,7%) tuvieron osteoporosis y 12/37 (32,4%) osteopenia, un paciente tuvo masa ósea disminuida para la edad. Todas las pacientes postmenopáusicas tuvieron DMO disminuida, osteoporosis en 75% y osteopenia en 25%; mientras que todas las pacientes premenopáusicas tuvieron masa ósea adecuada para la edad. El 91,7% de los varones con edad ≥ 50 años tuvo DMO disminuida, encontrándose osteoporosis en 16,7% y osteopenia en 75%; uno tuvo DMO normal. El 87,5% de los varones con edad < 50 años tuvo masa ósea adecuada para la edad y un paciente tuvo masa ósea disminuida.
El fósforo sérico promedio fue 3,11 ± 1,16 mg/dl, el calcio total sérico promedio 9,33 ± 0,75 mg/dl, la fosfatasa alcalina promedio 353,35 ± 210,54 IU/l y la PTH intacta 103,2 ± 126,7 pg/ml. La dosis de diálisis promedio fue 1,37 ± 0,49 y el índice de catabolismo proteico (ICP) promedio 0,76 ± 0,23 g/kg/d.
No se encontró asociación entre la presencia de MME y la edad, sexo, tiempo en HDC, etiología de ERC, comorbilidades, dosis de diálisis, ingesta proteica y niveles de calcio, fósforo, fosfatasa alcalina y PTH intacta. Sin embargo, se encontró relación entre la artrosis y la edad > 60 años (66,7% vs. 12,5%; p=0,000) y con la DM (68,6% vs. 32,7%; p=0.010), y entre la DMO disminuida con niveles bajos de PTH (55,68 ± 57,13 vs. 137,92 ± 138,47; p=0,0492) y con edad > 60 años (63,58 ± 12,74 vs. 29,23 ± 13,00; p=0,000).
DISCUSIÓN
Encontramos una elevada frecuencia de MME (73,5%), hallazgo similar a lo reportado en la literatura, describiéndose frecuencias entre 70 y 78,5% (3,15), a diferencia de los estudios publicados en los que el tiempo en HDC era mayor de 5 años (2,3,4,15), los nuestros tenían menos de dos años en HDC. Una posible explicación puede ser la diversa metodología para determinar las MME, ya que en nuestro estudio solo se realizó una evaluación clínica y bioquímica exhaustiva.
Sin embargo, otro estudio (16) encontró una menor frecuencia de MME (34%), observando artralgias en 46,6% de los pacientes con MME, dolor óseo en 21,9%, síndrome del túnel del carpo (STC) en 4,1%; el tiempo en HDC era el doble que el de nuestros pacientes, esta baja frecuencia de MME podría deberse en parte a que excluyeron pacientes con diagnósticos reumatológicos previos. También, las diferencias genéticas, raciales o ambientales podrían jugar un rol disminuyendo la frecuencia de MME (17).
Al igual que los estudios mencionados, encontramos alta proporción de MME respecto a la población general adulta (18,19).
Las comorbilidades más frecuentes descritas en varios estudios de pacientes en HDC son la DM e HTA (2, 3, 4), similar a lo encontrado en nuestro estudio. Las altas tasas de MME encontradas podrían deberse en parte a estas comorbilidades, junto a una mayor edad descrita y al impacto de la ERC y la HDC per se. En pacientes diabéticos se describe frecuentemente problemas reumáticos (20).
Reportamos una frecuencia de STC (13,24%) superior a la población general adulta (4,9%) (21) y menor al descrito en estudios donde el tiempo en HDC fue más prolongado (entre 37,5% y 50%) (2,15); se
señala que el STC se presenta entre 12 y 37% luego de 14 años en HDC y en el 100% al llegar a los 25 años en HDC (22). Además, hay que agregar que el STC es la neuropatía por atrapamiento que ocurre con más frecuencia en pacientes diabéticos (23). En nuestro estudio, encontramos STC en 26,3% de los pacientes con DM, frecuencia similar a lo reportado en pacientes con neuropatía diabética (30%) (24). Por lo tanto, sospechamos que la DM y el tiempo en HDC serían responsables de la presencia del STC en pacientes en HDC.
La proporción de artrosis observada (41,18%) es ligeramente superior a lo reportado por Akasbi y col (3). Existe poca información en la literatura sobre la prevalencia de artrosis en pacientes en HDC y una posible relación entre ellas. Aparentemente la HDC per sé no sería un factor de riesgo para el desarrollo de artrosis (25).
El tiempo en HDC parece estar relacionado con la presencia de algunas MME (2,3,4,15) y el número de sesiones insuficientes aumentaría el riesgo de desarrollar complicaciones reumáticas (3). Golan y col (26) señalan que en los pacientes en HDC, los niveles elevados de PTH y calcio, y los niveles bajos de calcitriol, se asociarían con mayor dolor crónico (entre ellas cefalea, dolor neuropático, lumbalgia, artralgias y otros dolores musculo-esqueléticos); otro estudio encontró asociación con la PTH (4).
Se ha descrito DMO disminuida en pacientes en HDC en 46 a 81% de los pacientes (27,28). En nuestro estudio encontramos una frecuencia similar (64,8%). Sin embargo, la frecuencia de osteoporosis en 29,7%, fue mayor al de otros estudios los que encuentran entre 5 y 15% (28,29) y mayor al 3,4 – 8% reportado en la población general (18,30).
La prevalencia de osteoporosis se estima entre 31 a 35,7% en mujeres posmenopáusicas en Lima Metropolitana (31,32). En nuestro estudio encontramos una frecuencia de 75%, más del doble, que lo reportado; este hallazgo podría estar relacionado a otros factores adicionales como la edad (27, 28) y a niveles deficientes de vitamina D (33).
Respecto a la DMO, estudios reportan asociación negativa con FA e PTH, y asociación positiva con P (5,28), hallazgos que difieren de los nuestros donde no encontramos asociación entre los niveles de P, FA y DMO, a excepción de la relación entre la DMO disminuida y los niveles bajos de PTH. No se encontró asociación entre la DMO y el tiempo en HDC, al igual que en otro estudio (28).
El 78,9% de pacientes tenía niveles de PTH por debajo de los valores recomendados por la NKF-K/DOQI. Considerando que la PTH es el biomarcador empleado para predecir el recambio óseo (14), estos resultados en su conjunto podrían indicar una enfermedad mineral ósea de bajo recambio (34). En la literatura médica se señala a la enfermedad ósea de alto remodelado como la enfermedad mineral ósea más frecuente en HDC, presente en 61,5% de los pacientes (35).
También, son llamativos los valores de ICP por debajo de las recomendaciones de la NKF-K/DOQI (13), datos que sugieren bajo consumo proteico, debido a que los pacientes proceden de zonas de bajos recursos económicos; esto explicaría también los niveles bajos de fósforo sérico encontrados en el estudio (36).
Fueron limitaciones del estudio, que la evaluación clínica haya sido realizada por un médico reumatólogo que conocía el estudio (sesgo del observador), que los datos bioquímicos se obtuvieran de la historia clínica (promedio de las tres últimas mediciones), que sólo se haya medido PTH y realizado densitometría ósea a un subgrupo de pacientes. Estos procesos conllevan a sesgos de medición y de posible subdiagnóstico.
En conclusión, nuestros hallazgos muestran que las manifestaciones musculo-esqueléticas son sumamente frecuentes en pacientes en HDC, siendo la artrosis, la lumbalgia y la DMO disminuida, las más frecuentes.
Declaración de Financiamiento y de conflictos de interés:
El estudio fue financiado por los autores. Para todos los autores del presente estudio no existe algún interés económico o financiero en el estudio o en sus resultados.
REFERENCIAS BIBLIOGRÁFICAS
1. Murphey MD, Sartoris D, Quale JL, Patbria MN, Martin NL. Musculoskeletal manifestations of chronic renal insufficiency. Radiographics. 1993; 13(2): 357-379. [ Links ]
2. Harris S, Brown E. Patients surviving more than 10 years on haemodialysis. The natural history of the complications of treatment. Nephrol Dial Transplant. 1998; 13(4): 1226–1233. [ Links ]
3. Akasbi N, Houssaini TS, Tahiri L, et al. Rheumatic complications of long term treatment with hemodialysis. Rheumatol Int. 2012; 32: 1161–1163. [ Links ]
4. Calls J, Rodríguez MA, Hernández D, et al. Evaluación del dolor en hemodiálisis mediante diversas escalas de medición validadas. Nefrología. 2009; 29(3): 236-243. [ Links ]
5. Taal M, Masud T, Green D, Cassidy M. Risk factors for reduced bone density in haemodialysis patients. Nephrol Dial Transplant. 1999; 14(8): 1922-1928. [ Links ]
6. Coresh J, Selvin E, Stevens L, et al. Prevalence of Chronic Kidney Disease in the United States. JAMA. 2007; 298(17): 2038-2047. [ Links ]
7. Bardin T. Musculoskeletal manifestations of chronic renal failure. Curr Opin Rheumatol. 2003; 15(1): 48- 54. [ Links ]
8. Wolfe F, Smythe HA, Yunus MN, et al. The American College of Rheumatology 1990 Criteria for the Classification of Fibromyalgia. Arthritis Rheum. 1990; 33(2): 160-172. [ Links ]
9. World Health Organization,Scientific Group on the assessment of osteoporosis at primary health care level. WHO Meeting Report (Internet). Brussels, Belgium: World Health Organization; 2004. (Citado el 18 de enero del 2011) Disponible en: http://www.who.int/chp/topics/Osteoporosis.pdf [ Links ]
10. Lewiecki EM, Gordon CM, Baim S, et al. International Society for Clinical Densitometry 2007 Adult and Pediatric Official Positions. Bone. 2008; 43(6): 1115- 1121. [ Links ]
11. Grupo de trabajo de menopausia y postmenopausia. Guía de práctica clínica sobre la menopausia y postmenopausia (Internet). Barcelona: Sociedad Española de Ginecología y Obstetricia, Asociación Española para el Estudio de la Menopausia, Sociedad Española de Medicina de Familia y Comunitaria y Centro Cochrane Iberoamericano; 2004. (Citado el 5 de enero del 2011) Disponible en: http://www.cochrane.es/files/GPC-menopausia-definitiva.pdf [ Links ]
12. National Kidney Foundation. K/DOQI Clinical practice guidelines for hemodialysis adequacy. Am J Kidney Dis. 2006; 48(1): S1-S322. [ Links ]
13. National Kidney Foundation. K/DOQI Clinical practice guidelines for nutrition in chronic renal failure. Am J Kidney Dis. 2000; 35(2): S1-S104. [ Links ]
14. National Kidney Foundation. K/DOQI Clinical practice guidelines for bone metabolism and disease in chronic kidney disease. Am J Kidney Dis. 2003; 42(4): S1-S201. [ Links ]
15. Brown E, Arnold I, Gower P. Dialysis arthropathy: complication of long term treatment with Haemodialysis. Br Med J. 1986; 292(3):163-166. [ Links ]
16. Braz A, Duarte A. Manifestacoes musculoesqueleticas nos pacientes em programa de hemodialise. Rev Bras Reumatol. 2003; 43(4):223-31. [ Links ]
17. Gourley M, Miller FW. Mechanisms of disease: environmental factors in the pathogenesis of rheumatic disease. Nat Rev Rheumatol. 2007; 3(3): 172-180. [ Links ]
18. European commission. Health in the European Union (Internet). European commission; 2007. (Citado el 28 de mayo del 2012) Disponible en: http://ec.europa.eu/health/ph_publication/eb_health_en.pdf [ Links ]
19. Gamboa R, Medina M, Acevedo E, et al. Prevalencia de enfermedades reumatologicas y discapacidad en una comunidad urbano-marginal: resultados del primer estudio Copcord en el Perú. Rev Perú Reum. 2009; 15(1): 40-46. [ Links ]
20. Serban A, Udrea G. Rheumatic manifestations in diabetic patients. Med Life. 2012; 5(3): 252-257. [ Links ]
21. Atroshi I, Gummesson Ch, Johnsson R, Ornstein E, Ranstam J, Rosén I. Prevalence of carpal tunnel syndrome in a general population. JAMA. 1999; 281(2): 153-158. [ Links ]
22. Fitzpatrick D, Jebson P, Madey S, Steyers C. Upper extremity musculoskeletal manifestations of dialysis- associated amyloidosis. Iowa Orthop J. 1996; 16(3): 135–138. [ Links ]
23. Ravindran Rajendran S, Bhansali A, Walia R, Dutta P, Bansal V, Shanmugasundar G.Prevalence and pattern of hand soft-tissue changes in type 2 diabetes mellitus. Diabetes Metab. 2011 Sep;37(4):312-7 [ Links ]
24. Bahrmann A, Tania Z, Neumann T, Hein G, Oster P. Carpal tunnel syndrome in diabetes mellitus. Med Klin. 2010; 105 (3): 150-154. [ Links ]
25. Kart-Köseoglu H, Yucel AE, Niron EA, Köseoglu H, Isiklar I, Ozdemir FN. Osteoarthritis in hemodialysis patients: relationships with bone mineral density and other clinical and laboratory parameters. Rheumatol Int. 2005; 25: 270-275. [ Links ]
26. Golan E, Haggiag I, Os P, Bernheim J. Calcium, parathyroid hormone, and vitamin D: Major determinants of chronic pain in hemodialysis patients. Clin J Am Soc Nephrol. 2009; 4(8): 1374-1380. [ Links ]
27. Barreto FC, Barreto DV, Moyses RMA, et al. Osteoporosis in hemodialysis patients revisited by bone histomorphometry: A new insight into an old problem. Kidney Int. 2006; 69(3):1852–1857. [ Links ]
28. Guey-Shiun H, Tzong-Shinn C, Meei-Fang L, Shiow-Li H, Rong-Sen Y. Factors associated with low bone mass in the hemodialysis patients - a cross- sectional correlation study. BMC Musculoskelet Disord. 2009; 10(60): 1-10. [ Links ]
29. Avramovski P, Sikole A. The progression of bone mineral density loss in dialysis patients compared with the general population. Korean J Intern Med. 2012; 27(4): 436–442. [ Links ]
30. Carmona L, Ballina J, Gabriel R, et al. The burden of musculoskeletal diseases in the general population of Spain: results from a national survey. Ann Rheum Dis. 2001; 60(4):1040–5 [ Links ]
31. Calvo A, León G, Glave C, Camargo VH. Prevalence of Osteoporosis and Osteopenia in Women Over 50 Years in the City of Lima Metropolitana: 2. J Clin Rheumatol. 2006; 12(4): S1. [ Links ]
32. Ibañez A, Rokes C, León G, Calvo A. Evaluación de la densidad mineral ósea de radio ultradistal en hombres y mujeres de la costa, sierra y selva del Perú. Rev Perú Reumatol. 2003; 9(1): 9-25 [ Links ]
33. Sotelo W, Calvo A. Niveles de vitamina D en mujeres posmenopáusicas con osteoporosis primaria. Rev Med Hered. 2011; 22(1): 10-14. [ Links ]
34. Moe1 S, Drüeke T, Cunningham J, et al. Definition, evaluation, and classification of renal osteodystrophy: A position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int. 2006; 69: 1945–1953. [ Links ]
35. Sherrard D, Hercz G, Pei Y, et al. The spectrum of bone disease in end-stage renal failure--an evolving disorder. Kidney Int. 1993; 43(2): 436-442. [ Links ]
36. Acchiardo S, Moore L, Latour P. Malnutrition as the main factor in morbidity and mortality of hemodialysis patients. Kidney Int. 1983; 24(S16):199-203. [ Links ]
Correspondencia:
Raúl Alca Clares
Jr. Rio Huarura N°5754 – Villa Del Norte - Los Olivos. Perú.
Correo electrónico: raul.alca@upch.pe
Recibido: 29/08/2013
Aceptado: 04/12/2013